化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共38张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 09:47:43 | ||
图片预览





文档简介
(共38张PPT)
meiyangyang8602
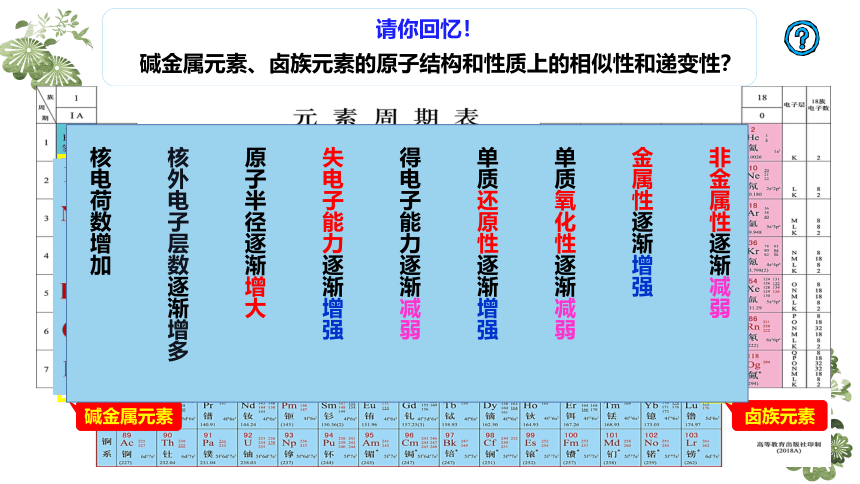
请你回忆!
碱金属元素、卤族元素的原子结构和性质上的相似性和递变性?
碱金属元素
卤族元素
Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
Ts
非金属性逐渐减弱
金属性逐渐增强
单质氧化性逐渐减弱
单质还原性逐渐增强
得电子能力逐渐减弱
失电子能力逐渐增强
原子半径逐渐增大
核外电子层数逐渐增多
核电荷数增加
meiyangyang8602
meiyangyang8602
meiyangyang8602
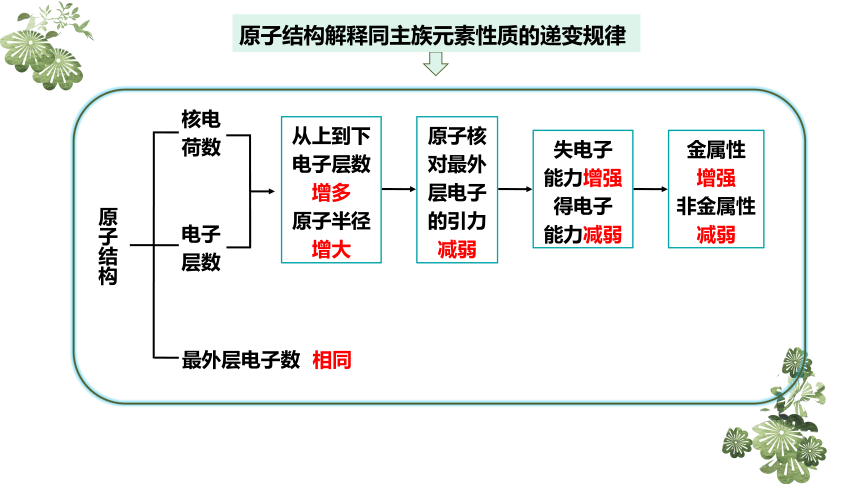
原子结构解释同主族元素性质的递变规律
原子结构
核电
荷数
电子
层数
最外层电子数
从上到下
电子层数
增多
原子半径
增大
原子核
对最外
层电子
的引力
减弱
失电子
能力增强
得电子
能力减弱
金属性
增强
非金属性
减弱
相同
meiyangyang8602
请你思考!
同一周期元素的性质又有什么变化规律?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第1课时 元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
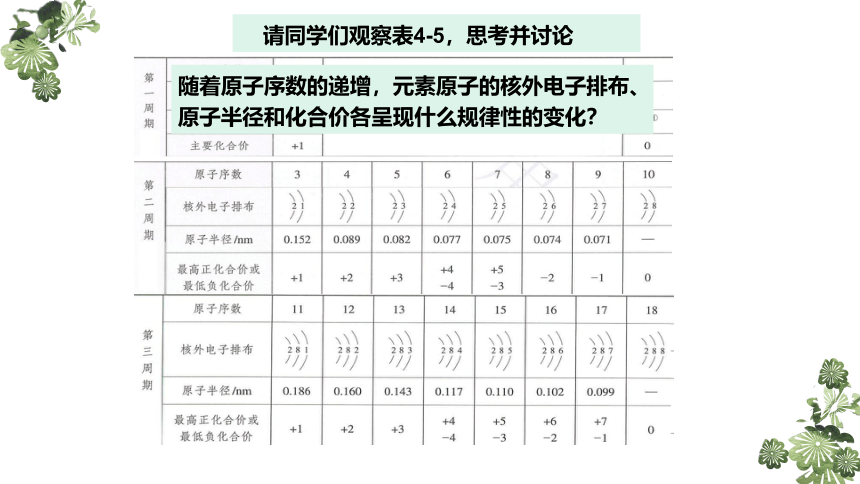
请同学们观察表4-5,思考并讨论
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?
赵健
01
原子最外层电子排布变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
核外电子排布的规律:
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
meiyangyang8602
原子最外层电子排布变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
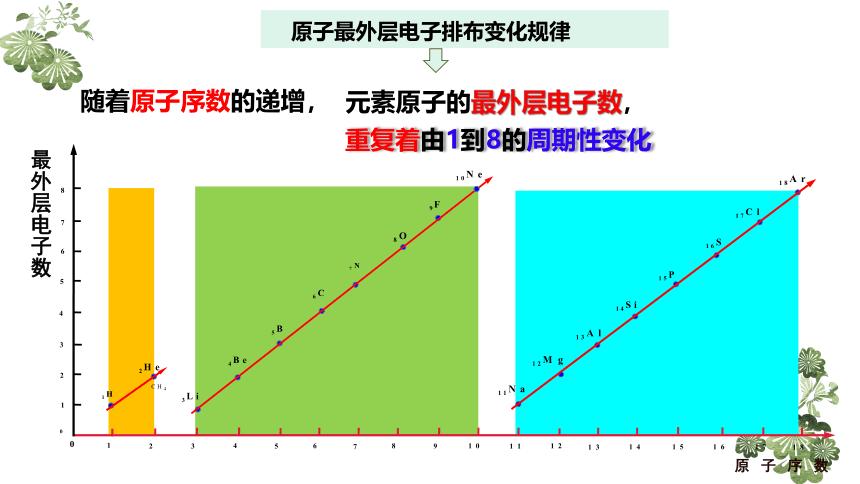
原子最外层电子排布变化规律
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
meiyangyang8602
meiyangyang8602
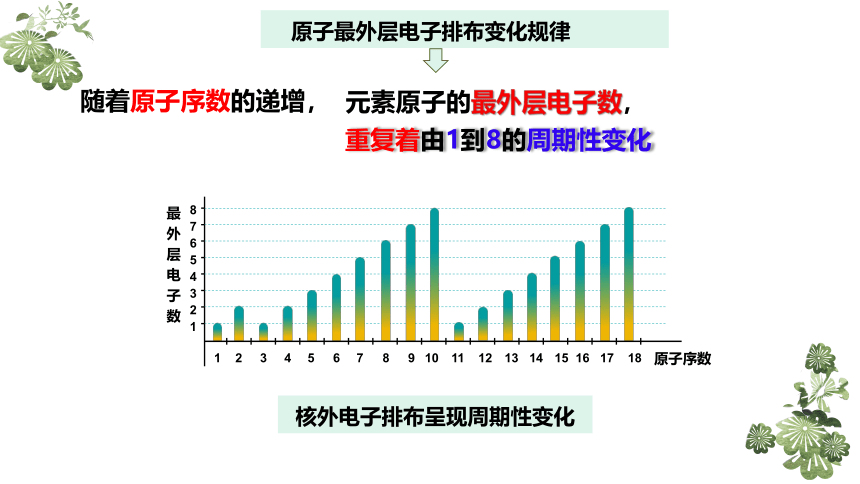
原子最外层电子排布变化规律
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
最外层电子数
原子序数
meiyangyang8602
核外电子排布呈现周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
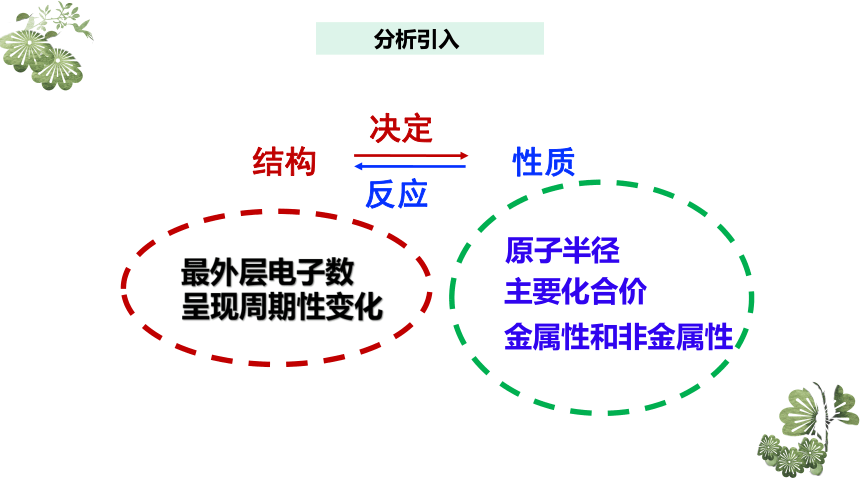
分析引入
结构
性质
决定
反应
原子半径
主要化合价
金属性和非金属性
最外层电子数
呈现周期性变化
赵健
02
原子半径的变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
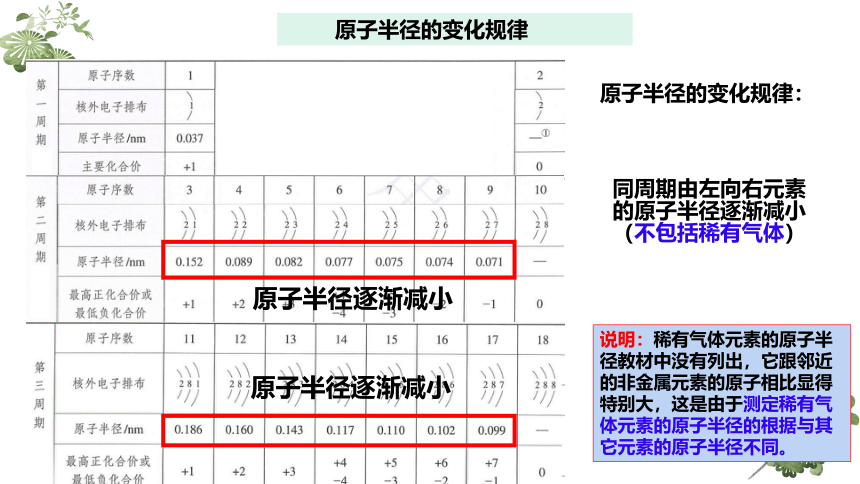
原子半径的变化规律
原子半径的变化规律:
原子半径逐渐减小
原子半径逐渐减小
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
说明:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
meiyangyang8602
请你试试!
绘制1—18号元素随着原子序数的递增,元素原子半径变化的折线图。
1 H
0.037
2 He
3 Li
0.134
4 Be
0.090
5 B
0.082
6 C
0.077
7 N
0.075
8 O
0.073
9 F
0.071
10 Ne
11 Na
0.154
12 Mg
0.130
13 Al
0.118
14 Si
0.111
15 P
0.106
16 S
0.102
17 Cl
0.099
18 Ar
原子序数
原
子
半
径
元素
原子半径
/nm
_
_
-
meiyangyang8602
请你试试!
绘制1—18号元素随着原子序数的递增,元素原子半径变化的折线图。
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子是?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
稀有气体除外
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
meiyangyang8602
meiyangyang8602
meiyangyang8602
原子半径”变化规律探讨
电子层数
核电荷数
核外电子数
同电子层结构:序大径小
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
r(Na)>r(F)
2、比较 Na+ 与 Cl 、Na+ 与 F 的半径大小?
r(Na+)r(Na+)3、比较 Na 与 Na+、Cl 与 Cl 的半径大小?
r(Na)>r(Na+)
r(Cl)meiyangyang8602
meiyangyang8602
meiyangyang8602
“三看”法比较简单粒子半径大小
2.比较Na与Mg、Al的原子半径大小
1.比较O和S的半径大小
3.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
OO2->Na+>Mg2+
4.比较Na和Na+、 O和O2-半径大小
Na>Na+
O最外层电子相同;硫的电子层数多
电子层数相同,核电荷数依次增大
核外电子排布相同,核电荷数依次增大
电子层数不同,核电荷数相同
核电荷数电、电子层数均相同,最外层电子不同
meiyangyang8602
meiyangyang8602
meiyangyang8602
“三看”法比较简单粒子半径大小
①同主族:序大径大
②同周期:序大径小
③同元素:价高径小
④同结构:价高径小
meiyangyang8602
meiyangyang8602
meiyangyang8602
微粒半径大小的比较规律总结
1)原子半径的比较
从上到下,原子半径逐渐增大(电子层数越多)
从左到右,原子半径逐渐减小(核电荷数越大)
r(Li)< r(Na)< r(K)
r(Na) >r(Mg) > r(Al)
2)离子半径的比较
⑴ 同种元素的微粒: 阳离子<中性原子<阴离子
价态越高,微粒半径越小。
举例: r(Cl)< r(Cl-)
r(H+)meiyangyang8602
meiyangyang8602
meiyangyang8602
微粒半径大小的比较规律总结
(3)电子层结构相同的离子,核电荷数越大,半径越小
(2) 带相同电荷的离子,电子层数越多,半径越大
举例: r(Li+) < r(Na+) < r(K+ )
电子层n: 1 2 3
r(F-) < r(Cl-) < r(Br-) < r( I-)
电子层n: 2 3 4 5
例: O2- > F- > Na+ > Mg2+ > Al3+
(第二周期阴离子)
(第三周期阳离子)
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1.比较下列微粒半径的大小
2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
3.下列粒子半径大小的比较中,正确的是( )
A.Na+Cl->Na+>Al3+
C.NaRb>K>Na
BD
4.下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
赵健
03
元素的主要化合价变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
meiyangyang8602
绘制1—18号元素随着原子序数的递增,
元素的最高正价、最低负价变化折线图。
meiyangyang8602
绘制1—18号元素随着原子序数的递增,
元素的最高正价、最低负价变化折线图。
随着核电荷数的递增,元素的最高正化合价呈现+1到+7(氧、氟除外)、最低负化合价呈现-4到-1的周期性变化。
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
主族元素的最高正化合价,重复着由+1到+7的周期性变化
随着原子序数的递增(除氢、稀有气体),
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
主族元素的最高正化合价,重复着由+1到+7,
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
主族元素主要化合价的确定方法
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
0族
(1)最高正价=主族的序号=最外层电子数(O、F除外)
(2)最低负价= ︱最高正价-8(H、O、F除外) ︱
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1
meiyangyang8602
meiyangyang8602
meiyangyang8602
主族元素主要化合价的确定方法
(1)最高正价=主族的序号=最外层电子数(O、F除外)
(2)最低负价= ︱最高正价-8(H、O、F除外) ︱
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1
氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
meiyangyang8602
周期 原子 序数 电子 层数 最外层 电子数 原子半径 (除稀有气 体元素) 最高或最低化合价变化
一 1~2 1 1~2 — +1→ 0
二 3~10 +1→+5
-4 → -1→0
三 11~18
结论: 规律: 1~8
1~8
大→小
大→小
+1 → +7
-4 → -1→0
(O和F无+6、+7最高正价)
最低负价由ⅣA族-4价升高至ⅦA族-1价
最高正价+|最低负价|=8
同一周期随着原子序数的递增,原子最外层电子数从1到8(或2)依次增加,
原子半径依次减小,最高或最低化合价也依次增加。
随着原子序数的递增,元素原子的核外电子排布、原子半径、元素化合价
呈周期性变化
最高正价从+1升至+7
2
3
meiyangyang8602
元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
下节课讲
meiyangyang8602
练习
1.除第一周期外,下列关于同周期主族元素的变化规律的叙述中不正确的是( )
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物碱性逐渐减弱,酸性逐渐增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负化合价从-4递变到-1
B
2.下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
meiyangyang8602
meiyangyang8602
meiyangyang8602
练习
3.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序逐渐增强
D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
B
4.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
C
赵健
谢谢观看
meiyangyang8602
meiyangyang8602
新人教版 化学 必修第一册
meiyangyang8602
请你回忆!
碱金属元素、卤族元素的原子结构和性质上的相似性和递变性?
碱金属元素
卤族元素
Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
Ts
非金属性逐渐减弱
金属性逐渐增强
单质氧化性逐渐减弱
单质还原性逐渐增强
得电子能力逐渐减弱
失电子能力逐渐增强
原子半径逐渐增大
核外电子层数逐渐增多
核电荷数增加
meiyangyang8602
meiyangyang8602
meiyangyang8602
原子结构解释同主族元素性质的递变规律
原子结构
核电
荷数
电子
层数
最外层电子数
从上到下
电子层数
增多
原子半径
增大
原子核
对最外
层电子
的引力
减弱
失电子
能力增强
得电子
能力减弱
金属性
增强
非金属性
减弱
相同
meiyangyang8602
请你思考!
同一周期元素的性质又有什么变化规律?
第二节
元素周期律
第四章 物质结构 元素周期表
赵健
第1课时 元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
请同学们观察表4-5,思考并讨论
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?
赵健
01
原子最外层电子排布变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
核外电子排布的规律:
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
meiyangyang8602
原子最外层电子排布变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
原子最外层电子排布变化规律
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
meiyangyang8602
meiyangyang8602
原子最外层电子排布变化规律
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
1
2
3
4
5
6
7
8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
最外层电子数
原子序数
meiyangyang8602
核外电子排布呈现周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
分析引入
结构
性质
决定
反应
原子半径
主要化合价
金属性和非金属性
最外层电子数
呈现周期性变化
赵健
02
原子半径的变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
原子半径的变化规律
原子半径的变化规律:
原子半径逐渐减小
原子半径逐渐减小
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
说明:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
meiyangyang8602
请你试试!
绘制1—18号元素随着原子序数的递增,元素原子半径变化的折线图。
1 H
0.037
2 He
3 Li
0.134
4 Be
0.090
5 B
0.082
6 C
0.077
7 N
0.075
8 O
0.073
9 F
0.071
10 Ne
11 Na
0.154
12 Mg
0.130
13 Al
0.118
14 Si
0.111
15 P
0.106
16 S
0.102
17 Cl
0.099
18 Ar
原子序数
原
子
半
径
元素
原子半径
/nm
_
_
-
meiyangyang8602
请你试试!
绘制1—18号元素随着原子序数的递增,元素原子半径变化的折线图。
元素(除稀有气体外)的原子半径,
重复着由大到小的周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子是?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
稀有气体除外
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
meiyangyang8602
meiyangyang8602
meiyangyang8602
原子半径”变化规律探讨
电子层数
核电荷数
核外电子数
同电子层结构:序大径小
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
r(Na)>r(F)
2、比较 Na+ 与 Cl 、Na+ 与 F 的半径大小?
r(Na+)
r(Na)>r(Na+)
r(Cl)
meiyangyang8602
meiyangyang8602
“三看”法比较简单粒子半径大小
2.比较Na与Mg、Al的原子半径大小
1.比较O和S的半径大小
3.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
O
4.比较Na和Na+、 O和O2-半径大小
Na>Na+
O
电子层数相同,核电荷数依次增大
核外电子排布相同,核电荷数依次增大
电子层数不同,核电荷数相同
核电荷数电、电子层数均相同,最外层电子不同
meiyangyang8602
meiyangyang8602
meiyangyang8602
“三看”法比较简单粒子半径大小
①同主族:序大径大
②同周期:序大径小
③同元素:价高径小
④同结构:价高径小
meiyangyang8602
meiyangyang8602
meiyangyang8602
微粒半径大小的比较规律总结
1)原子半径的比较
从上到下,原子半径逐渐增大(电子层数越多)
从左到右,原子半径逐渐减小(核电荷数越大)
r(Li)< r(Na)< r(K)
r(Na) >r(Mg) > r(Al)
2)离子半径的比较
⑴ 同种元素的微粒: 阳离子<中性原子<阴离子
价态越高,微粒半径越小。
举例: r(Cl)< r(Cl-)
r(H+)
meiyangyang8602
meiyangyang8602
微粒半径大小的比较规律总结
(3)电子层结构相同的离子,核电荷数越大,半径越小
(2) 带相同电荷的离子,电子层数越多,半径越大
举例: r(Li+) < r(Na+) < r(K+ )
电子层n: 1 2 3
r(F-) < r(Cl-) < r(Br-) < r( I-)
电子层n: 2 3 4 5
例: O2- > F- > Na+ > Mg2+ > Al3+
(第二周期阴离子)
(第三周期阳离子)
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
(1)r(F) r(Cl)
(4)r(Cl-) r(S2-)
(2)r(Cl) r( S) r( P)
(3)r(Al3+) r(Mg2+) r(Na+) r(F-) r(O2-)
<
<
<
<
<
<
<
<
1.比较下列微粒半径的大小
2.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
AB
meiyangyang8602
meiyangyang8602
meiyangyang8602
“原子半径”变化规律探讨
3.下列粒子半径大小的比较中,正确的是( )
A.Na+
C.Na
BD
4.下列各组微粒半径大小比较中,不正确的是( )
A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)
C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
B
赵健
03
元素的主要化合价变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
meiyangyang8602
绘制1—18号元素随着原子序数的递增,
元素的最高正价、最低负价变化折线图。
meiyangyang8602
绘制1—18号元素随着原子序数的递增,
元素的最高正价、最低负价变化折线图。
随着核电荷数的递增,元素的最高正化合价呈现+1到+7(氧、氟除外)、最低负化合价呈现-4到-1的周期性变化。
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
主族元素的最高正化合价,重复着由+1到+7的周期性变化
随着原子序数的递增(除氢、稀有气体),
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素的主要化合价变化规律
主族元素的最高正化合价,重复着由+1到+7,
随着原子序数的递增(除氢、稀有气体),
最低负化合价重复着由-4到-1的周期性变化
meiyangyang8602
meiyangyang8602
meiyangyang8602
主族元素主要化合价的确定方法
ⅠA
第Ⅷ族
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB
ⅡB
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
0族
(1)最高正价=主族的序号=最外层电子数(O、F除外)
(2)最低负价= ︱最高正价-8(H、O、F除外) ︱
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1
meiyangyang8602
meiyangyang8602
meiyangyang8602
主族元素主要化合价的确定方法
(1)最高正价=主族的序号=最外层电子数(O、F除外)
(2)最低负价= ︱最高正价-8(H、O、F除外) ︱
(3)H最高价为+1,最低价为-1;O最低价为-2;F无正化合价,最低价为-1
氢化物及其最高价含氧酸的关系
ⅣA ⅤA ⅥA ⅦA
氢化物 RH4 RH3 H2R HR
最高价氧化物对应的水化物 H2RO3或H4RO4 H3RO4或HRO3 H2RO4 HRO4
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
meiyangyang8602
周期 原子 序数 电子 层数 最外层 电子数 原子半径 (除稀有气 体元素) 最高或最低化合价变化
一 1~2 1 1~2 — +1→ 0
二 3~10 +1→+5
-4 → -1→0
三 11~18
结论: 规律: 1~8
1~8
大→小
大→小
+1 → +7
-4 → -1→0
(O和F无+6、+7最高正价)
最低负价由ⅣA族-4价升高至ⅦA族-1价
最高正价+|最低负价|=8
同一周期随着原子序数的递增,原子最外层电子数从1到8(或2)依次增加,
原子半径依次减小,最高或最低化合价也依次增加。
随着原子序数的递增,元素原子的核外电子排布、原子半径、元素化合价
呈周期性变化
最高正价从+1升至+7
2
3
meiyangyang8602
元素性质的周期性变化规律
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
元素性质的周期性变化规律
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律?
下节课讲
meiyangyang8602
练习
1.除第一周期外,下列关于同周期主族元素的变化规律的叙述中不正确的是( )
A.从左到右,原子半径逐渐减小
B.从左到右,单质的氧化性逐渐减弱,还原性逐渐增强
C.从左到右,元素最高价氧化物对应水化物碱性逐渐减弱,酸性逐渐增强
D.从左到右,元素最高正化合价从+1递变到+7(氧、氟除外),最低负化合价从-4递变到-1
B
2.下图表示1~18号元素原子结构或性质随核电荷数递增的变化。该图中纵坐标表示( )
A.电子层数 B.最外层电子数
C.最高化合价 D.原子半径
B
meiyangyang8602
meiyangyang8602
meiyangyang8602
练习
3.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.最高价含氧酸的酸性:H3ZO4>H2YO4>HXO4
B.非金属性:X>Y>Z
C.气态氢化物的稳定性按X、Y、Z顺序逐渐增强
D.元素的最低负化合价的绝对值按X、Y、Z顺序逐渐减小
B
4.某主族元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子数为( )
A.4 B.5 C.6 D.7
C
赵健
谢谢观看
meiyangyang8602
meiyangyang8602
新人教版 化学 必修第一册
