专题4 分子空间结构与物质性质 单元检测题(含答案) 高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 分子空间结构与物质性质 单元检测题(含答案) 高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 11:51:43 | ||
图片预览



文档简介
专题4《分子空间结构与物质性质》单元检测题
一、单选题(共13题)
1.葡酚酮是从葡萄籽中提取的一种花青素类衍生物(结构简式如图),葡酚酮分子中含有手性碳原子(连有四个不同原子或基团的碳原子)的个数为
A.2 B.3
C.4 D.5
2.厦门大学郑兰荪院士合成了C70Cl10富勒烯足球状分子,如下图,它是由C70分子与Cl2发生加成反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳均为4价。则有关说法中不正确的是
A.C70的熔点比石墨的熔点低
B.C70分子中的碳原子的杂化方式与碳酸中的碳原子相同
C.C70分子中含有70个σ键,35个π键
D.C70Cl10分子中共用电子对数目为145个
3.下列分子或离子中,立体构型不是三角锥形的是
A.PCl3 B.CH C.BBr3 D.AsH3
4.“类推”是一种重要的学习方法,但有时会产生错误的结论。下列类推结论中正确的是
A.CO2是直线形的非极性分子,可推测SO2也是直线形的非极性分子
B.卤族元素氧化物的水化物酸性:,则也有酸性:
C.离子晶体中都含有离子键,所以分子晶体中也一定含有共价键
D.SiH4的沸点高于CH4,可推测H2S的沸点高于H2O
5.下列与分子性质有关的说法正确的是
A.邻硝基苯酚()的沸点高于对硝基苯酚()是因为后者形成了分子间氢键
B.氟代丙二酸()的酸性强于丙二酸()是因为的极性大于的极性,导致氟代丙二酸羧基中的极性更大更易电离出
C.C的电负性强于,所以的熔沸点高于
D.受热易升华,是因为分子内共价键键能较小所致
6.2021年12月28日,中国科学院微生物研究所李寅团队发表了历时5年设计的全新最小化人工固碳循环图。下列关于该循环图叙述错误的是
A.甲、乙、丙、丁均能与乙醇发生酯化反应
B.丙与乙互为同系物,丙与乙均不能与酸性高锰酸钾溶液反应
C.该循环过程中存在非极性键的断裂和生成
D.每轮循环可以转化两分子CO2生成一分子乙二酸
7.一种叠氮桥基配位化合物C的合成方法如图,下列叙述正确的是( )
A.基态Br价电子排布式为3d104s24p5
B.NaN3中N立体构型为V形
C.物质C中氮原子杂化形式有sp、sp2、sp3
D.CH3OH是手性分子
8.离子液体常被用作电化学研究的电解质、有机合成的溶剂和催化剂。如图是离子液体1-丁基-3-甲基咪唑六氟磷酸盐的结构简式。下面说法正确的是
A.该物质含有的化学键类型是共价键
B.的空间构型为三角双锥形
C.该物质中N有2种杂化轨道类型
D.离子液体的沸点较低,容易挥发
9.水()是一种非常重要的资源,下面关于水的结构和性质的描述正确的是
A.水是平面三角形分子
B.水分子结构稳定,因为水分子可以形成氢键
C.冰熔化时水分子中共价键发生断裂
D.水分子中的氧原子采用杂化
10.干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较正确的是
A.晶体的熔点:干冰>冰
B.晶体中的空间利用率;干冰>冰
C.晶体中分子间相互作用力相同
D.晶体中键的极性和分子的极性相同
11.一种麻醉剂的分子结构式如图所示,其中X的原子核中只有1个质子,元素Y、Z、W的原子序数依次增大,且均位于X的下一周期;元素E的原子比元素W的原子多8个电子。下列说法正确的是
A.电负性:W>Z>Y>X
B.Y与E形成的化合物YE4是一种比水轻的油状液体
C.气态氢化物的稳定性Y>Z
D.ZW2的空间构型为直线形
12.下列关于元素或物质性质的比较中,正确的是
A.键长:HF>HCl>HBr>HI
B.熔点:CCl4>SiCl4
C.酸性:
D.沸点:对羟基苯甲醛()<邻羟基苯甲醛()
13.下列说法正确的是
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.Na投入到水中,有共价键的断裂与形成
C.N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构
D.常温常压下,H2O与NH3的状态不同可以说明H2O的热稳定性更好
二、非选择题(共10题)
14.碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______,每个Ba2+与____个O2-配位。
15.Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式是,其环状结构如图所示,S原子采用的轨道杂化方式是_______;
(2)Se的核外电子的排布式为_______;
(3)气态分子的立体构型为_______,离子的立体构型为_______;
(4)O的非金属性比S_______(填“强”或“弱”),举一个化学方程式说明:_______。
三、实验题
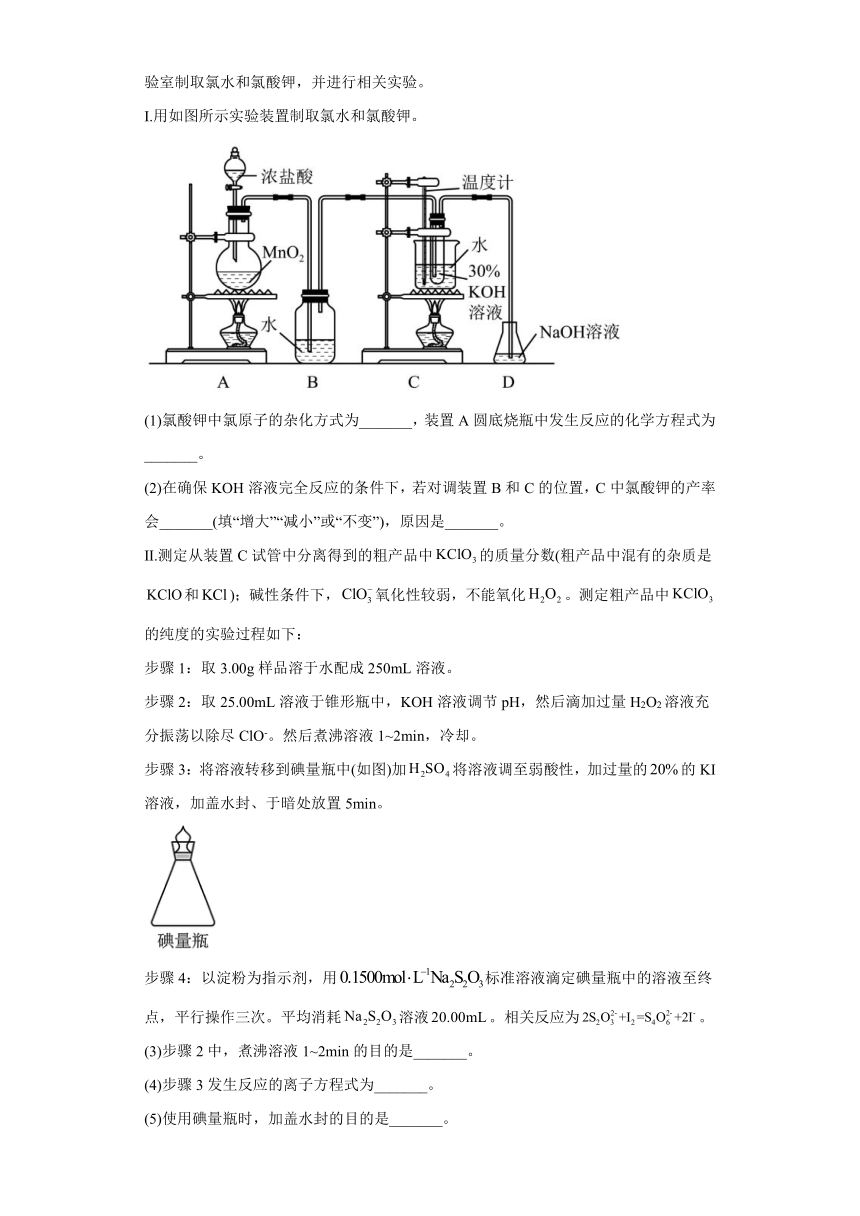
16.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。某化学兴趣小组在实验室制取氯水和氯酸钾,并进行相关实验。
Ⅰ.用如图所示实验装置制取氯水和氯酸钾。
(1)氯酸钾中氯原子的杂化方式为_______,装置A圆底烧瓶中发生反应的化学方程式为_______。
(2)在确保KOH溶液完全反应的条件下,若对调装置B和C的位置,C中氯酸钾的产率会_______(填“增大”“减小”或“不变”),原因是_______。
Ⅱ.测定从装置C试管中分离得到的粗产品中的质量分数(粗产品中混有的杂质是和);碱性条件下,氧化性较弱,不能氧化。测定粗产品中的纯度的实验过程如下:
步骤1:取3.00g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,KOH溶液调节pH,然后滴加过量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2min,冷却。
步骤3:将溶液转移到碘量瓶中(如图)加将溶液调至弱酸性,加过量的的KI溶液,加盖水封、于暗处放置5min。
步骤4:以淀粉为指示剂,用标准溶液滴定碘量瓶中的溶液至终点,平行操作三次。平均消耗溶液。相关反应为。
(3)步骤2中,煮沸溶液1~2min的目的是_______。
(4)步骤3发生反应的离子方程式为_______。
(5)使用碘量瓶时,加盖水封的目的是_______。
(6)粗产品中的质量分数为_______。(保留三位有效数字)
17.Ⅰ.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
(1)操作Ⅰ、Ⅱ中,不会用到的装置是_______(填序号)。
A. B. C.
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是_______。
(3)操作Ⅱ的名称是_______。操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)下列有关青蒿素研究的说法正确的是_______
A.利用黄花蒿茎叶研究青蒿素结构的基本步骤:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B.可用X射线衍射测定分子的空间结构
C.元素分析仪可以确定青蒿素中是否含有C、H、O等元素
D.可用质谱法确定分子中含有何种官能团的信息
(5)青蒿素分子中的含氧官能团除过氧基(-O-O-)外,还有_______(写名称)
Ⅱ.完成下列填空
(6)表示的有机物的分子式为_______;其中碳原子的杂化方式有_______种。
(7) 的系统命名法名称是_______,其一氯代物有_______种。
(8)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为_______,分子式为_______。
18.某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
装置 实验现象
现象i:一开始溶液颜色加深,由棕黄色变为红褐色。现象ii:一段时间后溶液颜色变浅,变为浅黄色。
(1)SO离子中中心原子的杂化类型___________,Fe3+简化的核外电子排布式___________。
(2)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:___________。
(3)探究现象i产生的原因:
①甲同学认为发生反应:2Fe3++3SO+6H2O2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1 mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是___________(填化学式)。
②乙同学认为还发生了氧化还原反应,其离子方程式为___________;他取少许红褐色溶液于试管中,加入___________,有白色沉淀产生,证明产物中含有SO。
丙同学认为乙同学的实验不严谨,因为在上述过程中SO可能被其它物质氧化。为了进一步确认SO被氧化的原因,丙同学设计了实验2。
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
(4)③实验2中正极的电极反应式为___________。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是___________。
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为___________。
四、计算题
19.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
20.有机化合物A含有C、H、O三种元素,取该有机物0.2 mol 和0.9 mol O2在密闭容器中燃烧,产物为CO、CO2和H2O(g),把产物依次通过浓硫酸、灼热的氧化铜和碱石灰。结果,浓H2SO4的质量重了18g ,CuO的质量轻了9.6g,碱石灰的质量增重了35.2g。
(1)通过计算确定有机物A的分子式为________;
(2)若A可与金属钠反应生成氢气,且A分子中含有手性碳原子, A的结构简式为________。
21.(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为_______g·cm-3(列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为_______nm。
22.Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于区,最外层没有单电子,其余的均为短周期主族元素;
②基态Y原子的价电子排布式为;
③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的能级有1个单电子。
请回答下列问题:
(1)Z在周期表中的位置为______。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为______(用对应元素的符号填写)。
(3)分析下表中两种物质的键能数据(单位:)。
351 745 1076
196 418 945
结合数据说明比活泼的原因:__________________。
23.X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的第二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子;基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。
(2)基态X原子的价层电子排布图为_______。基态W原子中有_______对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y_______(填“>”或“<”)Z。
(4)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为_______;其酸根离子的空间构型为_______。
(5)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______。
参考答案:
1.B 2.C 3.C 4.B 5.B 6.B 7.C 8.C 9.D 10.B 11.A 12.C 13.B
14. sp2 范德华力 C>H >Si < BaPbO3 12
15.(1)杂化
(2)
(3) 平面正三角形 三角锥形
(4) 强 /
16.(1) sp3 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) 减小 浓盐酸具有挥发性,A装置中挥发出来的HCl,会消耗C装置中的KOH
(3)除去溶液中过量的H2O2,防止干扰后续实验
(4)
(5)防止碘挥发损失
(6)20.4%(或0.204)
17.(1)C
(2)浸取青蒿素
(3) 蒸馏 B
(4)ABC
(5)醚键、酯基
(6) C8H11NO2 3
(7) 3,3,5,5—四甲基庚烷 4
(8) 74 C4H10O
18.(1) sp3 [Ar]3d5
(2)Fe3++3H2OFe(OH)3+3H+,盐酸抑制氯化铁水解
(3) SO2 2Fe3++SO+H2O=2Fe2++SO+2H+ 足量盐酸和BaCl2溶液
(4) Fe3++e-=Fe2+ Fe3+能够氧化SO
(5)随着FeCl3与Na2SO3之间氧化还原反应的进行,FeCl3与Na2SO3浓度降低,使得平衡2Fe3++3SO+6H2O2Fe(OH)3(胶体)+3H2SO3逆向移动,溶液颜色变浅
19.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
20.(1)C4H10O
(2)
21.
22. 第四周期IIB族 中断裂第一个π键的能量是,中断裂第一个π键的能量是,所以的第一个π键比更容易断裂
23.(1)电子云
(2) 9
(3)>
(4) sp2 平面三角形
(5)破坏分子间作用力和氢键所需能量低于破坏化学键所需能量
一、单选题(共13题)
1.葡酚酮是从葡萄籽中提取的一种花青素类衍生物(结构简式如图),葡酚酮分子中含有手性碳原子(连有四个不同原子或基团的碳原子)的个数为
A.2 B.3
C.4 D.5
2.厦门大学郑兰荪院士合成了C70Cl10富勒烯足球状分子,如下图,它是由C70分子与Cl2发生加成反应得到的。在C70分子中每个碳原子均与周围相邻的其他3个碳原子相连,70个碳原子组成若干个正六边形和正五边形,碳均为4价。则有关说法中不正确的是
A.C70的熔点比石墨的熔点低
B.C70分子中的碳原子的杂化方式与碳酸中的碳原子相同
C.C70分子中含有70个σ键,35个π键
D.C70Cl10分子中共用电子对数目为145个
3.下列分子或离子中,立体构型不是三角锥形的是
A.PCl3 B.CH C.BBr3 D.AsH3
4.“类推”是一种重要的学习方法,但有时会产生错误的结论。下列类推结论中正确的是
A.CO2是直线形的非极性分子,可推测SO2也是直线形的非极性分子
B.卤族元素氧化物的水化物酸性:,则也有酸性:
C.离子晶体中都含有离子键,所以分子晶体中也一定含有共价键
D.SiH4的沸点高于CH4,可推测H2S的沸点高于H2O
5.下列与分子性质有关的说法正确的是
A.邻硝基苯酚()的沸点高于对硝基苯酚()是因为后者形成了分子间氢键
B.氟代丙二酸()的酸性强于丙二酸()是因为的极性大于的极性,导致氟代丙二酸羧基中的极性更大更易电离出
C.C的电负性强于,所以的熔沸点高于
D.受热易升华,是因为分子内共价键键能较小所致
6.2021年12月28日,中国科学院微生物研究所李寅团队发表了历时5年设计的全新最小化人工固碳循环图。下列关于该循环图叙述错误的是
A.甲、乙、丙、丁均能与乙醇发生酯化反应
B.丙与乙互为同系物,丙与乙均不能与酸性高锰酸钾溶液反应
C.该循环过程中存在非极性键的断裂和生成
D.每轮循环可以转化两分子CO2生成一分子乙二酸
7.一种叠氮桥基配位化合物C的合成方法如图,下列叙述正确的是( )
A.基态Br价电子排布式为3d104s24p5
B.NaN3中N立体构型为V形
C.物质C中氮原子杂化形式有sp、sp2、sp3
D.CH3OH是手性分子
8.离子液体常被用作电化学研究的电解质、有机合成的溶剂和催化剂。如图是离子液体1-丁基-3-甲基咪唑六氟磷酸盐的结构简式。下面说法正确的是
A.该物质含有的化学键类型是共价键
B.的空间构型为三角双锥形
C.该物质中N有2种杂化轨道类型
D.离子液体的沸点较低,容易挥发
9.水()是一种非常重要的资源,下面关于水的结构和性质的描述正确的是
A.水是平面三角形分子
B.水分子结构稳定,因为水分子可以形成氢键
C.冰熔化时水分子中共价键发生断裂
D.水分子中的氧原子采用杂化
10.干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较正确的是
A.晶体的熔点:干冰>冰
B.晶体中的空间利用率;干冰>冰
C.晶体中分子间相互作用力相同
D.晶体中键的极性和分子的极性相同
11.一种麻醉剂的分子结构式如图所示,其中X的原子核中只有1个质子,元素Y、Z、W的原子序数依次增大,且均位于X的下一周期;元素E的原子比元素W的原子多8个电子。下列说法正确的是
A.电负性:W>Z>Y>X
B.Y与E形成的化合物YE4是一种比水轻的油状液体
C.气态氢化物的稳定性Y>Z
D.ZW2的空间构型为直线形
12.下列关于元素或物质性质的比较中,正确的是
A.键长:HF>HCl>HBr>HI
B.熔点:CCl4>SiCl4
C.酸性:
D.沸点:对羟基苯甲醛()<邻羟基苯甲醛()
13.下列说法正确的是
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.Na投入到水中,有共价键的断裂与形成
C.N2和HCl两种分子中,每个原子的最外层都具有8电子稳定结构
D.常温常压下,H2O与NH3的状态不同可以说明H2O的热稳定性更好
二、非选择题(共10题)
14.碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______,每个Ba2+与____个O2-配位。
15.Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式是,其环状结构如图所示,S原子采用的轨道杂化方式是_______;
(2)Se的核外电子的排布式为_______;
(3)气态分子的立体构型为_______,离子的立体构型为_______;
(4)O的非金属性比S_______(填“强”或“弱”),举一个化学方程式说明:_______。
三、实验题
16.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。某化学兴趣小组在实验室制取氯水和氯酸钾,并进行相关实验。
Ⅰ.用如图所示实验装置制取氯水和氯酸钾。
(1)氯酸钾中氯原子的杂化方式为_______,装置A圆底烧瓶中发生反应的化学方程式为_______。
(2)在确保KOH溶液完全反应的条件下,若对调装置B和C的位置,C中氯酸钾的产率会_______(填“增大”“减小”或“不变”),原因是_______。
Ⅱ.测定从装置C试管中分离得到的粗产品中的质量分数(粗产品中混有的杂质是和);碱性条件下,氧化性较弱,不能氧化。测定粗产品中的纯度的实验过程如下:
步骤1:取3.00g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,KOH溶液调节pH,然后滴加过量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2min,冷却。
步骤3:将溶液转移到碘量瓶中(如图)加将溶液调至弱酸性,加过量的的KI溶液,加盖水封、于暗处放置5min。
步骤4:以淀粉为指示剂,用标准溶液滴定碘量瓶中的溶液至终点,平行操作三次。平均消耗溶液。相关反应为。
(3)步骤2中,煮沸溶液1~2min的目的是_______。
(4)步骤3发生反应的离子方程式为_______。
(5)使用碘量瓶时,加盖水封的目的是_______。
(6)粗产品中的质量分数为_______。(保留三位有效数字)
17.Ⅰ.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
(1)操作Ⅰ、Ⅱ中,不会用到的装置是_______(填序号)。
A. B. C.
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是_______。
(3)操作Ⅱ的名称是_______。操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)下列有关青蒿素研究的说法正确的是_______
A.利用黄花蒿茎叶研究青蒿素结构的基本步骤:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B.可用X射线衍射测定分子的空间结构
C.元素分析仪可以确定青蒿素中是否含有C、H、O等元素
D.可用质谱法确定分子中含有何种官能团的信息
(5)青蒿素分子中的含氧官能团除过氧基(-O-O-)外,还有_______(写名称)
Ⅱ.完成下列填空
(6)表示的有机物的分子式为_______;其中碳原子的杂化方式有_______种。
(7) 的系统命名法名称是_______,其一氯代物有_______种。
(8)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为_______,分子式为_______。
18.某实验小组对FeCl3溶液与Na2SO3溶液的反应进行探究。
已知:铁氰化钾的化学式为K3[Fe(CN)6],用于检验Fe2+,遇Fe2+离子产生蓝色沉淀
【实验1】
装置 实验现象
现象i:一开始溶液颜色加深,由棕黄色变为红褐色。现象ii:一段时间后溶液颜色变浅,变为浅黄色。
(1)SO离子中中心原子的杂化类型___________,Fe3+简化的核外电子排布式___________。
(2)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。从化学平衡角度说明浓盐酸的作用:___________。
(3)探究现象i产生的原因:
①甲同学认为发生反应:2Fe3++3SO+6H2O2Fe(OH)3(胶体)+3H2SO3;他取少量红褐色溶液于试管中,继续滴加1 mol/L Na2SO3溶液,发现溶液红褐色变深且产生刺激性气味的气体,该气体是___________(填化学式)。
②乙同学认为还发生了氧化还原反应,其离子方程式为___________;他取少许红褐色溶液于试管中,加入___________,有白色沉淀产生,证明产物中含有SO。
丙同学认为乙同学的实验不严谨,因为在上述过程中SO可能被其它物质氧化。为了进一步确认SO被氧化的原因,丙同学设计了实验2。
【实验2】
用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转。
(4)③实验2中正极的电极反应式为___________。丙同学又用铁氰化钾溶液检验正极的产物,观察到有蓝色沉淀产生。他得出的结论是___________。
(5)综合上述结果,请从平衡移动角度解释,现象ii产生的原因为___________。
四、计算题
19.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
20.有机化合物A含有C、H、O三种元素,取该有机物0.2 mol 和0.9 mol O2在密闭容器中燃烧,产物为CO、CO2和H2O(g),把产物依次通过浓硫酸、灼热的氧化铜和碱石灰。结果,浓H2SO4的质量重了18g ,CuO的质量轻了9.6g,碱石灰的质量增重了35.2g。
(1)通过计算确定有机物A的分子式为________;
(2)若A可与金属钠反应生成氢气,且A分子中含有手性碳原子, A的结构简式为________。
21.(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.4665nm,阿伏加德罗常数的值为NA,则Li2O的密度为_______g·cm-3(列出计算式)。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Fe2+位于S所形成的正八面体的体心,该正八面体的边长为_______nm。
22.Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于区,最外层没有单电子,其余的均为短周期主族元素;
②基态Y原子的价电子排布式为;
③基态Q、X原子p轨道的未成对电子数都是2;
④基态M原子的能级有1个单电子。
请回答下列问题:
(1)Z在周期表中的位置为______。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为______(用对应元素的符号填写)。
(3)分析下表中两种物质的键能数据(单位:)。
351 745 1076
196 418 945
结合数据说明比活泼的原因:__________________。
23.X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的第二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子;基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_______形象化描述。
(2)基态X原子的价层电子排布图为_______。基态W原子中有_______对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y_______(填“>”或“<”)Z。
(4)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为_______;其酸根离子的空间构型为_______。
(5)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______。
参考答案:
1.B 2.C 3.C 4.B 5.B 6.B 7.C 8.C 9.D 10.B 11.A 12.C 13.B
14. sp2 范德华力 C>H >Si < BaPbO3 12
15.(1)杂化
(2)
(3) 平面正三角形 三角锥形
(4) 强 /
16.(1) sp3 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2) 减小 浓盐酸具有挥发性,A装置中挥发出来的HCl,会消耗C装置中的KOH
(3)除去溶液中过量的H2O2,防止干扰后续实验
(4)
(5)防止碘挥发损失
(6)20.4%(或0.204)
17.(1)C
(2)浸取青蒿素
(3) 蒸馏 B
(4)ABC
(5)醚键、酯基
(6) C8H11NO2 3
(7) 3,3,5,5—四甲基庚烷 4
(8) 74 C4H10O
18.(1) sp3 [Ar]3d5
(2)Fe3++3H2OFe(OH)3+3H+,盐酸抑制氯化铁水解
(3) SO2 2Fe3++SO+H2O=2Fe2++SO+2H+ 足量盐酸和BaCl2溶液
(4) Fe3++e-=Fe2+ Fe3+能够氧化SO
(5)随着FeCl3与Na2SO3之间氧化还原反应的进行,FeCl3与Na2SO3浓度降低,使得平衡2Fe3++3SO+6H2O2Fe(OH)3(胶体)+3H2SO3逆向移动,溶液颜色变浅
19.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
20.(1)C4H10O
(2)
21.
22. 第四周期IIB族 中断裂第一个π键的能量是,中断裂第一个π键的能量是,所以的第一个π键比更容易断裂
23.(1)电子云
(2) 9
(3)>
(4) sp2 平面三角形
(5)破坏分子间作用力和氢键所需能量低于破坏化学键所需能量
