2.2化学平衡同步练习题 (含解析)高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡同步练习题 (含解析)高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 00:00:00 | ||
图片预览



文档简介
2.2化学平衡同步练习题
一、选择题
1.工业合成氨: ,以下分析错误的是
A.增大压强,可提高的产率
B.适当升高温度,可提高的日产量
C.改用更高效催化剂,可提高的平衡转化率
D.提高反应物中比例,可提高的平衡转化率
2.一定温度下,向2L密闭容器中加入发生反应①,②,反应体系中、、的物质的量随反应时间t的部分变化曲线如图所示,下列说法正确的是
A.曲线Ⅱ表示随t的变化
B.内,
C.后,充入,容器的气体颜色先变深后变浅
D.后,充入,容器的气体颜色变浅
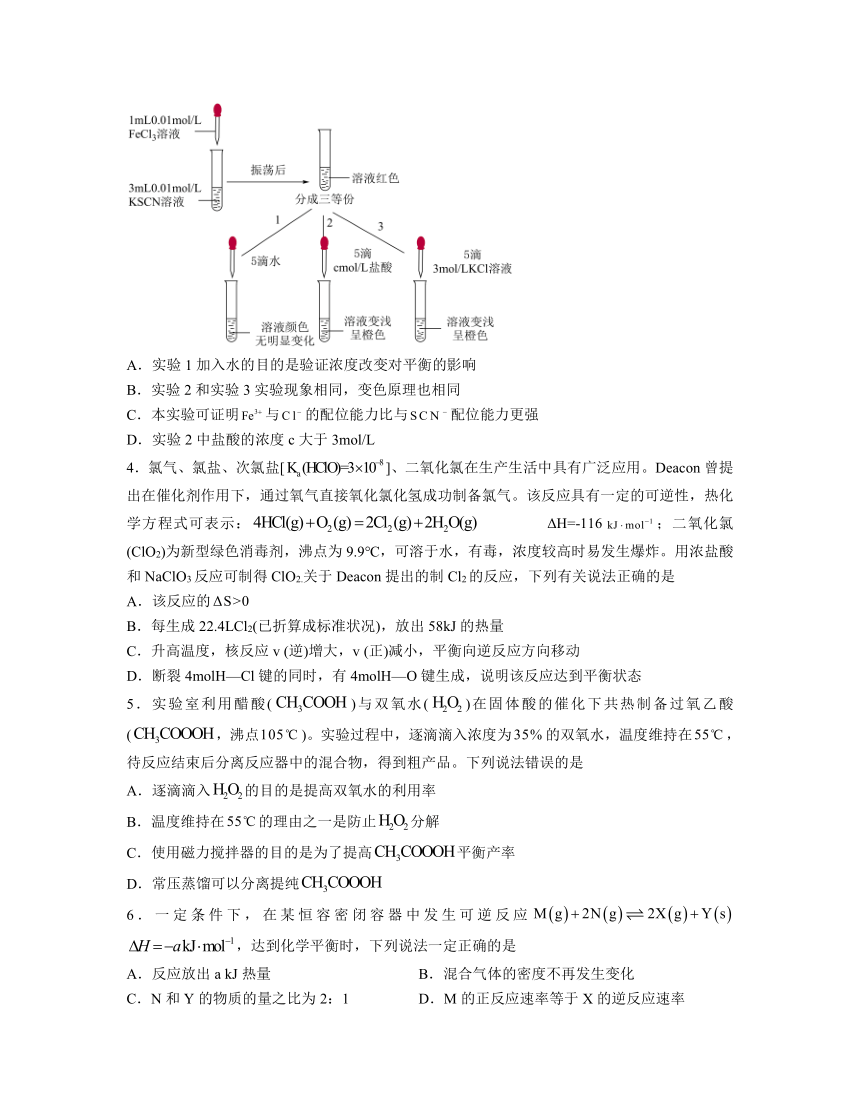
3.实验小组探究对的影响。已知(黄色)。将1mL 0.01mol/L 溶液与3mL 0.01mol/L KSCN溶液混合,得到红色溶液,将该红色溶液分成三等份,进行如下实验1、2、3,下列说法正确的是
A.实验1加入水的目的是验证浓度改变对平衡的影响
B.实验2和实验3实验现象相同,变色原理也相同
C.本实验可证明与的配位能力比与配位能力更强
D.实验2中盐酸的浓度c大于3mol/L
4.氯气、氯盐、次氯盐[]、二氧化氯在生产生活中具有广泛应用。Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示: ;二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。用浓盐酸和NaClO3反应可制得ClO2.关于Deacon提出的制Cl2的反应,下列有关说法正确的是
A.该反应的
B.每生成22.4LCl2(已折算成标准状况),放出58kJ的热量
C.升高温度,核反应v (逆)增大,v (正)减小,平衡向逆反应方向移动
D.断裂4molH—Cl键的同时,有4molH—O键生成,说明该反应达到平衡状态
5.实验室利用醋酸()与双氧水()在固体酸的催化下共热制备过氧乙酸(,沸点)。实验过程中,逐滴滴入浓度为的双氧水,温度维持在,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是
A.逐滴滴入的目的是提高双氧水的利用率
B.温度维持在的理由之一是防止分解
C.使用磁力搅拌器的目的是为了提高平衡产率
D.常压蒸馏可以分离提纯
6.一定条件下,在某恒容密闭容器中发生可逆反应 ,达到化学平衡时,下列说法一定正确的是
A.反应放出a kJ热量 B.混合气体的密度不再发生变化
C.N和Y的物质的量之比为2:1 D.M的正反应速率等于X的逆反应速率
7.下列变化不能用勒夏特列原理解释的是
A.紫色石蕊试剂遇酸变红
B.加入催化剂有利于合成氨的反应
C.向溶液中加入固体KSCN后颜色变深
D.合成氨时将氨液化分离,可提高原料的利用率
8.500℃时向恒容密闭容器中充入1molNO2(g)发生如下反应:2NO2(g)N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是
A.气体颜色最终比原平衡时还要浅
B.平衡常数K增大
C.平衡向正反应方向移动
D.若恒容密闭体系中通入氦气,平衡正向移动
9.在2A(g)+B(g) 4C(g)+D(s) (△H>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
A.增大压强 B.增大C的浓度 C.使用催化剂 D.升高温度
10.CO与在作用下发生反应的能量变化及反应历程如图所示,两步基元反应为①(慢) ,②(快) 。下列说法正确的是
A.总反应速率主要取决于反应②的快慢
B.升高温度,平衡常数、均增大
C.与均为直线形分子
D.降低了CO与反应的△H
二、填空题
11.工业上氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+O2(g)2SO3(g) △H=-198kJ mol-1。假设该反应处于平衡状态,在体积不变的条件下,下列措施会对化学平衡产生怎样的影响?
(1)增加二氧化硫____
(2)升高温度____
(3)增大压强____
(4)移出三氧化硫____
12.回答下列问题:
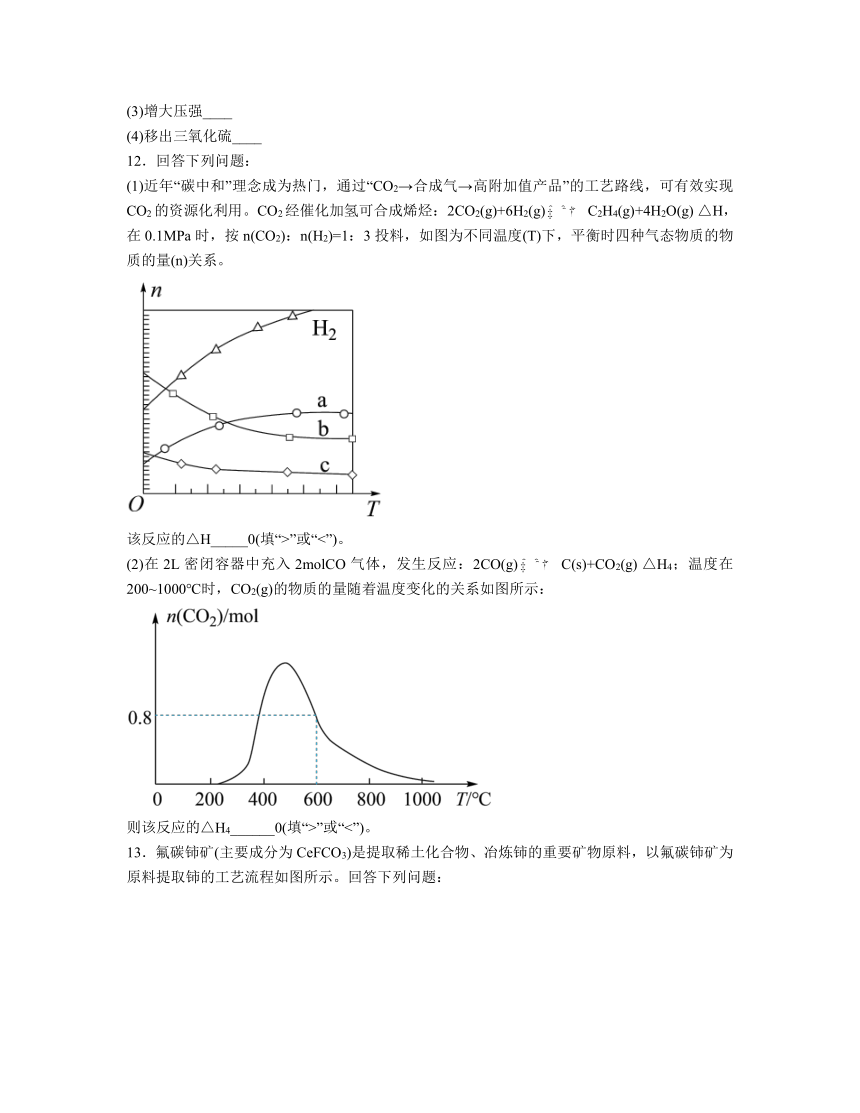
(1)近年“碳中和”理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路线,可有效实现CO2的资源化利用。CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) △H,在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
该反应的△H_____0(填“>”或“<”)。
(2)在2L密闭容器中充入2molCO气体,发生反应:2CO(g)C(s)+CO2(g) △H4;温度在200~1000℃时,CO2(g)的物质的量随着温度变化的关系如图所示:
则该反应的△H4______0(填“>”或“<”)。
13.氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
(1)HT是一种难溶于水的有机溶剂,则操作I的名称为___________
(2)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示:Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________
14.可逆反应①x(g)+2Y(g)2z(g)、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡时有关物理量的变化如下图:反应前,隔板左边加入1mol X和2mol Y,隔板右边加入2mol M;开始时隔板在“3”处,平衡(1)时隔板在“2.8”处,平衡(II)时隔板在“2.6”处。
(1)求平衡(I)时,体系的压强与反应开始时体系压强之比______。
(2)求平衡(II)时X的转化率______。
15.恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
16.某小组同学对与的反应进行探究。
【初步探究】室温下进行下表所列实验。
序号 操作 现象
实验I 取溶液,滴加溶液5~6滴(混合溶液) 溶液变为棕黄色
实验II 取实验反应后的溶液,滴加2滴溶液 溶液呈红色
(1)证明实验I中有生成,加入的试剂为_______。
(2)写出实验反应的离子方程式:_______。
(3)结合上述实验现象可以证明与发生可逆反应,原因是_______。
【深入探究】后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。
(4)已知在酸性较强的条件下,可被空气氧化为,故甲同学提出假设:该反应条件下空气将氧化为,使实验I中溶液棕黄色变深。甲同学设计实验:_______,内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_______(写出两条)。
(5)乙同学查阅资料可知:与的反应体系中还存在,呈棕褐色。依据资料从平衡移动原理解释实验II中后溶液红色变浅的原因:_______。
17.研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的氧化。原因是的反应速率慢,反应程度小。
①I-在酸性条件下与反应的离子方程式是_____________________________________。
②在酸性条件下I-易被氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有,会对氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的通入到下列试剂中,一段时间后,记录实验现象与结果。已知:每参与反应,生成。
序号 试剂组成 反应前溶液的 反应后溶液的 的转化率 的生成量
甲 5.3 11.0 约10%
乙 5.1 4.1 约100% 大量
丙 5.2 3.5 —— 少量
①_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明在实验乙中的作用并解释_______________________。
【参考答案】
一、选择题
1.C
解析:A.增大压强平衡正向移动,氨气产率增大,A正确;
B.温度升高反应速率增大,氨气的日产量增大,B正确;
C.催化剂只能改变反应速率,不能使平衡移动,转化率不变,C错误;
D.增大氮气的浓度,平衡正向移动,氢气的转化率增大,D正确;
故选C。
2.C
【分析】向2L密闭容器中加入发生反应①,②,反应体系中、、的物质的量随反应时间t的部分变化曲线如图所示,反应过程中的物质的量减小,则曲线III表示随t的变化, 和的物质的量增大,且生成的物质的量更多,则曲线I表示随t的变化,曲线II表示随t的变化,以此解答。
解析:A.由分析可知,曲线II表示随t的变化,故A错误;
B.曲线III表示随t的变化,结合方程式 可知,内,,故B错误;
C.后,充入,的浓度增大,容器的气体颜色变深,然后平衡正向移动,容器的气体颜色变浅,故C正确;
D.反应①不是可逆反应,后,充入,的浓度不变,容器的气体颜色不变,故D错误;
故选C。
3.B
解析:A.实验1加入水的目的是排除浓度改变对溶液颜色变化的影响,A错误;
B.实验2和实验3都是与络合,使减小,生成血红色物质的平衡逆移,颜色变浅呈橙色,B正确;
C.本实验中由于浓度远大于,所以不足以证明与的配位能力比与配位能力更强,C错误;
D.实验2中盐酸的浓度c应等于3mol/L,D错误;
故选B。
4.B
解析:A.反应为气体分子数减小的反应,为熵减反应,A错误;
B.由热化学方程式可知,每生成22.4LCl2(已折算成标准状况,为1mol),放出116kJ÷2=58kJ的热量,B正确;
C.升高温度,正逆反应速率均会变大,C错误;
D.断裂4molH—Cl键的同时,有4molH—O键生成,描述的都是正反应,不能说明该反应达到平衡状态,D错误;
故选B。
5.CD
解析:A.过氧化氢不稳定容易分解,逐滴滴入的目的是提高双氧水的利用率,A项正确;
B.过氧化氢受热分解生成氧气和水,温度维持在的理由之一是防止分解,B项正确;
C.使用磁力搅拌器的目的是为了增大反应物接触面积,加快反应速率,不能提高平衡产率,C项错误;
D.受热易分解,故采用减压蒸馏可以分离提纯出,D项错误;
故选CD。
6.B
解析:A.当1mol M(g)和2mol N(g)完全反应生成2mol X(g)和1mol Y(s)时才能放热a kJ,A错误;
B.化学平衡时,混合气体的密度不再发生变化,B正确;
C.起始时M和N的物质的量未知,反应进行的程度未知,故平衡时N和Y的物质的量之比不一定为2:1,C错误;
D.化学平衡时,正、逆反应速率相等,M的正反应速率与X的逆反应速率之比应等于化学计量数之比为1:2,D错误;
故选B。
7.B
解析:A.紫色石蕊试剂遇酸后离子会和氢离子结合生成红色物质,当氢离子浓度减小时红色物质又会生成离子,显示出蓝色,A错误;
B.加入催化剂是为了提高反应速率,不能用勒夏特列原理解释,B正确;
C.向溶液中加入固体KSCN后,增大了反应物的浓度平衡正向移动,颜色变深,C错误;
D.合成氨时将氨液化分离,减少了生成物的浓度平衡向正反应方向移动,可提高原料的利用率,D错误;
故选B。
8.C
【分析】恒容时达到平衡后,向容器内再充入1mol NO2,物质的量增大、压强增大,则平衡正向移动,但达到新平衡时浓度比原平衡时浓度大,且K与温度有关,以此来解答。
解析:A.达到新平衡时浓度比原平衡时浓度大,则气体颜色比原平衡时深,故A错误;
B.温度不变,平衡常数K不变,故B错误;
C.为气体体积减小的反应,恒容时,物质的量增大、压强增大,则平衡正向移动,故C正确;
D.向恒容容器中充入惰性气体,虽然压强增大,但是参与反应的各物质浓度都没有变化所以平衡不会移动,故D错误;
故答案选C。
【点睛】本题考查化学平衡,为高频考点,把握K与温度的关系、压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大。
9.D
解析:A.正反应气体系数增大,增大压强,正逆反应速率加快,平衡向左移动,A不符合题意;
B.增大C的浓度,正逆反应速率加快,平衡向左移动,B不符合题意;
C.使用催化剂,正逆反应速率加快,平衡不移动,C不符合题意;
D.反应吸热,升高温度,正逆反应速率加快,平衡向右移动,D符合题意;
故选D。
10.C
解析:A.总反应速率由反应慢的①决定,选项A错误;
B.①②均为放热反应,升高温度,平衡逆移,平衡常数减小,选项B错误;
C.氮气分子中存在氮氮三键,氮气的结构式为:N≡N,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的结构式为:O=C=O,与均为直线形分子,选项C正确;
D.作为反应的催化剂不能降低反应的△H,选项D错误;
答案选C。
二、填空题
11.(1)正向移动
(2)逆向移动
(3)不移动
(4)正向移动
解析:(1)增加二氧化硫,反应物浓度增大,平衡正向移动;
(2)该反应焓变小于0,为放热反应,升温平衡逆向移动;
(3)虽然增大压强,但体积不变,各物质的浓度不变,平衡不移动;
(4)移出三氧化硫,即减小生成物的浓度,平衡正向移动。
12.(1)<
(2)<
解析:(1)由曲线变化可知,随着温度升高,平衡时氢气的物质的量逐渐增大,说明升高温度,平衡逆向移动,则正反应放热,;
(2)从图可知,随着温度的升高,的物质的量先增大后减小,开始增大是因为温度升高反应速率增大,使得生成的增多,后的物质的量减小是因为温度升高,化学平衡逆向移动,导致的物质的量减小,则该反应是放热反应,;
13. 分液 向有机层中加入稀硫酸,c(H+)增大,平衡向形成Ce3+水溶液方向移动。
【分析】此工艺流程题属于物质的分离、提纯类型,主要考查了物质分离、提纯的基本方法与化学平衡移动原理。由题目中的流程图可知,酸浸后加入的HT属于萃取剂,即操作Ⅰ为分液;所得硫酸铈溶液与有机层主要通过调节pH,促进平衡移动得到Ce(OH)3后,通过氧气氧化最终获得Ce(OH)4。
解析:(1)加入萃取剂后经操作Ⅰ可分离出有机层和硫酸铈稀溶液,则操作Ⅰ为分液。
(2)由Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层),可知向有机层中加入稀硫酸,c(H+)增大,平衡逆向移动,即向形成Ce3+水溶液方向移动,从而获得较纯的含Ce3+水溶液。
14.3%
解析:(1)由右反应室内反应2M(g)N(g)+P(g)可知,右室内气体的物质的量不变,由图可知到达平衡(I)时,体系的压强与反应开始时体系压强之比为,故为;
(2)平衡(II)时,右边气体的物质的量不变,仍是2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,则有,解得x= mol,即物质的量减少了3-=mol,由反应x(g)+2Y(g)2z(g)可知,反应中减少的量等于反应的x的量,所以平衡(II)时X的转化率为×100%=83.3%,故为83.3%。
15.(1)3.65mol (2)65%
解析:(1) 2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2.0 a 0
变化量(mol) 1.3 0.65 1.3
平衡量(mol) 0.7 3.0 1.3
则a=3.0mol+0.65mol=3.65mol
(2)平衡时SO3的转化率=
16.(1)淀粉溶液
(2)2Fe3++2I-2Fe2++I2
(3)KI过量反应后仍含铁离子,说明反应不能进行彻底,证明反应为可逆反应
(4) 向试管中加入5mL0.1molKI溶液和2滴淀粉溶液,加酸调至pH=5 c(I-)低,c(H+)低
(5)由于存在化学平衡,使c(I2)减小,2Fe3++2I-2Fe2++I2平衡正向进行,c(Fe3+)减小,Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅
解析:(1)取溶液,滴加溶液5~6滴(混合溶液),证明实验I中有l2生成,检验碘单质可以选用淀粉溶液,溶液变蓝色说明生成了碘单质;
(2)实验I中Fe3+与I-发生氧化还原反应生成碘单质和亚铁离子,反应的离子方程式为: 2Fe3++2I-2Fe2++I2;
(3)实验II取2mL实验I反应后的溶液,滴加2滴溶液,溶液变红色,说明KI过量的前提下仍含铁离子,说明反应不能进行彻底,证明反应为可逆反应;
(4)已知在酸性较强的条件下,可被空气氧化为,故甲同学提出假设:该反应条件下空气将氧化为,使实验I中溶液棕黄色变深。甲同学可以设计如下实验:向试管中加入5mL0.1molIKI溶液和2滴淀粉溶液,加酸调至pH=5,20min 内溶液不变蓝,证明该假设不成立;导致溶液不变蓝的因素可能是浓度低、H+浓度低,故答案为:向试管中加入5mL0.1molKI溶液和2滴淀粉溶液,加酸调至pH=5;c(I-)低、 c(H+)低;
(5)实验I中20min后溶液红色变浅的原因:由于存在化学平衡,碘离子过量,则碘单质浓度减小为主要因素,使得2Fe3++2I-2Fe2++I2平衡正向进行,铁离子浓度减小,导致Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅,故答案为:由于存在化学平衡,使c(I2)减小,2Fe3++2I-2Fe2++I2平衡正向进行,c(Fe3+)减小,Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅;
17. 增大,减小,使平衡正向移动,反应易于进行等其他合理答案 或的氧化产物与和反应产生的结合,促使该平衡正向移动,提高了的转化率等其他合理答案
【分析】(1)根据成键方式书写电子式;(2)根据氧化还原反应原理书写反应方程式,并根据平衡移动原理分析解答;(3)根据实验数据及平衡移动原理分析解答。
解析:(1) I2属于共价分子,电子式为: ,故答案为: ;
(2)①根据题干信息分析,I-在酸性条件下被氧化生成I2,反应的离子方程式是;
②根据提给信息中I-在非酸性条件下被氧化的反应方程式分析知,在酸性条件下I-易被氧化的可能的原因是增大,减小,使平衡正向移动,反应易于进行,故答案为: ;增大,减小,使平衡正向移动,反应易于进行等;
(3)①验证Fe2+对O3氧化I-产生的影响时,必须排除其它干扰因素,所以A、B组对照实验中c(Cl-)要相同,即c(NaCl)=2c(FeCl2)=2×1.5×10-2mol/L=3×10-2mol/L,故答案为:3×10-2;
②O3氧化I-时溶液显碱性,说明生成了碱性物质或离子,离子方程式为:,故答案为:;
③Fe2+具有强还原性,易被O3氧化生成Fe3+,Fe2+或Fe3+结合OH-生成弱碱,促使反应正向进行,提高I-转化率,故答案为: 或的氧化产物与和反应产生的结合,促使该平衡正向移动,提高了的转化率。
一、选择题
1.工业合成氨: ,以下分析错误的是
A.增大压强,可提高的产率
B.适当升高温度,可提高的日产量
C.改用更高效催化剂,可提高的平衡转化率
D.提高反应物中比例,可提高的平衡转化率
2.一定温度下,向2L密闭容器中加入发生反应①,②,反应体系中、、的物质的量随反应时间t的部分变化曲线如图所示,下列说法正确的是
A.曲线Ⅱ表示随t的变化
B.内,
C.后,充入,容器的气体颜色先变深后变浅
D.后,充入,容器的气体颜色变浅
3.实验小组探究对的影响。已知(黄色)。将1mL 0.01mol/L 溶液与3mL 0.01mol/L KSCN溶液混合,得到红色溶液,将该红色溶液分成三等份,进行如下实验1、2、3,下列说法正确的是
A.实验1加入水的目的是验证浓度改变对平衡的影响
B.实验2和实验3实验现象相同,变色原理也相同
C.本实验可证明与的配位能力比与配位能力更强
D.实验2中盐酸的浓度c大于3mol/L
4.氯气、氯盐、次氯盐[]、二氧化氯在生产生活中具有广泛应用。Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示: ;二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。用浓盐酸和NaClO3反应可制得ClO2.关于Deacon提出的制Cl2的反应,下列有关说法正确的是
A.该反应的
B.每生成22.4LCl2(已折算成标准状况),放出58kJ的热量
C.升高温度,核反应v (逆)增大,v (正)减小,平衡向逆反应方向移动
D.断裂4molH—Cl键的同时,有4molH—O键生成,说明该反应达到平衡状态
5.实验室利用醋酸()与双氧水()在固体酸的催化下共热制备过氧乙酸(,沸点)。实验过程中,逐滴滴入浓度为的双氧水,温度维持在,待反应结束后分离反应器中的混合物,得到粗产品。下列说法错误的是
A.逐滴滴入的目的是提高双氧水的利用率
B.温度维持在的理由之一是防止分解
C.使用磁力搅拌器的目的是为了提高平衡产率
D.常压蒸馏可以分离提纯
6.一定条件下,在某恒容密闭容器中发生可逆反应 ,达到化学平衡时,下列说法一定正确的是
A.反应放出a kJ热量 B.混合气体的密度不再发生变化
C.N和Y的物质的量之比为2:1 D.M的正反应速率等于X的逆反应速率
7.下列变化不能用勒夏特列原理解释的是
A.紫色石蕊试剂遇酸变红
B.加入催化剂有利于合成氨的反应
C.向溶液中加入固体KSCN后颜色变深
D.合成氨时将氨液化分离,可提高原料的利用率
8.500℃时向恒容密闭容器中充入1molNO2(g)发生如下反应:2NO2(g)N2O4(g),反应达到平衡后,向容器内再充入1molNO2,下列说法正确的是
A.气体颜色最终比原平衡时还要浅
B.平衡常数K增大
C.平衡向正反应方向移动
D.若恒容密闭体系中通入氦气,平衡正向移动
9.在2A(g)+B(g) 4C(g)+D(s) (△H>0)已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施
A.增大压强 B.增大C的浓度 C.使用催化剂 D.升高温度
10.CO与在作用下发生反应的能量变化及反应历程如图所示,两步基元反应为①(慢) ,②(快) 。下列说法正确的是
A.总反应速率主要取决于反应②的快慢
B.升高温度,平衡常数、均增大
C.与均为直线形分子
D.降低了CO与反应的△H
二、填空题
11.工业上氧化二氧化硫制三氧化硫反应的化学方程式为:2SO2(g)+O2(g)2SO3(g) △H=-198kJ mol-1。假设该反应处于平衡状态,在体积不变的条件下,下列措施会对化学平衡产生怎样的影响?
(1)增加二氧化硫____
(2)升高温度____
(3)增大压强____
(4)移出三氧化硫____
12.回答下列问题:
(1)近年“碳中和”理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路线,可有效实现CO2的资源化利用。CO2经催化加氢可合成烯烃:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) △H,在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
该反应的△H_____0(填“>”或“<”)。
(2)在2L密闭容器中充入2molCO气体,发生反应:2CO(g)C(s)+CO2(g) △H4;温度在200~1000℃时,CO2(g)的物质的量随着温度变化的关系如图所示:
则该反应的△H4______0(填“>”或“<”)。
13.氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
(1)HT是一种难溶于水的有机溶剂,则操作I的名称为___________
(2)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示:Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________
14.可逆反应①x(g)+2Y(g)2z(g)、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡时有关物理量的变化如下图:反应前,隔板左边加入1mol X和2mol Y,隔板右边加入2mol M;开始时隔板在“3”处,平衡(1)时隔板在“2.8”处,平衡(II)时隔板在“2.6”处。
(1)求平衡(I)时,体系的压强与反应开始时体系压强之比______。
(2)求平衡(II)时X的转化率______。
15.恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g)2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
16.某小组同学对与的反应进行探究。
【初步探究】室温下进行下表所列实验。
序号 操作 现象
实验I 取溶液,滴加溶液5~6滴(混合溶液) 溶液变为棕黄色
实验II 取实验反应后的溶液,滴加2滴溶液 溶液呈红色
(1)证明实验I中有生成,加入的试剂为_______。
(2)写出实验反应的离子方程式:_______。
(3)结合上述实验现象可以证明与发生可逆反应,原因是_______。
【深入探究】后继续观察实验现象:实验I溶液棕黄色变深;实验II溶液红色变浅。
(4)已知在酸性较强的条件下,可被空气氧化为,故甲同学提出假设:该反应条件下空气将氧化为,使实验I中溶液棕黄色变深。甲同学设计实验:_______,内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_______(写出两条)。
(5)乙同学查阅资料可知:与的反应体系中还存在,呈棕褐色。依据资料从平衡移动原理解释实验II中后溶液红色变浅的原因:_______。
17.研究水体中碘的存在形态及其转化是近年的科研热点。I-与I2在水体和大气中的部分转化如下图所示。
(1) I2的电子式为______________。
(2)水体中的I-在非酸性条件下难于被空气中的氧化。原因是的反应速率慢,反应程度小。
①I-在酸性条件下与反应的离子方程式是_____________________________________。
②在酸性条件下I-易被氧化的可能的原因是______________________________________。
(3)有资料显示:水体中若含有,会对氧化I-产生影响。为检验这一结论,进行如下探究实验:分别将等量的通入到下列试剂中,一段时间后,记录实验现象与结果。已知:每参与反应,生成。
序号 试剂组成 反应前溶液的 反应后溶液的 的转化率 的生成量
甲 5.3 11.0 约10%
乙 5.1 4.1 约100% 大量
丙 5.2 3.5 —— 少量
①_______________________。
②甲中反应为可逆反应,其离子方程式是________________________。
③比较甲、乙、丙实验,说明在实验乙中的作用并解释_______________________。
【参考答案】
一、选择题
1.C
解析:A.增大压强平衡正向移动,氨气产率增大,A正确;
B.温度升高反应速率增大,氨气的日产量增大,B正确;
C.催化剂只能改变反应速率,不能使平衡移动,转化率不变,C错误;
D.增大氮气的浓度,平衡正向移动,氢气的转化率增大,D正确;
故选C。
2.C
【分析】向2L密闭容器中加入发生反应①,②,反应体系中、、的物质的量随反应时间t的部分变化曲线如图所示,反应过程中的物质的量减小,则曲线III表示随t的变化, 和的物质的量增大,且生成的物质的量更多,则曲线I表示随t的变化,曲线II表示随t的变化,以此解答。
解析:A.由分析可知,曲线II表示随t的变化,故A错误;
B.曲线III表示随t的变化,结合方程式 可知,内,,故B错误;
C.后,充入,的浓度增大,容器的气体颜色变深,然后平衡正向移动,容器的气体颜色变浅,故C正确;
D.反应①不是可逆反应,后,充入,的浓度不变,容器的气体颜色不变,故D错误;
故选C。
3.B
解析:A.实验1加入水的目的是排除浓度改变对溶液颜色变化的影响,A错误;
B.实验2和实验3都是与络合,使减小,生成血红色物质的平衡逆移,颜色变浅呈橙色,B正确;
C.本实验中由于浓度远大于,所以不足以证明与的配位能力比与配位能力更强,C错误;
D.实验2中盐酸的浓度c应等于3mol/L,D错误;
故选B。
4.B
解析:A.反应为气体分子数减小的反应,为熵减反应,A错误;
B.由热化学方程式可知,每生成22.4LCl2(已折算成标准状况,为1mol),放出116kJ÷2=58kJ的热量,B正确;
C.升高温度,正逆反应速率均会变大,C错误;
D.断裂4molH—Cl键的同时,有4molH—O键生成,描述的都是正反应,不能说明该反应达到平衡状态,D错误;
故选B。
5.CD
解析:A.过氧化氢不稳定容易分解,逐滴滴入的目的是提高双氧水的利用率,A项正确;
B.过氧化氢受热分解生成氧气和水,温度维持在的理由之一是防止分解,B项正确;
C.使用磁力搅拌器的目的是为了增大反应物接触面积,加快反应速率,不能提高平衡产率,C项错误;
D.受热易分解,故采用减压蒸馏可以分离提纯出,D项错误;
故选CD。
6.B
解析:A.当1mol M(g)和2mol N(g)完全反应生成2mol X(g)和1mol Y(s)时才能放热a kJ,A错误;
B.化学平衡时,混合气体的密度不再发生变化,B正确;
C.起始时M和N的物质的量未知,反应进行的程度未知,故平衡时N和Y的物质的量之比不一定为2:1,C错误;
D.化学平衡时,正、逆反应速率相等,M的正反应速率与X的逆反应速率之比应等于化学计量数之比为1:2,D错误;
故选B。
7.B
解析:A.紫色石蕊试剂遇酸后离子会和氢离子结合生成红色物质,当氢离子浓度减小时红色物质又会生成离子,显示出蓝色,A错误;
B.加入催化剂是为了提高反应速率,不能用勒夏特列原理解释,B正确;
C.向溶液中加入固体KSCN后,增大了反应物的浓度平衡正向移动,颜色变深,C错误;
D.合成氨时将氨液化分离,减少了生成物的浓度平衡向正反应方向移动,可提高原料的利用率,D错误;
故选B。
8.C
【分析】恒容时达到平衡后,向容器内再充入1mol NO2,物质的量增大、压强增大,则平衡正向移动,但达到新平衡时浓度比原平衡时浓度大,且K与温度有关,以此来解答。
解析:A.达到新平衡时浓度比原平衡时浓度大,则气体颜色比原平衡时深,故A错误;
B.温度不变,平衡常数K不变,故B错误;
C.为气体体积减小的反应,恒容时,物质的量增大、压强增大,则平衡正向移动,故C正确;
D.向恒容容器中充入惰性气体,虽然压强增大,但是参与反应的各物质浓度都没有变化所以平衡不会移动,故D错误;
故答案选C。
【点睛】本题考查化学平衡,为高频考点,把握K与温度的关系、压强对平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大。
9.D
解析:A.正反应气体系数增大,增大压强,正逆反应速率加快,平衡向左移动,A不符合题意;
B.增大C的浓度,正逆反应速率加快,平衡向左移动,B不符合题意;
C.使用催化剂,正逆反应速率加快,平衡不移动,C不符合题意;
D.反应吸热,升高温度,正逆反应速率加快,平衡向右移动,D符合题意;
故选D。
10.C
解析:A.总反应速率由反应慢的①决定,选项A错误;
B.①②均为放热反应,升高温度,平衡逆移,平衡常数减小,选项B错误;
C.氮气分子中存在氮氮三键,氮气的结构式为:N≡N,二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的结构式为:O=C=O,与均为直线形分子,选项C正确;
D.作为反应的催化剂不能降低反应的△H,选项D错误;
答案选C。
二、填空题
11.(1)正向移动
(2)逆向移动
(3)不移动
(4)正向移动
解析:(1)增加二氧化硫,反应物浓度增大,平衡正向移动;
(2)该反应焓变小于0,为放热反应,升温平衡逆向移动;
(3)虽然增大压强,但体积不变,各物质的浓度不变,平衡不移动;
(4)移出三氧化硫,即减小生成物的浓度,平衡正向移动。
12.(1)<
(2)<
解析:(1)由曲线变化可知,随着温度升高,平衡时氢气的物质的量逐渐增大,说明升高温度,平衡逆向移动,则正反应放热,;
(2)从图可知,随着温度的升高,的物质的量先增大后减小,开始增大是因为温度升高反应速率增大,使得生成的增多,后的物质的量减小是因为温度升高,化学平衡逆向移动,导致的物质的量减小,则该反应是放热反应,;
13. 分液 向有机层中加入稀硫酸,c(H+)增大,平衡向形成Ce3+水溶液方向移动。
【分析】此工艺流程题属于物质的分离、提纯类型,主要考查了物质分离、提纯的基本方法与化学平衡移动原理。由题目中的流程图可知,酸浸后加入的HT属于萃取剂,即操作Ⅰ为分液;所得硫酸铈溶液与有机层主要通过调节pH,促进平衡移动得到Ce(OH)3后,通过氧气氧化最终获得Ce(OH)4。
解析:(1)加入萃取剂后经操作Ⅰ可分离出有机层和硫酸铈稀溶液,则操作Ⅰ为分液。
(2)由Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层),可知向有机层中加入稀硫酸,c(H+)增大,平衡逆向移动,即向形成Ce3+水溶液方向移动,从而获得较纯的含Ce3+水溶液。
14.3%
解析:(1)由右反应室内反应2M(g)N(g)+P(g)可知,右室内气体的物质的量不变,由图可知到达平衡(I)时,体系的压强与反应开始时体系压强之比为,故为;
(2)平衡(II)时,右边气体的物质的量不变,仍是2mol,左右气体压强相等,设平衡时左边气体的物质的量为xmol,则有,解得x= mol,即物质的量减少了3-=mol,由反应x(g)+2Y(g)2z(g)可知,反应中减少的量等于反应的x的量,所以平衡(II)时X的转化率为×100%=83.3%,故为83.3%。
15.(1)3.65mol (2)65%
解析:(1) 2SO2(g)+O2(g)2SO3(g)
起始量(mol) 2.0 a 0
变化量(mol) 1.3 0.65 1.3
平衡量(mol) 0.7 3.0 1.3
则a=3.0mol+0.65mol=3.65mol
(2)平衡时SO3的转化率=
16.(1)淀粉溶液
(2)2Fe3++2I-2Fe2++I2
(3)KI过量反应后仍含铁离子,说明反应不能进行彻底,证明反应为可逆反应
(4) 向试管中加入5mL0.1molKI溶液和2滴淀粉溶液,加酸调至pH=5 c(I-)低,c(H+)低
(5)由于存在化学平衡,使c(I2)减小,2Fe3++2I-2Fe2++I2平衡正向进行,c(Fe3+)减小,Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅
解析:(1)取溶液,滴加溶液5~6滴(混合溶液),证明实验I中有l2生成,检验碘单质可以选用淀粉溶液,溶液变蓝色说明生成了碘单质;
(2)实验I中Fe3+与I-发生氧化还原反应生成碘单质和亚铁离子,反应的离子方程式为: 2Fe3++2I-2Fe2++I2;
(3)实验II取2mL实验I反应后的溶液,滴加2滴溶液,溶液变红色,说明KI过量的前提下仍含铁离子,说明反应不能进行彻底,证明反应为可逆反应;
(4)已知在酸性较强的条件下,可被空气氧化为,故甲同学提出假设:该反应条件下空气将氧化为,使实验I中溶液棕黄色变深。甲同学可以设计如下实验:向试管中加入5mL0.1molIKI溶液和2滴淀粉溶液,加酸调至pH=5,20min 内溶液不变蓝,证明该假设不成立;导致溶液不变蓝的因素可能是浓度低、H+浓度低,故答案为:向试管中加入5mL0.1molKI溶液和2滴淀粉溶液,加酸调至pH=5;c(I-)低、 c(H+)低;
(5)实验I中20min后溶液红色变浅的原因:由于存在化学平衡,碘离子过量,则碘单质浓度减小为主要因素,使得2Fe3++2I-2Fe2++I2平衡正向进行,铁离子浓度减小,导致Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅,故答案为:由于存在化学平衡,使c(I2)减小,2Fe3++2I-2Fe2++I2平衡正向进行,c(Fe3+)减小,Fe3++3SCN-=Fe(SCN)3平衡逆向进行,溶液红色变浅;
17. 增大,减小,使平衡正向移动,反应易于进行等其他合理答案 或的氧化产物与和反应产生的结合,促使该平衡正向移动,提高了的转化率等其他合理答案
【分析】(1)根据成键方式书写电子式;(2)根据氧化还原反应原理书写反应方程式,并根据平衡移动原理分析解答;(3)根据实验数据及平衡移动原理分析解答。
解析:(1) I2属于共价分子,电子式为: ,故答案为: ;
(2)①根据题干信息分析,I-在酸性条件下被氧化生成I2,反应的离子方程式是;
②根据提给信息中I-在非酸性条件下被氧化的反应方程式分析知,在酸性条件下I-易被氧化的可能的原因是增大,减小,使平衡正向移动,反应易于进行,故答案为: ;增大,减小,使平衡正向移动,反应易于进行等;
(3)①验证Fe2+对O3氧化I-产生的影响时,必须排除其它干扰因素,所以A、B组对照实验中c(Cl-)要相同,即c(NaCl)=2c(FeCl2)=2×1.5×10-2mol/L=3×10-2mol/L,故答案为:3×10-2;
②O3氧化I-时溶液显碱性,说明生成了碱性物质或离子,离子方程式为:,故答案为:;
③Fe2+具有强还原性,易被O3氧化生成Fe3+,Fe2+或Fe3+结合OH-生成弱碱,促使反应正向进行,提高I-转化率,故答案为: 或的氧化产物与和反应产生的结合,促使该平衡正向移动,提高了的转化率。
