专题1有机化学的发展及研究思路(含解析)单元测试卷高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题1有机化学的发展及研究思路(含解析)单元测试卷高二下学期化学苏教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 15:22:26 | ||
图片预览




文档简介
专题1《有机化学的发展及研究思路》单元测试卷
一、单选题
1.下列反应属于取代反应的是
①CHCl3+Cl2CCl4+HCl
②2HI+Cl2=2HCl+I2
③CO+2H2CH3OH
④CH3CH2CN+Cl2+HCl
⑤CH3CH2OH+HBrCH3CH2Br+H2O
A.①② B.①②③④
C.①④⑤ D.②④⑤
2.化学知识和技术发展离不开伟大化学家。下列人物与其贡献不匹配的是
A.侯德榜——工业制备烧碱 B.勒夏特列——化学平衡的移动
C.李比希——元素定量分析 D.盖斯——反应热的计算
3.从19世纪20年代开始,人们用从非生物体内取得的物质合成了许多有机物,下列属于最早合成的有机物是
A. B. C. D.
4.近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是
A.“天宫二号“航天器使用的质量轻强度高的材料——钛合金
B.“北斗三号”导航卫星使用的太阳能电池材料——砷化镓
C.“长征五号”运载火箭使用的高效燃料——液氢
D.“C919”飞机身使用的复合材料——碳纤维和环氧树脂
5.现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和甘油 ③溴化钠和单质溴的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是
A.分液、萃取、蒸馏、萃取 B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏 D.蒸馏、萃取、分液、萃取
6.下列各组物质,最适宜使用红外光谱法进行区分的是
A.1—丁醇(CH3CH2CH2CH2OH)、1—溴丁烷(CH3CH2CH2CH2Br)
B.1—丙醇(CH3CH2CH2OH),1—丁醇(CH3CH2CH2CH2OH)
C.苯( )、甲苯( )
D.2—甲基戊烷()、3—甲基戊烷( )
7.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.羟基的电子式:
C.乙炔的实验式:
D.乙醇的核磁共振氢谱:
8.1.4g某有机化合物在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O。下列说法不正确的是
A.该有机化合物中只含有碳元素和氢元素
B.该有机化合物中一定含有氧元素
C.该有机化合物的分子式可能是C2H4
D.该有机化合物分子中碳原子数与氢原子数之比一定是1:2
9.下列各组中的反应,属于同一反应类型的是
A.由溴乙烷水解制乙醇,由乙烯与水反应制乙醇
B.由对苯二甲酸与乙二醇制聚酯纤维;由乙烯制聚乙烯
C.乙烯使酸性高锰酸钾溶液褪色;葡萄糖发生的银镜反应
D.由氯代环己烷制环己烯;由丙烯加溴制-二溴丙烷
10.下列说法中正确的是
A.焰火、霓虹灯光、激光、荧光、LED灯光都与原子核外电子跃迁吸收能量有关
B.Li的发射光谱的谱图是亮底暗线
C.多原子分子的键角一定,表明共价键具有方向性
D.现代化学常利用红外光谱测定分子的相对分子质量
11.下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是
A.乙酸乙酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B.乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C.乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D.苯中含苯酚杂质:加入浓溴水,过滤
12.31g由三种醇组成的混合物与足量的金属钠完全反应后,得到标准状况下氢气11.2L,下列判断中正确的是
A.一定有甲醇 B.一定有乙醇
C.一定有甘油 D.一定有乙二醇
13.以下研究有机物方法的叙述不正确的是( )
A.质谱法可以快速、微量、精确测定相对分子质量
B.燃烧法是确定有机物成分的有效方法之一
C.从红外光谱图上可以获得分子中含有何种化学键或官能团的信息
D.从核磁共振氢谱图上只能推知有机物分子中氢原子的类型
14.下列有关物质的分离或鉴别说法正确的是
A.乙醛和乙酸无法通过核磁共振氢谱鉴别
B.质谱法是测定相对分子质量的精确方法、也可用于确定简单的分子结构
C.分液操作时应先将下层液体从分液漏斗下口放出后再将上层液体继续放出
D.石英玻璃的X射线衍射图存在明锐的衍射峰
15.燃烧0.1mol某有机物得0.2mol CO2和0.2mol H2O,由此得出的结论不正确的是
A.该有机物分子中可能含有氧原子
B.该有机物中碳、氢元素原子数目之比为1:2
C.该有机物分子中一定含有碳碳双键
D.该有机物分子中一定含有二个碳原子
二、填空题
16.经元素分析后,发现某烃的含碳量为82.76%,氢的质量分数则为17.24%,且相对分子质量为58,试推断该烃的分子式_____________
17.某含C、H、O三种元素的未知物A,现对A进行分析探究。
(1)经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则A的实验式为___________。
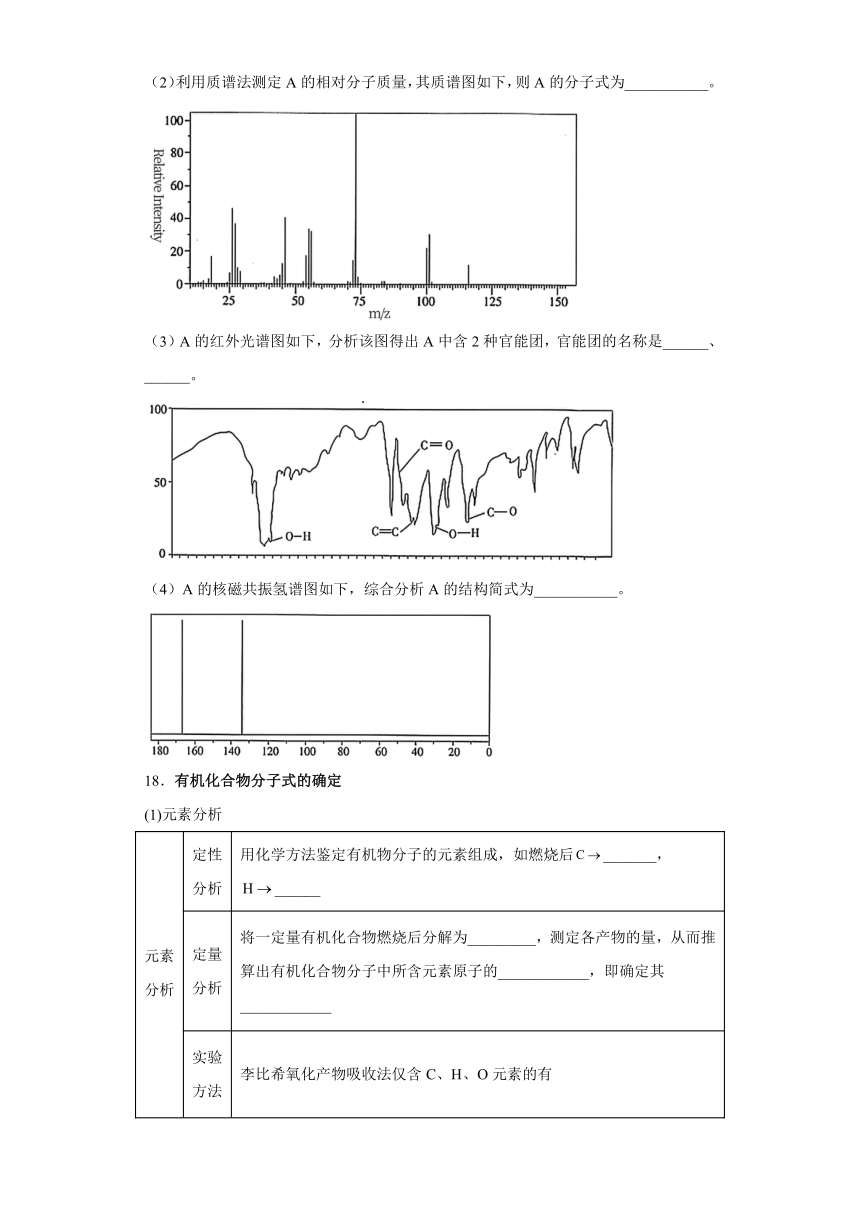
(2)利用质谱法测定A的相对分子质量,其质谱图如下,则A的分子式为___________。
(3)A的红外光谱图如下,分析该图得出A中含2种官能团,官能团的名称是______、______。
(4)A的核磁共振氢谱图如下,综合分析A的结构简式为___________。
18.有机化合物分子式的确定
(1)元素分析
元素分析 定性分析 用化学方法鉴定有机物分子的元素组成,如燃烧后_______,______
定量分析 将一定量有机化合物燃烧后分解为_________,测定各产物的量,从而推算出有机化合物分子中所含元素原子的____________,即确定其____________
实验方法 李比希氧化产物吸收法仅含C、H、O元素的有_________,;_________,→计算出分子中碳、氢原子的含量 →剩余的为________的含量 ②现代元素定量分析法
(2)相对分子质量的确定
①相对分子质量的测定——质谱法
质荷比(分子离子、碎片离子的_______________与其_______________的比值)_______________值即为该有机化合物的相对分子质量。
②计算气体相对分子质量的常用方法
a.
b.(标准状况)
c.根据阿伏加德罗定律,同温同压下,,则
三、实验题
19.咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10 4,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是___________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒___________。
(2)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是___________。
20.某化学小组为测定有机物G的组成和结构,设计如下实验装置:
回答下列问题:
(1)装置B和装置D中浓硫酸的作用分别是_______和_______。
(2)装置E和装置F中碱石灰的作用分别是_______和_______。
(3)若准确称取4.4g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成和),装置D质量增加3.6g,U形管E质量增加8.8g。又知有机物G的质谱图如图所示:
该有机物的分子式为_______。
(4)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6∶1∶1.综上所述,G的结构简式为_______。
21.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:+2CH3OH+2H2O。
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
物质 沸点/℃ 熔点/℃ 密度(20℃)/g·cm-3 溶解性
甲醇 64.7 0.7915 易溶于水
乙醚 34.5 0.7138 微溶于水
3,5-二甲氧基苯酚 33~36 易溶于甲醇、乙醚,微溶于水
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是____。
②萃取用到的分液漏斗使用前需____并洗净,分液时有机层在分液漏斗的____(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是____。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是____(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
参考答案:
1.C
【详解】①CHCl3中的H原子被Cl原子取代,属于取代反应;②该反应属于置换反应;③该反应属于化合反应;④CH3CH2CN分子中“—CH2—”的1个H原子被Cl原子取代,属于取代反应;⑤CH3CH2OH分子中的—OH被Br原子取代,属于取代反应。
答案选C。
2.A
【详解】A.侯德榜发明了侯氏制碱法,这里的碱指的是纯碱,A符合题意;
B.勒夏特列发现了勒夏特列原理,即化学平衡的移动原理,B不合题意;
C.李比希发明了李比希元素分析法,即通过氧化法进行元素定量分析,C不合题意;
D.盖斯发现了一个反应的反应热与反应途径无关,只与反应的始态和终态有关,即盖斯定律,因此可以计算一个反应的反应热,D不合题意;
故答案为A。
3.B
【详解】1828年德国化学家维勒,将一种无机物NH4CNO的水溶液加热得到了尿素,结构简式为NH2CONH2,开创了有机化学人工合成的新纪元。
故选B。
4.A
【详解】A.钛合金是合金材料,属于金属材料,故A符合题意
B.砷化镓是一种半导体材料,不是金属材料,故B不符合题意;
C.液氢是液态氢气单质,氢元素是非金属,不是金属材料,故C不符合题意;
D.碳纤维是碳元素组成的一种单质,是无机非金属材料,环氧树脂是有机高分子合成材料,都不是金属材料,故D不符合题意
答案选A。
5.C
【详解】萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质。乙酸乙酯不溶于水,分液即可;乙醇和甘油互溶,蒸馏即可;单质溴易溶在有机溶剂中,萃取即可;碘易溶在有机溶剂中,蒸馏即可,答案选C。
6.A
【分析】红外光谱法可以测定有机化合物分子中所含的化学键或官能团,若两种有机化合物中的化学键或官能团不同,则可以用红外光谱法进行区分,以此来解析;
【详解】A.1 丁醇的官能团是-OH,1 溴丁烷的官能团是碳溴键,化学键也不完全相同,可以用红外光谱法进行区分,A正确;
B.1-丙醇、1-丁醇的官能团都是-OH,化学键相同(C-C、C-H、C-O和O-H),无法用红外光谱法进行区分,B错误;
C.苯、甲苯中都没有官能团,化学键相同,无法用红外光谱法进行区分,C错误;
D.2-甲基戊烷、3-甲基戊烷中都没有官能团,化学键相同(C-C和C-H),无法用红外光谱法进行区分,D错误;
故选A。
7.B
【详解】A.丙烯的结构简式为CH3-CH=CH2,发生加聚反应生成聚丙烯,则聚丙烯的结构简式为,A项错误;
B.羟基的结构式为-OH,O原子最外层电子数为6,则羟基的电子式为,B项正确;
C.乙炔的分子式为C2H2,则乙炔的实验式(最简式)为CH,C项错误;
D.乙醇的结构简式为,乙醇分子中的等效氢原子有3种,则核磁共振氢谱有三组吸收峰,且氢原子的比值为3:2:1,则核磁共振氢谱吸收峰的峰面积比值为3:2:1,D项错误;
答案选B。
8.B
【详解】A.1.4g某有机化合物在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O,有机物中碳质量为,氢质量为,因此该有机化合物中只含有碳元素和氢元素,故A正确;
B.根据A选项分析得到该有机化合物中只含有碳元素和氢元素,一定不含有氧元素,故B错误;
C.根据A得到有机物碳、氢质量分别为1.2g、0.2g,则有机物中n(C):n(H)= ,因此该有机化合物的分子式可能是C2H4,故C正确;
D.根据前面C选项分子得到该有机化合物分子中碳原子数与氢原子数之比一定是1:2,故D正确。
综上所述,答案为B。
9.C
【详解】A.由溴乙烷水解制乙醇,发生的是取代反应,由乙烯与水反应制乙醇,发生的是加成反应,不属于同一反应类型,A错误;
B.由对苯二甲酸与乙二醇制聚酯纤维,发生的是缩聚反应,由乙烯制聚乙烯,发生是加聚反应,不属于同一反应类型,B错误;
C.乙烯使酸性高锰酸钾溶液褪色,发生的是氧化反应,葡萄糖发生的银镜反应,是氧化反应,属于同一反应类型,C正确;
D.由氯代环己烷制环己烯,发生的是消去反应,由丙烯加溴制-二溴丙烷,发生的是加成反应,不属于同一反应类型,D错误;
答案选C。
10.C
【详解】A.电子跃迁本质上是组成物质的粒子中电子的一种能量变化,焰火、霓虹灯光、激光、荧光、LED灯光产生时原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁释放能量有关,A错误;
B.物体发光直接产生的光谱叫做发射光谱,吸收光谱是在连续发射光谱的背景中呈现出的暗线,所以Li的发射光谱的谱图是暗底亮线,B错误;
C.共价键具有方向性,主要体现在多原子分子的键角一定,C正确;
D.质谱分析利用质荷比来测定分子的相对分子质量,红外光谱分析获得分子中含有的化学键或官能团的信息,D错误;
故选C。
11.A
【详解】A.乙酸乙酯中含乙酸杂质:若加入碳酸钠溶液,乙酸与碳酸钠发生反应产生可溶性乙酸钠,而乙酸乙酯在该溶液的溶解度很小,因此可以通过洗涤,分液分离得到,正确;
B.乙醇中含乙酸杂质:若加入碳酸钠溶液,乙酸与碳酸钠发生反应产生可溶性乙酸钠,但是由于乙醇也能够与水混溶,所以不能通过洗涤,分液的方法分离,错误;
C.乙醛中含乙酸杂质:若加入氢氧化钠溶液酸发生反应产生乙酸钠,而乙醛也在水中容易溶解,所以不能通过洗涤,分液分离,错误;
D.苯中含苯酚杂质:若加入溴水会形成三溴苯酚白色沉淀,但是三溴苯酚能够在苯中溶解,因此不能通过过滤除去,错误;
故选A。
12.C
【详解】若相当于一元醇,甲醇、甘油、乙醇分子量分别为:32、30.67、 46,11.2L(标准状况)氢气物质的量为0.5mol,则一元醇的物质的量为1mol,混合醇若为一元醇平均相对分子质量为:= 31,则三种醇平均相对分子质量为31,则一定含有相对分子质量大于31的物质,即可能含有有甲醇、乙醇,一定含有相对分子质量小于31的物质,一定含有甘油,综上所述,故选C。
13.D
【详解】A.质谱法可以快速、微量、精确测定有机物的相对分子质量,A正确;
B.利用燃烧法,能将有机物分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定实验式,B正确;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上处于不同的位置,所以红外光谱图能确定有机物分子中的化学键或官能团,C正确;
D.从核磁共振氢谱图上吸收峰的个数等于H原子的种类数量,吸收峰的面积之比等于不同类型H原子的个数比,故核磁共振氢谱图上可以推知有机物分子有几种不同类型的氢原子及它们的数目,D错误;
故答案为:D。
14.B
【详解】A.乙醛和乙酸中都有两种类型的H原子,且H原子个数比为1:3,但是化学位移不同,可以用核磁共振氢谱鉴别,A错误;
B.质谱仪把有机物打成很多小块,会有很多不同质荷比出现,其中最大的那个就是该有机物的相对分子质量,并依据质荷比及不同质荷比峰的相对强弱推测分子结构,B正确;
C.分液操作时应先将下层液体从分液漏斗下口放出后,再将上层液体从上口到处,C错误;
D.石英玻璃不是晶体,X射线衍射图不会出现明锐的衍射峰,D错误;
故选B。
15.C
【分析】燃烧0.1mol某有机物得0.2mol CO2和0.2mol H2O,根据元素守恒,则该有机物中有2个碳原子和4和氢原子,氧原子是否存在不确定,则该有机物可能为不含氧原子CH2=CH2,也可能为含有氧原子的CH3CHO;
【详解】A.由分析可知,该有机物可能为含有氧原子的CH3CHO,A项正确;
B.由分析可知,该有机物中有2个碳原子和4和氢原子,碳、氢元素原子数目之比为1:2,B项正确;
C.由分析可知,该有机物可能为含有氧原子的CH3CHO,该有机物中无碳碳双键,C项错误;
D.由分析可知,该有机物中有2个碳原子,D项正确;
答案选C。
16.C4H10
【详解】碳的质量分数是82.76%,氢的质量分数是17.24%,则该物质中碳、氢原子个数之比为(82.76%/12):(17.24%/1)=6:897:17.24=2:5,该烃的最简式是C2H5,相对分子质量为58,设分子式为C2nH5n:则12×2n+5n=58,得:n=2,则分子式C4H10。
17. 羧基 碳碳双键
【分析】(1)根据各元素的质量分数确定原子个数比,进而确定实验式;
(2)根据质谱图A的相对分子质量和实验式计算分子式;
(3)根据A的红外光谱图得出A中含官能团的种类;
(4)根据A的核磁共振氢谱图中氢原子种类和等效H个数比确定结构简式。
【详解】(1)根据已知碳的质量分数是41.38%,氢的质量分数是3.45%,则氧元素质量分数是1-41.38%-3.45%=55.17%,则该物质中碳、氢、氧原子个数之比=::=3.45:3.45:3.45=1:1:1,由原子个数比可知该有机物的实验式为CHO,故答案:CHO;
(2)由质谱图可知A的相对分子质量为116,根据A的实验式为CHO,设A的分子式为CnHnOn,则12n+4n+16n=116,解得n=4,则A的分子式为C4H4O4,故答案为:C4H4O4;
(3)根据A的红外光谱图得出A中含2种官能团分别为:碳碳双键、羧基,故答案为:碳碳双键;羧基;
(4)根据A的核磁共振氢谱图可知有两种类型的氢原子,且等效H个数比为1:1,则A的结构简式为HOOC CH=CH COOH,故答案为:HOOC CH=CH COOH。
18.(1) 简单无机物 最简整数比 实验式 无水 浓溶液 氧原子
(2) 相对质量 电荷数 最大
【详解】(1)用化学方法鉴定有机物分子的元素组成,燃烧后有CO2生成说明含有C元素、有H2O生成说明含有H元素;
将一定量有机化合物燃烧后分解为简单无机物,测定各产物的量,从而推算出有机化合物分子中所含元素原子的最简整数比,即确定其实验式;
仅含C、H、O元素的有机物氧化后,产物H2O用无水CaCl2吸收,CO2用KOH浓溶液吸收,根据二氧化碳、水的质量,计算出分子中碳氢原子的含量,其余的为氧原子的含量。
(2)质荷比(分子离子、碎片离子的相对质量与其电荷数的比值)最大值即为该有机化合物的相对分子质量。
19.(1) 增加固液接触面积,提取充分 几粒沸石
(2)升华
【详解】(1)萃取时将茶叶研细可以增加固液接触面积,从而使提取更充分;由于需要加热,为防止液体暴沸,加热前还要加入几粒沸石;
(2)根据已知信息可知咖啡因在100℃以上时开始升华,因此该分离提纯方法的名称是升华。
20.(1) 干燥 吸收有机物燃烧生成的水蒸气
(2) 吸收有机物燃烧生成的 吸收空气中的和
(3)
(4)
【分析】双氧水加入到二氧化锰中产生氧气,氧气中含有水蒸气,因此用浓硫酸干燥氧气,氧气和有机物样品反应生成二氧化碳和水,用浓硫酸吸收生成的水,利用浓硫酸增加的质量即为生成水的质量,E中碱石灰吸收生成的二氧化碳,F中碱石灰防止空气中二氧化碳和水进入到E中。
(1)
根据前面分析,氧气中含有水蒸气,因此装置B作用是干燥,反应后生成二氧化碳和水,因此装置D中浓硫酸的作用是吸收有机物燃烧生成的水蒸气;故答案为:干燥;吸收有机物燃烧生成的水蒸气。
(2)
装置E中碱石灰的作用是吸收有机物燃烧生成的,装置F中碱石灰的作用是吸收空气中的和,防止空气中的二氧化碳、水蒸气干扰实验;故答案为:吸收有机物燃烧生成的;吸收空气中的和。
(3)
根据题意,装置D质量增加3.6g,则水的质量为3.6g即物质的量为0.2mol,U形管E质量增加8.8g,则二氧化碳的质量为8.8g即物质的量为0.2mol。根据有机物G的质谱图分析得到相对分子质量为88,则4.4g该有机物物质的量为0.05mol,根据碳、氢守恒得到该有机物C4H8Ox,根据相对分子质量得到该有机物的分子式为;故答案为:。
(4)
已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6∶1∶1,则说明含有两个甲基,一个羧基,根据上述分析得到G的结构简式为 ;故答案为: 。
21.(1) 蒸馏 检查是否漏水 上
(2)除去HCl
(3)dcab
【分析】间苯三酚和甲醇在氯化氢的甲醇溶液中发生取代反应生成3,5-二甲氧基苯酚和水,反应结束后,先用蒸馏法离出甲醇,再加入乙醚进行萃取,有机相依次用饱和NaHCO3溶液洗涤除氯化氢、用饱和食盐水洗涤除碳酸氢钠、最后用少量蒸馏水进行洗涤;洗涤完成后,加入无水CaCl2、过滤除去干燥剂,蒸馏除去乙醚,重结晶得到3,5-二甲氧基苯酚。
(1)
①甲醇、3,5-二甲氧基苯酚的沸点不同,用蒸馏法分离出甲醇;
②分液漏斗使用前需检查是否漏水;乙醚的密度比水小,分液时有机层在分液漏斗的上层。
(2)
实验中加入了氯化氢的甲醇溶液,碳酸氢钠能和氯化氢反应,分离得到的有机层用饱和NaHCO3溶液洗涤的目的是除去HCl;
(3)
洗涤完成后,产物中有少量水和乙醚,通过加入无水CaCl2干燥、过滤除去干燥剂、蒸馏除去乙醚 、重结晶,提纯3,5-二甲氧基苯酚,正确的操作顺序是dcab。
一、单选题
1.下列反应属于取代反应的是
①CHCl3+Cl2CCl4+HCl
②2HI+Cl2=2HCl+I2
③CO+2H2CH3OH
④CH3CH2CN+Cl2+HCl
⑤CH3CH2OH+HBrCH3CH2Br+H2O
A.①② B.①②③④
C.①④⑤ D.②④⑤
2.化学知识和技术发展离不开伟大化学家。下列人物与其贡献不匹配的是
A.侯德榜——工业制备烧碱 B.勒夏特列——化学平衡的移动
C.李比希——元素定量分析 D.盖斯——反应热的计算
3.从19世纪20年代开始,人们用从非生物体内取得的物质合成了许多有机物,下列属于最早合成的有机物是
A. B. C. D.
4.近年来,我国航空航天事业成果显著。下列成果所涉及的材料为金属材料的是
A.“天宫二号“航天器使用的质量轻强度高的材料——钛合金
B.“北斗三号”导航卫星使用的太阳能电池材料——砷化镓
C.“长征五号”运载火箭使用的高效燃料——液氢
D.“C919”飞机身使用的复合材料——碳纤维和环氧树脂
5.现有四组混合物:①乙酸乙酯和乙酸钠溶液 ②乙醇和甘油 ③溴化钠和单质溴的水溶液 ④碘和四氯化碳的混合物,分离以上各混合物的正确方法依次是
A.分液、萃取、蒸馏、萃取 B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏 D.蒸馏、萃取、分液、萃取
6.下列各组物质,最适宜使用红外光谱法进行区分的是
A.1—丁醇(CH3CH2CH2CH2OH)、1—溴丁烷(CH3CH2CH2CH2Br)
B.1—丙醇(CH3CH2CH2OH),1—丁醇(CH3CH2CH2CH2OH)
C.苯( )、甲苯( )
D.2—甲基戊烷()、3—甲基戊烷( )
7.下列化学用语或图示表达正确的是
A.聚丙烯的结构简式:
B.羟基的电子式:
C.乙炔的实验式:
D.乙醇的核磁共振氢谱:
8.1.4g某有机化合物在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O。下列说法不正确的是
A.该有机化合物中只含有碳元素和氢元素
B.该有机化合物中一定含有氧元素
C.该有机化合物的分子式可能是C2H4
D.该有机化合物分子中碳原子数与氢原子数之比一定是1:2
9.下列各组中的反应,属于同一反应类型的是
A.由溴乙烷水解制乙醇,由乙烯与水反应制乙醇
B.由对苯二甲酸与乙二醇制聚酯纤维;由乙烯制聚乙烯
C.乙烯使酸性高锰酸钾溶液褪色;葡萄糖发生的银镜反应
D.由氯代环己烷制环己烯;由丙烯加溴制-二溴丙烷
10.下列说法中正确的是
A.焰火、霓虹灯光、激光、荧光、LED灯光都与原子核外电子跃迁吸收能量有关
B.Li的发射光谱的谱图是亮底暗线
C.多原子分子的键角一定,表明共价键具有方向性
D.现代化学常利用红外光谱测定分子的相对分子质量
11.下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是
A.乙酸乙酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B.乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C.乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D.苯中含苯酚杂质:加入浓溴水,过滤
12.31g由三种醇组成的混合物与足量的金属钠完全反应后,得到标准状况下氢气11.2L,下列判断中正确的是
A.一定有甲醇 B.一定有乙醇
C.一定有甘油 D.一定有乙二醇
13.以下研究有机物方法的叙述不正确的是( )
A.质谱法可以快速、微量、精确测定相对分子质量
B.燃烧法是确定有机物成分的有效方法之一
C.从红外光谱图上可以获得分子中含有何种化学键或官能团的信息
D.从核磁共振氢谱图上只能推知有机物分子中氢原子的类型
14.下列有关物质的分离或鉴别说法正确的是
A.乙醛和乙酸无法通过核磁共振氢谱鉴别
B.质谱法是测定相对分子质量的精确方法、也可用于确定简单的分子结构
C.分液操作时应先将下层液体从分液漏斗下口放出后再将上层液体继续放出
D.石英玻璃的X射线衍射图存在明锐的衍射峰
15.燃烧0.1mol某有机物得0.2mol CO2和0.2mol H2O,由此得出的结论不正确的是
A.该有机物分子中可能含有氧原子
B.该有机物中碳、氢元素原子数目之比为1:2
C.该有机物分子中一定含有碳碳双键
D.该有机物分子中一定含有二个碳原子
二、填空题
16.经元素分析后,发现某烃的含碳量为82.76%,氢的质量分数则为17.24%,且相对分子质量为58,试推断该烃的分子式_____________
17.某含C、H、O三种元素的未知物A,现对A进行分析探究。
(1)经燃烧分析实验测定,该未知物中碳的质量分数为41.38%,氢的质量分数为3.45%,则A的实验式为___________。
(2)利用质谱法测定A的相对分子质量,其质谱图如下,则A的分子式为___________。
(3)A的红外光谱图如下,分析该图得出A中含2种官能团,官能团的名称是______、______。
(4)A的核磁共振氢谱图如下,综合分析A的结构简式为___________。
18.有机化合物分子式的确定
(1)元素分析
元素分析 定性分析 用化学方法鉴定有机物分子的元素组成,如燃烧后_______,______
定量分析 将一定量有机化合物燃烧后分解为_________,测定各产物的量,从而推算出有机化合物分子中所含元素原子的____________,即确定其____________
实验方法 李比希氧化产物吸收法仅含C、H、O元素的有_________,;_________,→计算出分子中碳、氢原子的含量 →剩余的为________的含量 ②现代元素定量分析法
(2)相对分子质量的确定
①相对分子质量的测定——质谱法
质荷比(分子离子、碎片离子的_______________与其_______________的比值)_______________值即为该有机化合物的相对分子质量。
②计算气体相对分子质量的常用方法
a.
b.(标准状况)
c.根据阿伏加德罗定律,同温同压下,,则
三、实验题
19.咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为10 4,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是___________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒___________。
(2)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是___________。
20.某化学小组为测定有机物G的组成和结构,设计如下实验装置:
回答下列问题:
(1)装置B和装置D中浓硫酸的作用分别是_______和_______。
(2)装置E和装置F中碱石灰的作用分别是_______和_______。
(3)若准确称取4.4g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成和),装置D质量增加3.6g,U形管E质量增加8.8g。又知有机物G的质谱图如图所示:
该有机物的分子式为_______。
(4)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6∶1∶1.综上所述,G的结构简式为_______。
21.3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:+2CH3OH+2H2O。
甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见表:
物质 沸点/℃ 熔点/℃ 密度(20℃)/g·cm-3 溶解性
甲醇 64.7 0.7915 易溶于水
乙醚 34.5 0.7138 微溶于水
3,5-二甲氧基苯酚 33~36 易溶于甲醇、乙醚,微溶于水
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是____。
②萃取用到的分液漏斗使用前需____并洗净,分液时有机层在分液漏斗的____(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是____。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是____(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
参考答案:
1.C
【详解】①CHCl3中的H原子被Cl原子取代,属于取代反应;②该反应属于置换反应;③该反应属于化合反应;④CH3CH2CN分子中“—CH2—”的1个H原子被Cl原子取代,属于取代反应;⑤CH3CH2OH分子中的—OH被Br原子取代,属于取代反应。
答案选C。
2.A
【详解】A.侯德榜发明了侯氏制碱法,这里的碱指的是纯碱,A符合题意;
B.勒夏特列发现了勒夏特列原理,即化学平衡的移动原理,B不合题意;
C.李比希发明了李比希元素分析法,即通过氧化法进行元素定量分析,C不合题意;
D.盖斯发现了一个反应的反应热与反应途径无关,只与反应的始态和终态有关,即盖斯定律,因此可以计算一个反应的反应热,D不合题意;
故答案为A。
3.B
【详解】1828年德国化学家维勒,将一种无机物NH4CNO的水溶液加热得到了尿素,结构简式为NH2CONH2,开创了有机化学人工合成的新纪元。
故选B。
4.A
【详解】A.钛合金是合金材料,属于金属材料,故A符合题意
B.砷化镓是一种半导体材料,不是金属材料,故B不符合题意;
C.液氢是液态氢气单质,氢元素是非金属,不是金属材料,故C不符合题意;
D.碳纤维是碳元素组成的一种单质,是无机非金属材料,环氧树脂是有机高分子合成材料,都不是金属材料,故D不符合题意
答案选A。
5.C
【详解】萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质。乙酸乙酯不溶于水,分液即可;乙醇和甘油互溶,蒸馏即可;单质溴易溶在有机溶剂中,萃取即可;碘易溶在有机溶剂中,蒸馏即可,答案选C。
6.A
【分析】红外光谱法可以测定有机化合物分子中所含的化学键或官能团,若两种有机化合物中的化学键或官能团不同,则可以用红外光谱法进行区分,以此来解析;
【详解】A.1 丁醇的官能团是-OH,1 溴丁烷的官能团是碳溴键,化学键也不完全相同,可以用红外光谱法进行区分,A正确;
B.1-丙醇、1-丁醇的官能团都是-OH,化学键相同(C-C、C-H、C-O和O-H),无法用红外光谱法进行区分,B错误;
C.苯、甲苯中都没有官能团,化学键相同,无法用红外光谱法进行区分,C错误;
D.2-甲基戊烷、3-甲基戊烷中都没有官能团,化学键相同(C-C和C-H),无法用红外光谱法进行区分,D错误;
故选A。
7.B
【详解】A.丙烯的结构简式为CH3-CH=CH2,发生加聚反应生成聚丙烯,则聚丙烯的结构简式为,A项错误;
B.羟基的结构式为-OH,O原子最外层电子数为6,则羟基的电子式为,B项正确;
C.乙炔的分子式为C2H2,则乙炔的实验式(最简式)为CH,C项错误;
D.乙醇的结构简式为,乙醇分子中的等效氢原子有3种,则核磁共振氢谱有三组吸收峰,且氢原子的比值为3:2:1,则核磁共振氢谱吸收峰的峰面积比值为3:2:1,D项错误;
答案选B。
8.B
【详解】A.1.4g某有机化合物在足量氧气中完全燃烧,生成4.4gCO2和1.8gH2O,有机物中碳质量为,氢质量为,因此该有机化合物中只含有碳元素和氢元素,故A正确;
B.根据A选项分析得到该有机化合物中只含有碳元素和氢元素,一定不含有氧元素,故B错误;
C.根据A得到有机物碳、氢质量分别为1.2g、0.2g,则有机物中n(C):n(H)= ,因此该有机化合物的分子式可能是C2H4,故C正确;
D.根据前面C选项分子得到该有机化合物分子中碳原子数与氢原子数之比一定是1:2,故D正确。
综上所述,答案为B。
9.C
【详解】A.由溴乙烷水解制乙醇,发生的是取代反应,由乙烯与水反应制乙醇,发生的是加成反应,不属于同一反应类型,A错误;
B.由对苯二甲酸与乙二醇制聚酯纤维,发生的是缩聚反应,由乙烯制聚乙烯,发生是加聚反应,不属于同一反应类型,B错误;
C.乙烯使酸性高锰酸钾溶液褪色,发生的是氧化反应,葡萄糖发生的银镜反应,是氧化反应,属于同一反应类型,C正确;
D.由氯代环己烷制环己烯,发生的是消去反应,由丙烯加溴制-二溴丙烷,发生的是加成反应,不属于同一反应类型,D错误;
答案选C。
10.C
【详解】A.电子跃迁本质上是组成物质的粒子中电子的一种能量变化,焰火、霓虹灯光、激光、荧光、LED灯光产生时原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出,因而能使火焰呈现颜色,与电子跃迁释放能量有关,A错误;
B.物体发光直接产生的光谱叫做发射光谱,吸收光谱是在连续发射光谱的背景中呈现出的暗线,所以Li的发射光谱的谱图是暗底亮线,B错误;
C.共价键具有方向性,主要体现在多原子分子的键角一定,C正确;
D.质谱分析利用质荷比来测定分子的相对分子质量,红外光谱分析获得分子中含有的化学键或官能团的信息,D错误;
故选C。
11.A
【详解】A.乙酸乙酯中含乙酸杂质:若加入碳酸钠溶液,乙酸与碳酸钠发生反应产生可溶性乙酸钠,而乙酸乙酯在该溶液的溶解度很小,因此可以通过洗涤,分液分离得到,正确;
B.乙醇中含乙酸杂质:若加入碳酸钠溶液,乙酸与碳酸钠发生反应产生可溶性乙酸钠,但是由于乙醇也能够与水混溶,所以不能通过洗涤,分液的方法分离,错误;
C.乙醛中含乙酸杂质:若加入氢氧化钠溶液酸发生反应产生乙酸钠,而乙醛也在水中容易溶解,所以不能通过洗涤,分液分离,错误;
D.苯中含苯酚杂质:若加入溴水会形成三溴苯酚白色沉淀,但是三溴苯酚能够在苯中溶解,因此不能通过过滤除去,错误;
故选A。
12.C
【详解】若相当于一元醇,甲醇、甘油、乙醇分子量分别为:32、30.67、 46,11.2L(标准状况)氢气物质的量为0.5mol,则一元醇的物质的量为1mol,混合醇若为一元醇平均相对分子质量为:= 31,则三种醇平均相对分子质量为31,则一定含有相对分子质量大于31的物质,即可能含有有甲醇、乙醇,一定含有相对分子质量小于31的物质,一定含有甘油,综上所述,故选C。
13.D
【详解】A.质谱法可以快速、微量、精确测定有机物的相对分子质量,A正确;
B.利用燃烧法,能将有机物分解为简单无机物,并作定量测定,通过无机物的质量推算出组成该有机物元素原子的质量分数,然后计算出该有机物分子所含元素原子最简单的整数比,即确定实验式,B正确;
C.不同的化学键或官能团吸收频率不同,在红外光谱图上处于不同的位置,所以红外光谱图能确定有机物分子中的化学键或官能团,C正确;
D.从核磁共振氢谱图上吸收峰的个数等于H原子的种类数量,吸收峰的面积之比等于不同类型H原子的个数比,故核磁共振氢谱图上可以推知有机物分子有几种不同类型的氢原子及它们的数目,D错误;
故答案为:D。
14.B
【详解】A.乙醛和乙酸中都有两种类型的H原子,且H原子个数比为1:3,但是化学位移不同,可以用核磁共振氢谱鉴别,A错误;
B.质谱仪把有机物打成很多小块,会有很多不同质荷比出现,其中最大的那个就是该有机物的相对分子质量,并依据质荷比及不同质荷比峰的相对强弱推测分子结构,B正确;
C.分液操作时应先将下层液体从分液漏斗下口放出后,再将上层液体从上口到处,C错误;
D.石英玻璃不是晶体,X射线衍射图不会出现明锐的衍射峰,D错误;
故选B。
15.C
【分析】燃烧0.1mol某有机物得0.2mol CO2和0.2mol H2O,根据元素守恒,则该有机物中有2个碳原子和4和氢原子,氧原子是否存在不确定,则该有机物可能为不含氧原子CH2=CH2,也可能为含有氧原子的CH3CHO;
【详解】A.由分析可知,该有机物可能为含有氧原子的CH3CHO,A项正确;
B.由分析可知,该有机物中有2个碳原子和4和氢原子,碳、氢元素原子数目之比为1:2,B项正确;
C.由分析可知,该有机物可能为含有氧原子的CH3CHO,该有机物中无碳碳双键,C项错误;
D.由分析可知,该有机物中有2个碳原子,D项正确;
答案选C。
16.C4H10
【详解】碳的质量分数是82.76%,氢的质量分数是17.24%,则该物质中碳、氢原子个数之比为(82.76%/12):(17.24%/1)=6:897:17.24=2:5,该烃的最简式是C2H5,相对分子质量为58,设分子式为C2nH5n:则12×2n+5n=58,得:n=2,则分子式C4H10。
17. 羧基 碳碳双键
【分析】(1)根据各元素的质量分数确定原子个数比,进而确定实验式;
(2)根据质谱图A的相对分子质量和实验式计算分子式;
(3)根据A的红外光谱图得出A中含官能团的种类;
(4)根据A的核磁共振氢谱图中氢原子种类和等效H个数比确定结构简式。
【详解】(1)根据已知碳的质量分数是41.38%,氢的质量分数是3.45%,则氧元素质量分数是1-41.38%-3.45%=55.17%,则该物质中碳、氢、氧原子个数之比=::=3.45:3.45:3.45=1:1:1,由原子个数比可知该有机物的实验式为CHO,故答案:CHO;
(2)由质谱图可知A的相对分子质量为116,根据A的实验式为CHO,设A的分子式为CnHnOn,则12n+4n+16n=116,解得n=4,则A的分子式为C4H4O4,故答案为:C4H4O4;
(3)根据A的红外光谱图得出A中含2种官能团分别为:碳碳双键、羧基,故答案为:碳碳双键;羧基;
(4)根据A的核磁共振氢谱图可知有两种类型的氢原子,且等效H个数比为1:1,则A的结构简式为HOOC CH=CH COOH,故答案为:HOOC CH=CH COOH。
18.(1) 简单无机物 最简整数比 实验式 无水 浓溶液 氧原子
(2) 相对质量 电荷数 最大
【详解】(1)用化学方法鉴定有机物分子的元素组成,燃烧后有CO2生成说明含有C元素、有H2O生成说明含有H元素;
将一定量有机化合物燃烧后分解为简单无机物,测定各产物的量,从而推算出有机化合物分子中所含元素原子的最简整数比,即确定其实验式;
仅含C、H、O元素的有机物氧化后,产物H2O用无水CaCl2吸收,CO2用KOH浓溶液吸收,根据二氧化碳、水的质量,计算出分子中碳氢原子的含量,其余的为氧原子的含量。
(2)质荷比(分子离子、碎片离子的相对质量与其电荷数的比值)最大值即为该有机化合物的相对分子质量。
19.(1) 增加固液接触面积,提取充分 几粒沸石
(2)升华
【详解】(1)萃取时将茶叶研细可以增加固液接触面积,从而使提取更充分;由于需要加热,为防止液体暴沸,加热前还要加入几粒沸石;
(2)根据已知信息可知咖啡因在100℃以上时开始升华,因此该分离提纯方法的名称是升华。
20.(1) 干燥 吸收有机物燃烧生成的水蒸气
(2) 吸收有机物燃烧生成的 吸收空气中的和
(3)
(4)
【分析】双氧水加入到二氧化锰中产生氧气,氧气中含有水蒸气,因此用浓硫酸干燥氧气,氧气和有机物样品反应生成二氧化碳和水,用浓硫酸吸收生成的水,利用浓硫酸增加的质量即为生成水的质量,E中碱石灰吸收生成的二氧化碳,F中碱石灰防止空气中二氧化碳和水进入到E中。
(1)
根据前面分析,氧气中含有水蒸气,因此装置B作用是干燥,反应后生成二氧化碳和水,因此装置D中浓硫酸的作用是吸收有机物燃烧生成的水蒸气;故答案为:干燥;吸收有机物燃烧生成的水蒸气。
(2)
装置E中碱石灰的作用是吸收有机物燃烧生成的,装置F中碱石灰的作用是吸收空气中的和,防止空气中的二氧化碳、水蒸气干扰实验;故答案为:吸收有机物燃烧生成的;吸收空气中的和。
(3)
根据题意,装置D质量增加3.6g,则水的质量为3.6g即物质的量为0.2mol,U形管E质量增加8.8g,则二氧化碳的质量为8.8g即物质的量为0.2mol。根据有机物G的质谱图分析得到相对分子质量为88,则4.4g该有机物物质的量为0.05mol,根据碳、氢守恒得到该有机物C4H8Ox,根据相对分子质量得到该有机物的分子式为;故答案为:。
(4)
已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为6∶1∶1,则说明含有两个甲基,一个羧基,根据上述分析得到G的结构简式为 ;故答案为: 。
21.(1) 蒸馏 检查是否漏水 上
(2)除去HCl
(3)dcab
【分析】间苯三酚和甲醇在氯化氢的甲醇溶液中发生取代反应生成3,5-二甲氧基苯酚和水,反应结束后,先用蒸馏法离出甲醇,再加入乙醚进行萃取,有机相依次用饱和NaHCO3溶液洗涤除氯化氢、用饱和食盐水洗涤除碳酸氢钠、最后用少量蒸馏水进行洗涤;洗涤完成后,加入无水CaCl2、过滤除去干燥剂,蒸馏除去乙醚,重结晶得到3,5-二甲氧基苯酚。
(1)
①甲醇、3,5-二甲氧基苯酚的沸点不同,用蒸馏法分离出甲醇;
②分液漏斗使用前需检查是否漏水;乙醚的密度比水小,分液时有机层在分液漏斗的上层。
(2)
实验中加入了氯化氢的甲醇溶液,碳酸氢钠能和氯化氢反应,分离得到的有机层用饱和NaHCO3溶液洗涤的目的是除去HCl;
(3)
洗涤完成后,产物中有少量水和乙醚,通过加入无水CaCl2干燥、过滤除去干燥剂、蒸馏除去乙醚 、重结晶,提纯3,5-二甲氧基苯酚,正确的操作顺序是dcab。
