化学人教版(2019)必修第一册4.3.2共价键(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.2共价键(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 12:00:27 | ||
图片预览






文档简介
(共25张PPT)
第2课时 共价键
第四章 第三节 化学键
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程
(重、难点)。
2.会识别判断共价化合物,熟知分子结构的不同表示方法(难点)。
3.理解化学键的概念及化学反应的本质,培养“宏观辨识与微观探析”的核心
素养。
核心素养学习目标
创设情境
为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?氢分子和氯分子又是如何形成氯化氢分子的呢?
任务一:共价键与共价化合物
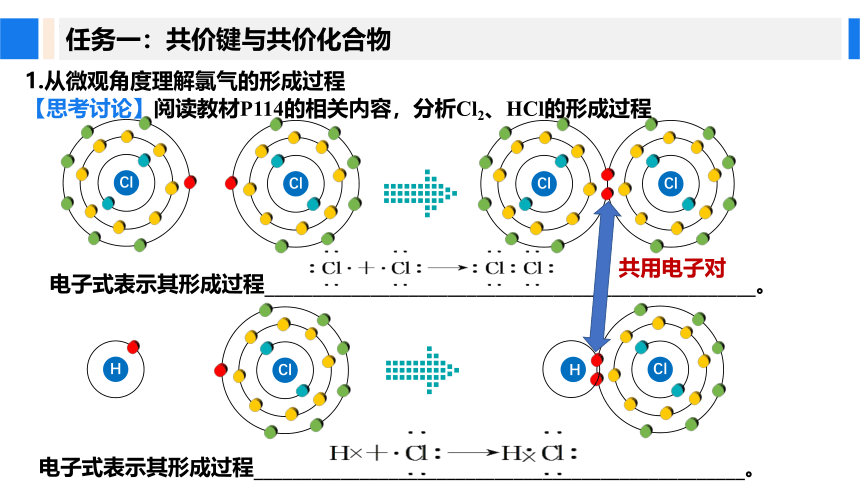
1.从微观角度理解氯气的形成过程
电子式表示其形成过程___________________________________________________。
Cl
Cl
Cl
Cl
【思考讨论】阅读教材P114的相关内容,分析Cl2、HCl的形成过程
电子式表示其形成过程___________________________________________________。
H
Cl
Cl
H
共用电子对
任务一:共价键与共价化合物
【概念学习】2.共价键
成键粒子:原子
成键本质:共用电子对与成键原子的静电作用
成键元素:一般为同种或不同种非金属元素
定义:原子间通过共用电子对所形成的相互作用
【思考讨论】HCl、Cl2的共用电子对有无偏移?你的判断依据是什么?
任务一:共价键与共价化合物
极性键
非极性键
不同种元素
同种元素
电子对偏移
电子对不偏移
一方显正电性,一方显负电性
成键原子不显电性
类型
构成元素
成键特点
原子电性
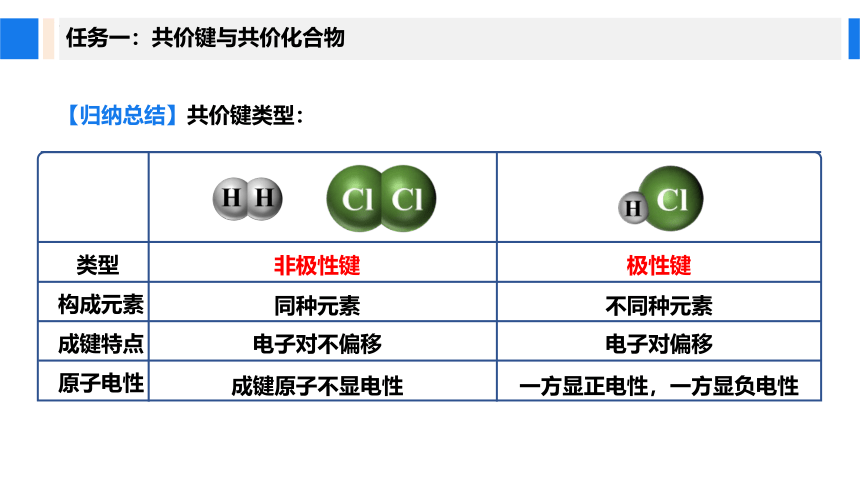
【归纳总结】共价键类型:
任务一:共价键与共价化合物
【概念学习】3.共价化合物
(2)与物质类别的关系
非金属氢化物: H2S、 HF 、NH3等
非金属氧化物:CO、CO2、H2O、SO2、SO3等
酸: HCl、 H2SO4 、HNO3等
大多数有机化合物:CH4、CH3CH2OH、CH3COOH等
常见类别
【思考讨论】NH4Cl是否是共价化合物?
离子化合物
(1)定义:以共用电子对形成分子的化合物。
任务一:共价键与共价化合物
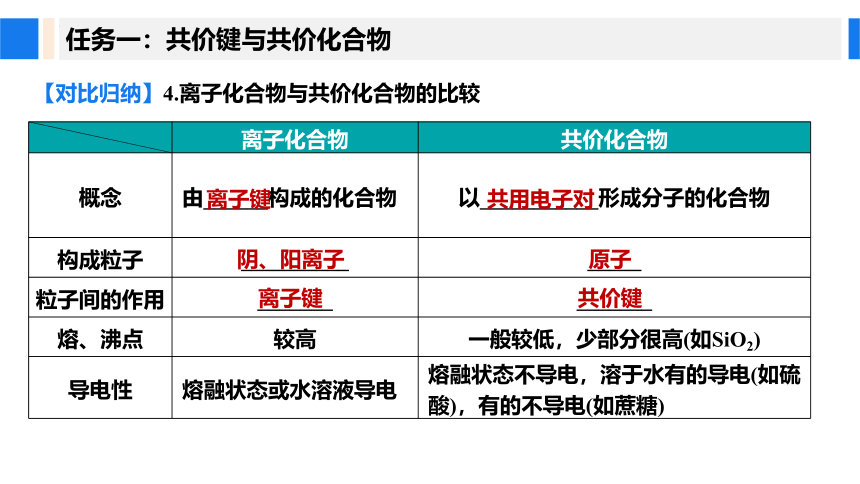
【对比归纳】4.离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由______构成的化合物 以___________形成分子的化合物
构成粒子 __________ _____
粒子间的作用 _______ _______
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融状态或水溶液导电 熔融状态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
离子键
共用电子对
阴、阳离子
原子
离子键
共价键
任务一:共价键与共价化合物
1.判断正误
(1)共价键与离子键的成键微粒是一样的
(2)非金属元素只能形成共价键
(3)共价化合物中可能含有离子键,离子化合物中也可能含有共价键
(4)稀有气体分子中一定存在共价键
×
×
×
×
2.下列元素最易形成共价键的是
A.Na B.Mg C.Al D.Si
√
【评价训练】
任务一:共价键与共价化合物
3.表中物质与其所含键的类型、所属化合物类型完全正确的一组是
选项 A B C D
物质 CaCl2 H2O Na2O2 NaOH
键的 类型 离子键、共价键 共价键 离子键 离子键、共价键
化合物 类型 离子化合物 共价化合物 离子化合物 共价化合物
√
1.电子式
2.结构式
化学上,常用“—”表示1对____________,如氯分子可表示为“Cl—Cl”,这种图示叫做结构式。
H2
H
H
N2
N
N
NH3
H
H
H
N
共用电子对
【微观表征】共价分子结构的表示方法
任务二:共价分子的表示方法
分子 HCl H2O CO2 CH4
电子式
结构式
分子结构模型
H—O—H
O==C==O
H
H
O
H
H
C
H
H
C
O
O
H—Cl
任务二:共价分子的表示方法
H
Cl
美国化学家托马斯·米奇利
制冷剂——氟利昂
上世纪80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害到人类的健康。在元素周期表和元素周期律的指导下,人们踏上了寻找新一代制冷剂的征程,氟利昂将逐步被新的制冷剂所替代。
任务二:共价分子的表示方法
1.判断正误
(1)HCl、BF3和CO2分子中各原子都满足8电子稳定结构
(2)N2和CO2的电子式分别为 和
(3) 的结构式可表示为
(4)H2S的电子式可表示为
×
√
×
×
【评价训练】
任务二:共价分子的表示方法
应用体验
2.下列电子式书写正确的是
A.氨:
B.氯化铵:
C.二氧化碳:
D.过氧化氢:
√
二、共价分子的表示方法
任务二:共价分子的表示方法
3.化学用语是学习化学的基础工具,下列有关微粒的描述正确的是
A.CCl4的电子式:
B.HClO的电子式: ,结构式:H—Cl—O
C.由NH3的电子式 知,NH3分子中共含8个电子
D.用电子式表示HCl的形成过程: + ―→
√
任务二:共价分子的表示方法
【归纳总结】复杂微粒的电子式
OH-
NH4Cl
NaOH
NH4+
H—O—Cl
H2O2
任务三:化学键与分子间作用力
【概念学习】1.化学键
(1)概念:相邻的原子之间强烈的相互作用。
(2)分类
离子键
共价键
非极性键
极性键
化学键
H—Cl
N≡N
O=O
H-H
H-O-O-H
共用电子对不偏移
共用电子对偏移
(3)化学反应的本质
旧键断裂,新键形成
【思考讨论】
1.有化学键断裂的过程一定是化学反应吗?
2.有化学键形成的过程一定有新物质生成吗?
不一定
如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
任务三:化学键与分子间作用力
【概念学习】2.分子间作用力
(1)概念:分子间存在一种把分子聚集在一起的作用力,又称范德华力。
熔化
【思考讨论】为什么干冰升华、硫晶体熔化等都要吸收能量?
由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
任务三:化学键与分子间作用力
范德华力
氢键:一种较强的分子间作用力,不是化学键。
化学键>氢键>范德华力
(3)氢键对物质的性质的影响:
使物质的熔点和沸点升高,冰的密度低于液态水的密度。
主要存在于H2O、NH3、HF分子之间
【思考讨论】水分子间存在氢键,故H2O的稳定性强于H2S,对吗?为什么?
不对。氢键只影响物理性质,而H2O的稳定性是O的非金属性决定,是化学性质。
(2)分类
任务三:化学键与分子间作用力
【思考讨论】冰能够浮在水面上,说明密度比液态水小,这是为什么呢?
除获1910年诺贝尔物理学奖外,他被授予剑桥大学荣誉博士学位;被授予莫斯科皇家博物学家学会、爱尔兰皇家学院和美国哲学学会荣誉会员,法兰西学院和柏林皇家科学院通讯院士,比利时皇家科学院准会员;伦敦化学学会、美国国家科学院和罗马林奇学会(Accademia dei Lincei of Rome)外籍院士。从1896年到1912年,他是荷兰皇家科学院的秘书,于1912年被选为荷兰化学学会名誉会员。
自学成才的博士——约翰尼斯·迪德里克·范·德·瓦耳斯
任务三:化学键与分子间作用力
【资料卡片】
1.判断正误
(1)NaHSO4中含有离子键、极性共价键与非极性共价键
(2)化学键既可存在于分子内的原子间,又可存在于分子之间
(3)氢键是一种特殊的化学键
(4)稀有气体中不存在化学键
(5)两原子之间的相互作用叫做化学键
(6)冰浮在水面上是因为冰中水分子间以氢键结合成排列规整的晶体,结构中有空隙,造成体积膨胀,密度减小至低于液态水的密度
×
√
√
×
×
×
任务三:化学键与分子间作用力
【评价训练】
2.关于氢键及范德华力,下列说法正确的是
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔、沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由H2O之间形成氢键所致
√
任务三:化学键与分子间作用力
3.在下列物质中:A.氩 B.NaOH C.甲烷(CH4) D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2
(1)只含离子键的物质是_____(填字母,下同)。
(2)既有离子键又有共价键的物质是_____。
(3)只含极性键的物质是_______。
(4)含非极性键的物质是______。
(5)NaOH溶于水时,断开的化学键的类型为________。
D
B
CFG
EH
离子键
任务三:化学键与分子间作用力
本课结束
今日作业
第四章 第三节 第2课时 共价键
第2课时 共价键
第四章 第三节 化学键
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程
(重、难点)。
2.会识别判断共价化合物,熟知分子结构的不同表示方法(难点)。
3.理解化学键的概念及化学反应的本质,培养“宏观辨识与微观探析”的核心
素养。
核心素养学习目标
创设情境
为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?氢分子和氯分子又是如何形成氯化氢分子的呢?
任务一:共价键与共价化合物
1.从微观角度理解氯气的形成过程
电子式表示其形成过程___________________________________________________。
Cl
Cl
Cl
Cl
【思考讨论】阅读教材P114的相关内容,分析Cl2、HCl的形成过程
电子式表示其形成过程___________________________________________________。
H
Cl
Cl
H
共用电子对
任务一:共价键与共价化合物
【概念学习】2.共价键
成键粒子:原子
成键本质:共用电子对与成键原子的静电作用
成键元素:一般为同种或不同种非金属元素
定义:原子间通过共用电子对所形成的相互作用
【思考讨论】HCl、Cl2的共用电子对有无偏移?你的判断依据是什么?
任务一:共价键与共价化合物
极性键
非极性键
不同种元素
同种元素
电子对偏移
电子对不偏移
一方显正电性,一方显负电性
成键原子不显电性
类型
构成元素
成键特点
原子电性
【归纳总结】共价键类型:
任务一:共价键与共价化合物
【概念学习】3.共价化合物
(2)与物质类别的关系
非金属氢化物: H2S、 HF 、NH3等
非金属氧化物:CO、CO2、H2O、SO2、SO3等
酸: HCl、 H2SO4 、HNO3等
大多数有机化合物:CH4、CH3CH2OH、CH3COOH等
常见类别
【思考讨论】NH4Cl是否是共价化合物?
离子化合物
(1)定义:以共用电子对形成分子的化合物。
任务一:共价键与共价化合物
【对比归纳】4.离子化合物与共价化合物的比较
离子化合物 共价化合物
概念 由______构成的化合物 以___________形成分子的化合物
构成粒子 __________ _____
粒子间的作用 _______ _______
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融状态或水溶液导电 熔融状态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
离子键
共用电子对
阴、阳离子
原子
离子键
共价键
任务一:共价键与共价化合物
1.判断正误
(1)共价键与离子键的成键微粒是一样的
(2)非金属元素只能形成共价键
(3)共价化合物中可能含有离子键,离子化合物中也可能含有共价键
(4)稀有气体分子中一定存在共价键
×
×
×
×
2.下列元素最易形成共价键的是
A.Na B.Mg C.Al D.Si
√
【评价训练】
任务一:共价键与共价化合物
3.表中物质与其所含键的类型、所属化合物类型完全正确的一组是
选项 A B C D
物质 CaCl2 H2O Na2O2 NaOH
键的 类型 离子键、共价键 共价键 离子键 离子键、共价键
化合物 类型 离子化合物 共价化合物 离子化合物 共价化合物
√
1.电子式
2.结构式
化学上,常用“—”表示1对____________,如氯分子可表示为“Cl—Cl”,这种图示叫做结构式。
H2
H
H
N2
N
N
NH3
H
H
H
N
共用电子对
【微观表征】共价分子结构的表示方法
任务二:共价分子的表示方法
分子 HCl H2O CO2 CH4
电子式
结构式
分子结构模型
H—O—H
O==C==O
H
H
O
H
H
C
H
H
C
O
O
H—Cl
任务二:共价分子的表示方法
H
Cl
美国化学家托马斯·米奇利
制冷剂——氟利昂
上世纪80年代,科学家们发现氟里昂会破坏大气的臭氧层,危害到人类的健康。在元素周期表和元素周期律的指导下,人们踏上了寻找新一代制冷剂的征程,氟利昂将逐步被新的制冷剂所替代。
任务二:共价分子的表示方法
1.判断正误
(1)HCl、BF3和CO2分子中各原子都满足8电子稳定结构
(2)N2和CO2的电子式分别为 和
(3) 的结构式可表示为
(4)H2S的电子式可表示为
×
√
×
×
【评价训练】
任务二:共价分子的表示方法
应用体验
2.下列电子式书写正确的是
A.氨:
B.氯化铵:
C.二氧化碳:
D.过氧化氢:
√
二、共价分子的表示方法
任务二:共价分子的表示方法
3.化学用语是学习化学的基础工具,下列有关微粒的描述正确的是
A.CCl4的电子式:
B.HClO的电子式: ,结构式:H—Cl—O
C.由NH3的电子式 知,NH3分子中共含8个电子
D.用电子式表示HCl的形成过程: + ―→
√
任务二:共价分子的表示方法
【归纳总结】复杂微粒的电子式
OH-
NH4Cl
NaOH
NH4+
H—O—Cl
H2O2
任务三:化学键与分子间作用力
【概念学习】1.化学键
(1)概念:相邻的原子之间强烈的相互作用。
(2)分类
离子键
共价键
非极性键
极性键
化学键
H—Cl
N≡N
O=O
H-H
H-O-O-H
共用电子对不偏移
共用电子对偏移
(3)化学反应的本质
旧键断裂,新键形成
【思考讨论】
1.有化学键断裂的过程一定是化学反应吗?
2.有化学键形成的过程一定有新物质生成吗?
不一定
如NaCl受热熔化断裂离子键,HCl溶于水断裂共价键,但都不是化学变化,NaCl溶液蒸发结晶,有离子键形成,但过程为物理变化,没有新物质生成。
任务三:化学键与分子间作用力
【概念学习】2.分子间作用力
(1)概念:分子间存在一种把分子聚集在一起的作用力,又称范德华力。
熔化
【思考讨论】为什么干冰升华、硫晶体熔化等都要吸收能量?
由分子构成的物质,其熔、沸点等物理性质主要由分子间作用力大小决定。
任务三:化学键与分子间作用力
范德华力
氢键:一种较强的分子间作用力,不是化学键。
化学键>氢键>范德华力
(3)氢键对物质的性质的影响:
使物质的熔点和沸点升高,冰的密度低于液态水的密度。
主要存在于H2O、NH3、HF分子之间
【思考讨论】水分子间存在氢键,故H2O的稳定性强于H2S,对吗?为什么?
不对。氢键只影响物理性质,而H2O的稳定性是O的非金属性决定,是化学性质。
(2)分类
任务三:化学键与分子间作用力
【思考讨论】冰能够浮在水面上,说明密度比液态水小,这是为什么呢?
除获1910年诺贝尔物理学奖外,他被授予剑桥大学荣誉博士学位;被授予莫斯科皇家博物学家学会、爱尔兰皇家学院和美国哲学学会荣誉会员,法兰西学院和柏林皇家科学院通讯院士,比利时皇家科学院准会员;伦敦化学学会、美国国家科学院和罗马林奇学会(Accademia dei Lincei of Rome)外籍院士。从1896年到1912年,他是荷兰皇家科学院的秘书,于1912年被选为荷兰化学学会名誉会员。
自学成才的博士——约翰尼斯·迪德里克·范·德·瓦耳斯
任务三:化学键与分子间作用力
【资料卡片】
1.判断正误
(1)NaHSO4中含有离子键、极性共价键与非极性共价键
(2)化学键既可存在于分子内的原子间,又可存在于分子之间
(3)氢键是一种特殊的化学键
(4)稀有气体中不存在化学键
(5)两原子之间的相互作用叫做化学键
(6)冰浮在水面上是因为冰中水分子间以氢键结合成排列规整的晶体,结构中有空隙,造成体积膨胀,密度减小至低于液态水的密度
×
√
√
×
×
×
任务三:化学键与分子间作用力
【评价训练】
2.关于氢键及范德华力,下列说法正确的是
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔、沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由H2O之间形成氢键所致
√
任务三:化学键与分子间作用力
3.在下列物质中:A.氩 B.NaOH C.甲烷(CH4) D.氯化钡 E.氮气 F.NH3 G.CCl4 H.H2O2
(1)只含离子键的物质是_____(填字母,下同)。
(2)既有离子键又有共价键的物质是_____。
(3)只含极性键的物质是_______。
(4)含非极性键的物质是______。
(5)NaOH溶于水时,断开的化学键的类型为________。
D
B
CFG
EH
离子键
任务三:化学键与分子间作用力
本课结束
今日作业
第四章 第三节 第2课时 共价键
