第三章 烃的衍生物 (含解析)测试题 2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第三章 烃的衍生物 (含解析)测试题 2023-2024学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 20:17:20 | ||
图片预览



文档简介
第三章 烃的衍生物 测试题
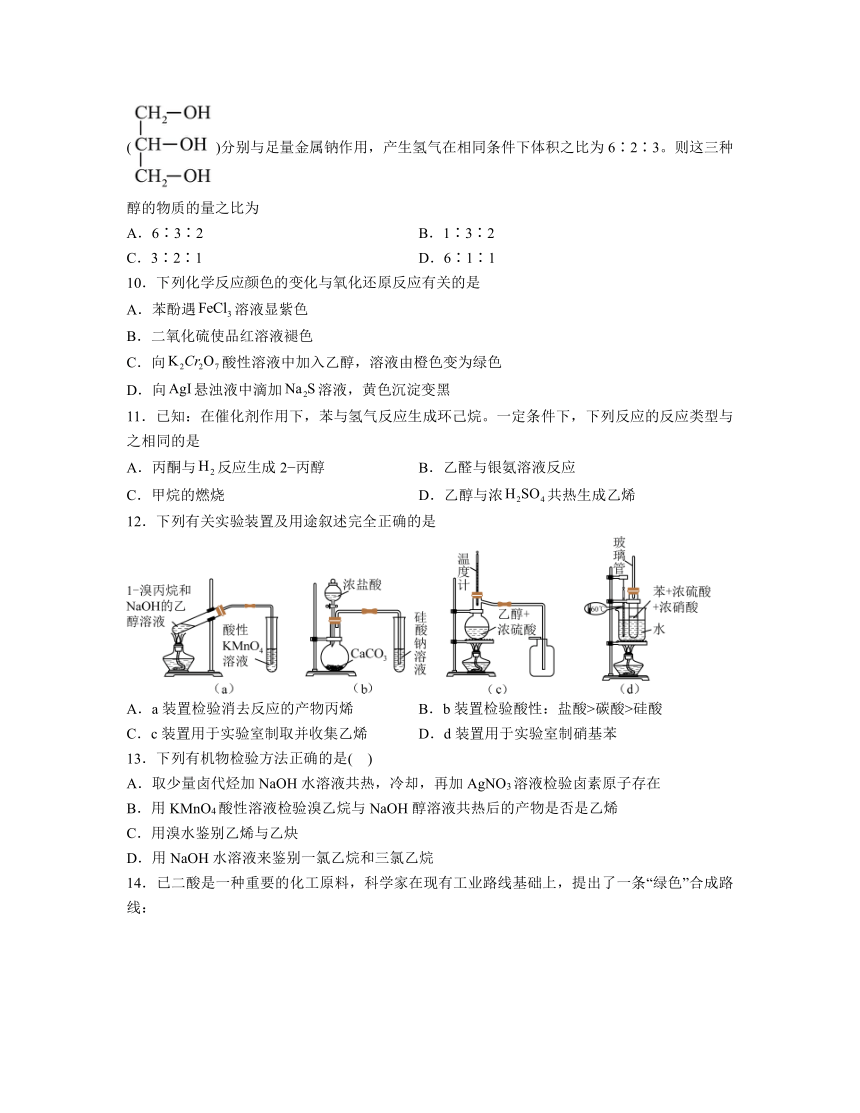
一、选择题
1.维生素C是一种重要的抗氧化剂.其结构简式如图,下列有关说法不正确的是
A.该分子中含四种官能团 B.该分子中所有原子一定不能共平面
C.该物质能使酸性高锰酸钾溶液褪色 D.分子式为
2.科学家发现某些高温油炸食品中含有一定量的丙烯酰胺()。食品中过量的丙烯酰胺可引起令人不安的食品安全问题。下列关于丙烯酰胺的叙述,其中正确的是
①能使酸性KMnO4溶液褪色
②能发生加聚反应生成高分子化合物
③是一种不饱和烃
④能与氢气发生加成反应
A.①②③ B.②③④ C.①③④ D.①②④
3.乙醇和乙酸在酸性条件下生成乙酸乙酯,反应机理如图,下列说法错误的是
A.Ⅰ→Ⅱ形成配位键,Ⅴ→Ⅵ断裂配位键
B.Ⅱ→Ⅲ的反应的原子利用率为100%
C.Ⅲ→Ⅳ质子发生转移
D.若反应条件为浓硫酸,只能加快反应速率,不能提高乙酸乙酯的平衡产率
4.符合限制条件的同分异构体数目最多的有机物是
选项 分子式 限制条件(不考虑立体异构)
A C4H8Br2 含2个甲基
B C8H10 与苯互为同系物
C C5H12O 能与金属钠反应
D C4H8O2 能与氢氧化钠溶液反应
A.A B.B C.C D.D
5.下列说法正确的是
A.蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处
B.用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量
C.可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大
D.向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键
6.化学学科需要借助化学语言来描述,下列化学用语正确的是
A.乙烯的空间充填模型: B.羟基的电子式:
C.丁烯的键线式: D.乙醛的结构简式
7.下列反应的方程式不正确的是
A.将碳酸氢钙溶液与过量的澄清石灰水混合:
B.将稀硫酸加入硫代硫酸钠溶液:
C.溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):
D.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
8.化合物Z是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关X、Y、Z的说法正确的是
A.X分子中C原子杂化类型有2种
B.Z与足量的氢气加成后产物中含有5个手性碳原子
C.Z可发生取代、加成和消去反应
D.可用氯化铁溶液鉴别Y、Z两种物质
9.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比为
A.6∶3∶2 B.1∶3∶2
C.3∶2∶1 D.6∶1∶1
10.下列化学反应颜色的变化与氧化还原反应有关的是
A.苯酚遇溶液显紫色
B.二氧化硫使品红溶液褪色
C.向酸性溶液中加入乙醇,溶液由橙色变为绿色
D.向悬浊液中滴加溶液,黄色沉淀变黑
11.已知:在催化剂作用下,苯与氢气反应生成环己烷。一定条件下,下列反应的反应类型与之相同的是
A.丙酮与反应生成2 丙醇 B.乙醛与银氨溶液反应
C.甲烷的燃烧 D.乙醇与浓共热生成乙烯
12.下列有关实验装置及用途叙述完全正确的是
A.a装置检验消去反应的产物丙烯 B.b装置检验酸性:盐酸>碳酸>硅酸
C.c装置用于实验室制取并收集乙烯 D.d装置用于实验室制硝基苯
13.下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤素原子存在
B.用KMnO4酸性溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙烯
C.用溴水鉴别乙烯与乙炔
D.用NaOH水溶液来鉴别一氯乙烷和三氯乙烷
14.已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
下列说法正确的是
A.苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
B.环已醇与乙醇互为同系物
C.环己烷分子中所有碳原子共平面
D.1mol已二酸与足量溶液反应生成
15.在通常情况下,下列各组物质的性质排列不正确的是
A.沸点:戊烷>2-甲基丁烷>乙醇
B.同分异构体种类:戊烷<戊烯
C.密度:苯<水<1,2-二溴乙烷
D.点燃时火焰明亮程度:乙烯>乙烷
二、填空题
16.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如表实验:
实验步骤 解释或实验结论
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 试通过计算填空:(1)A的相对分子质量为____。
(2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 (2)A的分子式为____。
(3)另取A9.0g,跟足量NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 (3)A中所含官能团名称____、____。
(4)A的核磁共振氢谱如图: (4)A中含有____种氢原子。
(5)综上所述,A的结构简式为____,A与浓硫酸混合,在一定条件下反应生成六元环状物,该反应类型是____反应。
17.反应③的方程式:_______
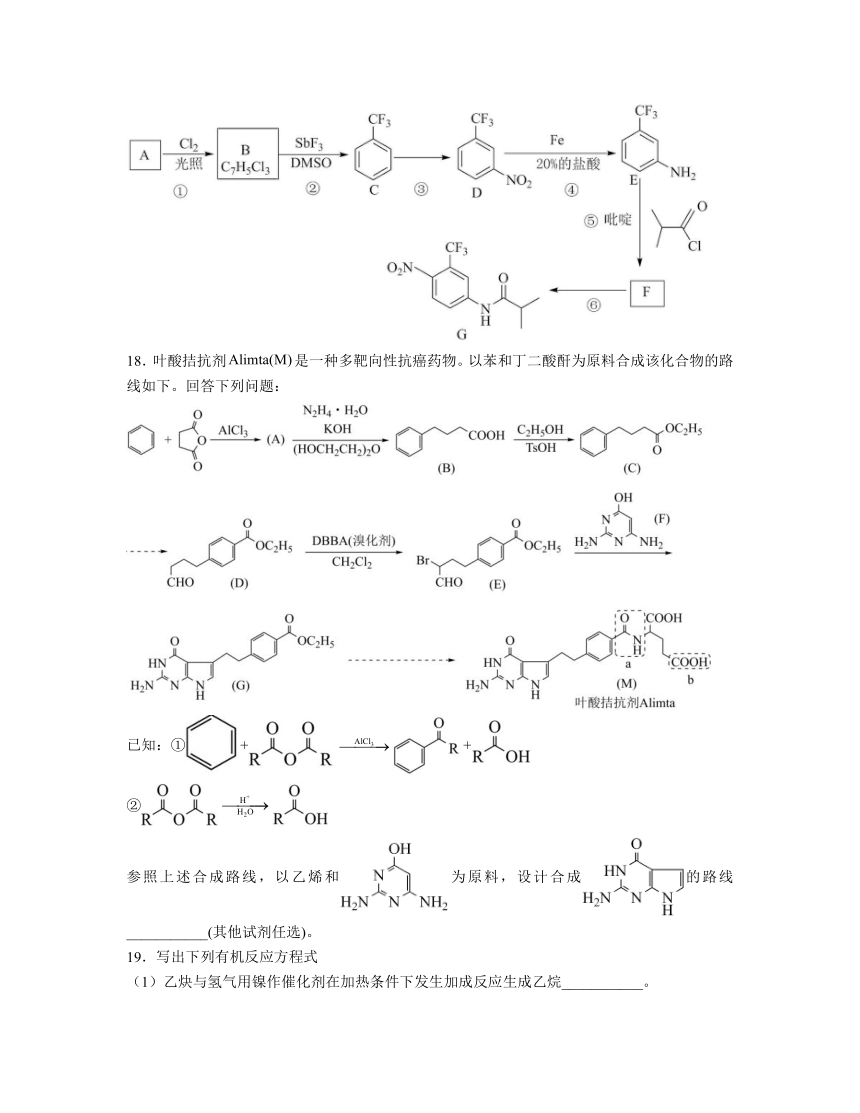
18.叶酸拮抗剂是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下。回答下列问题:
已知:①++
②
参照上述合成路线,以乙烯和为原料,设计合成的路线___________(其他试剂任选)。
19.写出下列有机反应方程式
(1)乙炔与氢气用镍作催化剂在加热条件下发生加成反应生成乙烷___________。
(2)苯与浓硫酸、浓硝酸的混合酸在100~110℃发生取代反应____________。
(3)2-氯丙烷与氢氧化钠水溶液共热________________。
(4)乙醛发生银镜反应________________。
(5)两分子乳酸脱去两分子水________________。
20.按要求解答下列各题,如图是合成某药物中间体分子(由9个C原子和若干H、O原子构成)的结构示意图:
试回答下列问题:
(1)通过对比上面的结构式与立体模型,请指出结构式中的“Et”表示的基团是(写结构简式)_______;该药物中间体的分子式为_______。
(2)该药物中间体的有机物类别是_______(填字母序号)。
a.酯 b.羧酸 c.醛
(3)该药物中间体分子中与C原子结合的H原子被Br原子取代,所得的一溴代物有_______种。
(4)该药物中间体分子有多种含苯环的同分异构体,请写出其中一种的结构简式:_______。
(5)按要求写出下列物质的名称
①CH2=CHCH2Cl _______
② _______
③_______
④C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则其化学名称为_______
21.已知:,试写出以1,3-丁二烯和乙炔为原料(无机试剂及催化剂任用)合成的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
22.根据下列信息,回答问题:
物质 A B C
结构及性质 分子式为C5H12O,在Cu催化下被O2氧化为酮,且分子内脱水后有机产物只有一种 是一种烷烃,碳的质量分数为84.21%,且该物质一氯取代只有一种 分子式为C8H10O,遇FeCl3溶液显蓝紫色,1molC可消耗1molBr2,且苯环上有3种氢原子
(1)A的结构简式是_______,A发生分子内脱水反应的化学方程式是_______
(2)B的分子式是_______,B的一氯取代产物与NaOH水溶液反应的化学方程式是_______
(3)C的结构简式是_______,与C互为同分异构体且能使FeCl3显色的物质有_______种(不包括C)
23.已知数据:
物质 熔点/℃ 沸点/℃ 密度/g·cm-3
乙醇 -117.3 78.5 0.789
乙酸 16.6 117.9 1.05
乙酸乙酯 -83.6 77.5 0.90
浓硫酸(98%) — 338.0 1.84
实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;
③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:___________。
(2)上述实验中饱和碳酸钠溶液的作用不包括_________(填字母代号)。
A.反应乙酸 B.吸收部分乙醇C.降低乙酸乙酯的溶解度,有利于分层析出 D.吸收挥发出的硫酸,加快反应速率
(3)步骤②中需要加热并且小火均匀加热的原因是___________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),与图1所示装置相比,此装置的主要优点有①增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯等,其中图2中冷凝水的流向为:____口进____口出(填写“a”或“b”)。
【参考答案】
一、选择题
1.A
解析:A.该分子中含三种官能团,分别为羟基、碳碳双键,酯基,故A错误;
B.该分子中存在三个饱和碳,所有原子一定不共平面,故B正确;
C.该物质含有碳碳双键、羟基,能与酸性高锰酸钾溶液发生氧化反应,因此能使酸性高锰酸钾溶液褪色,故C正确;
D.由结构简式可知,该物质分子式为C6H8O6,故D正确;
答案为A。
2.D
解析:①丙烯酰胺含有碳碳双键,能使酸性KMnO4溶液褪色,故①正确;②丙烯酰胺含有碳碳双键,能发生加聚反应生成高分子化合物,故正确;③丙烯酰胺含有氮和氧,不属于烃,故③错误;④丙烯酰胺含有碳碳双键,能与氢气发生加成反应,故④正确;因此①②④正确;故D正确。
综上所述,答案为D。
3.D
解析:A.由流程可知,Ⅰ→Ⅱ中氢离子提供空轨道、氧提供孤电子对形成配位键,Ⅴ→Ⅵ形成的配位键断裂,A正确;
B.Ⅱ→Ⅲ的反应中原子全部反应生成一种物质,原子利用率为100%,B正确;
C.由图可知,Ⅲ→Ⅳ过程中下侧的质子转移到了右侧羟基上,发生转移,C正确;
D.浓硫酸具有吸水性,吸收生成的水,导致平衡正向移动,能提高乙酸乙酯的平衡产率,D错误。
故选D。
4.C
解析:A.C4H8Br2含2个甲基的同分异构体有CH3C(Br)2CH2CH3、CH3CH BrCHBrCH3、CH(Br)2CH (CH3)2、CH2 BrCBr(CH3)2,共4种。
B.C8H10与苯互为同系物,可以为乙苯或邻二甲苯或间二甲苯,或对二甲苯,共4种。
C.C5H12O能与金属钠反应说明其含有羟基,则根据C5H11-有8种分析,该物质有8种结构。
D.C4H8O2能与氢氧化钠溶液反应,说明为羧酸或酯,对应的同分异构体有:丁酸、2-甲基丙酸、甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,共6种。
故同分异构体数目最多的为C。故选C。
5.A
解析:A.蒸馏时粗溴苯,温度计测定馏分的温度,则将温度计水银球置于蒸馏烧瓶支管口处,故A正确;
B.NaOH易潮解,具有腐蚀性,则称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,故B错误;
C.苯甲酸在冷水中溶解度很小,在热水中的溶解度很大,所以用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度受温度的影响很大,故C错误;
D.碳碳双键、-CHO均可被酸性高锰酸钾氧化,溶液褪色,不能证明含碳碳双键,故D错误;
故选:A。
6.C
解析:A.为乙烯的球棍模型,故A错误;
B.羟基的电子式为:,故B错误;
C.丁烯的键线式为:,故C正确;
D.乙醛的结构简式为:,故D错误;
故答案选C。
7.B
解析:A.碳酸氢钙溶液与过量的澄清石灰水混合反应生成碳酸钙沉淀和水,离子方程式正确,故A正确;
B.稀硫酸加入硫代硫酸钠溶液,硫代硫酸根离子在酸性条件下会发生歧化反应,其离子方程式为:,故B错误;
C.溶液与ZnS反应生成CuS和硫酸锌,其中ZnS和CuS难溶于水,离子方程式正确,故C正确;
D.银氨溶液中滴加乙醛,水浴加热,反应生成乙酸铵、Ag和水,离子方程式正确,故D正确;
故选:B。
8.D
解析:A.X中含有-CH2-、苯环、-CN,C原子杂化类型分别为sp3、sp2、sp共3种,选项A错误;
B.Z与足量的氢气加成后产物中含有4个手性碳原子,如图,选项B错误;
C.Z中含有酚羟基和羰基,可发生取代反应、加成反应,但不能发生消去反应,选项C错误;
D.Y中不含有酚羟基而Z中含有酚羟基,可用氯化铁溶液鉴别Y、Z两种物质,选项D正确;
答案选D。
9.D
解析:羟基个数与被置换的氢原子个数之比为1:1,三种醇与钠反应放出氢气的体积比为6:2:3(相同条件下),则三种醇提供的羟基数之比为6:2:3,因此三种醇的物质的量之比为(6×1)::=6:1:1;
故选D。
10.C
解析:A.苯酚遇溶液显紫色,原因是苯酚根离子与铁离子形成了有颜色的配合物,A错误;
B.二氧化硫使品红溶液褪色是因为二氧化硫具有漂白性,和有色物质结合成无色物质,B错误;
C.向酸性溶液中加入乙醇,溶液由橙色变为绿色,是因为重铬酸根离子变为铬离子,元素化合价发生改变,是氧化还原反应,C正确;
D.向悬浊液中滴加溶液,黄色沉淀变黑,是碘化银沉淀转化为硫化银沉淀,D错误;
故选C。
11.A
【分析】在催化剂作用下,苯与氢气反应生成环己烷,该反应为加成反应。
解析:A.丙酮与反应生成2 丙醇是加成反应,故A符合题意;
B.乙醛与银氨溶液反应是氧化反应,故B不符合题意;
C.甲烷的燃烧是氧化反应, 故C不符合题意;
D.乙醇与浓共热生成乙烯是消去反应,故D不符合题意。
综上所述,答案为A。
12.D
解析:A.醇及生成的烯烃均使高锰酸钾褪色,不能检验丙烯生成,故A错误;
B.盐酸易挥发,盐酸与硅酚钠反应,则不能比较碳酸、硅酸的酸性,故B错误;
C.测定反应液的温度为170℃,则温度计水银球应该插入反应液中,故C错误;
D.水浴加热制备,则装置可用于实验室制硝基苯,故D正确;
故选D。
13.B
解析:A.卤代烃在碱性条件下水解,检验卤离子时,应先酸化,排除AgOH的干扰,故A错误;
B.溴乙烷与NaOH醇溶液共热后,发生消去反应,生成乙烯,可以使酸性KMnO4溶液褪色,故B正确;
C.乙烯和乙炔都为不饱和烃,都可与溴水发生加成反应使其褪色,不能鉴别,故C错误;
D.一氯乙烷和三氯乙烷用氢氧化钠的水溶液不能判断Cl原子的个数,则不能鉴别,没有明显的不同现象,故D错误,
答案选B。
14.D
解析:A.苯的密度比水小,苯与溴水混合,充分振荡后静置,有机层在上层,应是上层溶液呈橙红色,故A错误;
B.环己醇含有六元碳环,和乙醇结构不相似,分子组成也不相差若干CH2原子团,不互为同系物,故B错误;
C.环己烷分子中的碳原子均为饱和碳原子,与每个碳原子直接相连的4个原子形成四面体结构,因此所有碳原子不可能共平面,故C错误;
D.己二酸分子中含有羧基,每1个能与NaHCO3溶液反应生成1个CO2,则1mol已二酸与足量溶液反应生成2mol CO2,即故D正确;
答案选D。
15.A
解析:A.乙醇分子间存在氢键,沸点高于戊烷,A错误;
B.戊烷的同分异构体的结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C共3种;戊烯的同分异构体的结构简式为CH2=CHCH2CH2CH3、CH3CH=CHCH2CH3、(CH3)2CHCH=CH2、(CH3)2C=CHCH3、CH2=C(CH3)CH2CH3共5种,B正确;
C.烃的密度小于水,二溴代烷的密度大于水,密度:苯<水<1,2-二溴乙烷,C正确;
D.乙烯含碳量大于乙烷,点燃时火焰明亮程度:乙烯>乙烷,D正确;
综上所述答案为A。
二、填空题
16.C3H6O3 羧基 羟基 4 酯化(取代)
解析:(1)该有机物蒸汽密度是相同条件下H2的45倍,故有机物的相对分子质量为45×2=90。
(2)9.0gA的物质的量是0.1mol,浓硫酸和碱石灰增加的质量分别是水和CO2的质量,即生成物水是5.4g,CO2是13.2g,物质的量分别是=0.3mol、=0.3mol,所以有机物A中碳氢原子的个数分别是3个和6个,则氧原子的个数是,所以A的化学式是C3H6O3;
(3)A跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),说明有机物A中含有羧基,9.0g有机物A的物质的量为0.1mol,二氧化碳的物质的量为=0.1mol,羧基与碳酸氢钠按1:1反应,故分子中含有羧基数目为0.1mol÷0.1mol=1个;2.24LH2(标准状况)的物质的量为=0.1mol,0.1mol羧基与钠反应生成0.05molH2,故有机物A中还含有羟基,其中含有羟基数目为;
(4)根据核磁共振氢谱可知,A分子中含有4类氢原子。
(5)综上所述,A的结构简式是;有机物A中含有羧基和羟基,可以自身发生酯化反应生成六元环酯B,因此B的结构简式是,该反应类型是酯化(取代)反应。
17.+HNO3(浓) +H2O
解析:根据物质转化可知A是甲苯,结构简式是,A与Cl2在光照条件下发生甲基上的取代反应产生B是;B与SbF3在DMSO作用下发生Cl原子的取代反应产生C:,C与浓硝酸、浓硫酸混合加热,发生苯环上已有取代基间位上的取代反应产生D:;D与Fe、20%盐酸发生还原反应产生E:;E与、吡啶发生取代反应产生F:;F与浓硝酸、浓硫酸混合加热,发生苯环上取代反应产生G:。反应③是与浓硝酸在浓硫酸催化下加热发生取代反应产生和H2O,该反应的化学方程式为:+HNO3(浓) +H2O。
18.H2C=CH2 CH3CH2OH
解析:由题给有机物的转化关系可知,与苯发生信息反应生成,则A为,一定条件下发生还原反应生成B,在TsOH作用下与乙醇发生酯化反应生酯化反应生成C,C经过多步转化,在CH2Cl2作用下, 与溴化剂发生取代反应生成,与生成G,G经过一系列反应生成M;
以乙烯和为原料合成的路线设计过程中,可利用E→F的反应类型实现,因此需先利用乙烯合成,中醛基可通过羟基催化氧化而得,中溴原子可利用D→E的反应类型实现,因此合成路线为,故答案为:。
19. CH≡CH+2H2CH3CH3 +HNO3+H2O CH3CHClCH3+NaOHCH3CHOHCH3+NaCl CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3↑+H2O 2CH3CH(OH)COOH+2H2O
解析:(1)乙炔与氢气用镍作催化剂在加热条件下发生加成反应生成乙烷,反应的化学方程式为CH≡CH+2H2CH3CH3。
(2)苯与浓硫酸、浓硝酸的混合酸在100~110℃发生取代反应生成硝基苯和水,反应的化学方程式为+HNO3+H2O。
(3)2-氯丙烷与氢氧化钠水溶液共热发生水解反应生成2-丙醇和氯化钠,反应的化学方程式为CH3CHClCH3+NaOHCH3CHOHCH3+NaCl。
(4)乙醛发生银镜反应的化学方程式为CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3↑+H2O。
(5)两分子乳酸脱去两分子水生成环酯,反应的化学方程式为2CH3CH(OH)COOH+2H2O。
20.(1) CH3CH2— C9H12O3
(2)a
(3)7
(4)
(5) 3-氯丙烯 2-乙基-1,3-丁二烯 1,2-丙二醇 2-甲基-2-氯丙烷
解析:(1)对比结构简式与立体模型可知,立体模型中为碳原子,为氢原子,为氧原子,则Et为CH3CH2-,由立体模型得其分子式为C9H12O3,故答案为:CH3CH2-;C9H12O3;
(2)该有机物中含-COOC-及C=O,属于酯类物质,故选a,故答案为:a;
(3)该有机物中含有7种不同环境的氢原子,其一溴代物有7种,故答案为:7;
(4)C9H12O3去掉一个苯环结构还剩余3个碳原子、3个氧原子、6个氢原子,可以多种方式连在苯环上,则其中一种同分异构体为,故答案为:;
(5)①CH2=CHCH2Cl中含有碳碳双键和氯原子,氯原子位于3号碳原子上,命名为3-氯丙烯,故答案为:3-氯丙烯;
②该物质含有两个碳碳双键,主链有4个碳原子,2号碳原子上有一个乙基,命名为2-乙基-1,3-丁二烯,故答案为:2-乙基-1,3-丁二烯;
③该物质主链有3个碳原子,1号和2号碳原子上分别有一个羟基,命名为1,2-丙二醇,故答案为:1,2-丙二醇;
④C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则该分子的结构简式为,其系统命名为2-甲基-2-氯丙烷,故答案为:2-甲基-2-氯丙烷。
21.
解析:由题中信息可知CH2=CHCH=CH2和HC≡CH发生加成反应生成,和溴单质发生加成反应生成,发生水解反应生成
22. CH3CH2CH(OH)CH2CH3 +H2O C8H18 +NaOH+NaCl 8
【分析】A的 分子式为C5H12O,在Cu催化下被O2氧化为酮,说明A中含有羟基,且与羟基相连的碳原子上只有一个氢原子,分子内脱水后有机产物只有一种,则A为CH3CH2CH(OH)CH2CH3;
B是一种烷烃,则其符合CnH2n+2,碳的质量分数为84.21%,则=84.21%,解得n=8,所以分子式为C8H18,该物质一氯取代只有一种,说明结构高度对称,则B为;
C的分子式为C8H10O,遇FeCl3溶液显蓝紫色,说明含有酚羟基,1molC可消耗1molBr2,说明在酚羟基的邻位或对位上有两个甲基,苯环上有3种氢原子,则C为。
解析:(1)根据分析可知A的结构简式为CH3CH2CH(OH)CH2CH3;A在浓硫酸作用下发生消去反应生成,化学方程式为+H2O;
(2)根据分析可知B的分子式为C8H18,B的一氯取代产物为,在NaOH水溶液中发生水解反应,化学方程式为+NaOH+NaCl;
(3)根据分析可知C为,C的同分异构体且能使FeCl3显色,说明含有酚羟基,则苯环上的取代基可以为2个甲基和1个羟基,两个甲基为邻位时,羟基有2种位置,两个甲基为间位时,羟基有3种位置(有一种为C),若两个甲基为对位,羟基有1种位置,苯环上的取代基还可以时乙基和羟基,有邻、间、对三种位置,所以共有2+2+1+3=8种。
23. CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3 D 加快反应速率,将生成的乙酸乙酯蒸出并防止乙醇和乙酸的大量挥发,有利于乙酸乙酯的生成 b a
【分析】在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液,一般先加乙醇,再加浓硫酸(防止浓硫酸放热而导致液体飞溅),降温后加乙酸(防止乙酸挥发);按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min,乙醇和乙酸发生酯化反应CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3,乙酸乙酯经过长导管,冷凝后变为液体进入B试管中,试管中饱和碳酸钠的作用为吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度;待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,使碳酸钠溶液与乙酸乙酯充分接触,将乙醇、乙酸等杂质除去,然后静置分层;从上口分离出乙酸乙酯层、洗涤和干燥,得到乙酸乙酯。
解析:(1)根据分析,制取乙酸乙酯的化学方程式为CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3;
(2)根据分析,饱和碳酸钠的作用为吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,故选D;
(3)加热的目的是加快反应速率,将生成的乙酸乙酯蒸出,根据各物质的沸点数据,乙酸、乙醇、乙酸乙酯的沸点较近,若大火加热,会将原料大量蒸出,另外,温度越高,副产物越多,故需小火均匀加热;
(4)为了保证冷凝效果,冷凝水应下进上出,故从b口进,a口出
一、选择题
1.维生素C是一种重要的抗氧化剂.其结构简式如图,下列有关说法不正确的是
A.该分子中含四种官能团 B.该分子中所有原子一定不能共平面
C.该物质能使酸性高锰酸钾溶液褪色 D.分子式为
2.科学家发现某些高温油炸食品中含有一定量的丙烯酰胺()。食品中过量的丙烯酰胺可引起令人不安的食品安全问题。下列关于丙烯酰胺的叙述,其中正确的是
①能使酸性KMnO4溶液褪色
②能发生加聚反应生成高分子化合物
③是一种不饱和烃
④能与氢气发生加成反应
A.①②③ B.②③④ C.①③④ D.①②④
3.乙醇和乙酸在酸性条件下生成乙酸乙酯,反应机理如图,下列说法错误的是
A.Ⅰ→Ⅱ形成配位键,Ⅴ→Ⅵ断裂配位键
B.Ⅱ→Ⅲ的反应的原子利用率为100%
C.Ⅲ→Ⅳ质子发生转移
D.若反应条件为浓硫酸,只能加快反应速率,不能提高乙酸乙酯的平衡产率
4.符合限制条件的同分异构体数目最多的有机物是
选项 分子式 限制条件(不考虑立体异构)
A C4H8Br2 含2个甲基
B C8H10 与苯互为同系物
C C5H12O 能与金属钠反应
D C4H8O2 能与氢氧化钠溶液反应
A.A B.B C.C D.D
5.下列说法正确的是
A.蒸馏粗溴苯时,温度计的水银球应置于蒸馏烧瓶的支管口处
B.用托盘天平称量4.0gNaOH时,先在左右两盘分别放质量相同的称量纸再称量
C.可用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度很大
D.向CH2=CH-CH2-CHO中滴加酸性高锰酸钾溶液,若紫色退去,则证明其分子中含有碳碳双键
6.化学学科需要借助化学语言来描述,下列化学用语正确的是
A.乙烯的空间充填模型: B.羟基的电子式:
C.丁烯的键线式: D.乙醛的结构简式
7.下列反应的方程式不正确的是
A.将碳酸氢钙溶液与过量的澄清石灰水混合:
B.将稀硫酸加入硫代硫酸钠溶液:
C.溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):
D.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
8.化合物Z是一种抗骨质疏松药的一种重要中间体,可由下列反应制得。下列有关X、Y、Z的说法正确的是
A.X分子中C原子杂化类型有2种
B.Z与足量的氢气加成后产物中含有5个手性碳原子
C.Z可发生取代、加成和消去反应
D.可用氯化铁溶液鉴别Y、Z两种物质
9.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比为
A.6∶3∶2 B.1∶3∶2
C.3∶2∶1 D.6∶1∶1
10.下列化学反应颜色的变化与氧化还原反应有关的是
A.苯酚遇溶液显紫色
B.二氧化硫使品红溶液褪色
C.向酸性溶液中加入乙醇,溶液由橙色变为绿色
D.向悬浊液中滴加溶液,黄色沉淀变黑
11.已知:在催化剂作用下,苯与氢气反应生成环己烷。一定条件下,下列反应的反应类型与之相同的是
A.丙酮与反应生成2 丙醇 B.乙醛与银氨溶液反应
C.甲烷的燃烧 D.乙醇与浓共热生成乙烯
12.下列有关实验装置及用途叙述完全正确的是
A.a装置检验消去反应的产物丙烯 B.b装置检验酸性:盐酸>碳酸>硅酸
C.c装置用于实验室制取并收集乙烯 D.d装置用于实验室制硝基苯
13.下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤素原子存在
B.用KMnO4酸性溶液检验溴乙烷与NaOH醇溶液共热后的产物是否是乙烯
C.用溴水鉴别乙烯与乙炔
D.用NaOH水溶液来鉴别一氯乙烷和三氯乙烷
14.已二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线:
下列说法正确的是
A.苯与溴水混合,充分振荡后静置,下层溶液呈橙红色
B.环已醇与乙醇互为同系物
C.环己烷分子中所有碳原子共平面
D.1mol已二酸与足量溶液反应生成
15.在通常情况下,下列各组物质的性质排列不正确的是
A.沸点:戊烷>2-甲基丁烷>乙醇
B.同分异构体种类:戊烷<戊烯
C.密度:苯<水<1,2-二溴乙烷
D.点燃时火焰明亮程度:乙烯>乙烷
二、填空题
16.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如表实验:
实验步骤 解释或实验结论
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 试通过计算填空:(1)A的相对分子质量为____。
(2)将此9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 (2)A的分子式为____。
(3)另取A9.0g,跟足量NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 (3)A中所含官能团名称____、____。
(4)A的核磁共振氢谱如图: (4)A中含有____种氢原子。
(5)综上所述,A的结构简式为____,A与浓硫酸混合,在一定条件下反应生成六元环状物,该反应类型是____反应。
17.反应③的方程式:_______
18.叶酸拮抗剂是一种多靶向性抗癌药物。以苯和丁二酸酐为原料合成该化合物的路线如下。回答下列问题:
已知:①++
②
参照上述合成路线,以乙烯和为原料,设计合成的路线___________(其他试剂任选)。
19.写出下列有机反应方程式
(1)乙炔与氢气用镍作催化剂在加热条件下发生加成反应生成乙烷___________。
(2)苯与浓硫酸、浓硝酸的混合酸在100~110℃发生取代反应____________。
(3)2-氯丙烷与氢氧化钠水溶液共热________________。
(4)乙醛发生银镜反应________________。
(5)两分子乳酸脱去两分子水________________。
20.按要求解答下列各题,如图是合成某药物中间体分子(由9个C原子和若干H、O原子构成)的结构示意图:
试回答下列问题:
(1)通过对比上面的结构式与立体模型,请指出结构式中的“Et”表示的基团是(写结构简式)_______;该药物中间体的分子式为_______。
(2)该药物中间体的有机物类别是_______(填字母序号)。
a.酯 b.羧酸 c.醛
(3)该药物中间体分子中与C原子结合的H原子被Br原子取代,所得的一溴代物有_______种。
(4)该药物中间体分子有多种含苯环的同分异构体,请写出其中一种的结构简式:_______。
(5)按要求写出下列物质的名称
①CH2=CHCH2Cl _______
② _______
③_______
④C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则其化学名称为_______
21.已知:,试写出以1,3-丁二烯和乙炔为原料(无机试剂及催化剂任用)合成的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
22.根据下列信息,回答问题:
物质 A B C
结构及性质 分子式为C5H12O,在Cu催化下被O2氧化为酮,且分子内脱水后有机产物只有一种 是一种烷烃,碳的质量分数为84.21%,且该物质一氯取代只有一种 分子式为C8H10O,遇FeCl3溶液显蓝紫色,1molC可消耗1molBr2,且苯环上有3种氢原子
(1)A的结构简式是_______,A发生分子内脱水反应的化学方程式是_______
(2)B的分子式是_______,B的一氯取代产物与NaOH水溶液反应的化学方程式是_______
(3)C的结构简式是_______,与C互为同分异构体且能使FeCl3显色的物质有_______种(不包括C)
23.已知数据:
物质 熔点/℃ 沸点/℃ 密度/g·cm-3
乙醇 -117.3 78.5 0.789
乙酸 16.6 117.9 1.05
乙酸乙酯 -83.6 77.5 0.90
浓硫酸(98%) — 338.0 1.84
实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min;
③待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,然后静置分层;
④分离出乙酸乙酯层、洗涤和干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:___________。
(2)上述实验中饱和碳酸钠溶液的作用不包括_________(填字母代号)。
A.反应乙酸 B.吸收部分乙醇C.降低乙酸乙酯的溶解度,有利于分层析出 D.吸收挥发出的硫酸,加快反应速率
(3)步骤②中需要加热并且小火均匀加热的原因是___________。
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),与图1所示装置相比,此装置的主要优点有①增加了温度计,有利于控制发生装置中反应液的温度;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯等,其中图2中冷凝水的流向为:____口进____口出(填写“a”或“b”)。
【参考答案】
一、选择题
1.A
解析:A.该分子中含三种官能团,分别为羟基、碳碳双键,酯基,故A错误;
B.该分子中存在三个饱和碳,所有原子一定不共平面,故B正确;
C.该物质含有碳碳双键、羟基,能与酸性高锰酸钾溶液发生氧化反应,因此能使酸性高锰酸钾溶液褪色,故C正确;
D.由结构简式可知,该物质分子式为C6H8O6,故D正确;
答案为A。
2.D
解析:①丙烯酰胺含有碳碳双键,能使酸性KMnO4溶液褪色,故①正确;②丙烯酰胺含有碳碳双键,能发生加聚反应生成高分子化合物,故正确;③丙烯酰胺含有氮和氧,不属于烃,故③错误;④丙烯酰胺含有碳碳双键,能与氢气发生加成反应,故④正确;因此①②④正确;故D正确。
综上所述,答案为D。
3.D
解析:A.由流程可知,Ⅰ→Ⅱ中氢离子提供空轨道、氧提供孤电子对形成配位键,Ⅴ→Ⅵ形成的配位键断裂,A正确;
B.Ⅱ→Ⅲ的反应中原子全部反应生成一种物质,原子利用率为100%,B正确;
C.由图可知,Ⅲ→Ⅳ过程中下侧的质子转移到了右侧羟基上,发生转移,C正确;
D.浓硫酸具有吸水性,吸收生成的水,导致平衡正向移动,能提高乙酸乙酯的平衡产率,D错误。
故选D。
4.C
解析:A.C4H8Br2含2个甲基的同分异构体有CH3C(Br)2CH2CH3、CH3CH BrCHBrCH3、CH(Br)2CH (CH3)2、CH2 BrCBr(CH3)2,共4种。
B.C8H10与苯互为同系物,可以为乙苯或邻二甲苯或间二甲苯,或对二甲苯,共4种。
C.C5H12O能与金属钠反应说明其含有羟基,则根据C5H11-有8种分析,该物质有8种结构。
D.C4H8O2能与氢氧化钠溶液反应,说明为羧酸或酯,对应的同分异构体有:丁酸、2-甲基丙酸、甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯,共6种。
故同分异构体数目最多的为C。故选C。
5.A
解析:A.蒸馏时粗溴苯,温度计测定馏分的温度,则将温度计水银球置于蒸馏烧瓶支管口处,故A正确;
B.NaOH易潮解,具有腐蚀性,则称量NaOH时,NaOH置于小烧杯中放在托盘天平左盘,故B错误;
C.苯甲酸在冷水中溶解度很小,在热水中的溶解度很大,所以用重结晶法除去苯甲酸固体中混有的NaCl,因为苯甲酸在水中的溶解度受温度的影响很大,故C错误;
D.碳碳双键、-CHO均可被酸性高锰酸钾氧化,溶液褪色,不能证明含碳碳双键,故D错误;
故选:A。
6.C
解析:A.为乙烯的球棍模型,故A错误;
B.羟基的电子式为:,故B错误;
C.丁烯的键线式为:,故C正确;
D.乙醛的结构简式为:,故D错误;
故答案选C。
7.B
解析:A.碳酸氢钙溶液与过量的澄清石灰水混合反应生成碳酸钙沉淀和水,离子方程式正确,故A正确;
B.稀硫酸加入硫代硫酸钠溶液,硫代硫酸根离子在酸性条件下会发生歧化反应,其离子方程式为:,故B错误;
C.溶液与ZnS反应生成CuS和硫酸锌,其中ZnS和CuS难溶于水,离子方程式正确,故C正确;
D.银氨溶液中滴加乙醛,水浴加热,反应生成乙酸铵、Ag和水,离子方程式正确,故D正确;
故选:B。
8.D
解析:A.X中含有-CH2-、苯环、-CN,C原子杂化类型分别为sp3、sp2、sp共3种,选项A错误;
B.Z与足量的氢气加成后产物中含有4个手性碳原子,如图,选项B错误;
C.Z中含有酚羟基和羰基,可发生取代反应、加成反应,但不能发生消去反应,选项C错误;
D.Y中不含有酚羟基而Z中含有酚羟基,可用氯化铁溶液鉴别Y、Z两种物质,选项D正确;
答案选D。
9.D
解析:羟基个数与被置换的氢原子个数之比为1:1,三种醇与钠反应放出氢气的体积比为6:2:3(相同条件下),则三种醇提供的羟基数之比为6:2:3,因此三种醇的物质的量之比为(6×1)::=6:1:1;
故选D。
10.C
解析:A.苯酚遇溶液显紫色,原因是苯酚根离子与铁离子形成了有颜色的配合物,A错误;
B.二氧化硫使品红溶液褪色是因为二氧化硫具有漂白性,和有色物质结合成无色物质,B错误;
C.向酸性溶液中加入乙醇,溶液由橙色变为绿色,是因为重铬酸根离子变为铬离子,元素化合价发生改变,是氧化还原反应,C正确;
D.向悬浊液中滴加溶液,黄色沉淀变黑,是碘化银沉淀转化为硫化银沉淀,D错误;
故选C。
11.A
【分析】在催化剂作用下,苯与氢气反应生成环己烷,该反应为加成反应。
解析:A.丙酮与反应生成2 丙醇是加成反应,故A符合题意;
B.乙醛与银氨溶液反应是氧化反应,故B不符合题意;
C.甲烷的燃烧是氧化反应, 故C不符合题意;
D.乙醇与浓共热生成乙烯是消去反应,故D不符合题意。
综上所述,答案为A。
12.D
解析:A.醇及生成的烯烃均使高锰酸钾褪色,不能检验丙烯生成,故A错误;
B.盐酸易挥发,盐酸与硅酚钠反应,则不能比较碳酸、硅酸的酸性,故B错误;
C.测定反应液的温度为170℃,则温度计水银球应该插入反应液中,故C错误;
D.水浴加热制备,则装置可用于实验室制硝基苯,故D正确;
故选D。
13.B
解析:A.卤代烃在碱性条件下水解,检验卤离子时,应先酸化,排除AgOH的干扰,故A错误;
B.溴乙烷与NaOH醇溶液共热后,发生消去反应,生成乙烯,可以使酸性KMnO4溶液褪色,故B正确;
C.乙烯和乙炔都为不饱和烃,都可与溴水发生加成反应使其褪色,不能鉴别,故C错误;
D.一氯乙烷和三氯乙烷用氢氧化钠的水溶液不能判断Cl原子的个数,则不能鉴别,没有明显的不同现象,故D错误,
答案选B。
14.D
解析:A.苯的密度比水小,苯与溴水混合,充分振荡后静置,有机层在上层,应是上层溶液呈橙红色,故A错误;
B.环己醇含有六元碳环,和乙醇结构不相似,分子组成也不相差若干CH2原子团,不互为同系物,故B错误;
C.环己烷分子中的碳原子均为饱和碳原子,与每个碳原子直接相连的4个原子形成四面体结构,因此所有碳原子不可能共平面,故C错误;
D.己二酸分子中含有羧基,每1个能与NaHCO3溶液反应生成1个CO2,则1mol已二酸与足量溶液反应生成2mol CO2,即故D正确;
答案选D。
15.A
解析:A.乙醇分子间存在氢键,沸点高于戊烷,A错误;
B.戊烷的同分异构体的结构简式为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C共3种;戊烯的同分异构体的结构简式为CH2=CHCH2CH2CH3、CH3CH=CHCH2CH3、(CH3)2CHCH=CH2、(CH3)2C=CHCH3、CH2=C(CH3)CH2CH3共5种,B正确;
C.烃的密度小于水,二溴代烷的密度大于水,密度:苯<水<1,2-二溴乙烷,C正确;
D.乙烯含碳量大于乙烷,点燃时火焰明亮程度:乙烯>乙烷,D正确;
综上所述答案为A。
二、填空题
16.C3H6O3 羧基 羟基 4 酯化(取代)
解析:(1)该有机物蒸汽密度是相同条件下H2的45倍,故有机物的相对分子质量为45×2=90。
(2)9.0gA的物质的量是0.1mol,浓硫酸和碱石灰增加的质量分别是水和CO2的质量,即生成物水是5.4g,CO2是13.2g,物质的量分别是=0.3mol、=0.3mol,所以有机物A中碳氢原子的个数分别是3个和6个,则氧原子的个数是,所以A的化学式是C3H6O3;
(3)A跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),说明有机物A中含有羧基,9.0g有机物A的物质的量为0.1mol,二氧化碳的物质的量为=0.1mol,羧基与碳酸氢钠按1:1反应,故分子中含有羧基数目为0.1mol÷0.1mol=1个;2.24LH2(标准状况)的物质的量为=0.1mol,0.1mol羧基与钠反应生成0.05molH2,故有机物A中还含有羟基,其中含有羟基数目为;
(4)根据核磁共振氢谱可知,A分子中含有4类氢原子。
(5)综上所述,A的结构简式是;有机物A中含有羧基和羟基,可以自身发生酯化反应生成六元环酯B,因此B的结构简式是,该反应类型是酯化(取代)反应。
17.+HNO3(浓) +H2O
解析:根据物质转化可知A是甲苯,结构简式是,A与Cl2在光照条件下发生甲基上的取代反应产生B是;B与SbF3在DMSO作用下发生Cl原子的取代反应产生C:,C与浓硝酸、浓硫酸混合加热,发生苯环上已有取代基间位上的取代反应产生D:;D与Fe、20%盐酸发生还原反应产生E:;E与、吡啶发生取代反应产生F:;F与浓硝酸、浓硫酸混合加热,发生苯环上取代反应产生G:。反应③是与浓硝酸在浓硫酸催化下加热发生取代反应产生和H2O,该反应的化学方程式为:+HNO3(浓) +H2O。
18.H2C=CH2 CH3CH2OH
解析:由题给有机物的转化关系可知,与苯发生信息反应生成,则A为,一定条件下发生还原反应生成B,在TsOH作用下与乙醇发生酯化反应生酯化反应生成C,C经过多步转化,在CH2Cl2作用下, 与溴化剂发生取代反应生成,与生成G,G经过一系列反应生成M;
以乙烯和为原料合成的路线设计过程中,可利用E→F的反应类型实现,因此需先利用乙烯合成,中醛基可通过羟基催化氧化而得,中溴原子可利用D→E的反应类型实现,因此合成路线为,故答案为:。
19. CH≡CH+2H2CH3CH3 +HNO3+H2O CH3CHClCH3+NaOHCH3CHOHCH3+NaCl CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3↑+H2O 2CH3CH(OH)COOH+2H2O
解析:(1)乙炔与氢气用镍作催化剂在加热条件下发生加成反应生成乙烷,反应的化学方程式为CH≡CH+2H2CH3CH3。
(2)苯与浓硫酸、浓硝酸的混合酸在100~110℃发生取代反应生成硝基苯和水,反应的化学方程式为+HNO3+H2O。
(3)2-氯丙烷与氢氧化钠水溶液共热发生水解反应生成2-丙醇和氯化钠,反应的化学方程式为CH3CHClCH3+NaOHCH3CHOHCH3+NaCl。
(4)乙醛发生银镜反应的化学方程式为CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3↑+H2O。
(5)两分子乳酸脱去两分子水生成环酯,反应的化学方程式为2CH3CH(OH)COOH+2H2O。
20.(1) CH3CH2— C9H12O3
(2)a
(3)7
(4)
(5) 3-氯丙烯 2-乙基-1,3-丁二烯 1,2-丙二醇 2-甲基-2-氯丙烷
解析:(1)对比结构简式与立体模型可知,立体模型中为碳原子,为氢原子,为氧原子,则Et为CH3CH2-,由立体模型得其分子式为C9H12O3,故答案为:CH3CH2-;C9H12O3;
(2)该有机物中含-COOC-及C=O,属于酯类物质,故选a,故答案为:a;
(3)该有机物中含有7种不同环境的氢原子,其一溴代物有7种,故答案为:7;
(4)C9H12O3去掉一个苯环结构还剩余3个碳原子、3个氧原子、6个氢原子,可以多种方式连在苯环上,则其中一种同分异构体为,故答案为:;
(5)①CH2=CHCH2Cl中含有碳碳双键和氯原子,氯原子位于3号碳原子上,命名为3-氯丙烯,故答案为:3-氯丙烯;
②该物质含有两个碳碳双键,主链有4个碳原子,2号碳原子上有一个乙基,命名为2-乙基-1,3-丁二烯,故答案为:2-乙基-1,3-丁二烯;
③该物质主链有3个碳原子,1号和2号碳原子上分别有一个羟基,命名为1,2-丙二醇,故答案为:1,2-丙二醇;
④C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则该分子的结构简式为,其系统命名为2-甲基-2-氯丙烷,故答案为:2-甲基-2-氯丙烷。
21.
解析:由题中信息可知CH2=CHCH=CH2和HC≡CH发生加成反应生成,和溴单质发生加成反应生成,发生水解反应生成
22. CH3CH2CH(OH)CH2CH3 +H2O C8H18 +NaOH+NaCl 8
【分析】A的 分子式为C5H12O,在Cu催化下被O2氧化为酮,说明A中含有羟基,且与羟基相连的碳原子上只有一个氢原子,分子内脱水后有机产物只有一种,则A为CH3CH2CH(OH)CH2CH3;
B是一种烷烃,则其符合CnH2n+2,碳的质量分数为84.21%,则=84.21%,解得n=8,所以分子式为C8H18,该物质一氯取代只有一种,说明结构高度对称,则B为;
C的分子式为C8H10O,遇FeCl3溶液显蓝紫色,说明含有酚羟基,1molC可消耗1molBr2,说明在酚羟基的邻位或对位上有两个甲基,苯环上有3种氢原子,则C为。
解析:(1)根据分析可知A的结构简式为CH3CH2CH(OH)CH2CH3;A在浓硫酸作用下发生消去反应生成,化学方程式为+H2O;
(2)根据分析可知B的分子式为C8H18,B的一氯取代产物为,在NaOH水溶液中发生水解反应,化学方程式为+NaOH+NaCl;
(3)根据分析可知C为,C的同分异构体且能使FeCl3显色,说明含有酚羟基,则苯环上的取代基可以为2个甲基和1个羟基,两个甲基为邻位时,羟基有2种位置,两个甲基为间位时,羟基有3种位置(有一种为C),若两个甲基为对位,羟基有1种位置,苯环上的取代基还可以时乙基和羟基,有邻、间、对三种位置,所以共有2+2+1+3=8种。
23. CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3 D 加快反应速率,将生成的乙酸乙酯蒸出并防止乙醇和乙酸的大量挥发,有利于乙酸乙酯的生成 b a
【分析】在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液,一般先加乙醇,再加浓硫酸(防止浓硫酸放热而导致液体飞溅),降温后加乙酸(防止乙酸挥发);按图1连接好装置(装置气密性良好),用小火均匀地加热装有混合液的大试管3~5 min,乙醇和乙酸发生酯化反应CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3,乙酸乙酯经过长导管,冷凝后变为液体进入B试管中,试管中饱和碳酸钠的作用为吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度;待试管B收集到一定量产物后停止加热,撤去试管B并用力振荡,使碳酸钠溶液与乙酸乙酯充分接触,将乙醇、乙酸等杂质除去,然后静置分层;从上口分离出乙酸乙酯层、洗涤和干燥,得到乙酸乙酯。
解析:(1)根据分析,制取乙酸乙酯的化学方程式为CH3COOH+CH3CH2OHH2O+CH3COOCH2CH3;
(2)根据分析,饱和碳酸钠的作用为吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,故选D;
(3)加热的目的是加快反应速率,将生成的乙酸乙酯蒸出,根据各物质的沸点数据,乙酸、乙醇、乙酸乙酯的沸点较近,若大火加热,会将原料大量蒸出,另外,温度越高,副产物越多,故需小火均匀加热;
(4)为了保证冷凝效果,冷凝水应下进上出,故从b口进,a口出
