2024届高三新高考化学大一轮专题训练--- -沉淀溶解平衡(含解析)
文档属性
| 名称 | 2024届高三新高考化学大一轮专题训练--- -沉淀溶解平衡(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 727.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-23 20:21:50 | ||
图片预览




文档简介
2024届高三新高考化学大一轮专题训练----沉淀溶解平衡
一、单选题
1.(2023·安徽铜陵·统考模拟预测)下列实验操作及现象与对应结论不匹配的是
选项 实验操作及现象 结论
A 向含有0.lmol/L的NaCl和0.1mol/L的NaI混合溶液中,滴加0.01mol/LAgNO3溶液,先生成黄色沉淀 Ksp(AgI)B 室温下,向NaAlO2溶液中滴加NaHCO3溶液,有白色絮状沉淀生成 结合H+能力比强
C 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀 溶液存在平衡: I2+I-
D 向苯与液溴的混合液中加入铁粉产生气体,将气体直接通入AgNO3溶液中,有浅黄色沉淀生成 液溴与苯发生取代反应
A.A B.B C.C D.D
2.(2023·广东深圳·翠园中学校考模拟预测)下列指定反应的离子方程式正确的是
A.向溶液中滴入少量溶液:
B.向二元弱酸亚磷酸溶液中滴入少量烧碱溶液:
C.向溶液中通入过量:
D.通入石灰乳中制取漂白粉:
3.(2023春·重庆沙坪坝·高二重庆一中校考期中)GaN常用于高能半导体材料的制备,工业上从废旧太阳能电池CIGS中回收利用Ga()。回收处理流程如图:
已知:高温Cu以价稳定,,,,已知:,
下列说法错误的是
A.酸浸氧化发生的主要氧化还原反应方程式为:
B.滤液1的主要成分是、
C.恰好完全沉淀时溶液的pH约为4.7
D.若在调pH过滤步骤中加入过量氨水,则溶解:
4.(2020春·北京海淀·高三人大附中阶段练习)下列解释事实的方程式不正确的是
A.醋酸溶液显酸性:CH3COOH H++CH3COO-
B.用氨水除去烟气中的SO2:SO2+2NH3 H2O=(NH4)2SO3+H2O
C.向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4
D.用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+
5.(2023·全国·高三统考专题练习)下列反应的离子方程式书写错误的是
A.向酸性溶液中滴加溶液,溶液褪色:
B.将溶液加入到石灰乳中得到氢氧化镁:
C.泡沬灭火器的反应原理:
D.在溶液中加入过量的溶液:
6.(2023春·陕西榆林·高二校联考期中)下列实验操作与实验目的一致的是
选项 实验操作 实验目的
A 将产生的气体依次通过无水、品红溶液、高锰酸钾溶液、品红溶液和澄清石灰水 检验加热条件下木炭与浓硫酸反应后的气体产物
B 将少量试样加水溶解,滴加稀酸化,再滴加KSCN溶液 检验试样是否变质
C 测定等浓度的HCl、两溶液的pH 比较Cl、N的非金属性强弱
D 向和混合溶液中,滴加少量溶液 比较与溶度积大小
A.A B.B C.C D.D
7.(2023春·四川内江·高二四川省内江市第六中学校考期中)下列实验的操作、现象和结论均正确的是
选项 实验操作 实验现象 实验结论,
A 相同温度下,分别测定浓度均为0.1 mol L 1的CH3COONa溶液和Na2CO3溶液的pH 后者大于前者 水解常数: Kh(CH3COO-)B 将密封有红棕色NO2气体的圆底烧瓶浸入冰水中 气体颜色变浅 反应2NO2N2O4 △H>0
C 分别向0.1 mol L 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 醋酸溶液中有气泡产生,硼酸溶液中无气泡 酸性:硼酸>醋酸>碳酸
D 将0.1 mol L 1AgNO3溶液和0.05 mol L 1 NaCl溶液等体积混合,再向混合液中滴入0.05 mol L 1NaI溶液 先产生白色沉淀,后产生黄色沉淀 Ksp(AgI)A.A B.B C.C D.D
8.(2023·全国·高二假期作业)已知H2X的电离常数、。常温下,难溶物BaX在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中)lgc(Ba2+)与pH的关系如图所示。下列说法错误的是
A.约为
B.M点:
C.N点:约为mol L
D.直线上任一点均满足:
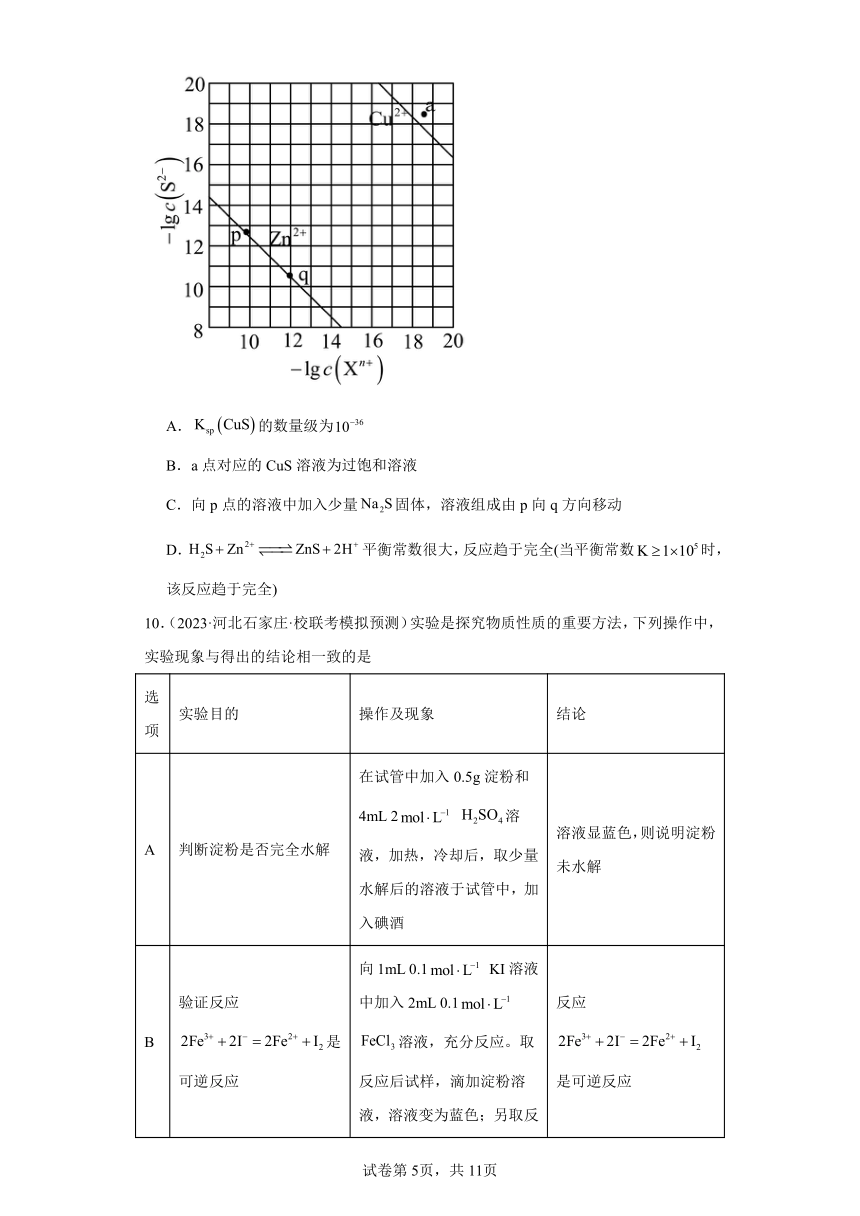
9.(2023秋·云南大理·高二统考期末)向废水中加入硫化物可以依次获得、纳米粒子。常温下,的,,溶液中平衡时相关离子浓度的关系如图所示。下列说法正确的是
A.的数量级为
B.a点对应的CuS溶液为过饱和溶液
C.向p点的溶液中加入少量固体,溶液组成由p向q方向移动
D.平衡常数很大,反应趋于完全(当平衡常数时,该反应趋于完全)
10.(2023·河北石家庄·校联考模拟预测)实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
选项 实验目的 操作及现象 结论
A 判断淀粉是否完全水解 在试管中加入0.5g淀粉和4mL 2 溶液,加热,冷却后,取少量水解后的溶液于试管中,加入碘酒 溶液显蓝色,则说明淀粉未水解
B 验证反应是可逆反应 向1mL 0.1 KI溶液中加入2mL 0.1 溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入溶液,产生黄色沉淀 反应是可逆反应
C 判断(AgCl)与(AgI)的大小 向NaCl、NaI的混合溶液中滴入少量稀溶液,有黄色沉淀生成
D 判断某溶液样品中是否含有 向某溶液样品中加入硫酸酸化的溶液,紫色褪去 该样品中一定含有
A.A B.B C.C D.D
11.(2023春·江苏徐州·高二统考期中)根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验目的或结论
A 室温下,用试纸测定浓度为溶液和溶液的 比较和的酸性强弱
B 向固体加入饱和溶液,过滤,洗涤,向滤渣中加入盐酸有气体生成
C 取溶液,向其中滴加溶液,加入振荡静置,取上层清液滴加溶液,溶液变成血红色 该反应是可逆反应
D 向等体积与的饱和溶液中分别加入足量的浓溶液,析出沉淀的物质的量多于
A.A B.B C.C D.D
12.(2023·北京昌平·统考二模)废旧铅蓄电池的铅膏中主要含、、PbO和Pb.还有少量及Fe、Al的氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
已知:
①一些难溶电解质的溶度积常数如下表:
难溶电解质
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
③“酸浸”后溶液的pH约为4. 9
下列说法中不正确的是
A.在脱硫过程中,可能转化为
B.在脱硫过程中,转化反应的离子方程式为:
C.“酸浸”过程中,做氧化剂而非还原剂
D.“酸浸”后,滤渣的主要成分是、
13.(2023·浙江·校联考模拟预测)已知:室温下氢硫酸的电离常数,;和的分别为、,下列说法不正确的是
A.反应的平衡常数的数值为
B.可以用除去污水中的
C.从上述数据可得出难溶于稀硫酸中
D.的溶液中加入等体积的溶液,则有:
二、多选题
14.(2023春·广西·高二校联考阶段练习)下列方程式正确的是
A.泡沫灭火器的反应原理:2Al3++3+3H2O=2Al(OH)3↓+3CO2↑
B.乙醇催化氧化制乙醛:CH3CH2OH+O2CH3CHO+H2O
C.向AgCl沉淀中滴加NaI溶液,白色沉淀变黄:AgCl(s)+I-(aq)AgI(s)+Cl-(aq)
D.用醋酸和淀粉-KI溶液检验加碘盐中IO的离子方程式: +5I-+6H+=3I2+3H2O
三、非选择题
15.(2020秋·江西赣州·高二赣州市赣县第三中学校考阶段练习)I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
醋酸 碳酸 氢氰酸
Ka=1.7×10 Ka1=4.2×10 Ka2=5.6×10 Ka=6.2×10
(1)写出碳酸的第一步电离方程式 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为 (填序号)。
(3)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO)=0.1mol/L的NaHSO3溶液中c(H2SO3)= 。
(4)下列方法中,可以使0.10mol/LCH3COOH溶液中值增大的措施是 (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸
d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
II.请用有关电解质溶液的知识回答下列问题:
(1)25℃时,FeCl3溶液的pH 7(填“>”、“<”或“=”),原因是 (用离子方程式表示)。把FeCl3溶液蒸干灼烧得到的主要产物是 。
(2)t℃, PH=12的Na2CO3溶液中由水电离产生的c(H+)= 。
(3)25℃时,将pH=11的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=3,则NaOH溶液与H2SO4溶液的体积比为 。
(4))已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时,= 。
16.(2020秋·江西赣州·高二赣州市赣县第三中学校考阶段练习)(1)K2C2O4水解的离子方程式 ;Fe(OH)3沉淀溶解平衡方程式 ,其溶度积的表达式为
(2)用离子方程式表示不能硫酸铝和硫化钠溶液制备硫化铝的的原因 。
(3)物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,其中c(CO)最小的是 (填序号)。
(4)请写出0.1mol/L的NH4HCO3物料守恒关系式: 。
(5)已知常温下,,。向含有和的混合溶液中逐滴加入溶液(忽略溶液体积变化),判断先析出的沉淀是 (写化学式)。
(6)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10 9. CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为 。
17.(2021·全国·高二假期作业)结合水溶液中离子平衡的相关知识回答下列问题:
Ⅰ.温度为 t℃时,某 NaOH 稀溶液中 c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数 Kw= 。
(2)该 NaOH 溶液中由水电离出的 c(OH-)为 。
Ⅱ.(1)某温度时,Ag2SO4 在水溶液中的沉淀溶解平衡曲线如图所示,计算此温度下 Ag2SO4 的溶度积常数 Ksp(Ag2SO4) = 。
(2)某工业废水中含有 Fe2+、Cu2+、Mg2+等金属离子,且三者浓度相同。此条件下,各金属离子开始沉淀时的 pH 如下:
离子 Fe2+ Cu2+ Mg2+
pH 7.6 5.2 10.4
若采用向该溶液中滴加NaOH溶液的方法除去其中的金属离子,则先沉淀的是 。
18.(2021秋·吉林白山·高二统考期末)依据所学知识回答问题:
(1)液态是一种似水溶剂,可以微弱电离:,在液态中,视为酸,为碱,试写出二者在液态体系中发生反应的化学方程式: 。
(2)盐类水解的实质就是盐产生的阴阳离子与水电离出的或结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
与水反应: ;
与热水反应: 。
(3)常温下,在水中的溶解平衡曲线如图所示,则该温度下, ;将的溶液与的溶液等体积混合后,混合溶液中 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.等浓度的NaCl和NaI混合溶液中,滴加硝酸银,先生成黄色沉淀即AgI,说明AgI溶解度更小,则Ksp(AgI)B.向NaAlO2溶液中滴加NaHCO3溶液,有白色絮状氢氧化铝沉淀生成,发生反应:,通过反应可知结合H+能力比强,故B正确;
C.向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀,说明在KI3溶液中存在I-和I2,则溶液中存在平衡: I2+I-,故C正确;
D.溴蒸气易挥发,挥发出的溴与AgNO3溶液反应生成浅黄色沉淀,因此不能说明液溴与苯发生取代反应,故D错误;
故选:D。
2.B
【详解】A.硫氢化钠少量,故反应中不会生成硫化氢气体,而是生成硫化银沉淀和氢离子,反应为,A错误;
B.向二元弱酸亚磷酸溶液中滴入少量烧碱溶液,电离出的部分氢离子和氢氧根离子反应生成:,B正确;
C.向溶液中通入过量,二氧化硫过量生成亚硫酸氢根离子和二氧化碳:,C错误;
D.石灰乳为浊液不能拆,通入石灰乳中制取漂白粉:,D错误;
故选B。
3.D
【分析】废旧太阳能电池CIGS高温焙烧得到的烧渣中的成分为(因为高温Cu以+1价稳定)、、,烧渣中加入,酸浸氧化使变成,浸出液中的主要成分为,加入氨水调节pH,会生成沉淀,滤液1中的主要成分含、,向滤渣中加入回流过滤,得到滤渣,滤液经过一系列操作得到GaN。
【详解】A. 由分析可知,酸浸氧化发生的主要氧化还原反应方程式为:,故A正确;
B. 由分析可知,滤液1的主要成分是、,故B正确;
C. 当浓度为恰好完全沉淀,由求得,pOH≈9.3,则pH≈4.7,故C正确;
D. 假设该反应能发生,则该反应,由已知条件,可得所以该反应的K=<,所以反应很难进行,故D错误。
故选D。
4.D
【详解】A.醋酸为弱电解质,部分电离,离子方程式:CH3COOH H++CH3COO﹣,故A正确;
B.用氨水除去烟气中的SO2,化学方程式:SO2+2NH3 H2O=(NH4)2SO3+H2O,故B正确;
C.向盐碱地中施放硫酸钙,降低其碱性,化学方程式:Na2CO3+CaSO4=CaCO3+Na2SO4,故C正确;
D.用三氯化铁溶液腐蚀线路板,离子方程式:2Fe3++Cu=2Fe2++Cu2+,故D错误;
故答案选D。
5.D
【详解】A.是弱酸,写成分子式,酸性条件下,将氧化为CO2,离子方程式 ,A正确;
B.石灰乳写成化学式形式,转化为难溶氢氧化镁,离子方程式,B正确;
C.泡沬灭火器中的碳酸氢钠水解呈碱性,硫酸铝溶液呈酸性,两者混合,水解相互促进彻底进行,产生大量的二氧化碳,离子方程式:,C正确;
D.在中Ca2+和HCO均能和OH-反应,根据“少定多变”,离子方程式中Ca2+和HCO的个数比为1∶2,所以题中离子方程式错误,应该为,D错误;
故答案选D。
6.A
【详解】A.木炭与浓硫酸在加热条件下反应生成水、二氧化硫和二氧化碳,用无水硫酸铜检验水,用品红溶液检验二氧化硫,用澄清石灰水检验二氧化碳,二氧化硫与澄清石灰水也产生白色沉淀,故检验二氧化碳前需要除去二氧化硫,二氧化硫具有还原性,用酸性高锰酸钾除去,在检验二氧化碳前还需检验二氧化硫是否除尽,因此将产生的气体依次通过无水、品红溶液、高锰酸钾溶液、品红溶液和澄清石灰水可检验木炭与浓硫酸反应后的气体产物,故A符合题意;
B.酸性条件下,硝酸根具有强氧化性,能将Fe2+氧化为Fe3+,该实验不能检验试样是否变质,故B不符合题意;
C.比较非金属性强弱,应比较最高价含氧酸的酸性强弱,HCl不是Cl元素的最高价含氧酸,所以不能比较Cl、N元素的非金属性强弱,故C不符合题意;
D.与都是白色沉淀,无法判断先生成的沉淀是哪一种,不能比较与溶度积大小,故D不符合题意;
故答案选A。
7.A
【详解】A.相同温度下,分别测定浓度均为0.1 mol L 1的CH3COONa溶液和Na2CO3溶液的pH ,后者pH值大,说明后者水解常数大,即Kh(CH3COO-)B.将密封有红棕色NO2气体的圆底烧瓶浸入冰水中,气体颜色变浅,说明平衡向生成四氧化二氮的方向移动,则降温,向放热反应移动,反应2NO2N2O4 △H<0,故B错误;
C.分别向0.1 mol L 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液,醋酸溶液中有气泡产生,硼酸溶液中无气泡,根据相对强的酸制备相对弱的酸,则酸性:醋酸>碳酸>硼酸,故C错误;
D.将0.1 mol L 1AgNO3溶液和0.05 mol L 1 NaCl溶液等体积混合,生成AgCl沉淀,但硝酸银过量,再向混合液中滴入0.05 mol L 1NaI溶液,后产生黄色沉淀,是多余的硝酸银和NaI反应生成的,并不是AgCl转化生成的,因此不能得出Ksp(AgI)综上所述,答案为A。
8.B
【详解】A.由BaX+2H+=Ba2++H2X结合H2X的Ka1、Ka2可知c(Ba2+)≈c(H2X),H2XH++HX-,HX-H++X2-故Ka1=,Ka2=,Ka1Ka2==,得到c(X2-)=,=c(Ba2+)c(X2-)=,由题干图示信息,当pH=1时,lg(Ba2+)=0即c(H+)=0.1mol/L,
c(Ba2+)=1.0mol/L,故=c(Ba2+)c(X2-)==约为,A正确;
B.由题干信息可知,直线MN的方程式为:lg(Ba2+)=1-pH,故M点为lg(Ba2+)=0.4,pH=0.6,故c(H2X)≈c(Ba2+)=10-0.4mol/L,c(H+)=10-0.6mol/L,此时溶质为BaCl2和H2X,故,B错误;
C.由题干信息可知,直线MN的方程式为:lg(Ba2+)=1-pH,故N点pH=0.8,lg(Ba2+)=0.2,故c(H2X)≈c(Ba2+)=10-0.2mol/L,c(H+)=10-0.8mol/L,==约为mol L,C正确;
D.由BaX+2H+=Ba2++H2X、H2XH++HX-、HX-H++X2-,根据物料守恒可知,直线上任一点均满足:,D正确;
故答案为:B。
9.C
【详解】A.最上面一条直线代表CuS溶液中相关离子浓度的关系, CuS的溶度积Ksp=c(Cu2+)×c(S2-) ,这条线上的每一个点对应的溶液为CuS的饱和溶液,任取一点,c(Cu2+)=1×10-18mol·L-1,此时c(S2-)在10-19~10-18之间,根据图像,大概为10-18.3mol·L-1,代入上式,Ksp(CuS)=1×10-18×1×10-18.3=1×10-36.3,数量级约为10-37,A错误;
B.在相同c(Cu2+)时,a点c(S2-)比饱和溶液中c(S2-)小,即a点QcC.p点存在溶解平衡是ZnS(s) Zn2+(aq)+S2-(aq),加入Na2S固体,溶液中c(S2-)增大,溶解平衡向左进行,溶液中c(Zn2+)减小,但该溶液仍为ZnS的饱和溶液,溶液组成由p向q方向移动,C正确;
D.该反应的平衡常数表达式为K=,按照A选项方法,c(S2-)=10-12mol·L-1,根据图像c(Zn2+)约为10-10.3mol·L-1,则Ksp(ZnS)=10-10.3×10-12=10-22.3,将数值代入上式,得出K=1.3×10-7×7.1×10-15×=1.3×7.1×100.3<105(趋向进行完全K>105),因此该反应不趋于完全,D错误;
故选:C。
10.B
【详解】A.加入碘酒之后溶液变蓝,说明溶液中还有淀粉,可能是淀粉部分水解或为水解,A错误;
B.与反应的KI不足,取反应后试样加入溶液,产生黄色沉淀,可知碘离子不完全转化,则是可逆反应,B正确;
C.由于NaCl、NaI的混合溶液的浓度未知,由实验操作及现象可知,不能比较(AgC1)、(AgI)的大小,C错误;
D.酸性高锰酸钾溶液可与溶液中的氯离子反应生成锰离子,现象也为紫色褪去,因此不能证明溶液中一定有亚铁离子,D错误;
故选B。
11.D
【详解】A.NaClO溶液可使pH试纸褪色,应选pH计测定等浓度盐溶液的pH,故A错误;
B.当Qc>Ksp时生成碳酸钡沉淀,由现象不能比较Ksp大小,故B错误;
C.氯化铁过量,现象可检验铁离子,由现象不能说明反应为可逆反应,故C错误;
D.等体积AgCl与AgBr的饱和溶液中分别加入足量的浓AgNO3溶液,析出沉淀的物质的量AgCl多于AgBr,可知AgCl的溶解度大,则Ksp(AgCl)>Ksp(AgBr),故D正确;
故选:D。
12.A
【分析】铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量硫酸钡、Fe、Al的氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁、过滤后向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
【详解】A.在脱硫中,加入Na2CO3不能使铅膏中BaSO4转化为BaCO3,主要原因为BaSO4的Ksp小于BaCO3的Ksp,BaSO4比BaCO3更难溶,A错误;
B.从表中可知,PbSO4的Ksp大于PbCO3的Ksp,PbCO3比PbSO4更难溶,脱硫时向PbSO4中加入Na2CO3,PbSO4转化为PbCO3,离子方程式为,B正确;
C.酸浸过程中过氧化氢将亚铁离子氧化成铁离子,过氧化氢作氧化剂而不是还原剂,C正确;
D.酸浸后溶液的pH约为4.9,且经过酸浸,亚铁离子被氧化成铁离子,根据金属氢氧化物沉淀时的pH表可知,此时氢氧化铁和氢氧化铝完全沉淀,滤渣的主要成分为氢氧化铝和氢氧化铁,D正确;
故答案选A。
13.D
【详解】A.反应的平衡常数,A正确;
B.、的溶度积常数分别为、溶度积大于溶度积,所以除去废水中的可以选用作沉淀剂,B正确;
C.若溶于稀硫酸中,反应为,反应的平衡常数=4.8×10-16,反应进行的程度很小,即难溶于稀硫酸,C正确;
D.的水解平衡常数,即的水解程度大于其电离程度,溶液呈碱性,由于水的电离,则、,的溶液中加入等体积的溶液恰好反应生成,溶液中离子浓度大小关系为,D错误;
故答案选D。
14.C
【详解】A.泡沫灭火器的反应原理是硫酸铝与碳酸氢钠溶液反应产生氢氧化铝、硫酸钠和二氧化碳,反应的离子方程式为:Al3++3=Al(OH)3↓+3CO2↑,选项A错误;
B.乙醇催化氧化制乙醛,反应的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O,选项B错误;
C.向AgCl沉淀中滴加NaI溶液,白色沉淀变黄,氯化银转化为碘化银沉淀,反应的离子方程式为:AgCl(s)+I-(aq)AgI(s)+Cl-(aq),选项C正确;
D.用醋酸和淀粉-KI溶液检验加碘盐中,反应的离子方程式为: +5I-+6CH3COOH=3I2+3H2O+6CH3COO-,选项D错误;
答案选C。
15. H2CO3 H++HCO ②>①>③ 10-2mol/L cdf < FeCl3为强酸弱碱盐,发生Fe3++3H2O Fe(OH)3+3H+,溶液显酸性 氧化铁 mol/L 9:2 Cu(OH)2 1.45×109
【详解】I(1)碳酸为二元弱酸,第一步电离方程式为H2CO3 H++HCO;
(2)酸的酸性越弱,其生成的盐水解程度越大,溶液的pH越大,根据电离平衡常数可知,酸性:CH3COOH>HCN>HCO,则溶液的pH由大到小的顺序为②>①>③;
(3)Ka==1×10-2mol/L,则c(H2SO3)= 10-3mol/L×0.1mol/L÷10-2mol/L=10-2mol/L;
(4) a.=Kw÷c(OH-),加水稀释氢离子浓度减小,c(OH-)增大,则减小,a与题意不符;
b.加入少量CH3COONa固体,醋酸的电离平衡逆向移动,醋酸的浓度增大,氢离子浓度减小,减小,b与题意不符;
c.加入少量冰醋酸,为加水稀释的逆过程,加水稀释减小,则加入冰醋酸增大,c符合题意;
d.通入少量HCl气体,导致醋酸的电离平衡逆向移动,但氢离子浓度增大的程度大于醋酸的浓度,则增大,d符合题意;
e.加少量烧碱溶液,导致醋酸的电离平衡正向移动,氢离子减小的程度大于醋酸减小的程度,减小,e与题意不符;
f.升高温度,醋酸的电离平衡正向移动,氢离子浓度增大,醋酸的浓度减小,则增大,f符合题意;
答案为cdf;
II.(1)FeCl3为强酸弱碱盐,发生Fe3++3H2O Fe(OH)3+3H+,溶液显酸性,则pH<7;蒸干FeCl3溶液,促使铁离子的水解平衡正向移动,且HCl易挥发,灼烧后得到氧化铁;
(2) Na2CO3为强碱弱酸盐,碳酸根离子水解,促进水的电离,水电离产生的氢离子与氢氧根离子相等,溶液的pH=12,温度为t℃,则水电离产生的c(H+)=mol/L;
(3) pH=11的NaOH溶液中c(OH-)=10-3mol/L,pH=2的H2SO4溶液中c(H+)=10-2mol/L,根据混合溶液的pH=3,可得10-2mol/L×V酸-10-3mol/L×V碱=10-3mol/L×(V酸+V碱),解得V碱:V酸=9:2;
(4)根据溶度积的数据,Ksp[Mg(OH)2]>Ksp[Cu(OH)2],向混合液中加入NaOH溶液,先生成Cu(OH)2沉淀;当两种沉淀共存时,溶液中氢氧根离子浓度相等,= ==1.45×109。
16. C2O+H2OHC2O+OH- HC2O+H2OH2C2O4+OH- Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp=C(Fe3+)· C3(OH-) 2Al3++3S2-+3H2O=2Al(OH)3↓+3H2S↑ ③ c(NH)+c(NH3·H2O)=c(HCO)+c(CO)+c(H2CO3) AgCl 210-4mol/L
【详解】(1)K2C2O4为强碱弱酸盐,草酸根离子发生一级水解离子方程式为:C2O+H2OHC2O+OH-、草酸根离子发生二级水解离子方程式为:HC2O+H2OH2C2O4+OH-;Fe(OH)3沉淀溶解平衡方程式Fe(OH)3(s) Fe3+(aq)+3OH-(aq),按定义可知,其溶度积的表达式为Ksp=c(Fe3+)· c3(OH-)。
(2)硫酸铝水溶液因铝离子水解呈酸性,硫化钠溶液因硫离子水解呈碱性,二者混合时水解相互促进,发生彻底双水解反应,离子方程式为:2Al3++3S2-+3H2O=2Al(OH)3↓+3H2S↑。
(3) ①④相比较,由于④发生互促水解,水解程度较大,则①>④,②⑤相比较,⑤发生互促水解,c(CO)的大小为②>⑤,③为二元弱酸,c(CO)最小,则答案为③。
(4) 0.1mol/L的NH4HCO3溶液中,n(N)= n(C),含N粒子有NH和NH3·H2O,含C粒子有HCO、CO和H2CO3,则物料守恒关系式:c(NH)+c(NH3·H2O)=c(HCO)+c(CO)+c(H2CO3)。
(5)已知常温下,,。开始生成Ag2CrO4沉淀时, ,开始生成AgCl沉淀时,,向含有和的混合溶液中逐滴加入溶液,后者需要的银离子浓度较小,先生成沉淀,故答案为:AgCl;
(6) ,若Na2CO3溶液的浓度为5.6×10 5mol/L,则等体积混合后混合液中×5.6×10 5mol/L=2.8×10 5mol/L,则,又所需CaCl2溶液的浓度为钙离子浓度的两倍,则生成沉淀所需CaCl2溶液的最小浓度为210-4mol/L;
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,根据越弱越水解可知HX酸性最弱,HY其次,HZ酸性最强,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为。
17. 10-12 10-a mol/L 1.6×10-5(molL-1)3 Cu2+
【详解】(1)溶液中水的离子积Kw=c(H+)×c(OH )=10 a×10 b=10 (a+b)=10 12;故答案为:10 12;
(2)该NaOH溶液中NaOH的物质的量浓度为c(NaOH)=c(OH )=10 bmol/L,依据溶液中的离子积Kw=c(H+)×c(OH )=10 12,该NaOH溶液中由水电离出的c水(OH )= c水(H+)==;故答案为:10 amol/L;
(3)由图象可知,当c(SO)=4×10-2mol/L时,c(Ag+)=2×10-2mol/L,则Ksp=c2(Ag+)×c(SO)=4×10-4×4×10-2= 1.6×10-5 (molL-1)3,故答案为:1.6×10-5;
(4) 金属离子开始沉淀时的 pH越小,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,故答案为:Cu2+。
18. [或写为“”]
【详解】(1)液态是一种似水溶剂,可以微弱电离:,在液态中,视为酸,为碱,二者在液态体系中发生反应的化学方程式为:,故答案为:;
(2)与水反应的实质是镁离子与水电离出的结合生成氢氧化镁,N3-与水电离出的结合生成氨气,化学方程式为:或;与热水反应生成H3PO4和HCl,反应方程式为:;故答案为:[或写为“”];;
(3)根据图示数据知,;将的溶液与的溶液等体积混合后,恰好完全反应生成碳酸钡沉淀,此时混合溶液中;故答案为:;。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.(2023·安徽铜陵·统考模拟预测)下列实验操作及现象与对应结论不匹配的是
选项 实验操作及现象 结论
A 向含有0.lmol/L的NaCl和0.1mol/L的NaI混合溶液中,滴加0.01mol/LAgNO3溶液,先生成黄色沉淀 Ksp(AgI)
C 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀 溶液存在平衡: I2+I-
D 向苯与液溴的混合液中加入铁粉产生气体,将气体直接通入AgNO3溶液中,有浅黄色沉淀生成 液溴与苯发生取代反应
A.A B.B C.C D.D
2.(2023·广东深圳·翠园中学校考模拟预测)下列指定反应的离子方程式正确的是
A.向溶液中滴入少量溶液:
B.向二元弱酸亚磷酸溶液中滴入少量烧碱溶液:
C.向溶液中通入过量:
D.通入石灰乳中制取漂白粉:
3.(2023春·重庆沙坪坝·高二重庆一中校考期中)GaN常用于高能半导体材料的制备,工业上从废旧太阳能电池CIGS中回收利用Ga()。回收处理流程如图:
已知:高温Cu以价稳定,,,,已知:,
下列说法错误的是
A.酸浸氧化发生的主要氧化还原反应方程式为:
B.滤液1的主要成分是、
C.恰好完全沉淀时溶液的pH约为4.7
D.若在调pH过滤步骤中加入过量氨水,则溶解:
4.(2020春·北京海淀·高三人大附中阶段练习)下列解释事实的方程式不正确的是
A.醋酸溶液显酸性:CH3COOH H++CH3COO-
B.用氨水除去烟气中的SO2:SO2+2NH3 H2O=(NH4)2SO3+H2O
C.向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4
D.用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+
5.(2023·全国·高三统考专题练习)下列反应的离子方程式书写错误的是
A.向酸性溶液中滴加溶液,溶液褪色:
B.将溶液加入到石灰乳中得到氢氧化镁:
C.泡沬灭火器的反应原理:
D.在溶液中加入过量的溶液:
6.(2023春·陕西榆林·高二校联考期中)下列实验操作与实验目的一致的是
选项 实验操作 实验目的
A 将产生的气体依次通过无水、品红溶液、高锰酸钾溶液、品红溶液和澄清石灰水 检验加热条件下木炭与浓硫酸反应后的气体产物
B 将少量试样加水溶解,滴加稀酸化,再滴加KSCN溶液 检验试样是否变质
C 测定等浓度的HCl、两溶液的pH 比较Cl、N的非金属性强弱
D 向和混合溶液中,滴加少量溶液 比较与溶度积大小
A.A B.B C.C D.D
7.(2023春·四川内江·高二四川省内江市第六中学校考期中)下列实验的操作、现象和结论均正确的是
选项 实验操作 实验现象 实验结论,
A 相同温度下,分别测定浓度均为0.1 mol L 1的CH3COONa溶液和Na2CO3溶液的pH 后者大于前者 水解常数: Kh(CH3COO-)
C 分别向0.1 mol L 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液 醋酸溶液中有气泡产生,硼酸溶液中无气泡 酸性:硼酸>醋酸>碳酸
D 将0.1 mol L 1AgNO3溶液和0.05 mol L 1 NaCl溶液等体积混合,再向混合液中滴入0.05 mol L 1NaI溶液 先产生白色沉淀,后产生黄色沉淀 Ksp(AgI)
8.(2023·全国·高二假期作业)已知H2X的电离常数、。常温下,难溶物BaX在不同浓度盐酸(足量)中恰好不再溶解时,测得混合液中)lgc(Ba2+)与pH的关系如图所示。下列说法错误的是
A.约为
B.M点:
C.N点:约为mol L
D.直线上任一点均满足:
9.(2023秋·云南大理·高二统考期末)向废水中加入硫化物可以依次获得、纳米粒子。常温下,的,,溶液中平衡时相关离子浓度的关系如图所示。下列说法正确的是
A.的数量级为
B.a点对应的CuS溶液为过饱和溶液
C.向p点的溶液中加入少量固体,溶液组成由p向q方向移动
D.平衡常数很大,反应趋于完全(当平衡常数时,该反应趋于完全)
10.(2023·河北石家庄·校联考模拟预测)实验是探究物质性质的重要方法,下列操作中,实验现象与得出的结论相一致的是
选项 实验目的 操作及现象 结论
A 判断淀粉是否完全水解 在试管中加入0.5g淀粉和4mL 2 溶液,加热,冷却后,取少量水解后的溶液于试管中,加入碘酒 溶液显蓝色,则说明淀粉未水解
B 验证反应是可逆反应 向1mL 0.1 KI溶液中加入2mL 0.1 溶液,充分反应。取反应后试样,滴加淀粉溶液,溶液变为蓝色;另取反应后试样,加入溶液,产生黄色沉淀 反应是可逆反应
C 判断(AgCl)与(AgI)的大小 向NaCl、NaI的混合溶液中滴入少量稀溶液,有黄色沉淀生成
D 判断某溶液样品中是否含有 向某溶液样品中加入硫酸酸化的溶液,紫色褪去 该样品中一定含有
A.A B.B C.C D.D
11.(2023春·江苏徐州·高二统考期中)根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验目的或结论
A 室温下,用试纸测定浓度为溶液和溶液的 比较和的酸性强弱
B 向固体加入饱和溶液,过滤,洗涤,向滤渣中加入盐酸有气体生成
C 取溶液,向其中滴加溶液,加入振荡静置,取上层清液滴加溶液,溶液变成血红色 该反应是可逆反应
D 向等体积与的饱和溶液中分别加入足量的浓溶液,析出沉淀的物质的量多于
A.A B.B C.C D.D
12.(2023·北京昌平·统考二模)废旧铅蓄电池的铅膏中主要含、、PbO和Pb.还有少量及Fe、Al的氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
已知:
①一些难溶电解质的溶度积常数如下表:
难溶电解质
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
③“酸浸”后溶液的pH约为4. 9
下列说法中不正确的是
A.在脱硫过程中,可能转化为
B.在脱硫过程中,转化反应的离子方程式为:
C.“酸浸”过程中,做氧化剂而非还原剂
D.“酸浸”后,滤渣的主要成分是、
13.(2023·浙江·校联考模拟预测)已知:室温下氢硫酸的电离常数,;和的分别为、,下列说法不正确的是
A.反应的平衡常数的数值为
B.可以用除去污水中的
C.从上述数据可得出难溶于稀硫酸中
D.的溶液中加入等体积的溶液,则有:
二、多选题
14.(2023春·广西·高二校联考阶段练习)下列方程式正确的是
A.泡沫灭火器的反应原理:2Al3++3+3H2O=2Al(OH)3↓+3CO2↑
B.乙醇催化氧化制乙醛:CH3CH2OH+O2CH3CHO+H2O
C.向AgCl沉淀中滴加NaI溶液,白色沉淀变黄:AgCl(s)+I-(aq)AgI(s)+Cl-(aq)
D.用醋酸和淀粉-KI溶液检验加碘盐中IO的离子方程式: +5I-+6H+=3I2+3H2O
三、非选择题
15.(2020秋·江西赣州·高二赣州市赣县第三中学校考阶段练习)I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
醋酸 碳酸 氢氰酸
Ka=1.7×10 Ka1=4.2×10 Ka2=5.6×10 Ka=6.2×10
(1)写出碳酸的第一步电离方程式 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为 (填序号)。
(3)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO)=0.1mol/L的NaHSO3溶液中c(H2SO3)= 。
(4)下列方法中,可以使0.10mol/LCH3COOH溶液中值增大的措施是 (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸
d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
II.请用有关电解质溶液的知识回答下列问题:
(1)25℃时,FeCl3溶液的pH 7(填“>”、“<”或“=”),原因是 (用离子方程式表示)。把FeCl3溶液蒸干灼烧得到的主要产物是 。
(2)t℃, PH=12的Na2CO3溶液中由水电离产生的c(H+)= 。
(3)25℃时,将pH=11的NaOH溶液与pH=2的H2SO4溶液混合,若所得混合溶液的pH=3,则NaOH溶液与H2SO4溶液的体积比为 。
(4))已知在25℃时Ksp[Mg(OH)2]=3.2×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时,= 。
16.(2020秋·江西赣州·高二赣州市赣县第三中学校考阶段练习)(1)K2C2O4水解的离子方程式 ;Fe(OH)3沉淀溶解平衡方程式 ,其溶度积的表达式为
(2)用离子方程式表示不能硫酸铝和硫化钠溶液制备硫化铝的的原因 。
(3)物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,其中c(CO)最小的是 (填序号)。
(4)请写出0.1mol/L的NH4HCO3物料守恒关系式: 。
(5)已知常温下,,。向含有和的混合溶液中逐滴加入溶液(忽略溶液体积变化),判断先析出的沉淀是 (写化学式)。
(6)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10 9. CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为 。
17.(2021·全国·高二假期作业)结合水溶液中离子平衡的相关知识回答下列问题:
Ⅰ.温度为 t℃时,某 NaOH 稀溶液中 c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知:a+b=12,请回答下列问题:
(1)该温度下水的离子积常数 Kw= 。
(2)该 NaOH 溶液中由水电离出的 c(OH-)为 。
Ⅱ.(1)某温度时,Ag2SO4 在水溶液中的沉淀溶解平衡曲线如图所示,计算此温度下 Ag2SO4 的溶度积常数 Ksp(Ag2SO4) = 。
(2)某工业废水中含有 Fe2+、Cu2+、Mg2+等金属离子,且三者浓度相同。此条件下,各金属离子开始沉淀时的 pH 如下:
离子 Fe2+ Cu2+ Mg2+
pH 7.6 5.2 10.4
若采用向该溶液中滴加NaOH溶液的方法除去其中的金属离子,则先沉淀的是 。
18.(2021秋·吉林白山·高二统考期末)依据所学知识回答问题:
(1)液态是一种似水溶剂,可以微弱电离:,在液态中,视为酸,为碱,试写出二者在液态体系中发生反应的化学方程式: 。
(2)盐类水解的实质就是盐产生的阴阳离子与水电离出的或结合的过程,下列物质与水反应和盐类水解类似,写出相应的化学方程式:
与水反应: ;
与热水反应: 。
(3)常温下,在水中的溶解平衡曲线如图所示,则该温度下, ;将的溶液与的溶液等体积混合后,混合溶液中 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.等浓度的NaCl和NaI混合溶液中,滴加硝酸银,先生成黄色沉淀即AgI,说明AgI溶解度更小,则Ksp(AgI)
C.向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者生成黄色沉淀,说明在KI3溶液中存在I-和I2,则溶液中存在平衡: I2+I-,故C正确;
D.溴蒸气易挥发,挥发出的溴与AgNO3溶液反应生成浅黄色沉淀,因此不能说明液溴与苯发生取代反应,故D错误;
故选:D。
2.B
【详解】A.硫氢化钠少量,故反应中不会生成硫化氢气体,而是生成硫化银沉淀和氢离子,反应为,A错误;
B.向二元弱酸亚磷酸溶液中滴入少量烧碱溶液,电离出的部分氢离子和氢氧根离子反应生成:,B正确;
C.向溶液中通入过量,二氧化硫过量生成亚硫酸氢根离子和二氧化碳:,C错误;
D.石灰乳为浊液不能拆,通入石灰乳中制取漂白粉:,D错误;
故选B。
3.D
【分析】废旧太阳能电池CIGS高温焙烧得到的烧渣中的成分为(因为高温Cu以+1价稳定)、、,烧渣中加入,酸浸氧化使变成,浸出液中的主要成分为,加入氨水调节pH,会生成沉淀,滤液1中的主要成分含、,向滤渣中加入回流过滤,得到滤渣,滤液经过一系列操作得到GaN。
【详解】A. 由分析可知,酸浸氧化发生的主要氧化还原反应方程式为:,故A正确;
B. 由分析可知,滤液1的主要成分是、,故B正确;
C. 当浓度为恰好完全沉淀,由求得,pOH≈9.3,则pH≈4.7,故C正确;
D. 假设该反应能发生,则该反应,由已知条件,可得所以该反应的K=<,所以反应很难进行,故D错误。
故选D。
4.D
【详解】A.醋酸为弱电解质,部分电离,离子方程式:CH3COOH H++CH3COO﹣,故A正确;
B.用氨水除去烟气中的SO2,化学方程式:SO2+2NH3 H2O=(NH4)2SO3+H2O,故B正确;
C.向盐碱地中施放硫酸钙,降低其碱性,化学方程式:Na2CO3+CaSO4=CaCO3+Na2SO4,故C正确;
D.用三氯化铁溶液腐蚀线路板,离子方程式:2Fe3++Cu=2Fe2++Cu2+,故D错误;
故答案选D。
5.D
【详解】A.是弱酸,写成分子式,酸性条件下,将氧化为CO2,离子方程式 ,A正确;
B.石灰乳写成化学式形式,转化为难溶氢氧化镁,离子方程式,B正确;
C.泡沬灭火器中的碳酸氢钠水解呈碱性,硫酸铝溶液呈酸性,两者混合,水解相互促进彻底进行,产生大量的二氧化碳,离子方程式:,C正确;
D.在中Ca2+和HCO均能和OH-反应,根据“少定多变”,离子方程式中Ca2+和HCO的个数比为1∶2,所以题中离子方程式错误,应该为,D错误;
故答案选D。
6.A
【详解】A.木炭与浓硫酸在加热条件下反应生成水、二氧化硫和二氧化碳,用无水硫酸铜检验水,用品红溶液检验二氧化硫,用澄清石灰水检验二氧化碳,二氧化硫与澄清石灰水也产生白色沉淀,故检验二氧化碳前需要除去二氧化硫,二氧化硫具有还原性,用酸性高锰酸钾除去,在检验二氧化碳前还需检验二氧化硫是否除尽,因此将产生的气体依次通过无水、品红溶液、高锰酸钾溶液、品红溶液和澄清石灰水可检验木炭与浓硫酸反应后的气体产物,故A符合题意;
B.酸性条件下,硝酸根具有强氧化性,能将Fe2+氧化为Fe3+,该实验不能检验试样是否变质,故B不符合题意;
C.比较非金属性强弱,应比较最高价含氧酸的酸性强弱,HCl不是Cl元素的最高价含氧酸,所以不能比较Cl、N元素的非金属性强弱,故C不符合题意;
D.与都是白色沉淀,无法判断先生成的沉淀是哪一种,不能比较与溶度积大小,故D不符合题意;
故答案选A。
7.A
【详解】A.相同温度下,分别测定浓度均为0.1 mol L 1的CH3COONa溶液和Na2CO3溶液的pH ,后者pH值大,说明后者水解常数大,即Kh(CH3COO-)
C.分别向0.1 mol L 1的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液,醋酸溶液中有气泡产生,硼酸溶液中无气泡,根据相对强的酸制备相对弱的酸,则酸性:醋酸>碳酸>硼酸,故C错误;
D.将0.1 mol L 1AgNO3溶液和0.05 mol L 1 NaCl溶液等体积混合,生成AgCl沉淀,但硝酸银过量,再向混合液中滴入0.05 mol L 1NaI溶液,后产生黄色沉淀,是多余的硝酸银和NaI反应生成的,并不是AgCl转化生成的,因此不能得出Ksp(AgI)
8.B
【详解】A.由BaX+2H+=Ba2++H2X结合H2X的Ka1、Ka2可知c(Ba2+)≈c(H2X),H2XH++HX-,HX-H++X2-故Ka1=,Ka2=,Ka1Ka2==,得到c(X2-)=,=c(Ba2+)c(X2-)=,由题干图示信息,当pH=1时,lg(Ba2+)=0即c(H+)=0.1mol/L,
c(Ba2+)=1.0mol/L,故=c(Ba2+)c(X2-)==约为,A正确;
B.由题干信息可知,直线MN的方程式为:lg(Ba2+)=1-pH,故M点为lg(Ba2+)=0.4,pH=0.6,故c(H2X)≈c(Ba2+)=10-0.4mol/L,c(H+)=10-0.6mol/L,此时溶质为BaCl2和H2X,故,B错误;
C.由题干信息可知,直线MN的方程式为:lg(Ba2+)=1-pH,故N点pH=0.8,lg(Ba2+)=0.2,故c(H2X)≈c(Ba2+)=10-0.2mol/L,c(H+)=10-0.8mol/L,==约为mol L,C正确;
D.由BaX+2H+=Ba2++H2X、H2XH++HX-、HX-H++X2-,根据物料守恒可知,直线上任一点均满足:,D正确;
故答案为:B。
9.C
【详解】A.最上面一条直线代表CuS溶液中相关离子浓度的关系, CuS的溶度积Ksp=c(Cu2+)×c(S2-) ,这条线上的每一个点对应的溶液为CuS的饱和溶液,任取一点,c(Cu2+)=1×10-18mol·L-1,此时c(S2-)在10-19~10-18之间,根据图像,大概为10-18.3mol·L-1,代入上式,Ksp(CuS)=1×10-18×1×10-18.3=1×10-36.3,数量级约为10-37,A错误;
B.在相同c(Cu2+)时,a点c(S2-)比饱和溶液中c(S2-)小,即a点Qc
D.该反应的平衡常数表达式为K=,按照A选项方法,c(S2-)=10-12mol·L-1,根据图像c(Zn2+)约为10-10.3mol·L-1,则Ksp(ZnS)=10-10.3×10-12=10-22.3,将数值代入上式,得出K=1.3×10-7×7.1×10-15×=1.3×7.1×100.3<105(趋向进行完全K>105),因此该反应不趋于完全,D错误;
故选:C。
10.B
【详解】A.加入碘酒之后溶液变蓝,说明溶液中还有淀粉,可能是淀粉部分水解或为水解,A错误;
B.与反应的KI不足,取反应后试样加入溶液,产生黄色沉淀,可知碘离子不完全转化,则是可逆反应,B正确;
C.由于NaCl、NaI的混合溶液的浓度未知,由实验操作及现象可知,不能比较(AgC1)、(AgI)的大小,C错误;
D.酸性高锰酸钾溶液可与溶液中的氯离子反应生成锰离子,现象也为紫色褪去,因此不能证明溶液中一定有亚铁离子,D错误;
故选B。
11.D
【详解】A.NaClO溶液可使pH试纸褪色,应选pH计测定等浓度盐溶液的pH,故A错误;
B.当Qc>Ksp时生成碳酸钡沉淀,由现象不能比较Ksp大小,故B错误;
C.氯化铁过量,现象可检验铁离子,由现象不能说明反应为可逆反应,故C错误;
D.等体积AgCl与AgBr的饱和溶液中分别加入足量的浓AgNO3溶液,析出沉淀的物质的量AgCl多于AgBr,可知AgCl的溶解度大,则Ksp(AgCl)>Ksp(AgBr),故D正确;
故选:D。
12.A
【分析】铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量硫酸钡、Fe、Al的氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁、过滤后向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
【详解】A.在脱硫中,加入Na2CO3不能使铅膏中BaSO4转化为BaCO3,主要原因为BaSO4的Ksp小于BaCO3的Ksp,BaSO4比BaCO3更难溶,A错误;
B.从表中可知,PbSO4的Ksp大于PbCO3的Ksp,PbCO3比PbSO4更难溶,脱硫时向PbSO4中加入Na2CO3,PbSO4转化为PbCO3,离子方程式为,B正确;
C.酸浸过程中过氧化氢将亚铁离子氧化成铁离子,过氧化氢作氧化剂而不是还原剂,C正确;
D.酸浸后溶液的pH约为4.9,且经过酸浸,亚铁离子被氧化成铁离子,根据金属氢氧化物沉淀时的pH表可知,此时氢氧化铁和氢氧化铝完全沉淀,滤渣的主要成分为氢氧化铝和氢氧化铁,D正确;
故答案选A。
13.D
【详解】A.反应的平衡常数,A正确;
B.、的溶度积常数分别为、溶度积大于溶度积,所以除去废水中的可以选用作沉淀剂,B正确;
C.若溶于稀硫酸中,反应为,反应的平衡常数=4.8×10-16,反应进行的程度很小,即难溶于稀硫酸,C正确;
D.的水解平衡常数,即的水解程度大于其电离程度,溶液呈碱性,由于水的电离,则、,的溶液中加入等体积的溶液恰好反应生成,溶液中离子浓度大小关系为,D错误;
故答案选D。
14.C
【详解】A.泡沫灭火器的反应原理是硫酸铝与碳酸氢钠溶液反应产生氢氧化铝、硫酸钠和二氧化碳,反应的离子方程式为:Al3++3=Al(OH)3↓+3CO2↑,选项A错误;
B.乙醇催化氧化制乙醛,反应的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O,选项B错误;
C.向AgCl沉淀中滴加NaI溶液,白色沉淀变黄,氯化银转化为碘化银沉淀,反应的离子方程式为:AgCl(s)+I-(aq)AgI(s)+Cl-(aq),选项C正确;
D.用醋酸和淀粉-KI溶液检验加碘盐中,反应的离子方程式为: +5I-+6CH3COOH=3I2+3H2O+6CH3COO-,选项D错误;
答案选C。
15. H2CO3 H++HCO ②>①>③ 10-2mol/L cdf < FeCl3为强酸弱碱盐,发生Fe3++3H2O Fe(OH)3+3H+,溶液显酸性 氧化铁 mol/L 9:2 Cu(OH)2 1.45×109
【详解】I(1)碳酸为二元弱酸,第一步电离方程式为H2CO3 H++HCO;
(2)酸的酸性越弱,其生成的盐水解程度越大,溶液的pH越大,根据电离平衡常数可知,酸性:CH3COOH>HCN>HCO,则溶液的pH由大到小的顺序为②>①>③;
(3)Ka==1×10-2mol/L,则c(H2SO3)= 10-3mol/L×0.1mol/L÷10-2mol/L=10-2mol/L;
(4) a.=Kw÷c(OH-),加水稀释氢离子浓度减小,c(OH-)增大,则减小,a与题意不符;
b.加入少量CH3COONa固体,醋酸的电离平衡逆向移动,醋酸的浓度增大,氢离子浓度减小,减小,b与题意不符;
c.加入少量冰醋酸,为加水稀释的逆过程,加水稀释减小,则加入冰醋酸增大,c符合题意;
d.通入少量HCl气体,导致醋酸的电离平衡逆向移动,但氢离子浓度增大的程度大于醋酸的浓度,则增大,d符合题意;
e.加少量烧碱溶液,导致醋酸的电离平衡正向移动,氢离子减小的程度大于醋酸减小的程度,减小,e与题意不符;
f.升高温度,醋酸的电离平衡正向移动,氢离子浓度增大,醋酸的浓度减小,则增大,f符合题意;
答案为cdf;
II.(1)FeCl3为强酸弱碱盐,发生Fe3++3H2O Fe(OH)3+3H+,溶液显酸性,则pH<7;蒸干FeCl3溶液,促使铁离子的水解平衡正向移动,且HCl易挥发,灼烧后得到氧化铁;
(2) Na2CO3为强碱弱酸盐,碳酸根离子水解,促进水的电离,水电离产生的氢离子与氢氧根离子相等,溶液的pH=12,温度为t℃,则水电离产生的c(H+)=mol/L;
(3) pH=11的NaOH溶液中c(OH-)=10-3mol/L,pH=2的H2SO4溶液中c(H+)=10-2mol/L,根据混合溶液的pH=3,可得10-2mol/L×V酸-10-3mol/L×V碱=10-3mol/L×(V酸+V碱),解得V碱:V酸=9:2;
(4)根据溶度积的数据,Ksp[Mg(OH)2]>Ksp[Cu(OH)2],向混合液中加入NaOH溶液,先生成Cu(OH)2沉淀;当两种沉淀共存时,溶液中氢氧根离子浓度相等,= ==1.45×109。
16. C2O+H2OHC2O+OH- HC2O+H2OH2C2O4+OH- Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp=C(Fe3+)· C3(OH-) 2Al3++3S2-+3H2O=2Al(OH)3↓+3H2S↑ ③ c(NH)+c(NH3·H2O)=c(HCO)+c(CO)+c(H2CO3) AgCl 210-4mol/L
【详解】(1)K2C2O4为强碱弱酸盐,草酸根离子发生一级水解离子方程式为:C2O+H2OHC2O+OH-、草酸根离子发生二级水解离子方程式为:HC2O+H2OH2C2O4+OH-;Fe(OH)3沉淀溶解平衡方程式Fe(OH)3(s) Fe3+(aq)+3OH-(aq),按定义可知,其溶度积的表达式为Ksp=c(Fe3+)· c3(OH-)。
(2)硫酸铝水溶液因铝离子水解呈酸性,硫化钠溶液因硫离子水解呈碱性,二者混合时水解相互促进,发生彻底双水解反应,离子方程式为:2Al3++3S2-+3H2O=2Al(OH)3↓+3H2S↑。
(3) ①④相比较,由于④发生互促水解,水解程度较大,则①>④,②⑤相比较,⑤发生互促水解,c(CO)的大小为②>⑤,③为二元弱酸,c(CO)最小,则答案为③。
(4) 0.1mol/L的NH4HCO3溶液中,n(N)= n(C),含N粒子有NH和NH3·H2O,含C粒子有HCO、CO和H2CO3,则物料守恒关系式:c(NH)+c(NH3·H2O)=c(HCO)+c(CO)+c(H2CO3)。
(5)已知常温下,,。开始生成Ag2CrO4沉淀时, ,开始生成AgCl沉淀时,,向含有和的混合溶液中逐滴加入溶液,后者需要的银离子浓度较小,先生成沉淀,故答案为:AgCl;
(6) ,若Na2CO3溶液的浓度为5.6×10 5mol/L,则等体积混合后混合液中×5.6×10 5mol/L=2.8×10 5mol/L,则,又所需CaCl2溶液的浓度为钙离子浓度的两倍,则生成沉淀所需CaCl2溶液的最小浓度为210-4mol/L;
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,根据越弱越水解可知HX酸性最弱,HY其次,HZ酸性最强,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为。
17. 10-12 10-a mol/L 1.6×10-5(molL-1)3 Cu2+
【详解】(1)溶液中水的离子积Kw=c(H+)×c(OH )=10 a×10 b=10 (a+b)=10 12;故答案为:10 12;
(2)该NaOH溶液中NaOH的物质的量浓度为c(NaOH)=c(OH )=10 bmol/L,依据溶液中的离子积Kw=c(H+)×c(OH )=10 12,该NaOH溶液中由水电离出的c水(OH )= c水(H+)==;故答案为:10 amol/L;
(3)由图象可知,当c(SO)=4×10-2mol/L时,c(Ag+)=2×10-2mol/L,则Ksp=c2(Ag+)×c(SO)=4×10-4×4×10-2= 1.6×10-5 (molL-1)3,故答案为:1.6×10-5;
(4) 金属离子开始沉淀时的 pH越小,溶度积常数越小的物质越先沉淀,所以Cu2+先沉淀,故答案为:Cu2+。
18. [或写为“”]
【详解】(1)液态是一种似水溶剂,可以微弱电离:,在液态中,视为酸,为碱,二者在液态体系中发生反应的化学方程式为:,故答案为:;
(2)与水反应的实质是镁离子与水电离出的结合生成氢氧化镁,N3-与水电离出的结合生成氨气,化学方程式为:或;与热水反应生成H3PO4和HCl,反应方程式为:;故答案为:[或写为“”];;
(3)根据图示数据知,;将的溶液与的溶液等体积混合后,恰好完全反应生成碳酸钡沉淀,此时混合溶液中;故答案为:;。
答案第1页,共2页
答案第1页,共2页
同课章节目录
