第五章 化工生产中的重要非金属元素 测试题(含解析) 人教版(2019)必修第二册
文档属性
| 名称 | 第五章 化工生产中的重要非金属元素 测试题(含解析) 人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 08:44:45 | ||
图片预览




文档简介
第五章《化工生产中的重要非金属元素》测试题
一、单选题(共12题)
1.下列有关实验操作、现象和结论都正确的是
选项 实验操作 现象及实验结论
A 向某溶液中先加入氯水,再加入KSCN溶液 溶液变红色,原溶液一定含Fe2+
B 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中 溶液变浑浊,原溶液一定含CO
C 向某溶液中加入NaOH溶液并加热 产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH
D 用砂纸打磨过的铝箔在空气中受热熔化,并不滴落 证明Al2O3熔点高于Al单质
A.A B.B C.C D.D
2.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是
A.实验室可用浓硫酸干燥氨气
B.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C.漂白粉变质后的残留固体有碳酸钙
D.单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
3.硫酸是重要的化工原料,工业上由硫或硫铁矿通过反应可得,催化氧化生成,再用浓硫酸吸收得发烟硫酸(),发烟硫酸与水反应可得硫酸。“热化学硫碘循环分解水”是一种利用硫酸、碘等来获取氢能源方法。下列有关接触法制硫酸的说法正确的是
A.硫铁矿和氧气在高温下发生置换反应
B.升高接触室中气体的温度能提高的平衡转化率
C.将从吸收塔底部通入,浓硫酸从塔顶喷淋,提高了的吸收率
D.将全部转化为需消耗
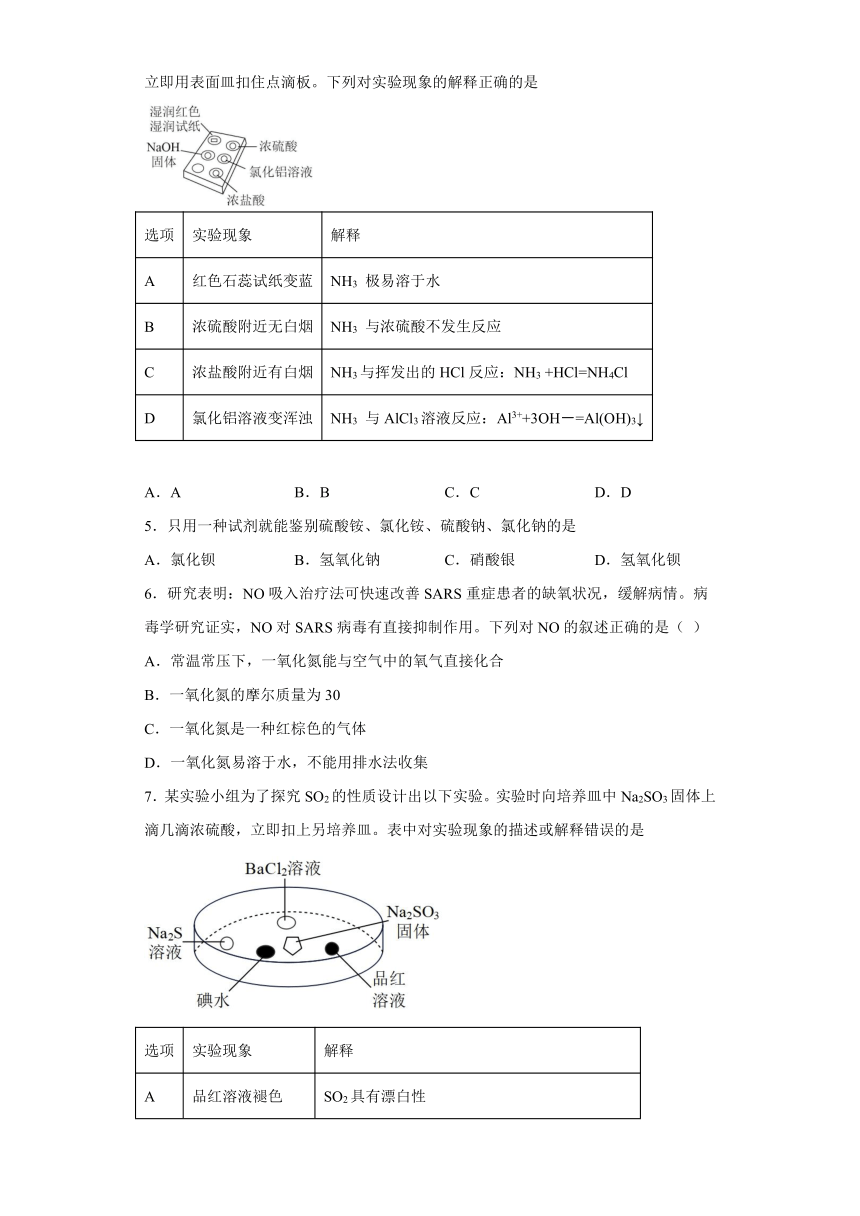
4.利用点滴板探究氨气的性质(如右图所示)。实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板。下列对实验现象的解释正确的是
选项 实验现象 解释
A 红色石蕊试纸变蓝 NH3 极易溶于水
B 浓硫酸附近无白烟 NH3 与浓硫酸不发生反应
C 浓盐酸附近有白烟 NH3与挥发出的HCl反应:NH3 +HCl=NH4Cl
D 氯化铝溶液变浑浊 NH3 与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓
A.A B.B C.C D.D
5.只用一种试剂就能鉴别硫酸铵、氯化铵、硫酸钠、氯化钠的是
A.氯化钡 B.氢氧化钠 C.硝酸银 D.氢氧化钡
6.研究表明:NO吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,NO对SARS病毒有直接抑制作用。下列对NO的叙述正确的是( )
A.常温常压下,一氧化氮能与空气中的氧气直接化合
B.一氧化氮的摩尔质量为30
C.一氧化氮是一种红棕色的气体
D.一氧化氮易溶于水,不能用排水法收集
7.某实验小组为了探究SO2的性质设计出以下实验。实验时向培养皿中Na2SO3固体上滴几滴浓硫酸,立即扣上另培养皿。表中对实验现象的描述或解释错误的是
选项 实验现象 解释
A 品红溶液褪色 SO2具有漂白性
B 碘水褪色 SO2具有还原性,与I2反应
C Na2S溶液变浑浊 SO2具有氧化性,与Na2S溶液反应生成硫单质
D BaCl2溶液变浑浊 SO2与BaCl2溶液反应生成BaSO3沉淀
A.A B.B C.C D.D
8.中国是世界著名的陶瓷古国。下列国宝级文物主要由陶瓷制成的是
选项 A B C D
文物
名称 东汉铜车马 舞马衔杯纹银壶 萧何月下追韩信梅瓶 雪景寒林图
A.A B.B C.C D.D
9.下列对某些物质的检验及结论一定正确的是( )
A.加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有SO42-
B.取少量待测液做焰色反应实验,火焰呈黄色,该溶液中一定含有NaOH
C.某气体能使品红溶液褪色,该气体一定是SO2
D.某溶液中先通入Cl2,再加入KSCN溶液,溶液显红色,则原溶液中可能含有Fe2+
10.下列说法错误的是
A.硅元素在自然界中无游离态,主要以硅酸盐和氧化物形式存在
B.常温下,晶体硅不能与盐酸反应
C.SiO2既能与酸又能与碱反应,所以SiO2属于两性氧化物
D.高纯硅可用于制作光伏电池,SiO2可用于制作光导纤维
11.利用FeSO4制备还原铁粉的工艺流程如图所示,下列说法错误的是
A.“转化”过程的离子方程式为Fe2++2=FeCO3↓+H2O+CO2↑
B.“洗涤”过程可用盐酸酸化的BaCl2溶液检验沉淀是否洗净
C.“干燥”过程应将固体置于烧杯中加强热快速烘干
D.“焙烧”过程产生的气体可能是CO和CO2的混合气体
12.下列各组离子在给定溶液中能大量共存的是
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.的溶液:、、、
二、非选择题(共10题)
13.如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。
(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
14.回答下列问题:
(1)高铁酸盐是一种新型、高效、多功能绿色水处理剂,工业上可用湿法制备高铁酸钾。化学反应原理为:2Fe(OH)3+3ClO-+4OH-=2FeO+3Cl-+5H2O。
①FeO中铁元素化合价为____,在该反应中氧化剂是____,还原剂是____,氧化产物是____。
②请用双线桥表示反应中电子转移情况:____。
③根据化合价,推测FeO能和下列____反应(填序号)。
A.KMnO4 B.SO2 C.H2S D.O2
(2)Co2O3、Co3+均属于极强的氧化剂,在生产中有着重要的应用。一定条件下,Co3+与过量Na2S2O3溶液反应后生成Co2+和SO,写出该反应的离子方程式____。设计实验证明反应后溶液中含有SO:____。(已知:S2O与H+反应生成S、SO2,BaS2O3不溶于水)
15.自然界中的氮循环部分过程如图所示,回答下列问题:
(1)①自然界中实现路径Ⅰ的固氮方式可能是___________(任写一种)。
②在哈伯等科学家的努力下,路径Ⅱ已实现工业大规模合成氨,反应方程式为___________。
(2)①实验室制的化学方程式为___________;
②干燥氨气不可以选用的试剂是___________(填字母)。
a.浓硫酸 b.碱石灰 c.NaOH固体
(3)除反硝化作用外,铵态氮()与亚硝态氮()也可以在细菌的作用下转化为氮气。请写出所涉及的离子反应方程式___________。该反应中,当产生0.02mol氮气时,转移电子的物质的量为___________。
(4)工业制硝酸时尾气中含有NO、,可用以两种下方法吸收:
①水吸收法。请用化学方程式说明用水吸收的缺陷___________。
②NaOH溶液吸收法。发生的反应有:、。用不同浓度NaOH溶液吸收含量不同的尾气,氮氧化物吸收率与NaOH浓度间的关系如图所示(α表示尾气里的含量):
ⅰ.根据图中得知___________(填字母)。
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
ⅱ.当α小于50%时,加入能提升氮氧化物的吸收率,原因是___________
16.学习元素化合物时可以借助“价类二维图”预测物质性质。如下是部分含硫化合物的二维图的相关信息。
(1)图中“X”代表的物质类别是_______;Y转化为Z体现了Y的_______性。
(2)SO2是重要的大气污染物,会导致“酸雨”。SO2产生硫酸型酸雨有两条途径:途径一是SO2→SO3→H2SO4;另一途径是:SO2→_______。
(3)将装有SO2的试管倒立在水槽中,可观察到_______。取出试管中的溶液,分别进行如下实验:
①滴加品红溶液,振荡,观察到红色褪去,说明SO2具有_______性。
②滴加BaCl2溶液,无明显现象,再滴入FeCl3溶液后出现白色沉淀。出现白色沉淀的原因_______。
(4)根据SO2的性质,提出一种燃煤脱硫的方法_______。
17.硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物性质和制备进行如下实验探究:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。
回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是_______。
(2)若B中是品红溶液,酸性KMnO4溶液的作用是_______,C中的试剂是_______。
(3)若将酸性高锰酸钾溶液换成溴水,写出该反应的离子方程式_______。
(4)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是_______、_______。
18.为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)混合粉末A中硫粉过量的原因是_________。
(2)反应在“惰性气体环境”中进行的原因是__________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明_____。
(4)操作②的作用是________,也可改用_________。
(5)操作③稀H2SO4煮沸的目的是________。
19.某同学欲研究SO2的性质。
(1)将相关的含硫物质分为如表所示3组,则第2组中物质X的化学式是_______。
第1组 第2组 第3组
S(单质) SO2、X、Na2SO3、NaHSO3 SO3、H2SO4、Na2SO4、NaHSO4
(2)实验室制取SO2的化学方程式为_______。
(3)利用如图所示的装置研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃,沸点:SO2-10℃,SO345℃)。
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是_______。
②甲同学按Ⅰ、Ⅱ、III、Ⅳ的顺序连接装置,装置Ⅱ的作用是_______;装置Ⅲ中溶液逐渐褪色,生成Mn2+,则该反应离子方程式是_______。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40mL2.5mol L-1NaOH溶液,反应后增重4.8g,则产物(水除外)的物质的量之比是_______。
20.将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体的体积为11.2L(已换算为标准状况下),请回答
(1)NO2的体积(换算为标准状况下)为___________。
(2)待产生的气体全部释放后,向溶液中加入VmL n mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为________mol·L-1。
21.50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________,生成SO2的体积为(标准状况下)____________mL。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)_______0.025a mol(填“等于”、“大于”或“小于”)。
(3)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为_____________。
22.工业上常用氨水等来处理制硫酸过程中产生的尾气(含SO2、O2),得到硫酸的铵盐产品。
(1)甲厂的尾气中含SO2 0.2%、O2 10.0%(体积分数,其余为N2)。该尾气对氢气的相对密度为_______________(保留3位小数)。若该厂每天排放的尾气为2×105 m3(标况下),则该厂每天最多能获得______________吨硫酸铵。(保留2位小数)
(2)乙厂得到的铵盐产品是硫酸铵和硫酸氢铵的混合物。为测定它们的含量,取不同质量的铵盐,分别加入到50.00mL相同浓度的NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 铵盐质量(g) 浓硫酸增加的质量(g)
第一次 9.05 1.7
第二次 18.10 1.7
第三次 27.15 a
第四次 36.20 0
①计算该铵盐中硫酸铵和硫酸氢铵的物质的量之比________________。
②计算第三次实验时浓硫酸增加的质量a的值_______________。
参考答案:
1.D
A.若原溶液中含有Fe3+,向某溶液中先加入氯水,再加入KSCN溶液,溶液也变红色,所以不能证明原溶液一定含Fe2+;若要证明Fe2+的存在,可以先向溶液中加入KSCN溶液,溶液颜色无变化,再加入氯水,溶液变红,可证明原溶液中有Fe2+,故A错误;
B.若原溶液中含有HCO或SO或HSO,向溶液中加入稀盐酸,产生的CO2或SO2都能使澄清石灰水变浑浊,故B错误;
C.氨气是碱性气体。向某溶液中加入NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,则原溶液一定有NH,故C错误;
D.用砂纸打磨过的铝箔在空气中受热熔化,并不滴落,说明铝表面包裹着一层熔点很高的氧化铝,证明Al2O3熔点高于Al单质,故D正确;
故选D。
2.C
A.氨气为碱性气体,能够与浓硫酸反应,不能用浓硫酸干燥,故A错误;
B.水晶主要成分二氧化硅,为氧化物,不属于硅酸盐材料,故B错误;
C.漂白粉变质时与水、二氧化碳反应生成碳酸钙和HClO,变质后的残留固体有碳酸钙,故C正确;
D.S具有弱氧化性,氯气具有强氧化性,分别与Fe反应生成FeS、氯化铁,Fe元素的化合价不同,故D错误;
故答案选C。
3.C
A.硫铁矿和氧气在高温下发生反应生成氧化铁和二氧化硫,反应不属于置换反应,选项A错误;
B.催化氧化生成是放热反应,升高接触室中气体的温度,平衡逆向移动,因此能降低的平衡转化率,选项B错误;
C.将从吸收塔底部通入,浓硫酸从塔顶喷淋,逆向对流有利于提高了的吸收率,选项C正确;
D.将全部转化为需消耗,生成2mol,选项D错误。
答案选C。
4.C
A.红色石蕊试纸变蓝是因为氨气溶于水显碱性,与NH3 极易溶于水性质无关,故A错误;
B.因为硫酸不具挥发性,因此浓硫酸与氨气反应附近无白烟,故B错误;
C.浓盐酸有挥发性,挥发出的HCl与NH3反应生成白烟NH3 +HCl=NH4Cl,故C正确;
D.一水合氨为弱碱,所以书写离子方程式时用化学式表示,故D错误。
综上所述,答案为C。
5.D
硫酸铵与氢氧化钡混合反应产生BaSO4白色沉淀和NH3,既有白色沉淀产生,又有刺激性气味的气体产生;氯化铵与氢氧化钡混合反应产生BaCl2和NH3,只有刺激性气味的气体产生;硝酸银与氢氧化钡混合反应产生Ba(NO3)2和AgOH白色沉淀,只有白色沉淀产生,而氯化钠与氢氧化钡混合,不能发生反应,四种物质与氢氧化钡混合,现象各不相同,可以鉴别,故合理选项是D。
6.A
A.常温常压下一氧化氮能够与氧气反应生成二氧化氮,A正确;
B.摩尔质量的单位是g/mol,B选项缺少单位所以B错误;
C.一氧化氮是一种无色气体,C错误;
D.一氧化氮难溶于水,可以用排水法收集,D错误。
故选A。
7.D
A.二氧化硫具有漂白性,能够使品红褪色,故A正确;
B.二氧化硫具有还原性,能够与I2发生氧化还原反应使碘水褪色,故B正确;
C.二氧化硫具有弱的氧化性能够氧化硫离子生成硫单质,所以Na2S溶液变浑浊,故C正确;
D.盐酸的酸性强于亚硫酸,二氧化硫与氯化钡不反应,不会产生沉淀,故D错误;
故选:D。
8.C
A.东汉铜车马为青铜器,属于合金,A不符合题意;
B.舞马衔杯纹银壶为金属制品,B不符合题意;
C.萧何月下追韩信梅瓶为瓷器,由陶瓷制成,C符合题意;
D.雪景寒林图为书画,由纤维素制成,D不符合题意;
综上所述答案为C。
9.D
A. 加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中可能含有SO42 、Ag+,故A错误;
B. 取少量待测液做焰色反应实验,火焰呈黄色,该溶液中一定含有钠的物质,不一定是NaOH,故B错误;
C. 某气体能使品红溶液褪色,该气体可能是SO2,还可能是Cl2,故C错误;
D. 某溶液中先通入Cl2,再加入KSCN溶液,溶液显红色,则原溶液中可能含有Fe2+或Fe3+,故D正确。
综上所述,答案为D。
10.C
A.硅元素在自然界中无游离态,化合态的硅元素主要以硅酸盐和氧化物形式存在,A正确;
B.常温下,晶体硅中原子之间以强烈的共价键结合,不能与盐酸反应,B正确;
C.SiO2能与碱反应,产生硅酸盐和水,而不能与酸反应产生盐和水,所以SiO2属于酸性氧化物,C错误;
D.高纯硅可用于制作光伏电池,SiO2能够使光线发生全反射,因此可用于制作光导纤维,D正确;
故合理选项是C。
11.C
A.“转化”过程加入的NH4HCO3溶液可电离产生,进一步电离产生H+和,反应得FeCO3、H2O和CO2,选项A正确;
B.“洗涤”过程是洗去FeCO3表面附着的、等离子,此法用检验是否存在来证明沉淀是否洗净,选项B正确;
C.“干燥”过程不可在烧杯中强热,选项C错误;
D.“焙烧”过程Fe2+被还原,碳被氧化可能生成CO和CO2的混合气,选项D正确;
答案选C。
12.B
A.氢离子可以和草酸根离子反应生成草酸,不能共存,A错误;
B.离子、、、和氢氧根离子不反应,和钡离子也不反应,可以共存,B正确;
C.硝酸根离子在氢离子存在的情况下可以把二价铁氧化为三价铁,不能共存,C错误;
D.硫酸氢钠电离出的氢离子可以和偏铝酸根离子反应,也可以和亚硫酸根离子反应,不能共存,D错误;
故选B。
13. N2 NO2 NO NH3 HNO3 N2+O22NO 4NH3+5O24NO+6H2O 3NO2+H2O=2HNO3+NO
根据题给信息,由B为红棕色气体可分析得出B为NO2,根据及题给的物质状态信息及A→E为五种含氮物质,结合图中A、B、C、D、E之间的转化关系可知,A为N2,B为NO2,C为NO,D为NH3,E为HNO3。据此进行分析。
(1)由分析可知:A为N2,B为NO2,C为NO,D为NH3,E为HNO3。故答案为:N2;NO2;NO;NH3;HNO3;
(2)反应中涉及的反应方程式为:①N2+O22NO;②4NH3+5O24NO+6H2O;⑤3NO2+H2O=2HNO3+NO;答案为:N2+O22NO;4NH3+5O24NO+6H2O;3NO2+H2O=2HNO3+NO;
14.(1) +6价 ClO- Fe(OH)3 FeO BC
(2) 8Co3++S2O+5H2O=8Co2++2SO+10H+ 取反应后的溶液少许,向其中加入足量的稀盐酸并不断搅拌,充分反应后静置,向上层清液滴加BaCl2溶液(或取上层清液少许,向其中加入BaCl2溶液),若有白色沉淀生成说明反应后的溶液中含有SO
(1)①FeO中O元素化合价为-2,则铁元素化合价为+6;在该反应中,ClO-中Cl元素化合价降低,氧化剂是ClO-;Fe(OH)3中Fe元素化合价升高发生氧化反应,还原剂是Fe(OH)3,氧化产物是FeO。
②ClO-中Cl元素化合价由+1降低为-1,Fe(OH)3中Fe元素化合价由+3升高为+6,用双线桥表示反应中电子转移情况为。
③根据化合价,推测FeO中Fe元素化合价为+6,具有强氧化性,SO2、H2S具有还原性,所以FeO能与SO2、H2S反应,选BC。
(2)Co2O3、Co3+均属于极强的氧化剂,一定条件下,Co3+与过量Na2S2O3溶液反应后生成Co2+和SO,Co元素化合价由+3降低为+2、S元素化合价由+2升高为+6,根据得失电子守恒、电荷守恒,反应的离子方程式为8Co3++S2O+5H2O=8Co2++2SO+10H+。根据题目信息,S2O与H+反应生成S、SO2,BaS2O3不溶于水,取反应后的溶液少许,向其中加入足量的稀盐酸并不断搅拌,充分反应后静置,除去S2O,再向上层清液滴加BaCl2溶液,若有白色沉淀生成说明反应后的溶液中含有SO。
15.(1) 生物固氮 2N2+3H22NH3
(2) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O a
(3) +=N2+2H2O 0.06mol
(4) 3+H2O=NO+2HNO3 b 当混合气体中 NO2含量小于 50% 时,具有氧化性的 H2O2的存在,会使 NO 氧化成 NO2,NO2的含量增大,从而使氮氧化物的吸收率增大
(1)①路径Ⅰ中N2转化为NO和NO,自然界中实现该过程的固氮方式可能是:生物固氮;
②路径Ⅱ中N2转化为NH3,在哈伯等科学家的努力下,路径Ⅱ已实现工业大规模合成氨,反应方程式为2N2+3H22NH3。
(2)①实验室用氯化铵和氢氧化钙加热制取氨气,该反应是复分解反应,反应为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
②氨气是碱性气体,不能用浓硫酸干燥,故选a。
(3)铵态氮()与亚硝态氮()也可以在细菌的作用下转化为氮气,根据得失电子守恒和电荷守恒配平离子方程式为:+=N2+2H2O,该反应中,中N元素由-3价上升到0价,当产生0.02mol氮气时,转移电子的物质的量为0.06mol。
(4)①和H2O反应的化学方程式为:3+H2O=NO+2HNO3,该过程中生成有毒气体NO;
②ⅰ.根据图中得知NaOH溶液浓度越大,氮氧化物的吸收率先增大后减小,含量越大,氮氧化物的吸收率越大,故选b;
ⅱ.当混合气体中 NO2含量小于 50% 时,具有氧化性的 H2O2的存在,会使 NO 氧化成 NO2,NO2的含量增大,从而使氮氧化物的吸收率增大。
16.(1) 氧化物(或非金属氧化物/酸性氧化物) 还原性
(2)H2SO3→H2SO4
(3) 液面上升至水充满整支试管 漂白性 Fe3+将SO2溶于水形成的H2SO3氧化成,遇Ba2+生成BaSO4沉淀
(4)在燃煤中加入适量石灰石(或石灰)
根据图示,Y为硫的-2价氢化物,为;Z为S硫单质;通过和可知X为物质类别中的氧化物(或非金属氧化物/酸性氧化物);
(1)通过和,两者均为硫的氧化,可知X为物质类别中的氧化物(或非金属氧化物/酸性氧化物);Y为硫的-2价氢化物,为,由转化为S,硫元素化合价降低,体现了的还原性,故填氧化物(或非金属氧化物/酸性氧化物);还原性;
(2)二氧化硫能溶于水形成,然后被氧化,最终转化为形成酸雨,故填→;
(3)因为溶于水,将装有SO2的试管倒立在水槽中,可观察到试管中液面上升至水充满整支试管,故填液面上升至水充满整支试管;
①溶于水形成亚硫酸,亚硫酸能与品红发生加成反应,生成不稳定的无色化合物,使品红溶液褪色,该过程可逆,说明SO2具有漂白性;
②溶于水形成亚硫酸,亚硫酸不与BaCl2溶液反应,无明显现象,滴加FeCl3溶液后,铁离子将二氧化硫氧化成硫酸根离子,与钡离子结合生成硫酸钡,故填Fe3+将SO2溶于水形成的H2SO3氧化成,遇Ba2+生成BaSO4沉淀;
(4)二氧化硫具有还原性,可以在燃煤中加入适量石灰石(或石灰),发生反应,达到燃煤脱硫的目的,故填在燃煤中加入适量石灰石(或石灰)。
17. SO2、H2 除去二氧化硫 浓硫酸 Br2+2H2O+SO2=2Br-+4H++ 黑色固体变为红色 硫酸铜变蓝
浓硫酸有强氧化性,Zn有还原性,Zn和浓硫酸在A中共热反应生成硫酸锌、水和二氧化硫,随着反应的进行,硫酸浓度降低变为稀硫酸,稀硫酸和Zn反应生成硫酸锌和氢气,因此气体X可能含有二氧化硫、水蒸气、氢气,B中盛放品红溶液检验二氧化硫,酸性高锰酸钾溶液除去二氧化硫,C中盛放浓硫酸,作用是吸收水蒸气,氢气和CuO反应生成Cu和水,用E中无水硫酸铜检验水蒸气,若E中硫酸铜变为蓝色,D中黑色固体变为红色,则可证明气体X中含氢气,据此解答。
(1)由分析可知气体X中除水蒸气之外,还可能有的气体是SO2、H2;
(2)酸性KMnO4溶液的作用是除去二氧化硫;C中的试剂是浓硫酸,作用是吸收水蒸气;
(3)若将酸性高锰酸钾溶液换成溴水,则溴水和二氧化硫发生氧化还原反应生成HBr和硫酸,反应的离子方程式为Br2+2H2O+SO2=2Br-+4H++;
(4)由分析可知D和E装置用来检验X中的氢气,若D中黑色固体变为红色,E中硫酸铜变蓝,则证明气体X中含氢气。
18. 防止因铁粉过量而使滤渣C中含铁粉,剩余铁粉与H2SO4反应生成Fe2+干扰实验 防止空气中的O2参与反应 硫和铁粉反应是放热的 除去混合物中的硫粉 CS2 防止稀H2SO4溶液溶解的氧气氧化生成的Fe2+
Fe与S单质在惰性气体中共热生成对应硫化物,再加入热的KOH是除去过量的S单质,再向滤渣中加入稀硫酸,滤渣与稀硫酸反应,根据反应后溶液颜色判断Fe的化合价。
(1)实验目的为探究铁和硫反应产物中铁元素的化合价,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,如果铁粉过量,过量的铁粉与硫酸反应生成Fe2+而干扰实验产物的检验,所以混合粉末A中S粉必须要过量,保证铁粉完全反应,故答案为:防止因铁粉过量而使滤渣C中含铁粉,剩余铁粉与H2SO4反应生成Fe2+干扰实验;
(2)四氧化三铁为黑色固体,铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,混合粉末A中S粉反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验,故答案为:防止空气中的O2参与反应;
(3)因硫和铁粉反应是放热反应,所以用烧热的玻璃棒点触,该发应能持续进行,故答案为:硫和铁粉反应是放热反应;
(4)操作②在黑色固体中加入热的氢氧化钾溶液,除去混合物中过量的硫粉,除了用热的KOH溶液之外,还可以用CS2,故答案为:除去混合物中过量的硫粉;CS2;
(5)亚铁离子具有强还原性,.操作③中稀硫酸煮沸,排出溶解在其中的氧气,防止硫酸中溶解的O2将前面反应过程中生成的Fe2+氧化,故答案为:防止稀H2SO4溶液溶解的氧气氧化生成的Fe2+。
19.(1)H2SO3
(2)Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O
(3) 2SO2+O22SO3 使SO3凝结成固体与SO2分离 5SO2+2MnO+2H2O=5SO+2Mn2++4H+ 1:2
(1)
根据表格提供的物质可知:第二组的物质中S元素的化合价都是+4价,其排列方式为氧化物、酸、盐、酸式盐,所以X是H2SO3;故答案为H2SO3;
(2)
实验室制取SO2的化学方程式为Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O;故答案为Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O;
(3)
①二氧化硫和氧气在催化剂存在时发生氧化还原反应生成SO3,反应的方程式是:2SO2+O22SO3;故答案为2SO2+O22SO3;
②甲同学按I、II、III、IV的顺序连接装置,I是SO2氧化为SO3,反应产生的SO3的熔点较低,只有16.8℃,所以装置II的作用是是使SO3凝结成固体与SO2分离;SO2有较强还原性,能被高锰酸钾氧化生成硫酸根离子,MnO被还原为Mn2+,使溶液的紫色褪去,装置III中溶液逐渐褪色,根据电子转移数目相等,结合电荷守恒及原子守恒,可得该反应方程式为:5SO2+2MnO+2H2O=5SO+2Mn2++4H+;故答案为使SO3凝结成固体与SO2分离;5SO2+2MnO+2H2O=5SO+2Mn2++4H+;
③乙同学按I、II、IV的顺序连接装置,则反应后的气体中的SO2与NaOH发生反应。如果全部生成亚硫酸钠,其质量增加是2.6g,如果全部是亚硫酸氢钠,其质量增加是6.4g,实际质量增加4.8g,所以是两种物质的混合物。反应后增重4.8g为SO2质量,反应的n(SO2)==0.075mol,40mL2.5mol L-1NaOH中n(NaOH)=40mL×2.5mol L-1=0.1mol,n(SO2)∶n(NaOH)=0.075:0.1=3∶4,反应的方程式为:3SO2+4NaOH=Na2SO3+2NaHSO3+H2O,则产物(水除外)的物质的量之比是1∶2;故答案为1∶2。
20.(1)5.6
(2)
(1)32gCu的物质的量是32g÷64g/mol=0.5mol,NO和二氧化氮的总物质的量是11.2L÷22.4L/mol=0.5mol,设混合气体中二氧化氮的物质的量是x,根据得失电子守恒,则0.5mol×2=x×1+(0.5mol-x)×3,解得x=0.25mol,所以二氧化氮的体积(换算为标准状况下)是0.25mol×22.4L/mol=5.6L;
(2)反应中的硝酸一部分被还原为NO和二氧化氮,其余未被还原,则与氢氧化钠溶液反应,最终生成硝酸钠,根据Na元素守恒,则未被还原的硝酸的物质的量是V×10-3L×n mol/L,则溶液中的硝酸的物质的量是(V×10-3L×n mol/L+0.5mol),所以硝酸的物质的量浓度是(V×10-3L×n mol/L+0.5mol)÷(140×10-3L)=mol/L。
21. 0.1 1 120 小于 18
(1)发生的反应是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,因为硫酸是过量的,因此根据铜进行计算,n(Cu)==0.05mol,消耗硫酸的物质的量为n(H2SO4)=2n(Cu)=2×0.05mol=0.1mol,产生V(SO2)=0.05mol×22.4L/mol=1.12L,即1120mL;
(2)在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中,被还原的硫酸的物质的量是参加反应的硫酸的一半。硫酸不足,铜过量,因此根据硫酸进行计算,被还原硫酸的物质的量为50×10-3×mol=0.025amol,但铜只与浓硫酸反应,随着反应的进行,硫酸浓度降低,转化成稀硫酸,反应停止,即被还原的稀硫酸的物质的量小于0.025amol;
(3)根据反应方程式,硫酸一部分起酸性,一部分作氧化剂,因此根据硫元素守恒,n(H2SO4)=[n(SO42-)+n(SO2)] mol=( +) mol=0.9mol,因此c(H2SO4)==18mol·L-1。
22. 14.236 2.36t 1:2 0.85g
(1)甲厂的尾气中含SO20.2%、O210.0%,含有N2的体积分数为:1-0.2%-10%=89.8%,相同条件下气体体积与物质的量成正比,则该混合气体的平均摩尔质量为:,相同条件下气体的密度与摩尔质量成正比,则该混合气体对氢气的相对密度为:,若该厂每天排放的尾气为2×105m3(标况下),则含有标况下的二氧化硫的体积为:2×105m3×0.2%=400 m3=4×105L,该二氧化硫的物质的量为:,根据硫酸根离子守恒可知,生成硫酸铵的物质的量为1.786×104mol,质量为:132g/mol×1.786×104mol=2.36×106g=2.36t,故答案为:14.236;2.36;
(2)①本反应历程为:OH-首先是和NH4HSO4中的H+反应,随后剩余的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO4的量也增大,放出的氨气的量会为0;浓硫酸增加的质量就是氨气的质量,第一次和第二次放出的氨气的量相等,所以第一次肯定是OH-过量,利用第一次的量计算(因为是OH-过量),设(NH4)2SO4的物质的量为x,NH4HSO4的物质的量为y,则:①:132x+115y=9.05,②:2x+y==0.1,联立解得:x=0.025mol、y=0.05mol,即(NH4)2SO4和NH4HSO4的物质的量之比为0.025mol:0.05mol=1:2,故答案为:1:2;
②根据①可知,9.05g混合物中含有0.025mol硫酸铵、0.05mo硫酸氢铵,则18.10混合物中含有0.05mol硫酸氢铵、0.1mol硫酸氢铵,且氢氧化钠完全反应,该50mL氢氧化钠溶液中含有氢氧化钠的物质的量为:n(NaOH)=n(NH4HSO4)+n(NH3)=0.1mol+0.1mol=0.2mol,27.15g混合物中含有硫酸铵的物质的量为:0.025mol×,含有硫酸氢铵的物质的量为:
0.05mol×=0.15mol,其中0.15molNH4HSO4消耗消耗0.15mol氢氧化钠,剩余的氢氧化钠与铵根离子反应生成氨气,则生成氨气的物质的量为:n(NH3)=n剩余(NaOH)=0.2mol-0.15mol=0.05mol,氨气的质量为:17g/mol×0.05mol=0.85g,故答案为:0.85g。
一、单选题(共12题)
1.下列有关实验操作、现象和结论都正确的是
选项 实验操作 现象及实验结论
A 向某溶液中先加入氯水,再加入KSCN溶液 溶液变红色,原溶液一定含Fe2+
B 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中 溶液变浑浊,原溶液一定含CO
C 向某溶液中加入NaOH溶液并加热 产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH
D 用砂纸打磨过的铝箔在空气中受热熔化,并不滴落 证明Al2O3熔点高于Al单质
A.A B.B C.C D.D
2.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是
A.实验室可用浓硫酸干燥氨气
B.陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C.漂白粉变质后的残留固体有碳酸钙
D.单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
3.硫酸是重要的化工原料,工业上由硫或硫铁矿通过反应可得,催化氧化生成,再用浓硫酸吸收得发烟硫酸(),发烟硫酸与水反应可得硫酸。“热化学硫碘循环分解水”是一种利用硫酸、碘等来获取氢能源方法。下列有关接触法制硫酸的说法正确的是
A.硫铁矿和氧气在高温下发生置换反应
B.升高接触室中气体的温度能提高的平衡转化率
C.将从吸收塔底部通入,浓硫酸从塔顶喷淋,提高了的吸收率
D.将全部转化为需消耗
4.利用点滴板探究氨气的性质(如右图所示)。实验时向NaOH 固体上滴几滴浓氨水后,立即用表面皿扣住点滴板。下列对实验现象的解释正确的是
选项 实验现象 解释
A 红色石蕊试纸变蓝 NH3 极易溶于水
B 浓硫酸附近无白烟 NH3 与浓硫酸不发生反应
C 浓盐酸附近有白烟 NH3与挥发出的HCl反应:NH3 +HCl=NH4Cl
D 氯化铝溶液变浑浊 NH3 与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓
A.A B.B C.C D.D
5.只用一种试剂就能鉴别硫酸铵、氯化铵、硫酸钠、氯化钠的是
A.氯化钡 B.氢氧化钠 C.硝酸银 D.氢氧化钡
6.研究表明:NO吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究证实,NO对SARS病毒有直接抑制作用。下列对NO的叙述正确的是( )
A.常温常压下,一氧化氮能与空气中的氧气直接化合
B.一氧化氮的摩尔质量为30
C.一氧化氮是一种红棕色的气体
D.一氧化氮易溶于水,不能用排水法收集
7.某实验小组为了探究SO2的性质设计出以下实验。实验时向培养皿中Na2SO3固体上滴几滴浓硫酸,立即扣上另培养皿。表中对实验现象的描述或解释错误的是
选项 实验现象 解释
A 品红溶液褪色 SO2具有漂白性
B 碘水褪色 SO2具有还原性,与I2反应
C Na2S溶液变浑浊 SO2具有氧化性,与Na2S溶液反应生成硫单质
D BaCl2溶液变浑浊 SO2与BaCl2溶液反应生成BaSO3沉淀
A.A B.B C.C D.D
8.中国是世界著名的陶瓷古国。下列国宝级文物主要由陶瓷制成的是
选项 A B C D
文物
名称 东汉铜车马 舞马衔杯纹银壶 萧何月下追韩信梅瓶 雪景寒林图
A.A B.B C.C D.D
9.下列对某些物质的检验及结论一定正确的是( )
A.加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有SO42-
B.取少量待测液做焰色反应实验,火焰呈黄色,该溶液中一定含有NaOH
C.某气体能使品红溶液褪色,该气体一定是SO2
D.某溶液中先通入Cl2,再加入KSCN溶液,溶液显红色,则原溶液中可能含有Fe2+
10.下列说法错误的是
A.硅元素在自然界中无游离态,主要以硅酸盐和氧化物形式存在
B.常温下,晶体硅不能与盐酸反应
C.SiO2既能与酸又能与碱反应,所以SiO2属于两性氧化物
D.高纯硅可用于制作光伏电池,SiO2可用于制作光导纤维
11.利用FeSO4制备还原铁粉的工艺流程如图所示,下列说法错误的是
A.“转化”过程的离子方程式为Fe2++2=FeCO3↓+H2O+CO2↑
B.“洗涤”过程可用盐酸酸化的BaCl2溶液检验沉淀是否洗净
C.“干燥”过程应将固体置于烧杯中加强热快速烘干
D.“焙烧”过程产生的气体可能是CO和CO2的混合气体
12.下列各组离子在给定溶液中能大量共存的是
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.的溶液:、、、
二、非选择题(共10题)
13.如图是A→E五种含氮物质相互转化的关系图。其中A、B、C、D常温下都是气体,且B为红棕色气体。
(1)写出下列物质的化学式:
A___、B___、C___、D____、E___。
(2)写出下面各步反应的化学方程式:
①___、②___、⑤___。
14.回答下列问题:
(1)高铁酸盐是一种新型、高效、多功能绿色水处理剂,工业上可用湿法制备高铁酸钾。化学反应原理为:2Fe(OH)3+3ClO-+4OH-=2FeO+3Cl-+5H2O。
①FeO中铁元素化合价为____,在该反应中氧化剂是____,还原剂是____,氧化产物是____。
②请用双线桥表示反应中电子转移情况:____。
③根据化合价,推测FeO能和下列____反应(填序号)。
A.KMnO4 B.SO2 C.H2S D.O2
(2)Co2O3、Co3+均属于极强的氧化剂,在生产中有着重要的应用。一定条件下,Co3+与过量Na2S2O3溶液反应后生成Co2+和SO,写出该反应的离子方程式____。设计实验证明反应后溶液中含有SO:____。(已知:S2O与H+反应生成S、SO2,BaS2O3不溶于水)
15.自然界中的氮循环部分过程如图所示,回答下列问题:
(1)①自然界中实现路径Ⅰ的固氮方式可能是___________(任写一种)。
②在哈伯等科学家的努力下,路径Ⅱ已实现工业大规模合成氨,反应方程式为___________。
(2)①实验室制的化学方程式为___________;
②干燥氨气不可以选用的试剂是___________(填字母)。
a.浓硫酸 b.碱石灰 c.NaOH固体
(3)除反硝化作用外,铵态氮()与亚硝态氮()也可以在细菌的作用下转化为氮气。请写出所涉及的离子反应方程式___________。该反应中,当产生0.02mol氮气时,转移电子的物质的量为___________。
(4)工业制硝酸时尾气中含有NO、,可用以两种下方法吸收:
①水吸收法。请用化学方程式说明用水吸收的缺陷___________。
②NaOH溶液吸收法。发生的反应有:、。用不同浓度NaOH溶液吸收含量不同的尾气,氮氧化物吸收率与NaOH浓度间的关系如图所示(α表示尾气里的含量):
ⅰ.根据图中得知___________(填字母)。
a.NaOH溶液浓度越大,氮氧化物的吸收率越大
b.含量越大,氮氧化物的吸收率越大
ⅱ.当α小于50%时,加入能提升氮氧化物的吸收率,原因是___________
16.学习元素化合物时可以借助“价类二维图”预测物质性质。如下是部分含硫化合物的二维图的相关信息。
(1)图中“X”代表的物质类别是_______;Y转化为Z体现了Y的_______性。
(2)SO2是重要的大气污染物,会导致“酸雨”。SO2产生硫酸型酸雨有两条途径:途径一是SO2→SO3→H2SO4;另一途径是:SO2→_______。
(3)将装有SO2的试管倒立在水槽中,可观察到_______。取出试管中的溶液,分别进行如下实验:
①滴加品红溶液,振荡,观察到红色褪去,说明SO2具有_______性。
②滴加BaCl2溶液,无明显现象,再滴入FeCl3溶液后出现白色沉淀。出现白色沉淀的原因_______。
(4)根据SO2的性质,提出一种燃煤脱硫的方法_______。
17.硫及其化合物是重要的化工原料,某学习小组对某些硫的化合物性质和制备进行如下实验探究:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析(水蒸气除外)。
回答下列问题:
(1)气体X中除水蒸气之外,还可能有的气体是_______。
(2)若B中是品红溶液,酸性KMnO4溶液的作用是_______,C中的试剂是_______。
(3)若将酸性高锰酸钾溶液换成溴水,写出该反应的离子方程式_______。
(4)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是_______、_______。
18.为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
请回答以下问题:
(1)混合粉末A中硫粉过量的原因是_________。
(2)反应在“惰性气体环境”中进行的原因是__________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明_____。
(4)操作②的作用是________,也可改用_________。
(5)操作③稀H2SO4煮沸的目的是________。
19.某同学欲研究SO2的性质。
(1)将相关的含硫物质分为如表所示3组,则第2组中物质X的化学式是_______。
第1组 第2组 第3组
S(单质) SO2、X、Na2SO3、NaHSO3 SO3、H2SO4、Na2SO4、NaHSO4
(2)实验室制取SO2的化学方程式为_______。
(3)利用如图所示的装置研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃,沸点:SO2-10℃,SO345℃)。
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是_______。
②甲同学按Ⅰ、Ⅱ、III、Ⅳ的顺序连接装置,装置Ⅱ的作用是_______;装置Ⅲ中溶液逐渐褪色,生成Mn2+,则该反应离子方程式是_______。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40mL2.5mol L-1NaOH溶液,反应后增重4.8g,则产物(水除外)的物质的量之比是_______。
20.将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2的混合气体的体积为11.2L(已换算为标准状况下),请回答
(1)NO2的体积(换算为标准状况下)为___________。
(2)待产生的气体全部释放后,向溶液中加入VmL n mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为________mol·L-1。
21.50 mL浓H2SO4溶液(足量)中加入3.2 g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________,生成SO2的体积为(标准状况下)____________mL。
(2)若题干中浓硫酸的物质的量浓度为a mol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)_______0.025a mol(填“等于”、“大于”或“小于”)。
(3)将题干中反应后的溶液稀释到500 mL,取出50 mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81 g,则原浓硫酸的物质的量浓度为_____________。
22.工业上常用氨水等来处理制硫酸过程中产生的尾气(含SO2、O2),得到硫酸的铵盐产品。
(1)甲厂的尾气中含SO2 0.2%、O2 10.0%(体积分数,其余为N2)。该尾气对氢气的相对密度为_______________(保留3位小数)。若该厂每天排放的尾气为2×105 m3(标况下),则该厂每天最多能获得______________吨硫酸铵。(保留2位小数)
(2)乙厂得到的铵盐产品是硫酸铵和硫酸氢铵的混合物。为测定它们的含量,取不同质量的铵盐,分别加入到50.00mL相同浓度的NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 铵盐质量(g) 浓硫酸增加的质量(g)
第一次 9.05 1.7
第二次 18.10 1.7
第三次 27.15 a
第四次 36.20 0
①计算该铵盐中硫酸铵和硫酸氢铵的物质的量之比________________。
②计算第三次实验时浓硫酸增加的质量a的值_______________。
参考答案:
1.D
A.若原溶液中含有Fe3+,向某溶液中先加入氯水,再加入KSCN溶液,溶液也变红色,所以不能证明原溶液一定含Fe2+;若要证明Fe2+的存在,可以先向溶液中加入KSCN溶液,溶液颜色无变化,再加入氯水,溶液变红,可证明原溶液中有Fe2+,故A错误;
B.若原溶液中含有HCO或SO或HSO,向溶液中加入稀盐酸,产生的CO2或SO2都能使澄清石灰水变浑浊,故B错误;
C.氨气是碱性气体。向某溶液中加入NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,则原溶液一定有NH,故C错误;
D.用砂纸打磨过的铝箔在空气中受热熔化,并不滴落,说明铝表面包裹着一层熔点很高的氧化铝,证明Al2O3熔点高于Al单质,故D正确;
故选D。
2.C
A.氨气为碱性气体,能够与浓硫酸反应,不能用浓硫酸干燥,故A错误;
B.水晶主要成分二氧化硅,为氧化物,不属于硅酸盐材料,故B错误;
C.漂白粉变质时与水、二氧化碳反应生成碳酸钙和HClO,变质后的残留固体有碳酸钙,故C正确;
D.S具有弱氧化性,氯气具有强氧化性,分别与Fe反应生成FeS、氯化铁,Fe元素的化合价不同,故D错误;
故答案选C。
3.C
A.硫铁矿和氧气在高温下发生反应生成氧化铁和二氧化硫,反应不属于置换反应,选项A错误;
B.催化氧化生成是放热反应,升高接触室中气体的温度,平衡逆向移动,因此能降低的平衡转化率,选项B错误;
C.将从吸收塔底部通入,浓硫酸从塔顶喷淋,逆向对流有利于提高了的吸收率,选项C正确;
D.将全部转化为需消耗,生成2mol,选项D错误。
答案选C。
4.C
A.红色石蕊试纸变蓝是因为氨气溶于水显碱性,与NH3 极易溶于水性质无关,故A错误;
B.因为硫酸不具挥发性,因此浓硫酸与氨气反应附近无白烟,故B错误;
C.浓盐酸有挥发性,挥发出的HCl与NH3反应生成白烟NH3 +HCl=NH4Cl,故C正确;
D.一水合氨为弱碱,所以书写离子方程式时用化学式表示,故D错误。
综上所述,答案为C。
5.D
硫酸铵与氢氧化钡混合反应产生BaSO4白色沉淀和NH3,既有白色沉淀产生,又有刺激性气味的气体产生;氯化铵与氢氧化钡混合反应产生BaCl2和NH3,只有刺激性气味的气体产生;硝酸银与氢氧化钡混合反应产生Ba(NO3)2和AgOH白色沉淀,只有白色沉淀产生,而氯化钠与氢氧化钡混合,不能发生反应,四种物质与氢氧化钡混合,现象各不相同,可以鉴别,故合理选项是D。
6.A
A.常温常压下一氧化氮能够与氧气反应生成二氧化氮,A正确;
B.摩尔质量的单位是g/mol,B选项缺少单位所以B错误;
C.一氧化氮是一种无色气体,C错误;
D.一氧化氮难溶于水,可以用排水法收集,D错误。
故选A。
7.D
A.二氧化硫具有漂白性,能够使品红褪色,故A正确;
B.二氧化硫具有还原性,能够与I2发生氧化还原反应使碘水褪色,故B正确;
C.二氧化硫具有弱的氧化性能够氧化硫离子生成硫单质,所以Na2S溶液变浑浊,故C正确;
D.盐酸的酸性强于亚硫酸,二氧化硫与氯化钡不反应,不会产生沉淀,故D错误;
故选:D。
8.C
A.东汉铜车马为青铜器,属于合金,A不符合题意;
B.舞马衔杯纹银壶为金属制品,B不符合题意;
C.萧何月下追韩信梅瓶为瓷器,由陶瓷制成,C符合题意;
D.雪景寒林图为书画,由纤维素制成,D不符合题意;
综上所述答案为C。
9.D
A. 加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中可能含有SO42 、Ag+,故A错误;
B. 取少量待测液做焰色反应实验,火焰呈黄色,该溶液中一定含有钠的物质,不一定是NaOH,故B错误;
C. 某气体能使品红溶液褪色,该气体可能是SO2,还可能是Cl2,故C错误;
D. 某溶液中先通入Cl2,再加入KSCN溶液,溶液显红色,则原溶液中可能含有Fe2+或Fe3+,故D正确。
综上所述,答案为D。
10.C
A.硅元素在自然界中无游离态,化合态的硅元素主要以硅酸盐和氧化物形式存在,A正确;
B.常温下,晶体硅中原子之间以强烈的共价键结合,不能与盐酸反应,B正确;
C.SiO2能与碱反应,产生硅酸盐和水,而不能与酸反应产生盐和水,所以SiO2属于酸性氧化物,C错误;
D.高纯硅可用于制作光伏电池,SiO2能够使光线发生全反射,因此可用于制作光导纤维,D正确;
故合理选项是C。
11.C
A.“转化”过程加入的NH4HCO3溶液可电离产生,进一步电离产生H+和,反应得FeCO3、H2O和CO2,选项A正确;
B.“洗涤”过程是洗去FeCO3表面附着的、等离子,此法用检验是否存在来证明沉淀是否洗净,选项B正确;
C.“干燥”过程不可在烧杯中强热,选项C错误;
D.“焙烧”过程Fe2+被还原,碳被氧化可能生成CO和CO2的混合气,选项D正确;
答案选C。
12.B
A.氢离子可以和草酸根离子反应生成草酸,不能共存,A错误;
B.离子、、、和氢氧根离子不反应,和钡离子也不反应,可以共存,B正确;
C.硝酸根离子在氢离子存在的情况下可以把二价铁氧化为三价铁,不能共存,C错误;
D.硫酸氢钠电离出的氢离子可以和偏铝酸根离子反应,也可以和亚硫酸根离子反应,不能共存,D错误;
故选B。
13. N2 NO2 NO NH3 HNO3 N2+O22NO 4NH3+5O24NO+6H2O 3NO2+H2O=2HNO3+NO
根据题给信息,由B为红棕色气体可分析得出B为NO2,根据及题给的物质状态信息及A→E为五种含氮物质,结合图中A、B、C、D、E之间的转化关系可知,A为N2,B为NO2,C为NO,D为NH3,E为HNO3。据此进行分析。
(1)由分析可知:A为N2,B为NO2,C为NO,D为NH3,E为HNO3。故答案为:N2;NO2;NO;NH3;HNO3;
(2)反应中涉及的反应方程式为:①N2+O22NO;②4NH3+5O24NO+6H2O;⑤3NO2+H2O=2HNO3+NO;答案为:N2+O22NO;4NH3+5O24NO+6H2O;3NO2+H2O=2HNO3+NO;
14.(1) +6价 ClO- Fe(OH)3 FeO BC
(2) 8Co3++S2O+5H2O=8Co2++2SO+10H+ 取反应后的溶液少许,向其中加入足量的稀盐酸并不断搅拌,充分反应后静置,向上层清液滴加BaCl2溶液(或取上层清液少许,向其中加入BaCl2溶液),若有白色沉淀生成说明反应后的溶液中含有SO
(1)①FeO中O元素化合价为-2,则铁元素化合价为+6;在该反应中,ClO-中Cl元素化合价降低,氧化剂是ClO-;Fe(OH)3中Fe元素化合价升高发生氧化反应,还原剂是Fe(OH)3,氧化产物是FeO。
②ClO-中Cl元素化合价由+1降低为-1,Fe(OH)3中Fe元素化合价由+3升高为+6,用双线桥表示反应中电子转移情况为。
③根据化合价,推测FeO中Fe元素化合价为+6,具有强氧化性,SO2、H2S具有还原性,所以FeO能与SO2、H2S反应,选BC。
(2)Co2O3、Co3+均属于极强的氧化剂,一定条件下,Co3+与过量Na2S2O3溶液反应后生成Co2+和SO,Co元素化合价由+3降低为+2、S元素化合价由+2升高为+6,根据得失电子守恒、电荷守恒,反应的离子方程式为8Co3++S2O+5H2O=8Co2++2SO+10H+。根据题目信息,S2O与H+反应生成S、SO2,BaS2O3不溶于水,取反应后的溶液少许,向其中加入足量的稀盐酸并不断搅拌,充分反应后静置,除去S2O,再向上层清液滴加BaCl2溶液,若有白色沉淀生成说明反应后的溶液中含有SO。
15.(1) 生物固氮 2N2+3H22NH3
(2) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O a
(3) +=N2+2H2O 0.06mol
(4) 3+H2O=NO+2HNO3 b 当混合气体中 NO2含量小于 50% 时,具有氧化性的 H2O2的存在,会使 NO 氧化成 NO2,NO2的含量增大,从而使氮氧化物的吸收率增大
(1)①路径Ⅰ中N2转化为NO和NO,自然界中实现该过程的固氮方式可能是:生物固氮;
②路径Ⅱ中N2转化为NH3,在哈伯等科学家的努力下,路径Ⅱ已实现工业大规模合成氨,反应方程式为2N2+3H22NH3。
(2)①实验室用氯化铵和氢氧化钙加热制取氨气,该反应是复分解反应,反应为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
②氨气是碱性气体,不能用浓硫酸干燥,故选a。
(3)铵态氮()与亚硝态氮()也可以在细菌的作用下转化为氮气,根据得失电子守恒和电荷守恒配平离子方程式为:+=N2+2H2O,该反应中,中N元素由-3价上升到0价,当产生0.02mol氮气时,转移电子的物质的量为0.06mol。
(4)①和H2O反应的化学方程式为:3+H2O=NO+2HNO3,该过程中生成有毒气体NO;
②ⅰ.根据图中得知NaOH溶液浓度越大,氮氧化物的吸收率先增大后减小,含量越大,氮氧化物的吸收率越大,故选b;
ⅱ.当混合气体中 NO2含量小于 50% 时,具有氧化性的 H2O2的存在,会使 NO 氧化成 NO2,NO2的含量增大,从而使氮氧化物的吸收率增大。
16.(1) 氧化物(或非金属氧化物/酸性氧化物) 还原性
(2)H2SO3→H2SO4
(3) 液面上升至水充满整支试管 漂白性 Fe3+将SO2溶于水形成的H2SO3氧化成,遇Ba2+生成BaSO4沉淀
(4)在燃煤中加入适量石灰石(或石灰)
根据图示,Y为硫的-2价氢化物,为;Z为S硫单质;通过和可知X为物质类别中的氧化物(或非金属氧化物/酸性氧化物);
(1)通过和,两者均为硫的氧化,可知X为物质类别中的氧化物(或非金属氧化物/酸性氧化物);Y为硫的-2价氢化物,为,由转化为S,硫元素化合价降低,体现了的还原性,故填氧化物(或非金属氧化物/酸性氧化物);还原性;
(2)二氧化硫能溶于水形成,然后被氧化,最终转化为形成酸雨,故填→;
(3)因为溶于水,将装有SO2的试管倒立在水槽中,可观察到试管中液面上升至水充满整支试管,故填液面上升至水充满整支试管;
①溶于水形成亚硫酸,亚硫酸能与品红发生加成反应,生成不稳定的无色化合物,使品红溶液褪色,该过程可逆,说明SO2具有漂白性;
②溶于水形成亚硫酸,亚硫酸不与BaCl2溶液反应,无明显现象,滴加FeCl3溶液后,铁离子将二氧化硫氧化成硫酸根离子,与钡离子结合生成硫酸钡,故填Fe3+将SO2溶于水形成的H2SO3氧化成,遇Ba2+生成BaSO4沉淀;
(4)二氧化硫具有还原性,可以在燃煤中加入适量石灰石(或石灰),发生反应,达到燃煤脱硫的目的,故填在燃煤中加入适量石灰石(或石灰)。
17. SO2、H2 除去二氧化硫 浓硫酸 Br2+2H2O+SO2=2Br-+4H++ 黑色固体变为红色 硫酸铜变蓝
浓硫酸有强氧化性,Zn有还原性,Zn和浓硫酸在A中共热反应生成硫酸锌、水和二氧化硫,随着反应的进行,硫酸浓度降低变为稀硫酸,稀硫酸和Zn反应生成硫酸锌和氢气,因此气体X可能含有二氧化硫、水蒸气、氢气,B中盛放品红溶液检验二氧化硫,酸性高锰酸钾溶液除去二氧化硫,C中盛放浓硫酸,作用是吸收水蒸气,氢气和CuO反应生成Cu和水,用E中无水硫酸铜检验水蒸气,若E中硫酸铜变为蓝色,D中黑色固体变为红色,则可证明气体X中含氢气,据此解答。
(1)由分析可知气体X中除水蒸气之外,还可能有的气体是SO2、H2;
(2)酸性KMnO4溶液的作用是除去二氧化硫;C中的试剂是浓硫酸,作用是吸收水蒸气;
(3)若将酸性高锰酸钾溶液换成溴水,则溴水和二氧化硫发生氧化还原反应生成HBr和硫酸,反应的离子方程式为Br2+2H2O+SO2=2Br-+4H++;
(4)由分析可知D和E装置用来检验X中的氢气,若D中黑色固体变为红色,E中硫酸铜变蓝,则证明气体X中含氢气。
18. 防止因铁粉过量而使滤渣C中含铁粉,剩余铁粉与H2SO4反应生成Fe2+干扰实验 防止空气中的O2参与反应 硫和铁粉反应是放热的 除去混合物中的硫粉 CS2 防止稀H2SO4溶液溶解的氧气氧化生成的Fe2+
Fe与S单质在惰性气体中共热生成对应硫化物,再加入热的KOH是除去过量的S单质,再向滤渣中加入稀硫酸,滤渣与稀硫酸反应,根据反应后溶液颜色判断Fe的化合价。
(1)实验目的为探究铁和硫反应产物中铁元素的化合价,铁粉和硫粉在惰性气体环境中反应生成硫化亚铁,如果铁粉过量,过量的铁粉与硫酸反应生成Fe2+而干扰实验产物的检验,所以混合粉末A中S粉必须要过量,保证铁粉完全反应,故答案为:防止因铁粉过量而使滤渣C中含铁粉,剩余铁粉与H2SO4反应生成Fe2+干扰实验;
(2)四氧化三铁为黑色固体,铁能和氧气反应生成四氧化三铁,硫和氧气反应生成二氧化硫,混合粉末A中S粉反应在“惰性气体环境中”进行防止Fe和S被氧化,尤其是Fe被氧化成Fe3O4而干扰实验,故答案为:防止空气中的O2参与反应;
(3)因硫和铁粉反应是放热反应,所以用烧热的玻璃棒点触,该发应能持续进行,故答案为:硫和铁粉反应是放热反应;
(4)操作②在黑色固体中加入热的氢氧化钾溶液,除去混合物中过量的硫粉,除了用热的KOH溶液之外,还可以用CS2,故答案为:除去混合物中过量的硫粉;CS2;
(5)亚铁离子具有强还原性,.操作③中稀硫酸煮沸,排出溶解在其中的氧气,防止硫酸中溶解的O2将前面反应过程中生成的Fe2+氧化,故答案为:防止稀H2SO4溶液溶解的氧气氧化生成的Fe2+。
19.(1)H2SO3
(2)Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O
(3) 2SO2+O22SO3 使SO3凝结成固体与SO2分离 5SO2+2MnO+2H2O=5SO+2Mn2++4H+ 1:2
(1)
根据表格提供的物质可知:第二组的物质中S元素的化合价都是+4价,其排列方式为氧化物、酸、盐、酸式盐,所以X是H2SO3;故答案为H2SO3;
(2)
实验室制取SO2的化学方程式为Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O;故答案为Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O;
(3)
①二氧化硫和氧气在催化剂存在时发生氧化还原反应生成SO3,反应的方程式是:2SO2+O22SO3;故答案为2SO2+O22SO3;
②甲同学按I、II、III、IV的顺序连接装置,I是SO2氧化为SO3,反应产生的SO3的熔点较低,只有16.8℃,所以装置II的作用是是使SO3凝结成固体与SO2分离;SO2有较强还原性,能被高锰酸钾氧化生成硫酸根离子,MnO被还原为Mn2+,使溶液的紫色褪去,装置III中溶液逐渐褪色,根据电子转移数目相等,结合电荷守恒及原子守恒,可得该反应方程式为:5SO2+2MnO+2H2O=5SO+2Mn2++4H+;故答案为使SO3凝结成固体与SO2分离;5SO2+2MnO+2H2O=5SO+2Mn2++4H+;
③乙同学按I、II、IV的顺序连接装置,则反应后的气体中的SO2与NaOH发生反应。如果全部生成亚硫酸钠,其质量增加是2.6g,如果全部是亚硫酸氢钠,其质量增加是6.4g,实际质量增加4.8g,所以是两种物质的混合物。反应后增重4.8g为SO2质量,反应的n(SO2)==0.075mol,40mL2.5mol L-1NaOH中n(NaOH)=40mL×2.5mol L-1=0.1mol,n(SO2)∶n(NaOH)=0.075:0.1=3∶4,反应的方程式为:3SO2+4NaOH=Na2SO3+2NaHSO3+H2O,则产物(水除外)的物质的量之比是1∶2;故答案为1∶2。
20.(1)5.6
(2)
(1)32gCu的物质的量是32g÷64g/mol=0.5mol,NO和二氧化氮的总物质的量是11.2L÷22.4L/mol=0.5mol,设混合气体中二氧化氮的物质的量是x,根据得失电子守恒,则0.5mol×2=x×1+(0.5mol-x)×3,解得x=0.25mol,所以二氧化氮的体积(换算为标准状况下)是0.25mol×22.4L/mol=5.6L;
(2)反应中的硝酸一部分被还原为NO和二氧化氮,其余未被还原,则与氢氧化钠溶液反应,最终生成硝酸钠,根据Na元素守恒,则未被还原的硝酸的物质的量是V×10-3L×n mol/L,则溶液中的硝酸的物质的量是(V×10-3L×n mol/L+0.5mol),所以硝酸的物质的量浓度是(V×10-3L×n mol/L+0.5mol)÷(140×10-3L)=mol/L。
21. 0.1 1 120 小于 18
(1)发生的反应是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,因为硫酸是过量的,因此根据铜进行计算,n(Cu)==0.05mol,消耗硫酸的物质的量为n(H2SO4)=2n(Cu)=2×0.05mol=0.1mol,产生V(SO2)=0.05mol×22.4L/mol=1.12L,即1120mL;
(2)在Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O中,被还原的硫酸的物质的量是参加反应的硫酸的一半。硫酸不足,铜过量,因此根据硫酸进行计算,被还原硫酸的物质的量为50×10-3×mol=0.025amol,但铜只与浓硫酸反应,随着反应的进行,硫酸浓度降低,转化成稀硫酸,反应停止,即被还原的稀硫酸的物质的量小于0.025amol;
(3)根据反应方程式,硫酸一部分起酸性,一部分作氧化剂,因此根据硫元素守恒,n(H2SO4)=[n(SO42-)+n(SO2)] mol=( +) mol=0.9mol,因此c(H2SO4)==18mol·L-1。
22. 14.236 2.36t 1:2 0.85g
(1)甲厂的尾气中含SO20.2%、O210.0%,含有N2的体积分数为:1-0.2%-10%=89.8%,相同条件下气体体积与物质的量成正比,则该混合气体的平均摩尔质量为:,相同条件下气体的密度与摩尔质量成正比,则该混合气体对氢气的相对密度为:,若该厂每天排放的尾气为2×105m3(标况下),则含有标况下的二氧化硫的体积为:2×105m3×0.2%=400 m3=4×105L,该二氧化硫的物质的量为:,根据硫酸根离子守恒可知,生成硫酸铵的物质的量为1.786×104mol,质量为:132g/mol×1.786×104mol=2.36×106g=2.36t,故答案为:14.236;2.36;
(2)①本反应历程为:OH-首先是和NH4HSO4中的H+反应,随后剩余的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO4的量也增大,放出的氨气的量会为0;浓硫酸增加的质量就是氨气的质量,第一次和第二次放出的氨气的量相等,所以第一次肯定是OH-过量,利用第一次的量计算(因为是OH-过量),设(NH4)2SO4的物质的量为x,NH4HSO4的物质的量为y,则:①:132x+115y=9.05,②:2x+y==0.1,联立解得:x=0.025mol、y=0.05mol,即(NH4)2SO4和NH4HSO4的物质的量之比为0.025mol:0.05mol=1:2,故答案为:1:2;
②根据①可知,9.05g混合物中含有0.025mol硫酸铵、0.05mo硫酸氢铵,则18.10混合物中含有0.05mol硫酸氢铵、0.1mol硫酸氢铵,且氢氧化钠完全反应,该50mL氢氧化钠溶液中含有氢氧化钠的物质的量为:n(NaOH)=n(NH4HSO4)+n(NH3)=0.1mol+0.1mol=0.2mol,27.15g混合物中含有硫酸铵的物质的量为:0.025mol×,含有硫酸氢铵的物质的量为:
0.05mol×=0.15mol,其中0.15molNH4HSO4消耗消耗0.15mol氢氧化钠,剩余的氢氧化钠与铵根离子反应生成氨气,则生成氨气的物质的量为:n(NH3)=n剩余(NaOH)=0.2mol-0.15mol=0.05mol,氨气的质量为:17g/mol×0.05mol=0.85g,故答案为:0.85g。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
