2024届高三化学二轮复习专题3:数据运用——电离常数、溶度积常数的有关计算(含答案)
文档属性
| 名称 | 2024届高三化学二轮复习专题3:数据运用——电离常数、溶度积常数的有关计算(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 351.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 18:37:09 | ||
图片预览




文档简介
培优练3 数据运用——电离常数、溶度积常数的有关计算
1.工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如图所示,该流程同时获取副产物Fe2O3和MnCl2。
已知:
Ⅰ.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25 ℃时,Ksp[Fe(OH)3]=1.0×10-38、
Ksp[Mn(OH)2]=4.0×10-14。
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有________,“气体”除水蒸气、HCl外还有________(均填化学式)。
(2)过程①中MnWO4参与反应的化学方程式为_____________________________;
FeWO4参与的反应中氧化剂与还原剂的物质的量之比为________。
(3)过程⑦在25 ℃时调pH,至少应调至________(当离子浓度等于1.0×10-5 mol·L-1时,可认为其已沉淀完全)。
2.以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
(1)“氧化”时,反应的离子方程式为____________________________________。
可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为________(写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_________________________________________________________。
(3)“沉铜”时,若滤液中c(Mn2+)=0.21 mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为________。(已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5 mol·L-1可视为沉淀完全)
(4)本工艺中可循环使用的物质是______________。
(5)结合图像,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:____________、____________,酒精洗涤,低温干燥。
3.钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为________________;滤渣Ⅰ的主要成分是________(填化学式)。
(2)“氧化”时加入足量H2O2的目的是_____________________________________
_____________________________________________________________________;
氧化后溶液中Fe3+浓度为0.001 mol·L-1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为________(忽略调pH前后溶液的体积变化)。
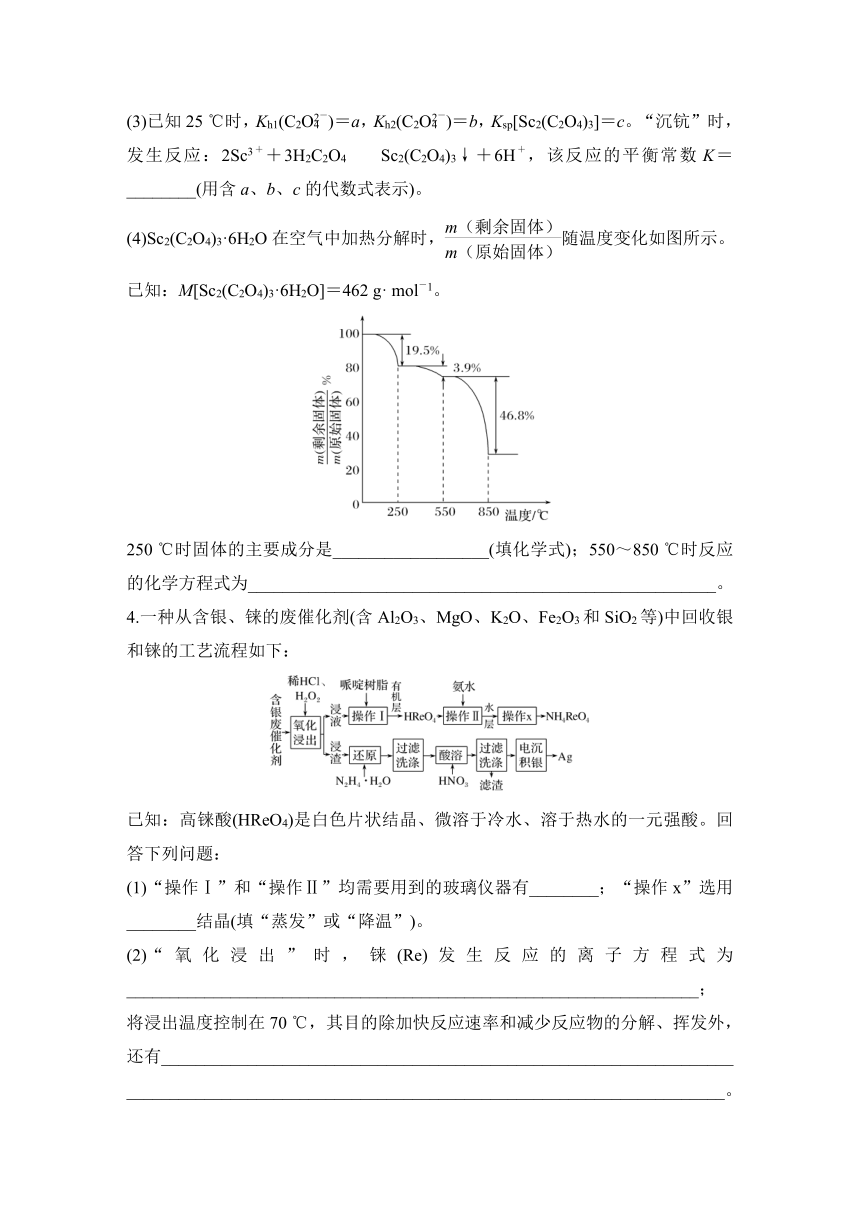
(3)已知25 ℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4??Sc2(C2O4)3↓+6H+,该反应的平衡常数K=________(用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。
已知:M[Sc2(C2O4)3·6H2O]=462 g· mol-1。
250 ℃时固体的主要成分是__________________(填化学式);550~850 ℃时反应的化学方程式为______________________________________________________。
4.一种从含银、铼的废催化剂(含Al2O3、MgO、K2O、Fe2O3和SiO2等)中回收银和铼的工艺流程如下:
已知:高铼酸(HReO4)是白色片状结晶、微溶于冷水、溶于热水的一元强酸。回答下列问题:
(1)“操作Ⅰ”和“操作Ⅱ”均需要用到的玻璃仪器有________;“操作x”选用________结晶(填“蒸发”或“降温”)。
(2)“氧化浸出”时,铼(Re)发生反应的离子方程式为__________________________________________________________________;
将浸出温度控制在70 ℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有__________________________________________________________________
_____________________________________________________________________。
(3)用石墨电极进行“电沉积银”,所得沉积液可循环到________中使用(填操作单元名称)。
(4)“氧化浸出”时有AgCl生成,“还原”时,N2H4·H2O与AgCl反应生成N2H5Cl和一种无毒气体,该反应的化学方程式为__________________________________。
若生成的AgCl用NH3(aq)溶解,则100 mL 6 mol·L-1NH3(aq)最多能溶解AgCl________ g(保留两位有效数字)。已知:Ag+(aq)+2NH3(aq)??[Ag(NH3)2]+(aq)的平衡常数称为稳定平衡常数,K(稳)=8.0×107;AgCl的Ksp=1.25×10-10。
5.氧化钪可提高计算机记忆元件性能,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:
已知:钪与铝类似,其氢氧化物具有两性;HTBP是钪元素的萃取剂,萃取发生的反应为Sc3++3HTBPSc(TBP)3+3H+。
(1)加入氨水调节pH=3,过滤,滤渣主要成分是________。
(2)上述洗脱剂X最好选择________(选填“酸性”、“碱性”或“中性”)溶液。
(3)过程中Mn2+生成MnO2的离子方程式___________________________________
_____________________________________________________________________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25 ℃时pH=2的草酸溶液中=________。(25 ℃时,草酸电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)。
(5)“沉钪”后所得到的草酸钪晶体的化学式为Sc2(C2O4)3·5H2O,灼烧发生分解反应的化学方程式为_____________________________________________________,
写出固体产物溶于NaOH溶液的离子方程式________________________________
_____________________________________________________________________。
6.硫酸镍广泛应用于电镀、电池等工业。以红土镍矿(主要成分为NiO,含MgO、Al2O3、Fe2O3、FeOOH、Fe3O4、CuO、ZnO、SiO2等杂质)为原料制备,工艺流程如下。
已知:①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 6.3 1.8 3.4 8.9 6.2 6.9
沉淀完全的pH 8.3 3.2 4.7 10.9 8.2 8.9
②当离子完全沉淀时,c(Mn+)≤10-5 mol·L-1。
回答下列问题:
(1)为提高“酸溶”中镍的浸出率,可采取的措施有__________________________
(写一条即可)。“滤渣1”的主要成分为________。
(2)写出“硫化除铜”过程中涉及反应的离子方程式________________________、
__________________________________________________________________。
(3)“氧化除杂”中加入H2O2和Ni(OH)2的作用分别是_______________________
_____________________________________________________________________,
溶液的pH应调节为________~6之间。
(4)“氟化除杂”中,若c(Mg2+)=0.004 mol·L-1,取等体积的NiF2溶液加入体系中发生反应,则加入的NiF2溶液的浓度至少为________ mol·L-1。[已知Ksp(MgF2)=6.25×10-9]
(5)称取m g硫酸镍晶体(NiSO4·H2O,摩尔质量M g·mol-1)样品溶于水,配成250 mL溶液。量取25.00 mL用c mol·L-1EDTA(Na2H2Y)标准溶液滴定,反应为Ni2++H2Y2-===NiY2-+2H+。重复三次,平均消耗EDTA标准溶液V mL,则样品纯度为________。
参考答案
1.(1)Fe2O3 Cl2 (2)2MnWO4+2Na2CO3+O22Na2WO4+2MnO2+2CO2 1∶4 (3)3.0
解析 从精制黑钨矿中提取金属钨,由流程可知加入纯碱,通入空气焙烧,然后加水溶解、过滤,滤液1中含有Na2WO4,加入盐酸生成钨酸,加热分解生成WO3,加热条件下通入氢气,可生成W;滤渣1含有二氧化锰、氧化铁等,加入浓盐酸并加热,可生成氯气,溶液中含有氯化铁、氯化锰,调节溶液pH生成滤渣2为氢氧化铁,灼烧可生成氧化铁,滤液2含有氯化锰,加热蒸发得到副产物MnCl2,以此解答该题。(1)由以上分析可知流程中的“滤渣1”除MnO2外还有Fe2O3,“气体”除水蒸气、HCl外还有Cl2。(2)过程①中MnWO4参与反应的化学方程式为2MnWO4+2Na2CO3+O22Na2WO4+2CO2+2MnO2;FeWO4参与的反应中氧化剂为氧气,Fe化合价由+2价升高到+3价,则氧化剂与还原剂的物质的量之比为1∶4。(3)25 ℃时,Ksp[Fe(OH)3]=1.0×10-38,如完全生成氢氧化铁沉淀,则c(OH-)= mol·L-1=10-11 mol·L-1,则pH=3.0。
2.(1)MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O K3[Fe(CN)6](或KMnO4)
(2)3MnCO3 +2Fe3+ +3H2O===2Fe(OH)3 +3Mn2+ +3CO2 ↑
(3)6.5≤pH<8 (或6.5~8) (4)NH3、MnCO3
(5)蒸发结晶 趁热过滤
解析 碳酸锰铜矿主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO杂质,用硫酸酸浸,得到硫酸锰、硫酸铜、硫酸铁、硫酸亚铁的混合溶液,加入二氧化锰, Fe2+被氧化为Fe3+;加入MnCO3调节pH生成氢氧化铁沉淀;过滤后向溶液中通入氨气生成氢氧化铜沉淀,过滤,向滤液中加入NH4HCO3,生成MnCO3沉淀,MnCO3沉淀中加硫酸,得到硫酸锰溶液。(1)“氧化”时,二氧化锰把酸浸后的二价铁离子氧化为三价铁离子,离子方程式为MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O;二价铁和铁氰化钾相遇时会生成蓝色沉淀,可以用铁氰化钾来检验,另外二价铁有还原性,可以使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液来检验。(2)碳酸锰消耗三价铁离子水解产生的氢离子,导致氢离子浓度降低,促进三价铁离子水解,该反应的离子方程式为3MnCO3 +2Fe3+ +3H2O===2Fe(OH)3+3Mn2+ +3CO2 ↑。(3)铜离子完全沉淀时铜离子浓度小于或等于10-5 mol·L-1,此时c(OH-)= mol·L-1=10-7.5 mol·L-1,c(H+)= mol·L-1=10-6.5 mol·L-1,pH=6.5;锰离子开始沉淀时,c(OH-)= mol·L-1=10-6 mol·L-1,c(H+)= mol·L-1=10-8 mol·L-1,pH=8,故应控制pH的范围为6.5≤pH<8(或6.5~8)。(4)通过流程图可知,在加热赶氨时产生氨气可循环使用,另外在沉锰的时候生成MnCO3也可循环使用。(5)从MnSO4溶液中得到MnSO4·H2O的方法为:蒸发结晶、趁热过滤、洗涤、干燥。
3.(1)将“赤泥”粉碎 SiO2、TiO2
(2)将Fe2+氧化为Fe3+便于后续调节pH除去Fe3+ 99%
(3)
(4)Sc2(C2O4)3·H2O 2Sc2(C2O4)3+3O22Sc2O3+12CO2
解析 (1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;(2)氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度=10-11 mol/L,此时三价铁的浓度== mol/L=1.0×10-5 mol/L,则Fe3+的去除率=×100%=99%;(3)已知25 ℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4??Sc2(C2O4)3↓+6H+的平衡常数K==;(4)设有1 mol草酸钪晶体(462 g)在空气中受热,250 ℃时,减少的质量为462 g×19.5%=90 g,即250 ℃时,1 mol晶体失去5 mol水,则此时晶体的主要成分是Sc2(C2O4)3·H2O;550 ℃时,减少的质量为462 g×3.9%=18 g,则250~550 ℃,1 mol Sc2(C2O4)3·H2O失去1 mol水变为1 mol Sc2(C2O4)3;850 ℃时,剩余固体质量为462 g×(1-19.5%-3.9%-46.8%)=137.68 g≈138 g,由于M(Sc2O3)=138 g/mol,故可知550~850 ℃,1 mol Sc2(C2O4)3分解产生1 mol Sc2O3,反应的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
4.(1)分液漏斗和烧杯 降温
(2)2Re+7H2O2===2ReO+6H2O+2H+ 溶解高铼酸
(3)酸溶 (4)4AgCl+5N2H4·H2O===4Ag↓+N2↑+4N2H5Cl+5H2O 7.18
解析 (1)“操作Ⅰ”和“操作Ⅱ”是萃取分液,需用到的玻璃仪器是分液漏斗和烧杯;铵盐受热容易分解,故“操作x”选用降温结晶;(2)“氧化浸出”时,铼(Re)被双氧水氧化生成高铼酸,发生反应的离子方程式为2Re+7H2O2===2ReO+6H2O+2H+;高铼酸(HReO4)是白色片状结晶、微溶于冷水、溶于热水的一元强酸。将浸出温度控制在70 ℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有使高铼酸溶解的目的;(3)滤液主要含硝酸银,通过电解得纯银,副产物中含有稀硝酸,可重复使用到酸溶过程;(4)“还原”时,N2H4·H2O与AgCl反应生成N2H5Cl和一种无毒气体氮气,该反应的化学方程式为4AgCl+5N2H4·H2O===4Ag↓+N2↑+4N2H5Cl+5H2O;已知:①Ag+(aq)+2NH3(aq)??[Ag(NH3)2]+(aq) K(稳)=8.0×107;②AgCl(s)??Ag+(aq)+Cl-(aq) Ksp=1.25×10-10;①+②可得AgCl(s)+2NH3(aq)??[Ag(NH3)2]+(aq)+Cl-(aq) K=K稳×Ksp=8.0×107×1.25×10-10=0.01。设100 mL 6 mol·L-1NH3(aq)最多能溶解AgCl的物质的量为n mol;
K==0.01
n(AgCl)=0.05 mol,m(AgCl)=0.05 mol×143.5 g/mol≈7.18 g。
5.(1)Fe(OH)3 (2)酸性
(3)Mn2++H2O2+2OH-===MnO2↓+2H2O (4)2.7×10-2
(5)Sc2(C2O4)3·5H2OSc2O3+3CO2↑+3CO↑+5H2O Sc2O3+2OH-+3H2O===2Sc(OH)
解析 (1)根据流程中物质分离的信息,加入氨水调节pH=3目的是除去溶液中的Fe3+,故滤渣主要成分是Fe(OH)3。(2)根据方程式Sc3++3HTBPSc(TBP)3+3H+知洗脱时加入的X最好选择酸性溶液。(3)过程中Mn2+在碱性条件下被双氧水氧化生成MnO2的离子方程式为:Mn2++H2O2+2OH-===MnO2↓+2H2O。(4)根据草酸的电离平衡常数得:Ka1==5.0×10-2,Ka2==5.4×10-5,pH=2时c(H+)=1.0×10-2 mol·L-1,Ka1×Ka2==2.7×10-6,故=2.7×10-2。(5)Sc2(C2O4)3·5H2O中碳元素显+3价,Sc2(C2O4)3·5H2O灼烧分解时碳发生歧化反应,分解反应的化学方程式为:Sc2(C2O4)3·5H2OSc2O3+3CO2↑+3CO↑+5H2O。固体产物溶于NaOH溶液的离子方程式为:Sc2O3+2OH-+3H2O===2Sc(OH)。
6.(1)增大硫酸浓度或加热 SiO2
(2)Cu2++H2S===CuS↓+2H+ 2Fe3++H2S===2Fe2++S↓+2H+
(3)H2O2将Fe2+氧化为Fe3+,Ni(OH)2调节溶液pH除去Fe3+和Al3+ 4.7
(4)2.9×10-2 (5)%
解析 (1)为提高酸溶中镍的浸出率,可采取的措施为增大硫酸浓度或加热。根据分析可知,滤渣1为SiO2。(2)滤液1中能与H2S反应的物质有Fe3+、Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+、2Fe3++H2S===2Fe2++S↓+2H+。(3)氧化除杂中加入H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2的作用为调节溶液的pH除去Fe3+和Al3+。从表中可知,Al3+完全沉淀的pH为4.7,同时又不能使Ni2+沉淀,因此pH应调节为4.7~6之间。(4)设加入的NiF2的浓度为x mol/L,混合前两溶液的体积均为a L,反应后Mg2+浓度为10-5 mol/L,则反应掉的Mg2+的物质的量约为0.004a mol,根据离子方程式Mg2++2F-===MgF2↓,参与反应的F-物质的量为0.008a mol,则剩余F-物质的量为(2xa-0.008a) mol,混合后溶液中F-浓度为 mol/L= mol/L,根据Ksp(MgF2)=6.25×10-9,=0.025 mol/L,解得x=0.029。(5)已知消耗EDTA的物质的量为cV×10-3 mol,根据方程式Ni2++H2Y2-===NiY2-+2H+可知,消耗的Ni2+物质的量为cV×10-3 mol,则m g样品中含有NiSO4·H2O的物质的量为cV×10-2 mol,该样品的纯度为×100%=%
1.工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如图所示,该流程同时获取副产物Fe2O3和MnCl2。
已知:
Ⅰ.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25 ℃时,Ksp[Fe(OH)3]=1.0×10-38、
Ksp[Mn(OH)2]=4.0×10-14。
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有________,“气体”除水蒸气、HCl外还有________(均填化学式)。
(2)过程①中MnWO4参与反应的化学方程式为_____________________________;
FeWO4参与的反应中氧化剂与还原剂的物质的量之比为________。
(3)过程⑦在25 ℃时调pH,至少应调至________(当离子浓度等于1.0×10-5 mol·L-1时,可认为其已沉淀完全)。
2.以碳酸锰铜矿(主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO等杂质)为原料制备硫酸锰的一种工艺流程如下:
(1)“氧化”时,反应的离子方程式为____________________________________。
可用一种试剂检验氧化后的溶液中是否含有Fe2+,该试剂为________(写化学式)。
(2)加入MnCO3调节pH=3.3时可以将Fe3+转化为Fe(OH)3而除去,该反应的离子方程式为_________________________________________________________。
(3)“沉铜”时,若滤液中c(Mn2+)=0.21 mol·L-1,向其中缓慢通入氨气,为了使铜离子完全沉淀而又避免生成Mn(OH)2,应控制pH的范围为________。(已知:常温下,Ksp[Cu(OH)2]=1×10-20,Ksp[Mn(OH)2]=2.1×10-13,离子浓度小于或等于10-5 mol·L-1可视为沉淀完全)
(4)本工艺中可循环使用的物质是______________。
(5)结合图像,分析获得(MnSO4·H2O)晶体的“系列操作”步骤为:____________、____________,酒精洗涤,低温干燥。
3.钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为________________;滤渣Ⅰ的主要成分是________(填化学式)。
(2)“氧化”时加入足量H2O2的目的是_____________________________________
_____________________________________________________________________;
氧化后溶液中Fe3+浓度为0.001 mol·L-1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为________(忽略调pH前后溶液的体积变化)。
(3)已知25 ℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4??Sc2(C2O4)3↓+6H+,该反应的平衡常数K=________(用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。
已知:M[Sc2(C2O4)3·6H2O]=462 g· mol-1。
250 ℃时固体的主要成分是__________________(填化学式);550~850 ℃时反应的化学方程式为______________________________________________________。
4.一种从含银、铼的废催化剂(含Al2O3、MgO、K2O、Fe2O3和SiO2等)中回收银和铼的工艺流程如下:
已知:高铼酸(HReO4)是白色片状结晶、微溶于冷水、溶于热水的一元强酸。回答下列问题:
(1)“操作Ⅰ”和“操作Ⅱ”均需要用到的玻璃仪器有________;“操作x”选用________结晶(填“蒸发”或“降温”)。
(2)“氧化浸出”时,铼(Re)发生反应的离子方程式为__________________________________________________________________;
将浸出温度控制在70 ℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有__________________________________________________________________
_____________________________________________________________________。
(3)用石墨电极进行“电沉积银”,所得沉积液可循环到________中使用(填操作单元名称)。
(4)“氧化浸出”时有AgCl生成,“还原”时,N2H4·H2O与AgCl反应生成N2H5Cl和一种无毒气体,该反应的化学方程式为__________________________________。
若生成的AgCl用NH3(aq)溶解,则100 mL 6 mol·L-1NH3(aq)最多能溶解AgCl________ g(保留两位有效数字)。已知:Ag+(aq)+2NH3(aq)??[Ag(NH3)2]+(aq)的平衡常数称为稳定平衡常数,K(稳)=8.0×107;AgCl的Ksp=1.25×10-10。
5.氧化钪可提高计算机记忆元件性能,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:
已知:钪与铝类似,其氢氧化物具有两性;HTBP是钪元素的萃取剂,萃取发生的反应为Sc3++3HTBPSc(TBP)3+3H+。
(1)加入氨水调节pH=3,过滤,滤渣主要成分是________。
(2)上述洗脱剂X最好选择________(选填“酸性”、“碱性”或“中性”)溶液。
(3)过程中Mn2+生成MnO2的离子方程式___________________________________
_____________________________________________________________________。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25 ℃时pH=2的草酸溶液中=________。(25 ℃时,草酸电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)。
(5)“沉钪”后所得到的草酸钪晶体的化学式为Sc2(C2O4)3·5H2O,灼烧发生分解反应的化学方程式为_____________________________________________________,
写出固体产物溶于NaOH溶液的离子方程式________________________________
_____________________________________________________________________。
6.硫酸镍广泛应用于电镀、电池等工业。以红土镍矿(主要成分为NiO,含MgO、Al2O3、Fe2O3、FeOOH、Fe3O4、CuO、ZnO、SiO2等杂质)为原料制备,工艺流程如下。
已知:①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 6.3 1.8 3.4 8.9 6.2 6.9
沉淀完全的pH 8.3 3.2 4.7 10.9 8.2 8.9
②当离子完全沉淀时,c(Mn+)≤10-5 mol·L-1。
回答下列问题:
(1)为提高“酸溶”中镍的浸出率,可采取的措施有__________________________
(写一条即可)。“滤渣1”的主要成分为________。
(2)写出“硫化除铜”过程中涉及反应的离子方程式________________________、
__________________________________________________________________。
(3)“氧化除杂”中加入H2O2和Ni(OH)2的作用分别是_______________________
_____________________________________________________________________,
溶液的pH应调节为________~6之间。
(4)“氟化除杂”中,若c(Mg2+)=0.004 mol·L-1,取等体积的NiF2溶液加入体系中发生反应,则加入的NiF2溶液的浓度至少为________ mol·L-1。[已知Ksp(MgF2)=6.25×10-9]
(5)称取m g硫酸镍晶体(NiSO4·H2O,摩尔质量M g·mol-1)样品溶于水,配成250 mL溶液。量取25.00 mL用c mol·L-1EDTA(Na2H2Y)标准溶液滴定,反应为Ni2++H2Y2-===NiY2-+2H+。重复三次,平均消耗EDTA标准溶液V mL,则样品纯度为________。
参考答案
1.(1)Fe2O3 Cl2 (2)2MnWO4+2Na2CO3+O22Na2WO4+2MnO2+2CO2 1∶4 (3)3.0
解析 从精制黑钨矿中提取金属钨,由流程可知加入纯碱,通入空气焙烧,然后加水溶解、过滤,滤液1中含有Na2WO4,加入盐酸生成钨酸,加热分解生成WO3,加热条件下通入氢气,可生成W;滤渣1含有二氧化锰、氧化铁等,加入浓盐酸并加热,可生成氯气,溶液中含有氯化铁、氯化锰,调节溶液pH生成滤渣2为氢氧化铁,灼烧可生成氧化铁,滤液2含有氯化锰,加热蒸发得到副产物MnCl2,以此解答该题。(1)由以上分析可知流程中的“滤渣1”除MnO2外还有Fe2O3,“气体”除水蒸气、HCl外还有Cl2。(2)过程①中MnWO4参与反应的化学方程式为2MnWO4+2Na2CO3+O22Na2WO4+2CO2+2MnO2;FeWO4参与的反应中氧化剂为氧气,Fe化合价由+2价升高到+3价,则氧化剂与还原剂的物质的量之比为1∶4。(3)25 ℃时,Ksp[Fe(OH)3]=1.0×10-38,如完全生成氢氧化铁沉淀,则c(OH-)= mol·L-1=10-11 mol·L-1,则pH=3.0。
2.(1)MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O K3[Fe(CN)6](或KMnO4)
(2)3MnCO3 +2Fe3+ +3H2O===2Fe(OH)3 +3Mn2+ +3CO2 ↑
(3)6.5≤pH<8 (或6.5~8) (4)NH3、MnCO3
(5)蒸发结晶 趁热过滤
解析 碳酸锰铜矿主要成分为MnCO3、CuCO3,还含有Fe2O3、FeO杂质,用硫酸酸浸,得到硫酸锰、硫酸铜、硫酸铁、硫酸亚铁的混合溶液,加入二氧化锰, Fe2+被氧化为Fe3+;加入MnCO3调节pH生成氢氧化铁沉淀;过滤后向溶液中通入氨气生成氢氧化铜沉淀,过滤,向滤液中加入NH4HCO3,生成MnCO3沉淀,MnCO3沉淀中加硫酸,得到硫酸锰溶液。(1)“氧化”时,二氧化锰把酸浸后的二价铁离子氧化为三价铁离子,离子方程式为MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O;二价铁和铁氰化钾相遇时会生成蓝色沉淀,可以用铁氰化钾来检验,另外二价铁有还原性,可以使酸性高锰酸钾溶液褪色,可以用酸性高锰酸钾溶液来检验。(2)碳酸锰消耗三价铁离子水解产生的氢离子,导致氢离子浓度降低,促进三价铁离子水解,该反应的离子方程式为3MnCO3 +2Fe3+ +3H2O===2Fe(OH)3+3Mn2+ +3CO2 ↑。(3)铜离子完全沉淀时铜离子浓度小于或等于10-5 mol·L-1,此时c(OH-)= mol·L-1=10-7.5 mol·L-1,c(H+)= mol·L-1=10-6.5 mol·L-1,pH=6.5;锰离子开始沉淀时,c(OH-)= mol·L-1=10-6 mol·L-1,c(H+)= mol·L-1=10-8 mol·L-1,pH=8,故应控制pH的范围为6.5≤pH<8(或6.5~8)。(4)通过流程图可知,在加热赶氨时产生氨气可循环使用,另外在沉锰的时候生成MnCO3也可循环使用。(5)从MnSO4溶液中得到MnSO4·H2O的方法为:蒸发结晶、趁热过滤、洗涤、干燥。
3.(1)将“赤泥”粉碎 SiO2、TiO2
(2)将Fe2+氧化为Fe3+便于后续调节pH除去Fe3+ 99%
(3)
(4)Sc2(C2O4)3·H2O 2Sc2(C2O4)3+3O22Sc2O3+12CO2
解析 (1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;(2)氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度=10-11 mol/L,此时三价铁的浓度== mol/L=1.0×10-5 mol/L,则Fe3+的去除率=×100%=99%;(3)已知25 ℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4??Sc2(C2O4)3↓+6H+的平衡常数K==;(4)设有1 mol草酸钪晶体(462 g)在空气中受热,250 ℃时,减少的质量为462 g×19.5%=90 g,即250 ℃时,1 mol晶体失去5 mol水,则此时晶体的主要成分是Sc2(C2O4)3·H2O;550 ℃时,减少的质量为462 g×3.9%=18 g,则250~550 ℃,1 mol Sc2(C2O4)3·H2O失去1 mol水变为1 mol Sc2(C2O4)3;850 ℃时,剩余固体质量为462 g×(1-19.5%-3.9%-46.8%)=137.68 g≈138 g,由于M(Sc2O3)=138 g/mol,故可知550~850 ℃,1 mol Sc2(C2O4)3分解产生1 mol Sc2O3,反应的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
4.(1)分液漏斗和烧杯 降温
(2)2Re+7H2O2===2ReO+6H2O+2H+ 溶解高铼酸
(3)酸溶 (4)4AgCl+5N2H4·H2O===4Ag↓+N2↑+4N2H5Cl+5H2O 7.18
解析 (1)“操作Ⅰ”和“操作Ⅱ”是萃取分液,需用到的玻璃仪器是分液漏斗和烧杯;铵盐受热容易分解,故“操作x”选用降温结晶;(2)“氧化浸出”时,铼(Re)被双氧水氧化生成高铼酸,发生反应的离子方程式为2Re+7H2O2===2ReO+6H2O+2H+;高铼酸(HReO4)是白色片状结晶、微溶于冷水、溶于热水的一元强酸。将浸出温度控制在70 ℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有使高铼酸溶解的目的;(3)滤液主要含硝酸银,通过电解得纯银,副产物中含有稀硝酸,可重复使用到酸溶过程;(4)“还原”时,N2H4·H2O与AgCl反应生成N2H5Cl和一种无毒气体氮气,该反应的化学方程式为4AgCl+5N2H4·H2O===4Ag↓+N2↑+4N2H5Cl+5H2O;已知:①Ag+(aq)+2NH3(aq)??[Ag(NH3)2]+(aq) K(稳)=8.0×107;②AgCl(s)??Ag+(aq)+Cl-(aq) Ksp=1.25×10-10;①+②可得AgCl(s)+2NH3(aq)??[Ag(NH3)2]+(aq)+Cl-(aq) K=K稳×Ksp=8.0×107×1.25×10-10=0.01。设100 mL 6 mol·L-1NH3(aq)最多能溶解AgCl的物质的量为n mol;
K==0.01
n(AgCl)=0.05 mol,m(AgCl)=0.05 mol×143.5 g/mol≈7.18 g。
5.(1)Fe(OH)3 (2)酸性
(3)Mn2++H2O2+2OH-===MnO2↓+2H2O (4)2.7×10-2
(5)Sc2(C2O4)3·5H2OSc2O3+3CO2↑+3CO↑+5H2O Sc2O3+2OH-+3H2O===2Sc(OH)
解析 (1)根据流程中物质分离的信息,加入氨水调节pH=3目的是除去溶液中的Fe3+,故滤渣主要成分是Fe(OH)3。(2)根据方程式Sc3++3HTBPSc(TBP)3+3H+知洗脱时加入的X最好选择酸性溶液。(3)过程中Mn2+在碱性条件下被双氧水氧化生成MnO2的离子方程式为:Mn2++H2O2+2OH-===MnO2↓+2H2O。(4)根据草酸的电离平衡常数得:Ka1==5.0×10-2,Ka2==5.4×10-5,pH=2时c(H+)=1.0×10-2 mol·L-1,Ka1×Ka2==2.7×10-6,故=2.7×10-2。(5)Sc2(C2O4)3·5H2O中碳元素显+3价,Sc2(C2O4)3·5H2O灼烧分解时碳发生歧化反应,分解反应的化学方程式为:Sc2(C2O4)3·5H2OSc2O3+3CO2↑+3CO↑+5H2O。固体产物溶于NaOH溶液的离子方程式为:Sc2O3+2OH-+3H2O===2Sc(OH)。
6.(1)增大硫酸浓度或加热 SiO2
(2)Cu2++H2S===CuS↓+2H+ 2Fe3++H2S===2Fe2++S↓+2H+
(3)H2O2将Fe2+氧化为Fe3+,Ni(OH)2调节溶液pH除去Fe3+和Al3+ 4.7
(4)2.9×10-2 (5)%
解析 (1)为提高酸溶中镍的浸出率,可采取的措施为增大硫酸浓度或加热。根据分析可知,滤渣1为SiO2。(2)滤液1中能与H2S反应的物质有Fe3+、Cu2+,离子方程式为Cu2++H2S===CuS↓+2H+、2Fe3++H2S===2Fe2++S↓+2H+。(3)氧化除杂中加入H2O2将Fe2+氧化为Fe3+,加入Ni(OH)2的作用为调节溶液的pH除去Fe3+和Al3+。从表中可知,Al3+完全沉淀的pH为4.7,同时又不能使Ni2+沉淀,因此pH应调节为4.7~6之间。(4)设加入的NiF2的浓度为x mol/L,混合前两溶液的体积均为a L,反应后Mg2+浓度为10-5 mol/L,则反应掉的Mg2+的物质的量约为0.004a mol,根据离子方程式Mg2++2F-===MgF2↓,参与反应的F-物质的量为0.008a mol,则剩余F-物质的量为(2xa-0.008a) mol,混合后溶液中F-浓度为 mol/L= mol/L,根据Ksp(MgF2)=6.25×10-9,=0.025 mol/L,解得x=0.029。(5)已知消耗EDTA的物质的量为cV×10-3 mol,根据方程式Ni2++H2Y2-===NiY2-+2H+可知,消耗的Ni2+物质的量为cV×10-3 mol,则m g样品中含有NiSO4·H2O的物质的量为cV×10-2 mol,该样品的纯度为×100%=%
同课章节目录
