2024届高三化学二轮复习 反应原理与物质结构综合题(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习 反应原理与物质结构综合题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 565.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 18:45:24 | ||
图片预览



文档简介
综合题突破3 反应原理与物质结构综合题
一、速率、平衡——物质结构综合题
1.(2023·山西一模)碳及其化合物的资源化利用在生产、生活中具有重要的意义。回答下列问题:
Ⅰ.汽车尾气的处理:2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH=-620.4 kJ·mol-1。
该反应的反应历程及反应物和生成物的相对能量如下图所示:
(1)反应________(填“①”“②”或“③” )是该反应的决速步骤。
(2)写出反应②的热化学方程式__________________________________________
____________________________________________________________________。
Ⅱ.向一恒容密闭容器中,充入1 mol CO气体和一定量的NO气体发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g),下图是3种投料比[n(CO)∶n(NO)分别为2∶1、1∶1、1∶2]时,反应温度对CO平衡转化率的影响曲线。
(3)图中表示投料比为2∶1的曲线的是________。
(4)m点NO的逆反应速率________n点NO的正反应速率(填“>”“<”或“=”)。
(5)T1条件下,起始时容器内气体的总压强为3 MPa,则p点时该反应的平衡常数Kp=________ (MPa)-1(保留两位小数,以分压表示,气体分压=总压 ×物质的量分数);p点时,再向容器中充入NO和CO2,使二者分压均增大为原来的2倍,则CO的转化率________(填“增大”“不变”或“减小”)。
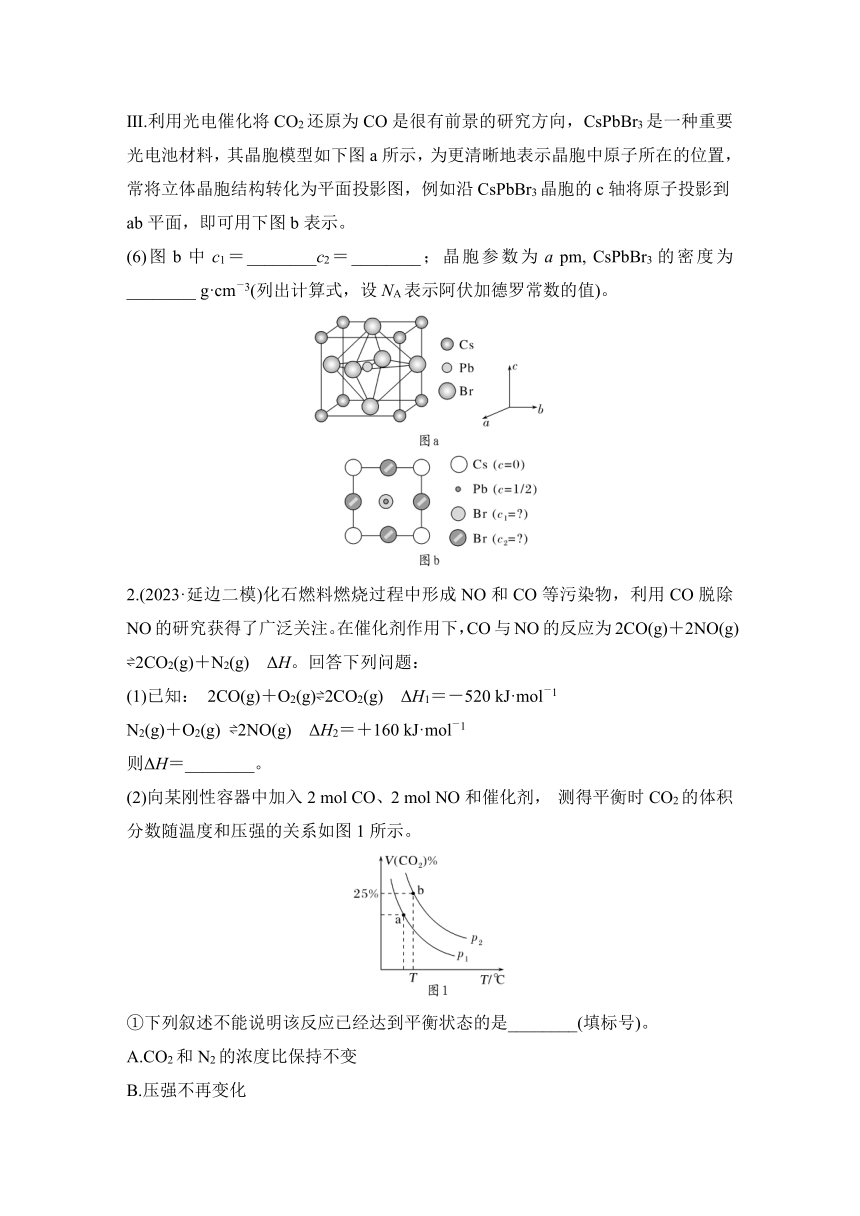
Ⅲ.利用光电催化将CO2还原为CO是很有前景的研究方向,CsPbBr3是一种重要光电池材料,其晶胞模型如下图a所示,为更清晰地表示晶胞中原子所在的位置,常将立体晶胞结构转化为平面投影图,例如沿CsPbBr3晶胞的c轴将原子投影到ab平面,即可用下图b表示。
(6)图b中c1=________c2=________;晶胞参数为a pm, CsPbBr3的密度为________ g·cm-3(列出计算式,设NA表示阿伏加德罗常数的值)。
2.(2023·延边二模)化石燃料燃烧过程中形成NO和CO等污染物,利用CO脱除NO的研究获得了广泛关注。在催化剂作用下,CO与NO的反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH。回答下列问题:
(1)已知: 2CO(g)+O2(g) 2CO2(g) ΔH1=-520 kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+160 kJ·mol-1
则ΔH=________。
(2)向某刚性容器中加入2 mol CO、2 mol NO和催化剂, 测得平衡时CO2的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明该反应已经达到平衡状态的是________(填标号)。
A.CO2和N2的浓度比保持不变
B.压强不再变化
C.混合气体的密度不再变化
D.混合气体的摩尔质量不再变化
②压强p1________p2(填“>”或“<”, 下同), a、b两点的平衡常数Ka________Kb。
③b点CO的转化率为________%(保留一位小数),b点的Kp=________(用含p2的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 ×体积分数)。
(3)金属锌作催化剂,在相同时间内,以相同投料比反应时,容器中CO2的物质的量随温度变化的曲线如图2。当温度高于T ℃时,n(CO2)下降的原因可能是___________________________________________________________________
____________________________________________________________________
(答出一点即可,不考虑物质的稳定性)。
(4)硫与催化剂锌所形成化合物晶体的晶胞如图3所示。在该晶胞中原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0); b为(,0,);c为(,,0)。则d的坐标参数为________。已知该晶胞的密度为ρ g·cm-3,则其中两个最近S原子之间的距离为__________ pm(列出计算式即可)。
3.(2023·安庆二模)乙烯是重要的有机化学原料,工业上可利用乙烷脱氢制备乙烯。
(1)乙烷裂解为乙烯为自由基反应,其可能的引发反应及对应化学键的解离能如下:
可能的引发反应 有关键的解离能(kJ/mol)
C2H6(g)→C2H5·(g)+H·(g) 410
C2H6(g)→ 2CH3·(g) 368
根据表格信息,乙烷裂解引发的反应主要为_________________________________
_____________________________________________________________________。
(2)经过引发的后续反应历程为(已略去链终止过程):
……
C2H5·(g)→C2H4(g)+H·(g) ΔH1
H·(g)+C2H6(g)→C2H5·(g)+H2(g) ΔH2
①C2H4(g)+H2(g) →C2H6(g)的ΔH=__________(用含ΔH1和ΔH2的式子表示)。
②上述历程中“……”所代表的反应为__________________________________。
(3)CH3·中的单电子不能占据杂化轨道,则CH3·中碳原子的杂化方式为________________。
(4)乙烷裂解中主要发生的反应及其在不同温度下的平衡常数如下表:
反应 1 100 K 1 300 K 1 500 K
Ⅰ.C2H6??C2H4+H2 1.6 18.9 72.0
Ⅱ.C2H6??C2H4+CH4 60.9 108.7 165.8
Ⅲ.C2H4??C2H2+H2 0.015 0.33 3.2
Ⅳ.C2H2??2C+H2 6.5×107 1.5×106 1.0×105
①当裂解反应达到平衡状态时,体系将会产生大量积碳。由表中数据分析,平衡时混合气体中______________(填化学式)的百分含量最大,原因是_____________________________________________________________________
_____________________________________________________________________。
②为提高乙烯的产率,工业生产的适宜反应条件为________(填标号)。
A.高温 较长的反应时间
B.高温 较短的反应时间
C.低温 较长的反应时间
D.低温 较短的反应时间
③在某温度下投入x mol C2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为m mol、n mol、r mol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp=__________(以分压表示,分压=总压×物质的量分数)。
(5)工业上制备乙烯常使用Ni-Cr-Fe合金炉,某Ni-Cr-Fe合金的晶胞结构如图所示,●表示Ni原子,○表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中△位置),则该合金可表示为__________________(填化学式)。
二、速率、平衡——能量变化综合题
4.(2023·湖北5月联考)CO2的资源化利用有利于碳中和目标的实现。
回答下列问题:
(1)将CO2催化加氢转化为CH3OCH3是资源化利用的途径之一,适当温度下,在催化剂存在的CO2加氢反应器中,主要反应有:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41 kJ·mol-1 K1
ⅱ.2CO(g)+4H2(g) H3OCH3(g)+H2O(g) ΔH2=-204 kJ·mol-1 K2
ⅲ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH3 K3
①ΔH3=__________ kJ·mol-1,K3=__________(用含K1、K2的式子表示)。
②将1 mol CO2、3 mol H2充入2 L的刚性容器中,测得反应进行到10 min时,CO2的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
则三种催化剂条件下的反应中,T2温度下活化能最小的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”),a点对应反应的v(CO2)=________ mol·L-1·min-1;转化率b>c的原因可能是________(填选项字母)。
A.b点平衡后升温平衡逆向移动
B.温度过高导致催化剂Y催化活性降低,c点时反应还没有达到平衡
C.b点不是平衡态c点是平衡态
(2)CO2与H2也可用于制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。T K时,向压强为9 MPa的恒压容器中充入3 mol CO2和7 mol H2,达到平衡时,CH3OH的体积分数为。
①写出能提高CH3OH产率的两种方法:____________________________________
_____________________________________________________________________。
②CO2和H2的平衡转化率之比为______________;T K时,该反应的平衡常数KP=________ (MPa)-2(以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
5.(2023·全国甲卷)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)===2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g)===2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________ kJ·mol-1,平衡常数K3=__________(用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。图中300 K的曲线是________(填“a”或“b”)。300 K、60 s时MO+的转化率为_____________________________________________________(列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是________(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线________(填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD________CHD2OH(填“>”“<”或“=”)。若MO+与CHD3反应,生成的氘代甲醇有________种。
6.(2023·衡水二中三调)环己烯是工业常用的化工品。工业上通过热铂基催化剂重整将环己烷脱氢制备环己烯,化学反应为C6H12(g)??C6H10(g)+H2(g) ΔH。
(1)几种共价键的键能数据如下:
共价键 H—H C—H C—C C===C
键能/(kJ· mol-1) 436 413 348 615
ΔH=________kJ· mol-1。
(2)在恒温恒容密闭容器中充入环己烷气体,仅发生上述反应。下列叙述错误的是___________________(填字母)。
A.气体平均摩尔质量不随时间变化时反应达到平衡状态
B.平衡后再充入C6H12气体,平衡向右移动,转化率增大
C.加入高效催化剂,单位时间内C6H10的产率可能会增大
D.增大固体催化剂的质量,一定能提高正、逆反应速率
(3)环己烷的平衡转化率和环己烯的选择性(选择性=)随温度的变化如图所示。
①随着温度升高,环己烷平衡转化率增大的原因是______________________。
随着温度升高,环己烯的选择性变化的可能原因是________(填字母)。
A.平衡向逆反应方向移动
B.环己烷裂解发生副反应
C.环己烯易发生聚合反应
D.催化剂的选择性增大
②当温度高于600 ℃时,可能的副产物有__________________________________
______________________________________________(任写一种结构简式)。
(4)在873 K、100 kPa条件下,向反应器中充入氩气和环己烷的混合气体,仅发生反应:C6H12(g) C6H10(g)+H2(g)。
①环己烷的平衡转化率随的增大而升高,其原因是_____________________________________________________________________
_____________________________________________________________________。
②当=1∶3时,达到平衡所需时间为20 min,环己烷的平衡转化率为,则环己烷分压的平均转化速率为________ kPa·min-1。该环己烷脱氢反应的压强平衡常数Kp=________ kPa。(均保留2位小数)注:用分压计算的平衡常数为压强平衡常数(Kp),分压=总压×物质的量分数。
(5)“)”表示铂基催化剂,“*”表示吸附在该催化剂表面,环己烷脱氢反应的机理如下,请补充基元反应③___________________________________;
7.(2023·全国甲卷)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)===2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g)===2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________ kJ·mol-1,平衡常数K3=________(用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。图中300 K的曲线是________(填“a”或“b”)。300 K、60 s时MO+的转化率为_____________(列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是________(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线________(填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD________CHD2OH(填“>”“<”或“=”)。若MO+与CHD3反应,生成的氘代甲醇有________种。
命题角度3 反应热与离子平衡综合题
8.(2023·山东卷)一定条件下,水气变换反应CO+H2O??CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH??CO+H2O(快)
Ⅱ.HCOOH??CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=____________(用含ΔH1、ΔH2的代数式表示)。
(2)反应Ⅰ正反应速率方程为:v=kc(H+)·c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为x mol·L-1 时,H+浓度为______________________________mol·L-1,此时反应Ⅰ正反应速率v=________ mol·L-1·h-1(用含Ka、x和k的代数式表示)。
(3)T3温度下,在密封石英管内完全充满1.0 mol·L-1 HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70 mol·L-1、0.16 mol·L-1,反应Ⅱ达平衡时,测得H2的浓度为y mol·L-1。体系达平衡后=________(用含y的代数式表示,下同),反应Ⅱ的平衡常数为_______________。
相同条件下,若反应起始时溶液中同时还含有0.10 mol·L-1 盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是________(填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度________(填“增大”“减小”或“不变”),的值________(填“增大”“减小”或“不变”)。
三、反应原理综合题
7.(2023·福州八中质检)我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。
Ⅰ.利用温室气体CO2和CH4制备燃料合成器,计算机模拟单个二氧化碳分子与甲烷分子的反应历程如图所示:
已知:1 eV为1电子伏特,表示一个电子(所带电量为-1.6×10-19C)经过1伏特的电位差加速后所获得的动能。
(1)制备合成气CO、H2总反应的热化学方程式为____________________________。
(2)向密闭容器中充入等体积的CO2和CH4,测得平衡时压强对数lgp(CO2)和lgp(H2)的关系如图所示。(压强的单位为:MPa)
①T1____________T2(填“>”“<”或“=”)。
②温度为T1时,该反应的压强平衡常数Kp=____________MPa2。
Ⅱ.丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应:
反应i:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1=-235 kJ/mol
反应ii:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) ΔH2=-2 742 kJ/mol
回答下列问题:
(3)在刚性绝热容器中发生反应i,下列能说明已达到平衡状态的有____________(填标号)。
A.每断裂1 mol O===O键,同时生成4 mol O—H键
B.容器内温度不再变化
C.混合气体的密度不再变化
D.n(C3H8)=n(C3H6)
(4)在压强恒定为100 kPa条件下,按起始投料n(C3H8)∶n(O2)=2∶1,匀速通入反应器中在不同温度下反应相同时间,测得丙烷和氧气的转化率如图。
①线________(填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1 K后曲线L2随温度升高而降低的原因为_____________________________________________________________________。
③当温度高于____________(填“T1”或“T2”)时,可判断反应ii不再发生。
Ⅲ.常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
(5)若某次捕捉后得到pH=11的溶液,则溶液中c(CO)∶c(HCO)=____________(常温下Ka1(H2CO3)=4.5×10-7、Ka2(H2CO3)=4.7×10-11)。
(6)现有46.6 g BaSO4固体,每次用1 L 1.3 mol/L Na2CO3溶液处理,若使BaSO4中的SO全部转化到溶液中,需要反复处理____________次。(已知:Ksp(BaCO3)=2.5×10-9、Ksp(BaSO4)=1.0×10-10)
参考答案
1.(1)① (2)N2O2(g)+CO(g)===CO2(g)+N2O(g) ΔH=-513.2 kJ/mol (3)D (4)> (5)4.44 不变 (6)0
解析 (1)反应的活化能越大,反应速率越慢,慢反应是化学反应的决速步骤,由图可知,反应①的活化能最大,反应速率最慢,则反应①是该反应的决速步骤;(2)由图可知,反应①为吸热反应,反应ΔH1 =+199.4 kJ/mol,反应③为放热反应,反应ΔH3 =-306.6 kJ/mol,由盖斯定律可知反应①+②+③得到总反应,则反应②的焓变ΔH2 =ΔH-ΔH1-ΔH3=(-620.4 kJ/mol)-(+199.4 kJ/mol)-(-306.6 kJ/mol)=-513.2 kJ/mol,反应的热化学方程式为N2O2(g)+CO(g)===CO2(g)+N2O(g) ΔH=-513.2 kJ/mol;(3)恒容密闭容器中,投料比n(CO)∶n(NO)越小相当于一氧化氮的浓度越大,增大一氧化氮的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则n(CO)∶n(NO)分别投料比为2∶1、1∶1、1∶2的反应中,投料比为2∶1的一氧化氮浓度最小,一氧化碳转化率最小,则图中表示投料比为2∶1的曲线是D;(4)恒容密闭容器中,投料比n(CO)∶n(NO)越小相当于一氧化氮的浓度越大,增大一氧化氮的浓度,反应速率加快,平衡向正反应方向移动,一氧化碳的转化率增大,则图中表示投料比为1∶1、1∶2的曲线分别是B、A,所以m点一氧化氮的浓度大于n点,反应速率大于n点;(5)平衡常数为温度函数,温度不变,平衡常数不变,所以图中T1条件下,m点和p点的平衡常数相等,由图可知,m点一氧化碳的转化率为80%,设起始一氧化碳和一氧化氮的物质的量分别为1 mol和2 mol,由题意可建立如下三段式:
起始时容器内气体的总压强为3 MPa,由物质的量之比等于气体压强之比可得平衡时气体压强为=2.6 MPa;则反应的平衡常数Kp=≈4.44;p点时,再向容器中充入一氧化氮和二氧化碳,使二者分压均增大为原来的2倍,反应的浓度熵Q=≈4.44=Kp,则化学平衡不移动,一氧化碳的转化率不变;(6)由题给信息可知,晶胞模型中位于顶点的铯原子、位于体心的铅原子中平面投影图b中在c轴的坐标分别为0、,则晶胞模型中位于上下面心的溴原子在c轴的坐标c1为0、位于前后和左右面心的溴原子在c轴的坐标c1为;由晶胞结构可知,位于体内的铅原子个数为1可知,晶胞中CsPbBr3的个数为1,设晶体的密度为d g/cm3,由晶胞的质量公式可得:=10-30a3d,解得d=。
2.(1)-680 kJ·mol-1 (2)①AC ②< > ③44.4%
(3)随温度升高,催化剂活性降低,反应速率减慢,相同时间生成的CO2的物质的量减少(反应达平衡,温度升高,平衡逆向移动,CO2的物质的量减小)
(4)(1,,) ××1010
解析 (1)①2CO(g)+O2(g) ??2CO2(g) ΔH1=-520 kJ·mol-1;②N2(g)+O2(g) ??2NO(g) ΔH2=+160 kJ·mol-1 ,由盖斯定律:①-②得2CO(g)+2NO(g) ?? 2CO2(g)+N2(g) ΔH=- 520 kJ·mol-1-160 kJ·mol-1=-680 kJ·mol-1;(2)①A.2CO(g)+2NO(g) ?? 2CO2(g)+N2(g),CO2和N2的浓度比始终保持不变,故A选;B.反应为气体体积减小的反应,压强不再变化,说明反应达到平衡状态,故B不选;C.反应前后均为气体,总质量不变,混合气体的密度始终保持不变,当气体的密度不再变化时,不能说明反应达到平衡状态,故C选;D.反应前后均为气体,总质量不变,但反应后物质的量减小,反应混合气体的摩尔质量不再变化,说明反应达到平衡状态,故D不选;②由图1可得:相同温度下,p2的二氧化碳含量大,结合方程式,加压,平衡正向移动,压强p1< p2,由a到b温度升高,对于放热反应,平衡逆向移动,平衡常数减小, a、b两点的平衡常数Ka>Kb。
③
b点二氧化碳的体积分数为:
×100%=25% ,x= mol,b点CO的转化率为×100%= 44.4%,平衡时,CO(g)为 mol,NO(g)为 mol, CO2(g)为 mol,N2(g)为 mol,平衡时总物质的量为 mol,b点的Kp= =;(3)容器中CO2的物质的量随温度变化的曲线如图2,当温度高于T ℃时,n(CO2)下降的原因可能是随温度升高,催化剂活性降低,反应速率减慢,相同时间生成的CO2的物质的量减少(反应达平衡,温度升高,平衡逆向移动,CO2的物质的量减小)(答出一点即可,不考虑物质的稳定性)。(4)在该晶胞中,Zn的配位数为原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0, 0);b为(,0,);c为(,,0),a为原点,b、c、d为三个面的面心,则d的坐标参数为(1,,)。晶胞中Zn原子数目=8×+6×=4,S的原子数目为4,所以R的化学式为ZnS,晶胞的质量m= g,晶胞的密度ρ,则晶胞棱长= cm,两个最近S2-之间的距离为面对角线的一半,则其中两个最近S原子之间的距离为××1010 pm。
3.(1)C2H6(g)→2CH3·(g)
(2)①-(ΔH1+ΔH2)或-ΔH1 -ΔH2 ②CH3·(g)+C2H6(g)→C2H5·(g)+CH4(g)
(3)sp2
(4)①H2 反应Ⅳ的平衡常数远大于其它反应,体系主要得到碳和氢气,其他气体含量很少 ②B ③
(5)Ni2Cr3Fe2
解析 (1)解离能越小,发生的可能性越大,所以乙烷裂解引发的反应主要为C2H6(g)→2CH3·(g);(2)①C2H5·(g)→C2H4(g)+H·(g) ΔH1②H·(g)+C2H6(g)→C2H5·(g)+H2(g) ΔH2,由盖斯定律①+②得C2H6(g)→C2H4(g)+H2(g),所以C2H4(g)+H2(g)→C2H6(g),ΔH=-(ΔH1+ΔH2)或-ΔH1 -ΔH2;②由解离能得大小可判断主要生成甲基自由基,所以甲基自由基要转化为乙基自由基才能使反应生成乙烯,所以历程中“……”所代表的反应为CH3·(g)+C2H6(g)→C2H5·(g)+CH4(g);(3)CH3·结构中中心原子周围有3对电子对,杂化方式为sp2;(4)①反应Ⅳ的平衡常数远大于其它反应,体系主要得到碳和氢气,其他气体含量很少,所以平衡时混合,气体中H2的百分含量最大;②工业生产Ⅰ、Ⅱ反应生成乙烯,温度升高平衡常数增大所以需要高温,又因为Ⅲ、Ⅳ会消耗乙烯所以时间不宜过长,故选B;③根据氢元素守恒:n(H2)=(3x-3m-2n-2r) mol,n(总)=(3x-3m-2n-2r+m+n+r) mol=(3x-2m-n-r) mol,KP==;(5)晶胞中Fe原子个数是2,Ni原子个数是8×+4×=2,Ni、Fe所形成的八面体空隙中心共有6个(10×+1=6),由于只填充了一半的空隙,因此该合金可表示为Ni2Cr3Fe2。
4.(1)①-122 K·K2 ②Ⅰ 0.03 AB
(2)①在较低温度下进行反应,不断分离出产品,在较高压强下进行反应等(任答两条) ②7∶9 1.8
解析 (1)①由盖斯定律知,2×ⅰ+ⅱ得:2CO2(g)+6H2(g)??CH3OCH3(g)+3H2O(g) ΔH3=-122 kJ·mol-1。K3=K·K2。②不同催化剂、相同温度下经过相同时间时,途径Ⅰ中CO2的转化率最高,说明途径Ⅰ反应速率最大,相应地活化能最小;a点对应反应的v(CO2)==0.03 mol·(L·min)-1。因总反应是放热反应,b点转化率最高,处于平衡状态,温度高反应速率快,达到平衡所需要的时间较少,而温度高不利于平衡向右进行,故转化率降低;当温度过高有可能导致催化剂催化活性降低,从而导致反应速率降低,在10 min时反应还没有达到平衡,故转化率低于b点,A、B项正确。
(2)①正反应是气体分子数目减少的放热反应,低温、高压有利于平衡向右移动,不断分离出产品也有利于平衡向右进行,从而提高CH3OH的产率。
=,解得x=2。CO2的转化率为,氢气的转化率为,二者转化率之比为7∶9;平衡时,p(CH3OH)=p(H2O)=×9 MPa=3 MP,同理可求出p(CO2)=p(H2)=1.5 MPa,KP=≈1.8(MPa)-2。
5.(1)-307 或
(2)b ×100%或×100%
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
解析 (1)根据盖斯定律可知,反应③=(反应②-①),所以对应ΔH3=(ΔH2-ΔH1)=(-329 kJ·mol-1-285 kJ·mol-1)=-307 kJ·mol-1;根据平衡常数表达式与热化学方程式之间的关系可知,对应化学平衡常数K3=或;(2)根据图示信息可知,纵坐标表示-lg,即与MO+的微粒分布系数成反比,与M+的微粒分布系数成正比。则同一时间内,b曲线生成M+的物质的量浓度比a曲线的小,证明化学反应速率慢,又因同一条件下降低温度化学反应速率减慢,所以曲线b表示的是300 K条件下的反应;根据上述分析结合图像可知,300 K、60 s时-lg=0.1,则=10-0.1,利用数学关系式可求出c(M+)=(100.1-1)c(MO+),根据反应MO++CH4===M++CH3OH可知,生成的M+即为转化的MO+,则MO+的转化率为×100%或×100%;(3)(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ;(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c;(ⅲ)MO+与CH2D2反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD<CHD2OH;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH共2种。
6.(1)+123 (2)BD
(3)①正反应是吸热反应,升高温度,平衡正向移动 BC
②、、等
(4)①恒压条件下,增大Ar的物质的量,相当于减小压强,平衡正向移动 ②2.92 66.67
(5)
解析 (1)焓变=反应物的总键能-生成物的总键能,C6H12(g)??C6H10(g)+H2(g) ΔH=348×6+413×12-(348×5+615+413×10+436)=+123 kJ· mol-1;(2)A.反应过程中气体总质量不变,气体物质的量增大,气体平均摩尔质量是变量,所以气体平均摩尔质量不随时间变化时反应达到平衡状态,故A正确;B.平衡后再充入C6H12气体,相当于增大压强,转化率减小,故B错误;C.加入高效催化剂,反应速率加快,单位时间内C6H10的产率可能会增大,故C正确; D.催化剂通过参与化学反应改变反应历程,加快反应速率,增大固体催化剂的质量,如果不能增大接触面积,不一定能提高正、逆反应速率,故D错误;选BD;(3)①C6H12(g)??C6H10(g)+H2(g)正反应吸热,升高温度平衡正向移动,所以随着温度升高环己烷平衡转化率增大。A.C6H12(g)??C6H10(g)+H2(g)正反应吸热,升高温度平衡正向移动,故不选A;B.环己烷裂解发生副反应,使环己烷平衡转化率增大而环己烯的选择性降低,故选B;C.环己烯易发生聚合反应,环己烯产率降低,使环己烯的选择性降低,故选C;D.若催化剂的选择性增大,生成的环己烯增多,使环己烯的选择性增大,与题图不符,故不选D;选BC;②当温度高于600 ℃时,环己烷脱氢,可能的副产物有、、等;(4)①恒压条件下,增大Ar的物质的量,相当于减小压强,平衡正向移动,环己烷的平衡转化率随的增大而升高;②当=1∶3时,初始时,环己烷的分压为× 100 kPa=75 kPa,达到平衡所需时间为20 min,环己烷的平衡转化率为,
达到平衡时环己烷的分压为100×= kPa、环己烯的分压为 kPa、氢气的分压为 kPa ,则环己烷分压的平均转化速率为=2.92 kPa·min-1。该环己烷脱氢反应的压强平衡常数Kp==66.67 kPa;(5)根据基元反应④,可知基元反应③为
。
7. (1)-307 或
(2)b ×100%或×100%
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
解析 (1)根据盖斯定律可知,反应③=(反应②-①),所以对应ΔH3=(ΔH2-ΔH1)=(-329 kJ·mol-1-285 kJ·mol-1)=-307 kJ·mol-1;根据平衡常数表达式与热化学方程式之间的关系可知,对应化学平衡常数K3=或;(2)根据图示信息可知,纵坐标表示-lg,即与MO+的微粒分布系数成反比,与M+的微粒分布系数成正比。则同一时间内,b曲线生成M+的物质的量浓度比a曲线的小,证明化学反应速率慢,又因同一条件下降低温度化学反应速率减慢,所以曲线b表示的是300 K条件下的反应;根据上述分析结合图像可知,300 K、60 s时-lg=0.1,则=10-0.1,利用数学关系式可求出c(M+)=(100.1-1)c(MO+),根据反应MO++CH4===M++CH3OH可知,生成的M+即为转化的MO+,则MO+的转化率为×100%或×100%;(3)(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ;(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c;(ⅲ)MO+与CH2D2反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD<CHD2OH;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH共2种。
8.(1)ΔH2-ΔH1 (2) kx (3) b 减小 不变
解析 (1)根据盖斯定律,反应 Ⅱ-反应 Ⅰ=水气变换反应,故水气变换反应的焓变ΔH=ΔH2-ΔH1;(2)T1温度时,HCOOH建立电离平衡:
Ka=,c(HCOO-)=c(H+),故c(H+)=。v=kc(H+)·c(HCOOH)=kx。
(3)t1时刻时,c(CO)达到最大值,说明此时反应 Ⅰ达平衡状态。此时
故t1时刻c(HCOOH)=1.0-0.70-0.16=0.14 mol·L-1,K(Ⅰ)===5。t1时刻→反应Ⅱ达平衡过程,
则c(H2)=b+0.16=y,b=(y-0.16) mol·L-1,c(HCOOH)=0.14-a-b=0.3-a-y,c(CO)=a+0.7,K(Ⅰ)===5,a=。故==,K(Ⅱ)===。加入0.10 mol·L-1盐酸后,H+作催化剂,反应Ⅰ的反应速率加快,达平衡的时间缩短,催化剂不影响平衡移动,故CO的浓度峰值不变,则CO新的浓度峰值点可能是b点。此时由于反应Ⅱ未达平衡,且c(HCOOH)浓度迅速减小,生成CO2的反应速率减小,相同时间内c(CO2)会小于不含盐酸的浓度,=K(Ⅰ),温度不变,平衡常数不变,则的值不变。
9.(1)CO2(g)+CH4(g)===2CO(g)+2H2(g) ΔH=+(E5-E1)NA eV/mol
(2)①> ②0.01 (3)B
(4)①L2 ②两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低 ③T2
(5)4.7∶1 (6)4
解析 (1)由图示可知该反应为吸热反应,生成物能量高于反应物,而图示中是单个CO2分子与CH4分子的反应历程,ΔH=(E生-E反)NA eV/mol,所以热化学方程式为:CO2(g)+CH4(g)===2CO(g)+2H2(g) ΔH=+(E5-E1)NA eV/mol;(2)①由于反应吸热,温度越高,正向进行程度越大,p(H2)越大,所以T1>T2;②Kp= ,温度为T1时,由b点可以知道各气体分压,p(CO)=p(H2)=1 MPa,p(CO2)=p(CH4) =10 MPa,代入Kp表达式即可求得Kp=0.01 MPa2;(3)A.O2中O===O键断裂代表正反应方向,H2O中O-H 键生成也代表正反应方向,不能说明已达平衡状态,A不符合;B.在绝热条件下,容器内的温度是个变量,当其不再变化时说明已达到平衡状态,B符合;C.反应物和生成物均是气体,则混合气体的质量不变,容器为刚性容器,体积不变,则混合气体密度是个不变量,不能作为是否已达平衡状态的依据,C不符合;D.当n(C3H8)=n(C3H6)时,反应不一定达到平衡,D不符合;(4)①通过两反应方程式系数可知,丙烷转化率低于氧气,所以曲线L2表示丙烷的转化率;②由于T1 K后反应达到平衡,两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低;③当温度达到T2时,O2与丙烷的转化率相同,且起始投料比n(C3H8)∶n(O2)=2∶1,可以判断温度达到T2后反应ii不再发生,T2 K时只发生反应i;(5)CO2气体用NaOH溶液吸收,反应产生Na2CO3、NaHCO3,所得混合溶液pH=11,则c(H+)=10-11 mol/L。由于H2CO3是二元弱酸,溶液中分步电离,存在电离平衡,第二步电离平衡:HCO??H++CO,Ka2==4.7×10-11,则===4.7,即c(CO)∶c(HCO)=4.7∶1;(6)46.6 g BaSO4的物质的量n(BaSO4)==0.2 mol,设每次用1 L 1.3 mol/L Na2CO3溶液能处理x mol BaSO4,BaSO4(s)+CO(aq)??BaCO3(s)+SO(aq),c(CO)=(1.3-x) mol/L,c(SO)=x mol/L,根据K=====0.04,解得x=0.05,处理次数=4,所以至少要反复处理4次
一、速率、平衡——物质结构综合题
1.(2023·山西一模)碳及其化合物的资源化利用在生产、生活中具有重要的意义。回答下列问题:
Ⅰ.汽车尾气的处理:2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH=-620.4 kJ·mol-1。
该反应的反应历程及反应物和生成物的相对能量如下图所示:
(1)反应________(填“①”“②”或“③” )是该反应的决速步骤。
(2)写出反应②的热化学方程式__________________________________________
____________________________________________________________________。
Ⅱ.向一恒容密闭容器中,充入1 mol CO气体和一定量的NO气体发生反应:2CO(g)+2NO(g) 2CO2(g)+N2(g),下图是3种投料比[n(CO)∶n(NO)分别为2∶1、1∶1、1∶2]时,反应温度对CO平衡转化率的影响曲线。
(3)图中表示投料比为2∶1的曲线的是________。
(4)m点NO的逆反应速率________n点NO的正反应速率(填“>”“<”或“=”)。
(5)T1条件下,起始时容器内气体的总压强为3 MPa,则p点时该反应的平衡常数Kp=________ (MPa)-1(保留两位小数,以分压表示,气体分压=总压 ×物质的量分数);p点时,再向容器中充入NO和CO2,使二者分压均增大为原来的2倍,则CO的转化率________(填“增大”“不变”或“减小”)。
Ⅲ.利用光电催化将CO2还原为CO是很有前景的研究方向,CsPbBr3是一种重要光电池材料,其晶胞模型如下图a所示,为更清晰地表示晶胞中原子所在的位置,常将立体晶胞结构转化为平面投影图,例如沿CsPbBr3晶胞的c轴将原子投影到ab平面,即可用下图b表示。
(6)图b中c1=________c2=________;晶胞参数为a pm, CsPbBr3的密度为________ g·cm-3(列出计算式,设NA表示阿伏加德罗常数的值)。
2.(2023·延边二模)化石燃料燃烧过程中形成NO和CO等污染物,利用CO脱除NO的研究获得了广泛关注。在催化剂作用下,CO与NO的反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH。回答下列问题:
(1)已知: 2CO(g)+O2(g) 2CO2(g) ΔH1=-520 kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+160 kJ·mol-1
则ΔH=________。
(2)向某刚性容器中加入2 mol CO、2 mol NO和催化剂, 测得平衡时CO2的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明该反应已经达到平衡状态的是________(填标号)。
A.CO2和N2的浓度比保持不变
B.压强不再变化
C.混合气体的密度不再变化
D.混合气体的摩尔质量不再变化
②压强p1________p2(填“>”或“<”, 下同), a、b两点的平衡常数Ka________Kb。
③b点CO的转化率为________%(保留一位小数),b点的Kp=________(用含p2的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 ×体积分数)。
(3)金属锌作催化剂,在相同时间内,以相同投料比反应时,容器中CO2的物质的量随温度变化的曲线如图2。当温度高于T ℃时,n(CO2)下降的原因可能是___________________________________________________________________
____________________________________________________________________
(答出一点即可,不考虑物质的稳定性)。
(4)硫与催化剂锌所形成化合物晶体的晶胞如图3所示。在该晶胞中原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0,0); b为(,0,);c为(,,0)。则d的坐标参数为________。已知该晶胞的密度为ρ g·cm-3,则其中两个最近S原子之间的距离为__________ pm(列出计算式即可)。
3.(2023·安庆二模)乙烯是重要的有机化学原料,工业上可利用乙烷脱氢制备乙烯。
(1)乙烷裂解为乙烯为自由基反应,其可能的引发反应及对应化学键的解离能如下:
可能的引发反应 有关键的解离能(kJ/mol)
C2H6(g)→C2H5·(g)+H·(g) 410
C2H6(g)→ 2CH3·(g) 368
根据表格信息,乙烷裂解引发的反应主要为_________________________________
_____________________________________________________________________。
(2)经过引发的后续反应历程为(已略去链终止过程):
……
C2H5·(g)→C2H4(g)+H·(g) ΔH1
H·(g)+C2H6(g)→C2H5·(g)+H2(g) ΔH2
①C2H4(g)+H2(g) →C2H6(g)的ΔH=__________(用含ΔH1和ΔH2的式子表示)。
②上述历程中“……”所代表的反应为__________________________________。
(3)CH3·中的单电子不能占据杂化轨道,则CH3·中碳原子的杂化方式为________________。
(4)乙烷裂解中主要发生的反应及其在不同温度下的平衡常数如下表:
反应 1 100 K 1 300 K 1 500 K
Ⅰ.C2H6??C2H4+H2 1.6 18.9 72.0
Ⅱ.C2H6??C2H4+CH4 60.9 108.7 165.8
Ⅲ.C2H4??C2H2+H2 0.015 0.33 3.2
Ⅳ.C2H2??2C+H2 6.5×107 1.5×106 1.0×105
①当裂解反应达到平衡状态时,体系将会产生大量积碳。由表中数据分析,平衡时混合气体中______________(填化学式)的百分含量最大,原因是_____________________________________________________________________
_____________________________________________________________________。
②为提高乙烯的产率,工业生产的适宜反应条件为________(填标号)。
A.高温 较长的反应时间
B.高温 较短的反应时间
C.低温 较长的反应时间
D.低温 较短的反应时间
③在某温度下投入x mol C2H6发生上述反应,平衡时混合体系的压强为p,其中C2H6、C2H4、CH4的物质的量分别为m mol、n mol、r mol,未检测出C2H2。则此温度下反应Ⅰ的平衡常数Kp=__________(以分压表示,分压=总压×物质的量分数)。
(5)工业上制备乙烯常使用Ni-Cr-Fe合金炉,某Ni-Cr-Fe合金的晶胞结构如图所示,●表示Ni原子,○表示Fe原子,由4个Ni原子和2个Fe原子所形成的八面体空隙中心的一半填充Cr原子(如图中△位置),则该合金可表示为__________________(填化学式)。
二、速率、平衡——能量变化综合题
4.(2023·湖北5月联考)CO2的资源化利用有利于碳中和目标的实现。
回答下列问题:
(1)将CO2催化加氢转化为CH3OCH3是资源化利用的途径之一,适当温度下,在催化剂存在的CO2加氢反应器中,主要反应有:
ⅰ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41 kJ·mol-1 K1
ⅱ.2CO(g)+4H2(g) H3OCH3(g)+H2O(g) ΔH2=-204 kJ·mol-1 K2
ⅲ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH3 K3
①ΔH3=__________ kJ·mol-1,K3=__________(用含K1、K2的式子表示)。
②将1 mol CO2、3 mol H2充入2 L的刚性容器中,测得反应进行到10 min时,CO2的转化率与催化剂(X、Y、Z)、温度(T)间关系如图所示:
则三种催化剂条件下的反应中,T2温度下活化能最小的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”),a点对应反应的v(CO2)=________ mol·L-1·min-1;转化率b>c的原因可能是________(填选项字母)。
A.b点平衡后升温平衡逆向移动
B.温度过高导致催化剂Y催化活性降低,c点时反应还没有达到平衡
C.b点不是平衡态c点是平衡态
(2)CO2与H2也可用于制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。T K时,向压强为9 MPa的恒压容器中充入3 mol CO2和7 mol H2,达到平衡时,CH3OH的体积分数为。
①写出能提高CH3OH产率的两种方法:____________________________________
_____________________________________________________________________。
②CO2和H2的平衡转化率之比为______________;T K时,该反应的平衡常数KP=________ (MPa)-2(以分压表示,分压=总压×气体物质的量分数,保留两位有效数字)。
5.(2023·全国甲卷)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)===2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g)===2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________ kJ·mol-1,平衡常数K3=__________(用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。图中300 K的曲线是________(填“a”或“b”)。300 K、60 s时MO+的转化率为_____________________________________________________(列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是________(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线________(填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD________CHD2OH(填“>”“<”或“=”)。若MO+与CHD3反应,生成的氘代甲醇有________种。
6.(2023·衡水二中三调)环己烯是工业常用的化工品。工业上通过热铂基催化剂重整将环己烷脱氢制备环己烯,化学反应为C6H12(g)??C6H10(g)+H2(g) ΔH。
(1)几种共价键的键能数据如下:
共价键 H—H C—H C—C C===C
键能/(kJ· mol-1) 436 413 348 615
ΔH=________kJ· mol-1。
(2)在恒温恒容密闭容器中充入环己烷气体,仅发生上述反应。下列叙述错误的是___________________(填字母)。
A.气体平均摩尔质量不随时间变化时反应达到平衡状态
B.平衡后再充入C6H12气体,平衡向右移动,转化率增大
C.加入高效催化剂,单位时间内C6H10的产率可能会增大
D.增大固体催化剂的质量,一定能提高正、逆反应速率
(3)环己烷的平衡转化率和环己烯的选择性(选择性=)随温度的变化如图所示。
①随着温度升高,环己烷平衡转化率增大的原因是______________________。
随着温度升高,环己烯的选择性变化的可能原因是________(填字母)。
A.平衡向逆反应方向移动
B.环己烷裂解发生副反应
C.环己烯易发生聚合反应
D.催化剂的选择性增大
②当温度高于600 ℃时,可能的副产物有__________________________________
______________________________________________(任写一种结构简式)。
(4)在873 K、100 kPa条件下,向反应器中充入氩气和环己烷的混合气体,仅发生反应:C6H12(g) C6H10(g)+H2(g)。
①环己烷的平衡转化率随的增大而升高,其原因是_____________________________________________________________________
_____________________________________________________________________。
②当=1∶3时,达到平衡所需时间为20 min,环己烷的平衡转化率为,则环己烷分压的平均转化速率为________ kPa·min-1。该环己烷脱氢反应的压强平衡常数Kp=________ kPa。(均保留2位小数)注:用分压计算的平衡常数为压强平衡常数(Kp),分压=总压×物质的量分数。
(5)“)”表示铂基催化剂,“*”表示吸附在该催化剂表面,环己烷脱氢反应的机理如下,请补充基元反应③___________________________________;
7.(2023·全国甲卷)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①3O2(g)===2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g)===2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________ kJ·mol-1,平衡常数K3=________(用K1、K2表示)。
(2)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如下图所示。图中300 K的曲线是________(填“a”或“b”)。300 K、60 s时MO+的转化率为_____________(列出算式)。
(3)MO+分别与CH4、CD4反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以CH4示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是________(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则MO+与CD4反应的能量变化应为图中曲线________(填“c”或“d”)。
(ⅲ)MO+与CH2D2反应,氘代甲醇的产量CH2DOD________CHD2OH(填“>”“<”或“=”)。若MO+与CHD3反应,生成的氘代甲醇有________种。
命题角度3 反应热与离子平衡综合题
8.(2023·山东卷)一定条件下,水气变换反应CO+H2O??CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:
Ⅰ.HCOOH??CO+H2O(快)
Ⅱ.HCOOH??CO2+H2(慢)
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=____________(用含ΔH1、ΔH2的代数式表示)。
(2)反应Ⅰ正反应速率方程为:v=kc(H+)·c(HCOOH),k为反应速率常数。T1温度下,HCOOH电离平衡常数为Ka,当HCOOH平衡浓度为x mol·L-1 时,H+浓度为______________________________mol·L-1,此时反应Ⅰ正反应速率v=________ mol·L-1·h-1(用含Ka、x和k的代数式表示)。
(3)T3温度下,在密封石英管内完全充满1.0 mol·L-1 HCOOH水溶液,使HCOOH分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。t1时刻测得CO、CO2的浓度分别为0.70 mol·L-1、0.16 mol·L-1,反应Ⅱ达平衡时,测得H2的浓度为y mol·L-1。体系达平衡后=________(用含y的代数式表示,下同),反应Ⅱ的平衡常数为_______________。
相同条件下,若反应起始时溶液中同时还含有0.10 mol·L-1 盐酸,则图示点a、b、c、d中,CO新的浓度峰值点可能是________(填标号)。与不含盐酸相比,CO达浓度峰值时,CO2浓度________(填“增大”“减小”或“不变”),的值________(填“增大”“减小”或“不变”)。
三、反应原理综合题
7.(2023·福州八中质检)我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。
Ⅰ.利用温室气体CO2和CH4制备燃料合成器,计算机模拟单个二氧化碳分子与甲烷分子的反应历程如图所示:
已知:1 eV为1电子伏特,表示一个电子(所带电量为-1.6×10-19C)经过1伏特的电位差加速后所获得的动能。
(1)制备合成气CO、H2总反应的热化学方程式为____________________________。
(2)向密闭容器中充入等体积的CO2和CH4,测得平衡时压强对数lgp(CO2)和lgp(H2)的关系如图所示。(压强的单位为:MPa)
①T1____________T2(填“>”“<”或“=”)。
②温度为T1时,该反应的压强平衡常数Kp=____________MPa2。
Ⅱ.丙烯是重要的有机合成原料。由丙烷制备丙烯是近年来研究的热点,主要涉及如下反应:
反应i:2C3H8(g)+O2(g) 2C3H6(g)+2H2O(g) ΔH1=-235 kJ/mol
反应ii:2C3H8(g)+7O2(g) 6CO(g)+8H2O(g) ΔH2=-2 742 kJ/mol
回答下列问题:
(3)在刚性绝热容器中发生反应i,下列能说明已达到平衡状态的有____________(填标号)。
A.每断裂1 mol O===O键,同时生成4 mol O—H键
B.容器内温度不再变化
C.混合气体的密度不再变化
D.n(C3H8)=n(C3H6)
(4)在压强恒定为100 kPa条件下,按起始投料n(C3H8)∶n(O2)=2∶1,匀速通入反应器中在不同温度下反应相同时间,测得丙烷和氧气的转化率如图。
①线________(填“L1”或“L2”)表示丙烷的转化率。
②温度高于T1 K后曲线L2随温度升高而降低的原因为_____________________________________________________________________。
③当温度高于____________(填“T1”或“T2”)时,可判断反应ii不再发生。
Ⅲ.常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
(5)若某次捕捉后得到pH=11的溶液,则溶液中c(CO)∶c(HCO)=____________(常温下Ka1(H2CO3)=4.5×10-7、Ka2(H2CO3)=4.7×10-11)。
(6)现有46.6 g BaSO4固体,每次用1 L 1.3 mol/L Na2CO3溶液处理,若使BaSO4中的SO全部转化到溶液中,需要反复处理____________次。(已知:Ksp(BaCO3)=2.5×10-9、Ksp(BaSO4)=1.0×10-10)
参考答案
1.(1)① (2)N2O2(g)+CO(g)===CO2(g)+N2O(g) ΔH=-513.2 kJ/mol (3)D (4)> (5)4.44 不变 (6)0
解析 (1)反应的活化能越大,反应速率越慢,慢反应是化学反应的决速步骤,由图可知,反应①的活化能最大,反应速率最慢,则反应①是该反应的决速步骤;(2)由图可知,反应①为吸热反应,反应ΔH1 =+199.4 kJ/mol,反应③为放热反应,反应ΔH3 =-306.6 kJ/mol,由盖斯定律可知反应①+②+③得到总反应,则反应②的焓变ΔH2 =ΔH-ΔH1-ΔH3=(-620.4 kJ/mol)-(+199.4 kJ/mol)-(-306.6 kJ/mol)=-513.2 kJ/mol,反应的热化学方程式为N2O2(g)+CO(g)===CO2(g)+N2O(g) ΔH=-513.2 kJ/mol;(3)恒容密闭容器中,投料比n(CO)∶n(NO)越小相当于一氧化氮的浓度越大,增大一氧化氮的浓度,平衡向正反应方向移动,一氧化碳的转化率增大,则n(CO)∶n(NO)分别投料比为2∶1、1∶1、1∶2的反应中,投料比为2∶1的一氧化氮浓度最小,一氧化碳转化率最小,则图中表示投料比为2∶1的曲线是D;(4)恒容密闭容器中,投料比n(CO)∶n(NO)越小相当于一氧化氮的浓度越大,增大一氧化氮的浓度,反应速率加快,平衡向正反应方向移动,一氧化碳的转化率增大,则图中表示投料比为1∶1、1∶2的曲线分别是B、A,所以m点一氧化氮的浓度大于n点,反应速率大于n点;(5)平衡常数为温度函数,温度不变,平衡常数不变,所以图中T1条件下,m点和p点的平衡常数相等,由图可知,m点一氧化碳的转化率为80%,设起始一氧化碳和一氧化氮的物质的量分别为1 mol和2 mol,由题意可建立如下三段式:
起始时容器内气体的总压强为3 MPa,由物质的量之比等于气体压强之比可得平衡时气体压强为=2.6 MPa;则反应的平衡常数Kp=≈4.44;p点时,再向容器中充入一氧化氮和二氧化碳,使二者分压均增大为原来的2倍,反应的浓度熵Q=≈4.44=Kp,则化学平衡不移动,一氧化碳的转化率不变;(6)由题给信息可知,晶胞模型中位于顶点的铯原子、位于体心的铅原子中平面投影图b中在c轴的坐标分别为0、,则晶胞模型中位于上下面心的溴原子在c轴的坐标c1为0、位于前后和左右面心的溴原子在c轴的坐标c1为;由晶胞结构可知,位于体内的铅原子个数为1可知,晶胞中CsPbBr3的个数为1,设晶体的密度为d g/cm3,由晶胞的质量公式可得:=10-30a3d,解得d=。
2.(1)-680 kJ·mol-1 (2)①AC ②< > ③44.4%
(3)随温度升高,催化剂活性降低,反应速率减慢,相同时间生成的CO2的物质的量减少(反应达平衡,温度升高,平衡逆向移动,CO2的物质的量减小)
(4)(1,,) ××1010
解析 (1)①2CO(g)+O2(g) ??2CO2(g) ΔH1=-520 kJ·mol-1;②N2(g)+O2(g) ??2NO(g) ΔH2=+160 kJ·mol-1 ,由盖斯定律:①-②得2CO(g)+2NO(g) ?? 2CO2(g)+N2(g) ΔH=- 520 kJ·mol-1-160 kJ·mol-1=-680 kJ·mol-1;(2)①A.2CO(g)+2NO(g) ?? 2CO2(g)+N2(g),CO2和N2的浓度比始终保持不变,故A选;B.反应为气体体积减小的反应,压强不再变化,说明反应达到平衡状态,故B不选;C.反应前后均为气体,总质量不变,混合气体的密度始终保持不变,当气体的密度不再变化时,不能说明反应达到平衡状态,故C选;D.反应前后均为气体,总质量不变,但反应后物质的量减小,反应混合气体的摩尔质量不再变化,说明反应达到平衡状态,故D不选;②由图1可得:相同温度下,p2的二氧化碳含量大,结合方程式,加压,平衡正向移动,压强p1< p2,由a到b温度升高,对于放热反应,平衡逆向移动,平衡常数减小, a、b两点的平衡常数Ka>Kb。
③
b点二氧化碳的体积分数为:
×100%=25% ,x= mol,b点CO的转化率为×100%= 44.4%,平衡时,CO(g)为 mol,NO(g)为 mol, CO2(g)为 mol,N2(g)为 mol,平衡时总物质的量为 mol,b点的Kp= =;(3)容器中CO2的物质的量随温度变化的曲线如图2,当温度高于T ℃时,n(CO2)下降的原因可能是随温度升高,催化剂活性降低,反应速率减慢,相同时间生成的CO2的物质的量减少(反应达平衡,温度升高,平衡逆向移动,CO2的物质的量减小)(答出一点即可,不考虑物质的稳定性)。(4)在该晶胞中,Zn的配位数为原子坐标参数可表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数a为(0,0, 0);b为(,0,);c为(,,0),a为原点,b、c、d为三个面的面心,则d的坐标参数为(1,,)。晶胞中Zn原子数目=8×+6×=4,S的原子数目为4,所以R的化学式为ZnS,晶胞的质量m= g,晶胞的密度ρ,则晶胞棱长= cm,两个最近S2-之间的距离为面对角线的一半,则其中两个最近S原子之间的距离为××1010 pm。
3.(1)C2H6(g)→2CH3·(g)
(2)①-(ΔH1+ΔH2)或-ΔH1 -ΔH2 ②CH3·(g)+C2H6(g)→C2H5·(g)+CH4(g)
(3)sp2
(4)①H2 反应Ⅳ的平衡常数远大于其它反应,体系主要得到碳和氢气,其他气体含量很少 ②B ③
(5)Ni2Cr3Fe2
解析 (1)解离能越小,发生的可能性越大,所以乙烷裂解引发的反应主要为C2H6(g)→2CH3·(g);(2)①C2H5·(g)→C2H4(g)+H·(g) ΔH1②H·(g)+C2H6(g)→C2H5·(g)+H2(g) ΔH2,由盖斯定律①+②得C2H6(g)→C2H4(g)+H2(g),所以C2H4(g)+H2(g)→C2H6(g),ΔH=-(ΔH1+ΔH2)或-ΔH1 -ΔH2;②由解离能得大小可判断主要生成甲基自由基,所以甲基自由基要转化为乙基自由基才能使反应生成乙烯,所以历程中“……”所代表的反应为CH3·(g)+C2H6(g)→C2H5·(g)+CH4(g);(3)CH3·结构中中心原子周围有3对电子对,杂化方式为sp2;(4)①反应Ⅳ的平衡常数远大于其它反应,体系主要得到碳和氢气,其他气体含量很少,所以平衡时混合,气体中H2的百分含量最大;②工业生产Ⅰ、Ⅱ反应生成乙烯,温度升高平衡常数增大所以需要高温,又因为Ⅲ、Ⅳ会消耗乙烯所以时间不宜过长,故选B;③根据氢元素守恒:n(H2)=(3x-3m-2n-2r) mol,n(总)=(3x-3m-2n-2r+m+n+r) mol=(3x-2m-n-r) mol,KP==;(5)晶胞中Fe原子个数是2,Ni原子个数是8×+4×=2,Ni、Fe所形成的八面体空隙中心共有6个(10×+1=6),由于只填充了一半的空隙,因此该合金可表示为Ni2Cr3Fe2。
4.(1)①-122 K·K2 ②Ⅰ 0.03 AB
(2)①在较低温度下进行反应,不断分离出产品,在较高压强下进行反应等(任答两条) ②7∶9 1.8
解析 (1)①由盖斯定律知,2×ⅰ+ⅱ得:2CO2(g)+6H2(g)??CH3OCH3(g)+3H2O(g) ΔH3=-122 kJ·mol-1。K3=K·K2。②不同催化剂、相同温度下经过相同时间时,途径Ⅰ中CO2的转化率最高,说明途径Ⅰ反应速率最大,相应地活化能最小;a点对应反应的v(CO2)==0.03 mol·(L·min)-1。因总反应是放热反应,b点转化率最高,处于平衡状态,温度高反应速率快,达到平衡所需要的时间较少,而温度高不利于平衡向右进行,故转化率降低;当温度过高有可能导致催化剂催化活性降低,从而导致反应速率降低,在10 min时反应还没有达到平衡,故转化率低于b点,A、B项正确。
(2)①正反应是气体分子数目减少的放热反应,低温、高压有利于平衡向右移动,不断分离出产品也有利于平衡向右进行,从而提高CH3OH的产率。
=,解得x=2。CO2的转化率为,氢气的转化率为,二者转化率之比为7∶9;平衡时,p(CH3OH)=p(H2O)=×9 MPa=3 MP,同理可求出p(CO2)=p(H2)=1.5 MPa,KP=≈1.8(MPa)-2。
5.(1)-307 或
(2)b ×100%或×100%
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
解析 (1)根据盖斯定律可知,反应③=(反应②-①),所以对应ΔH3=(ΔH2-ΔH1)=(-329 kJ·mol-1-285 kJ·mol-1)=-307 kJ·mol-1;根据平衡常数表达式与热化学方程式之间的关系可知,对应化学平衡常数K3=或;(2)根据图示信息可知,纵坐标表示-lg,即与MO+的微粒分布系数成反比,与M+的微粒分布系数成正比。则同一时间内,b曲线生成M+的物质的量浓度比a曲线的小,证明化学反应速率慢,又因同一条件下降低温度化学反应速率减慢,所以曲线b表示的是300 K条件下的反应;根据上述分析结合图像可知,300 K、60 s时-lg=0.1,则=10-0.1,利用数学关系式可求出c(M+)=(100.1-1)c(MO+),根据反应MO++CH4===M++CH3OH可知,生成的M+即为转化的MO+,则MO+的转化率为×100%或×100%;(3)(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ;(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c;(ⅲ)MO+与CH2D2反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD<CHD2OH;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH共2种。
6.(1)+123 (2)BD
(3)①正反应是吸热反应,升高温度,平衡正向移动 BC
②、、等
(4)①恒压条件下,增大Ar的物质的量,相当于减小压强,平衡正向移动 ②2.92 66.67
(5)
解析 (1)焓变=反应物的总键能-生成物的总键能,C6H12(g)??C6H10(g)+H2(g) ΔH=348×6+413×12-(348×5+615+413×10+436)=+123 kJ· mol-1;(2)A.反应过程中气体总质量不变,气体物质的量增大,气体平均摩尔质量是变量,所以气体平均摩尔质量不随时间变化时反应达到平衡状态,故A正确;B.平衡后再充入C6H12气体,相当于增大压强,转化率减小,故B错误;C.加入高效催化剂,反应速率加快,单位时间内C6H10的产率可能会增大,故C正确; D.催化剂通过参与化学反应改变反应历程,加快反应速率,增大固体催化剂的质量,如果不能增大接触面积,不一定能提高正、逆反应速率,故D错误;选BD;(3)①C6H12(g)??C6H10(g)+H2(g)正反应吸热,升高温度平衡正向移动,所以随着温度升高环己烷平衡转化率增大。A.C6H12(g)??C6H10(g)+H2(g)正反应吸热,升高温度平衡正向移动,故不选A;B.环己烷裂解发生副反应,使环己烷平衡转化率增大而环己烯的选择性降低,故选B;C.环己烯易发生聚合反应,环己烯产率降低,使环己烯的选择性降低,故选C;D.若催化剂的选择性增大,生成的环己烯增多,使环己烯的选择性增大,与题图不符,故不选D;选BC;②当温度高于600 ℃时,环己烷脱氢,可能的副产物有、、等;(4)①恒压条件下,增大Ar的物质的量,相当于减小压强,平衡正向移动,环己烷的平衡转化率随的增大而升高;②当=1∶3时,初始时,环己烷的分压为× 100 kPa=75 kPa,达到平衡所需时间为20 min,环己烷的平衡转化率为,
达到平衡时环己烷的分压为100×= kPa、环己烯的分压为 kPa、氢气的分压为 kPa ,则环己烷分压的平均转化速率为=2.92 kPa·min-1。该环己烷脱氢反应的压强平衡常数Kp==66.67 kPa;(5)根据基元反应④,可知基元反应③为
。
7. (1)-307 或
(2)b ×100%或×100%
(3)(ⅰ)Ⅰ (ⅱ)c (ⅲ)< 2
解析 (1)根据盖斯定律可知,反应③=(反应②-①),所以对应ΔH3=(ΔH2-ΔH1)=(-329 kJ·mol-1-285 kJ·mol-1)=-307 kJ·mol-1;根据平衡常数表达式与热化学方程式之间的关系可知,对应化学平衡常数K3=或;(2)根据图示信息可知,纵坐标表示-lg,即与MO+的微粒分布系数成反比,与M+的微粒分布系数成正比。则同一时间内,b曲线生成M+的物质的量浓度比a曲线的小,证明化学反应速率慢,又因同一条件下降低温度化学反应速率减慢,所以曲线b表示的是300 K条件下的反应;根据上述分析结合图像可知,300 K、60 s时-lg=0.1,则=10-0.1,利用数学关系式可求出c(M+)=(100.1-1)c(MO+),根据反应MO++CH4===M++CH3OH可知,生成的M+即为转化的MO+,则MO+的转化率为×100%或×100%;(3)(ⅰ)步骤Ⅰ涉及的是碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以符合题意的是步骤Ⅰ;(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则此时正反应活化能会增大,根据图示可知,MO+与CD4反应的能量变化应为图中曲线c;(ⅲ)MO+与CH2D2反应时,因直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则单位时间内产量会下降,则氘代甲醇的产量CH2DOD<CHD2OH;根据反应机理可知,若MO+与CHD3反应,生成的氘代甲醇可能为CHD2OD或CD3OH共2种。
8.(1)ΔH2-ΔH1 (2) kx (3) b 减小 不变
解析 (1)根据盖斯定律,反应 Ⅱ-反应 Ⅰ=水气变换反应,故水气变换反应的焓变ΔH=ΔH2-ΔH1;(2)T1温度时,HCOOH建立电离平衡:
Ka=,c(HCOO-)=c(H+),故c(H+)=。v=kc(H+)·c(HCOOH)=kx。
(3)t1时刻时,c(CO)达到最大值,说明此时反应 Ⅰ达平衡状态。此时
故t1时刻c(HCOOH)=1.0-0.70-0.16=0.14 mol·L-1,K(Ⅰ)===5。t1时刻→反应Ⅱ达平衡过程,
则c(H2)=b+0.16=y,b=(y-0.16) mol·L-1,c(HCOOH)=0.14-a-b=0.3-a-y,c(CO)=a+0.7,K(Ⅰ)===5,a=。故==,K(Ⅱ)===。加入0.10 mol·L-1盐酸后,H+作催化剂,反应Ⅰ的反应速率加快,达平衡的时间缩短,催化剂不影响平衡移动,故CO的浓度峰值不变,则CO新的浓度峰值点可能是b点。此时由于反应Ⅱ未达平衡,且c(HCOOH)浓度迅速减小,生成CO2的反应速率减小,相同时间内c(CO2)会小于不含盐酸的浓度,=K(Ⅰ),温度不变,平衡常数不变,则的值不变。
9.(1)CO2(g)+CH4(g)===2CO(g)+2H2(g) ΔH=+(E5-E1)NA eV/mol
(2)①> ②0.01 (3)B
(4)①L2 ②两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低 ③T2
(5)4.7∶1 (6)4
解析 (1)由图示可知该反应为吸热反应,生成物能量高于反应物,而图示中是单个CO2分子与CH4分子的反应历程,ΔH=(E生-E反)NA eV/mol,所以热化学方程式为:CO2(g)+CH4(g)===2CO(g)+2H2(g) ΔH=+(E5-E1)NA eV/mol;(2)①由于反应吸热,温度越高,正向进行程度越大,p(H2)越大,所以T1>T2;②Kp= ,温度为T1时,由b点可以知道各气体分压,p(CO)=p(H2)=1 MPa,p(CO2)=p(CH4) =10 MPa,代入Kp表达式即可求得Kp=0.01 MPa2;(3)A.O2中O===O键断裂代表正反应方向,H2O中O-H 键生成也代表正反应方向,不能说明已达平衡状态,A不符合;B.在绝热条件下,容器内的温度是个变量,当其不再变化时说明已达到平衡状态,B符合;C.反应物和生成物均是气体,则混合气体的质量不变,容器为刚性容器,体积不变,则混合气体密度是个不变量,不能作为是否已达平衡状态的依据,C不符合;D.当n(C3H8)=n(C3H6)时,反应不一定达到平衡,D不符合;(4)①通过两反应方程式系数可知,丙烷转化率低于氧气,所以曲线L2表示丙烷的转化率;②由于T1 K后反应达到平衡,两个反应均为放热反应,温度升高,化学平衡逆向移动,导致丙烷转化率降低;③当温度达到T2时,O2与丙烷的转化率相同,且起始投料比n(C3H8)∶n(O2)=2∶1,可以判断温度达到T2后反应ii不再发生,T2 K时只发生反应i;(5)CO2气体用NaOH溶液吸收,反应产生Na2CO3、NaHCO3,所得混合溶液pH=11,则c(H+)=10-11 mol/L。由于H2CO3是二元弱酸,溶液中分步电离,存在电离平衡,第二步电离平衡:HCO??H++CO,Ka2==4.7×10-11,则===4.7,即c(CO)∶c(HCO)=4.7∶1;(6)46.6 g BaSO4的物质的量n(BaSO4)==0.2 mol,设每次用1 L 1.3 mol/L Na2CO3溶液能处理x mol BaSO4,BaSO4(s)+CO(aq)??BaCO3(s)+SO(aq),c(CO)=(1.3-x) mol/L,c(SO)=x mol/L,根据K=====0.04,解得x=0.05,处理次数=4,所以至少要反复处理4次
同课章节目录
