福建省泉州市泉港区重点中学2023-2024学年高二上学期12月第三次月考化学试题(含答案)
文档属性
| 名称 | 福建省泉州市泉港区重点中学2023-2024学年高二上学期12月第三次月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 928.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 18:50:15 | ||
图片预览


文档简介
泉港二中2023秋季高二化学第三次月考化学科试卷
(试卷满分:100分 考试时间:75分钟)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 C1:35.5 Fe:56
一、选择题(每题仅一个选项符合题意,共10小题,每小题4分,共40分)
1.“嫦娥五号”着陆月球采样返回,“天问一号”着陆巡视器在火星着陆,“祝融号”火星车在火星表面进行科学实验。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢、液态肼()、煤油等化学品。肼的燃烧热为,下列有关说法错误的是( )
A、煤油是不可再生资源
B.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能
C.运载火箭燃料使用的液氢燃烧的产物不污染环境,有利于实现“碳中和”
D.表示肼燃烧热的热化学方程式:
2.下列有关说法正确的是( )
A.回收处理废旧电池,主要是为了变废为宝
B.在化学工业中,选用催化剂一定能提高经济效益
C.反应在室温下可自发进行,则该反应的
D.可用PH试纸测定新制氯水的PH,但是不能用蒸馏水将PH试纸事先润湿
3.工业上在催化作用下生产: ,该反应可看作两步①(快)②(慢)。下列说法正确的是( )
A.的能量比的能量高
B.①的活化能一定大于②的活化能
C.减小的浓度能降低的生成速率
D.的存在使有效碰撞次数增加,降低了该反应的焓变
4.下列对物质的分类完全正确的是( )
选项 A B C D
强电解质 生石灰 硫酸钾 苛性钠 氯化钠
弱电解质 亚硫酸 氨水 氢硫酸 次氯酸
非电解质 干冰 二氧化硫 碳酸钙 氯气
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清无色透明溶液中:、、、
B.使酚酞试液呈红色的溶液中:、、、
C.加入Al能放出的溶液中:、、、;
D.由水电离出的的溶液中:、、、
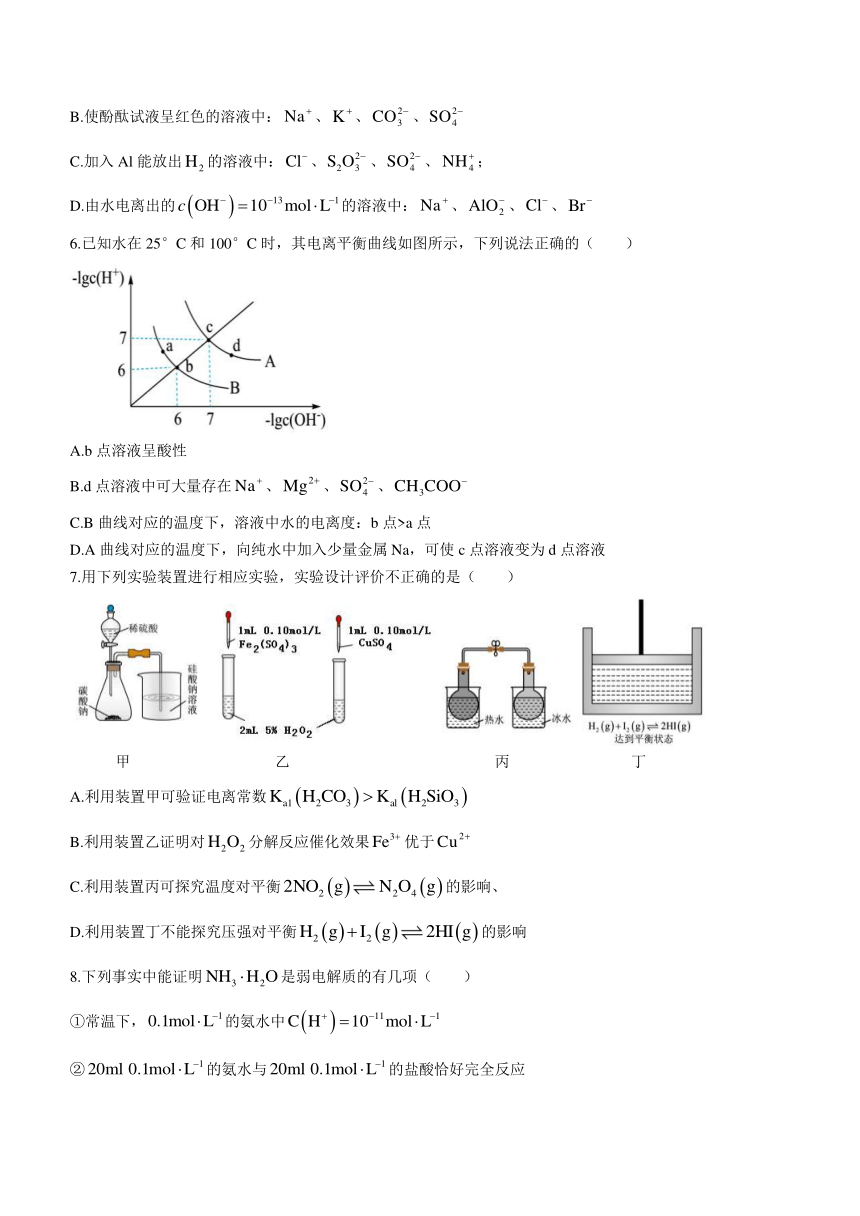
6.已知水在25°C和100°C时,其电离平衡曲线如图所示,下列说法正确的( )
A.b点溶液呈酸性
B.d点溶液中可大量存在、、、
C.B曲线对应的温度下,溶液中水的电离度:b点>a点
D.A曲线对应的温度下,向纯水中加入少量金属Na,可使c点溶液变为d点溶液
7.用下列实验装置进行相应实验,实验设计评价不正确的是( )
甲 乙 丙 丁
A.利用装置甲可验证电离常数
B.利用装置乙证明对分解反应催化效果优于
C.利用装置丙可探究温度对平衡的影响、
D.利用装置丁不能探究压强对平衡的影响
8.下列事实中能证明是弱电解质的有几项( )
①常温下,的氨水中
②的氨水与的盐酸恰好完全反应
③常温下,5ml 的浓氨水中加水至5000mL,
④用氨水做导电实验,灯泡很暗
A.4项 B.3项 C.2项 D.1项
9.通过控制光沉积的方法构建复合材料光催化剂,以和渗透Nafion膜在酸性介质下构建了一个还原和氧化分离的人工光合体系,光照时,光催化电极产生电子()和空穴(),与相应物质发生氧化还原反应,其反应机理如图。下列说法错误的是( )
A.图中a、b分别代表和
B.体系中能量转化形式:光能→化学能
C.升高温度,总反应的化学平衡常数K减小
D.Nafion膜左侧发生的反应为:
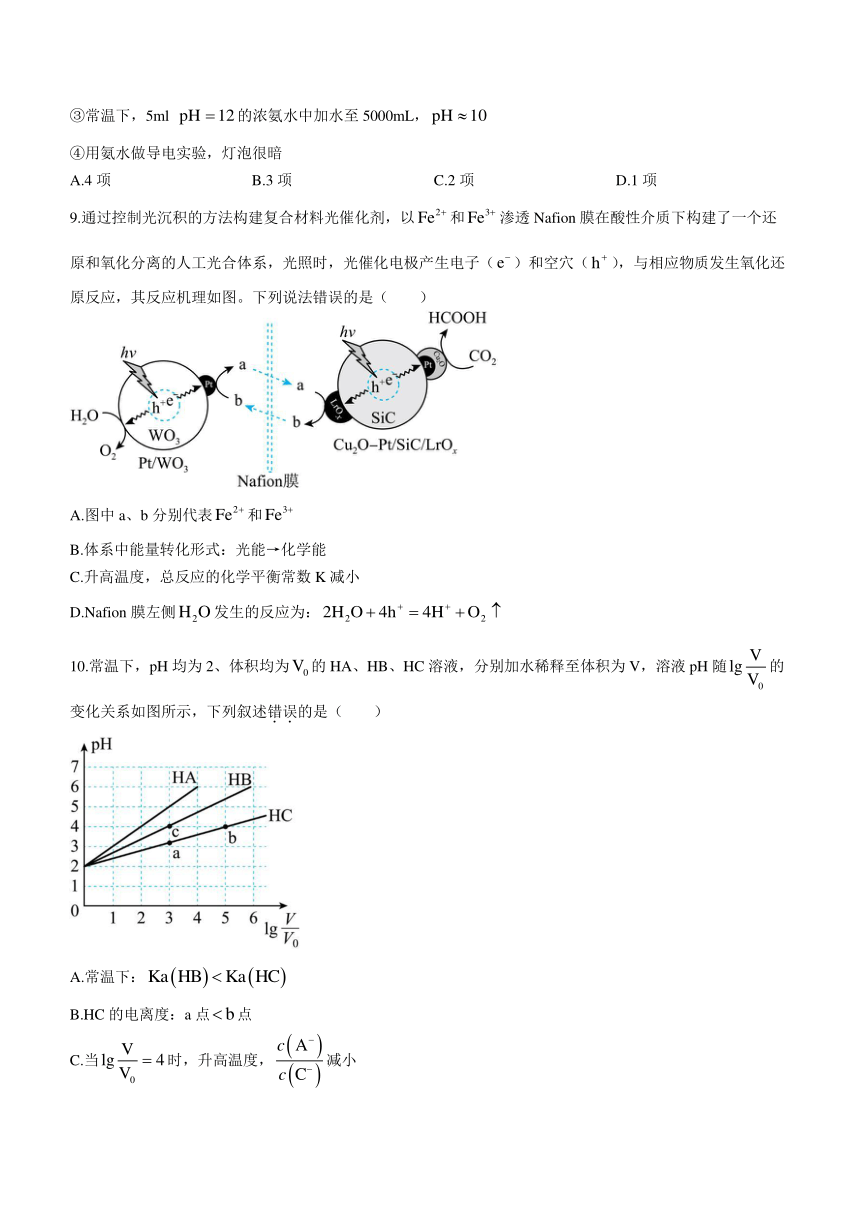
10.常温下,pH均为2、体积均为的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( )
A.常温下:
B.HC的电离度:a点点
C.当时,升高温度,减小
D.三种溶液分别与Zn反应产生相等质量的时,消耗HA的体积最多
二、非选择题(本题共4个小题,共60分)
11.(18分)电解质的水溶液跟日常生活、工农业生产和环境保护息息相关。完成下列问题:
(1)现有下列物质:①;②酒精;③溶液;④;⑤冰醋酸;⑥熔融状态的。其中能导电的物质有______(填序号)
(2)用等物质的量浓度的盐酸和醋酸分别与NaOH进行中和反应反应热的测定,测得反应热的数值情况,盐酸______醋酸(填“>”“<”或“=”),其原因是______
(3)已知25°C时,的;的: ;HCN的回答下列问题:
①25°C时,向NaCN溶液中通入少量,反应的离子方程式为______
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是______
a. b. c. d.电离度
③下列措施中能使醋酸的水溶液中増大的同时减小的是______(填标号)。
A.加入固体 B.加入固体 C.加入NaCN固体 D.升高温度
(4)常温时 溶液,浓度为______,由水电离的为______。
(5)常温下,的NaOH溶液与的溶液按体积比为1:9混合,所得溶液的PH值为______。(近似认为酸碱总体积就是混合液体积)
(6)化学中常用AG表示溶液的酸度。室温下,向20.00mL 0.1000mol/L的氨水中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。
①根据图象可知,该稀硫酸的浓度为______。
②恰好完全中和时AG______0(填“>”、“<”或“=”)。
12.(10分)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为
;请回答下列问题:
(1)放电时,正极上的电极反应式为______;充电时,阴极附近溶液的碱性______。(填“增强”或“减弱”)
(2)高铁电池作为电源来进行电解。
①此装置中高铁电池的正极是______(填“X”或“Y”)
②电极A上的电极反应式为______。
③理论上当高铁电池中Zn极质量增加10.2g时,消耗的在标况下的体积为______。
13.(16分)加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。
(1)由加氢生成的反应为
①若为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热______
物质
0
②若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高平衡转化率的措施有______(写出两种)。
③下列说法可以证明该反应已达到平衡状态的是______(填字母)。
a. b.的物质的量分数不再改变
c.容器内气体密度不再改变 d.和的浓度之比为1:2
e.混合气的平均摩尔质量不再变化 f.单位时间内生成的同时又消耗
④催化加氢合成过程中,活化的可能途径如有图所示,CO是活化的优势中间体,原因是______。
(2)一定条件下与也可以生成,某温度下在容积为2L的恒容密闭容器中充入和一定量发生反应:
。
的平衡分压与起始投料比的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则______。b点时,再充入和,使两者分压均增大0.2kPa,则此时平衡______(填“正向”、“逆向”或“不”)移动。
(3)一定条件下与还可以生成甲酸,方程式为 。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,除了能分解成和,还能分解为CO和,反应为: ,则此平衡体系中CO或的选择性和HCOOH的转化率随温度变化曲线如图所示。
提示:CO(或氢气)的选择性
图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降可能的原因:______;
400°C时的体积分数为______。
14.(16分)溶液常用作氧化还原反应滴定的标准液,由于的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质。
Ⅰ:配制标准溶液的操作是:
a.称取稍多于所需量的固体溶于水,将溶液加热并保持微沸1h;
b.用微孔玻璃漏斗过滤除去难溶的;
c.过滤得到的溶液贮存于棕色试剂瓶放在暗处;
d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是______。
(2)准确量取一定体积的溶液用______。(填“酸式滴定管”或“碱式滴定管”)
(3)在下列物质中,用于标定溶液的基准试剂最好选用______。(填序号)
A. B. C.浓盐酸 D.
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠()样品的纯度,进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量酸化,用标准溶液进行滴定(还原产物为,滴定至终点时消耗溶液VmL。
(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有______(填一种)。
(5)判断该实验达到滴定终点的现象是:______。
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为______mL。
(7)下列叙述正确的是______。
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的标准溶液滴定,测得的浓度值将偏小
C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入溶液,用溶液滴定,对实验无影响
(8)滴定过程中反应的离子方程式为:______
该样品中的质量分数为______(用含字母a、V的最简式表示)。
泉港二中2023秋季高二化学第三次月考化学科答案
1-5 DCCAB 6-10 CBCCA
11(18分)(1)③⑥(各1分)
(2)> 醋酸是弱电解质,电离过程中会吸热,造成放出的热量减少,所以反应热的数值会减小(各1分)
(3)①;②ad ③AC
(4)0.05mol/L (或者)
(5)10 (6)0.0500mol/L >(1分)
12(10分)(1);增强
(2)①Y ② ③2.24L
13.(16分)(1)①
②增大浓度、将或从体系中移出 ③be
④生成中间体CO反应的活化能小,反应速率快、CO中间体能量低,稳定,有利于生成
(2)或者 正向
(3)随着温度升高,主要发生反应,不利于分解生成CO和;
14.(1)将水中还原性物质完全氧化; (2)酸式滴定管(1分)
(3)A (4)100mL容量瓶(1分)
(5)当滴入最后半滴(或一滴)溶液时,锥形瓶中溶液由无色变为浅紫色(或浅红色),且半分钟内(或30s内)不褪色
(6)25.40 (7)CE
(8);或者
(试卷满分:100分 考试时间:75分钟)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 C1:35.5 Fe:56
一、选择题(每题仅一个选项符合题意,共10小题,每小题4分,共40分)
1.“嫦娥五号”着陆月球采样返回,“天问一号”着陆巡视器在火星着陆,“祝融号”火星车在火星表面进行科学实验。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢、液态肼()、煤油等化学品。肼的燃烧热为,下列有关说法错误的是( )
A、煤油是不可再生资源
B.“祝融号”火星车使用的太阳能电池板将太阳能转化为电能
C.运载火箭燃料使用的液氢燃烧的产物不污染环境,有利于实现“碳中和”
D.表示肼燃烧热的热化学方程式:
2.下列有关说法正确的是( )
A.回收处理废旧电池,主要是为了变废为宝
B.在化学工业中,选用催化剂一定能提高经济效益
C.反应在室温下可自发进行,则该反应的
D.可用PH试纸测定新制氯水的PH,但是不能用蒸馏水将PH试纸事先润湿
3.工业上在催化作用下生产: ,该反应可看作两步①(快)②(慢)。下列说法正确的是( )
A.的能量比的能量高
B.①的活化能一定大于②的活化能
C.减小的浓度能降低的生成速率
D.的存在使有效碰撞次数增加,降低了该反应的焓变
4.下列对物质的分类完全正确的是( )
选项 A B C D
强电解质 生石灰 硫酸钾 苛性钠 氯化钠
弱电解质 亚硫酸 氨水 氢硫酸 次氯酸
非电解质 干冰 二氧化硫 碳酸钙 氯气
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清无色透明溶液中:、、、
B.使酚酞试液呈红色的溶液中:、、、
C.加入Al能放出的溶液中:、、、;
D.由水电离出的的溶液中:、、、
6.已知水在25°C和100°C时,其电离平衡曲线如图所示,下列说法正确的( )
A.b点溶液呈酸性
B.d点溶液中可大量存在、、、
C.B曲线对应的温度下,溶液中水的电离度:b点>a点
D.A曲线对应的温度下,向纯水中加入少量金属Na,可使c点溶液变为d点溶液
7.用下列实验装置进行相应实验,实验设计评价不正确的是( )
甲 乙 丙 丁
A.利用装置甲可验证电离常数
B.利用装置乙证明对分解反应催化效果优于
C.利用装置丙可探究温度对平衡的影响、
D.利用装置丁不能探究压强对平衡的影响
8.下列事实中能证明是弱电解质的有几项( )
①常温下,的氨水中
②的氨水与的盐酸恰好完全反应
③常温下,5ml 的浓氨水中加水至5000mL,
④用氨水做导电实验,灯泡很暗
A.4项 B.3项 C.2项 D.1项
9.通过控制光沉积的方法构建复合材料光催化剂,以和渗透Nafion膜在酸性介质下构建了一个还原和氧化分离的人工光合体系,光照时,光催化电极产生电子()和空穴(),与相应物质发生氧化还原反应,其反应机理如图。下列说法错误的是( )
A.图中a、b分别代表和
B.体系中能量转化形式:光能→化学能
C.升高温度,总反应的化学平衡常数K减小
D.Nafion膜左侧发生的反应为:
10.常温下,pH均为2、体积均为的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH随的变化关系如图所示,下列叙述错误的是( )
A.常温下:
B.HC的电离度:a点点
C.当时,升高温度,减小
D.三种溶液分别与Zn反应产生相等质量的时,消耗HA的体积最多
二、非选择题(本题共4个小题,共60分)
11.(18分)电解质的水溶液跟日常生活、工农业生产和环境保护息息相关。完成下列问题:
(1)现有下列物质:①;②酒精;③溶液;④;⑤冰醋酸;⑥熔融状态的。其中能导电的物质有______(填序号)
(2)用等物质的量浓度的盐酸和醋酸分别与NaOH进行中和反应反应热的测定,测得反应热的数值情况,盐酸______醋酸(填“>”“<”或“=”),其原因是______
(3)已知25°C时,的;的: ;HCN的回答下列问题:
①25°C时,向NaCN溶液中通入少量,反应的离子方程式为______
②用蒸馏水稀释的醋酸,下列各式表示的数值随水量的增加而增大的是______
a. b. c. d.电离度
③下列措施中能使醋酸的水溶液中増大的同时减小的是______(填标号)。
A.加入固体 B.加入固体 C.加入NaCN固体 D.升高温度
(4)常温时 溶液,浓度为______,由水电离的为______。
(5)常温下,的NaOH溶液与的溶液按体积比为1:9混合,所得溶液的PH值为______。(近似认为酸碱总体积就是混合液体积)
(6)化学中常用AG表示溶液的酸度。室温下,向20.00mL 0.1000mol/L的氨水中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。
①根据图象可知,该稀硫酸的浓度为______。
②恰好完全中和时AG______0(填“>”、“<”或“=”)。
12.(10分)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池的总反应式为
;请回答下列问题:
(1)放电时,正极上的电极反应式为______;充电时,阴极附近溶液的碱性______。(填“增强”或“减弱”)
(2)高铁电池作为电源来进行电解。
①此装置中高铁电池的正极是______(填“X”或“Y”)
②电极A上的电极反应式为______。
③理论上当高铁电池中Zn极质量增加10.2g时,消耗的在标况下的体积为______。
13.(16分)加氢是对温室气体的有效转化,也是生成再生能源与化工原料重要途径。
(1)由加氢生成的反应为
①若为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。则该反应的反应热______
物质
0
②若在一定温度下的容积固定的密闭容器中进行该反应,则可以提高平衡转化率的措施有______(写出两种)。
③下列说法可以证明该反应已达到平衡状态的是______(填字母)。
a. b.的物质的量分数不再改变
c.容器内气体密度不再改变 d.和的浓度之比为1:2
e.混合气的平均摩尔质量不再变化 f.单位时间内生成的同时又消耗
④催化加氢合成过程中,活化的可能途径如有图所示,CO是活化的优势中间体,原因是______。
(2)一定条件下与也可以生成,某温度下在容积为2L的恒容密闭容器中充入和一定量发生反应:
。
的平衡分压与起始投料比的变化关系如图所示,已知b点对应投料比的起始压强为1.5kPa,则______。b点时,再充入和,使两者分压均增大0.2kPa,则此时平衡______(填“正向”、“逆向”或“不”)移动。
(3)一定条件下与还可以生成甲酸,方程式为 。恒定压强为100kPa时,向密闭容器中充入一定量的HCOOH气体,除了能分解成和,还能分解为CO和,反应为: ,则此平衡体系中CO或的选择性和HCOOH的转化率随温度变化曲线如图所示。
提示:CO(或氢气)的选择性
图中随着温度升高,HCOOH的转化率增大,请解释CO的选择性下降可能的原因:______;
400°C时的体积分数为______。
14.(16分)溶液常用作氧化还原反应滴定的标准液,由于的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质。
Ⅰ:配制标准溶液的操作是:
a.称取稍多于所需量的固体溶于水,将溶液加热并保持微沸1h;
b.用微孔玻璃漏斗过滤除去难溶的;
c.过滤得到的溶液贮存于棕色试剂瓶放在暗处;
d.利用氧化还原滴定方法,在70°C-80°C条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是______。
(2)准确量取一定体积的溶液用______。(填“酸式滴定管”或“碱式滴定管”)
(3)在下列物质中,用于标定溶液的基准试剂最好选用______。(填序号)
A. B. C.浓盐酸 D.
Ⅱ.氧化还原滴定原理与中和滴定原理相似:为测定某亚硝酸钠()样品的纯度,进行如下实验:
①称取样品ag,加水溶解,配制成100mL溶液。
②取25.00mL溶液于锥形瓶中,再向瓶中滴加少量酸化,用标准溶液进行滴定(还原产物为,滴定至终点时消耗溶液VmL。
(4)上述实验①所需玻璃仪器除玻璃棒、胶头滴管、烧杯之外还有______(填一种)。
(5)判断该实验达到滴定终点的现象是:______。
(6)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为______mL。
(7)下列叙述正确的是______。
A.滴定过程中发现溶液颜色变化立即读数,测定结果偏大
B.若用放置两周的标准溶液滴定,测得的浓度值将偏小
C.滴定前装有标准液的滴定管尖嘴处有气泡,滴定后气泡消失,测定结果偏大
D.装有标准液的滴定管滴定前读数正确,滴定后仰视滴定管读数,测定结果偏小
E.锥形瓶用蒸馏水洗涤后直接加入溶液,用溶液滴定,对实验无影响
(8)滴定过程中反应的离子方程式为:______
该样品中的质量分数为______(用含字母a、V的最简式表示)。
泉港二中2023秋季高二化学第三次月考化学科答案
1-5 DCCAB 6-10 CBCCA
11(18分)(1)③⑥(各1分)
(2)> 醋酸是弱电解质,电离过程中会吸热,造成放出的热量减少,所以反应热的数值会减小(各1分)
(3)①;②ad ③AC
(4)0.05mol/L (或者)
(5)10 (6)0.0500mol/L >(1分)
12(10分)(1);增强
(2)①Y ② ③2.24L
13.(16分)(1)①
②增大浓度、将或从体系中移出 ③be
④生成中间体CO反应的活化能小,反应速率快、CO中间体能量低,稳定,有利于生成
(2)或者 正向
(3)随着温度升高,主要发生反应,不利于分解生成CO和;
14.(1)将水中还原性物质完全氧化; (2)酸式滴定管(1分)
(3)A (4)100mL容量瓶(1分)
(5)当滴入最后半滴(或一滴)溶液时,锥形瓶中溶液由无色变为浅紫色(或浅红色),且半分钟内(或30s内)不褪色
(6)25.40 (7)CE
(8);或者
同课章节目录
