第九单元溶液单元同步训练卷(含答案)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液单元同步训练卷(含答案)-2023-2024学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 366.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 20:13:42 | ||
图片预览



文档简介
第九单元 溶液 单元同步训练卷
一、单选题
1.下列关于溶液的说法中正确的是
A.溶液一定是混合物 B.某温度下蔗糖溶液密封放置一段时间后会析出固体
C.溶液中溶质只能有一种 D.溶液一定是无色透明的液体
2.在一定温度下,向盛有100g蔗糖溶液的烧杯中再加入5g蔗糖,充分搅拌后,一定保持不变的是
A.溶质的质量 B.溶液的质量 C.蔗糖的溶解度 D.溶质的质量分数
3.推理是化学学习中的常用方法,下列推理正确的是
A.溶液具有均一性和稳定性,所以均一、稳定的液体都是溶液
B.氯化钠溶液中的溶质是以钠离子和氯离子形式存在的,所以溶质均以离子形式分散到溶剂中
C.饱和溶液是指在一定温度下不能继续溶解该溶质的溶液,所以同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.溶质质量分数是溶质质量与溶液质量之比,所以饱和溶液析出晶体后溶质质量分数一定变小
4.下列洗涤方法中利用了乳化原理的是
A.用洗洁精洗去餐具上的油污
B.用汽油洗去手上的油污
C.用酒精洗去试管中的碘
D.用稀盐酸清洗装过澄清石灰水的试剂瓶
5.已知X物质与Y物质的溶解度都随温度的升高而增大,20℃时,10g水中最多溶解4g X物质,30℃时,20g水中最多溶解 8g Y物质,则20℃时X与Y的溶解度相比是( )
A.X=Y B.X<Y C.X>Y D.无法比较
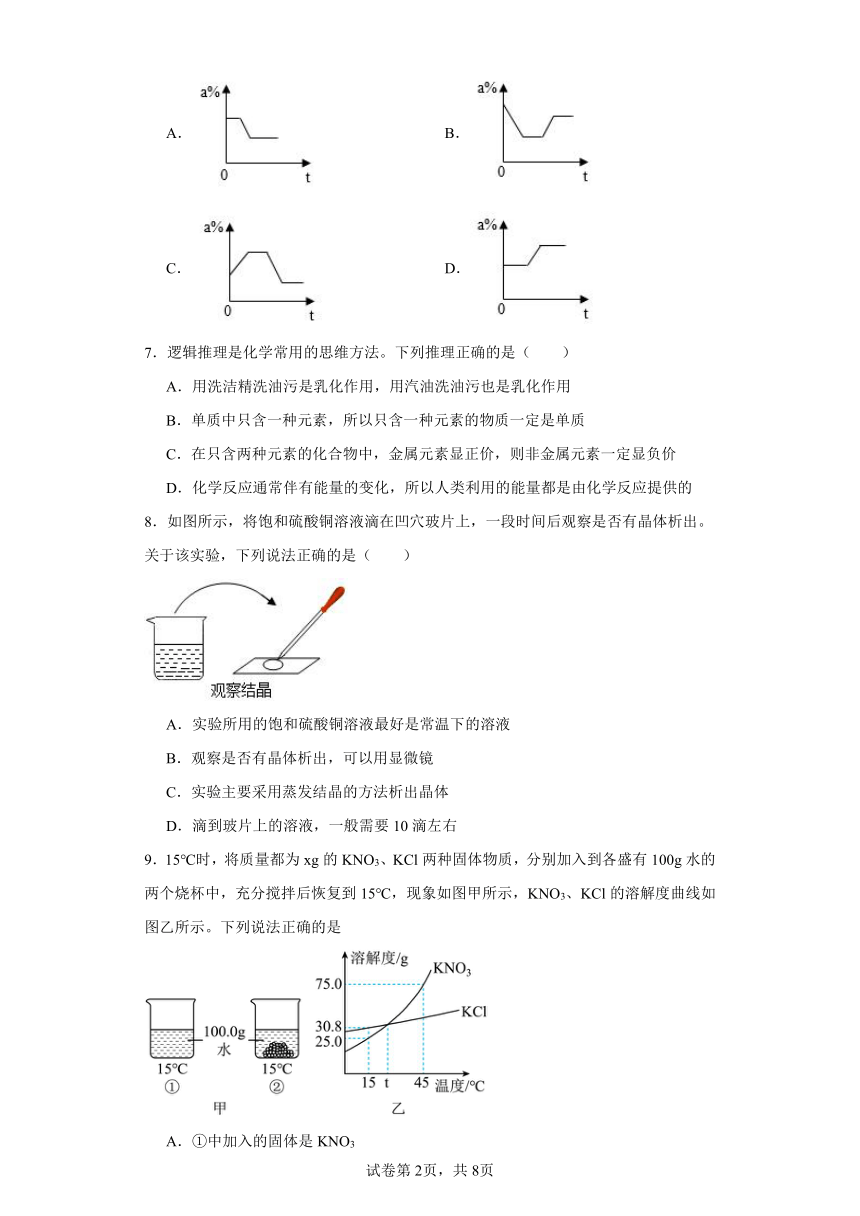
6.在T1温度时,将一定质量的KNO3饱和溶液恒温蒸发部分水,然后再将溶液逐渐冷却至T2(T1>T2)。能够正确表示此过程中溶质质量分数(a%)与时间t的关系示意图是( )
A. B.
C. D.
7.逻辑推理是化学常用的思维方法。下列推理正确的是( )
A.用洗洁精洗油污是乳化作用,用汽油洗油污也是乳化作用
B.单质中只含一种元素,所以只含一种元素的物质一定是单质
C.在只含两种元素的化合物中,金属元素显正价,则非金属元素一定显负价
D.化学反应通常伴有能量的变化,所以人类利用的能量都是由化学反应提供的
8.如图所示,将饱和硫酸铜溶液滴在凹穴玻片上,一段时间后观察是否有晶体析出。关于该实验,下列说法正确的是( )
A.实验所用的饱和硫酸铜溶液最好是常温下的溶液
B.观察是否有晶体析出,可以用显微镜
C.实验主要采用蒸发结晶的方法析出晶体
D.滴到玻片上的溶液,一般需要10滴左右
9.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图甲所示,KNO3、KCl的溶解度曲线如图乙所示。下列说法正确的是
A.①中加入的固体是KNO3
B.固体质量:25.0C.将①、②两烧杯的温度从15℃升高到t℃,两溶液都是饱和溶液
D.将KCl、KNO3的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
10.为探究硝酸钾的溶解性,进行了如图所示实验,结合硝酸钾在不同温度下的溶解度(下表),判断下列说法不正确的是
温度/ 10 20 30 40 50 60
溶解度 20.9 31.6 45.8 63.9 85.5 110.0
A.①③中的溶液均为不饱和溶液 B.②③中溶液的质量:③>②
C.④中析出晶体的质量是 D.溶液的溶质质量分数:③>②>④
11.化学小组用U形管设计了如下实验,其中能达到实验目的的是
A.证明分子在不断运动 B.可以随时控制反应的发生与停止
C.证明硝酸铵溶于水吸热 D.证明可燃物燃烧需要与氧气接触
A.A B.B C.C D.D
二、填空题
12.溶液与人类生产、生活密切相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填序号)。
A.植物油 B.面粉 C.白糖
(2)甲、乙、丙三种固体物质的溶解度曲线如图所示。
①t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 ;
②t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数最大的是 ;
③将t2℃时的甲、乙、丙三种物质饱和溶液降温至t1℃,所得三种溶液溶质质量分数由大到小的顺序是 。
13.认识溶液有助于我们更好的服务于生产、生活。
(1)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度升高。这种物质是 (填字母)
A.氢氧化钠 B.硝酸铵 C.氯化钠
(2)下图为KNO3和NaCl的溶解度曲线,请回答下列问题:
①t1℃时,KNO3的溶解度 NaCl的溶解度(填“大于”、“等于”或“小于”)
②t2℃时,接近饱和的KNO3的饱和转化为饱和溶液,可以采取的方法是 (一种即可)。
③已知20℃时KNO3的溶解度为31.6g:80℃时,KNO3的溶解度为169g。在20℃时,向盛有200g水的烧杯中加入80g KNO3,充分溶解,得到该温度时KNO3的 (填“饱和”或“不饱和”)溶液:若使烧杯内物质缓慢升温至80℃,最终所得溶液的质量为 g。
④当KNO3,中混有少量NaCl时,若要提纯KNO3,可以采用 的方法。(填“降温结晶”或“蒸发结晶”)
(3)欲配制50g质量分数为16%的氯化钠溶液,如图是部分操作过程。
①正确的操作顺序是甲→ → → → →己(填序号)。
②丙操作中仪器a的作用为
③配好50g该溶液后,稀释成10%的溶液需要加入水的质量是 g。
④下列错误操作中,可能导致溶质质量分数偏小的是 (填序号)
A.甲中NaCl含有杂质
B.丁操作中砝码和氯化钠放错托盘(1g以下用游码)
C. 己操作中溶液有少量酒出
14.溶液是生产生活中常用的物质。
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)为配制100g、15%的氯化钠溶液,需称取氯化钠 g。
(2)20℃时,分别配制等质量的氯化钠、硝酸钾的饱和溶液,所需水量较多的物质是 。
(3)60℃时,50g饱和硝酸钾溶液中,溶质与溶剂的质量比为 。
(4)某固体混合物含244gKNO3、36.3gNaCl。为得到尽可能多且纯度较高的硝酸钾,设计如下实验:在该固体中加入100g水,加热至100℃,固体全部溶解后,再 。(请将操作步骤补充完整)
15.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是 。
(2)t2℃时,物质a的溶解度与物质 的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是 (填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用 的方法。
16.小宁和小雨在家里配制蔗糖溶液,用于自制冰棍。结合蔗糖的溶解度表,回答下列问题:
温度/℃ 10 20 40 60
溶解度/g 191 204 238 287
(1)20℃时,蔗糖的溶解度为 g。
(2)20℃时,为了得到最甜的蔗糖溶液,二人决定配制80g蔗糖饱和溶液,则需要取用蔗糖的质量为 g(计算结果取整数)。
(3)配制过程中,能够加快蔗糖溶解的方法有 (答出一点即可)。
(4)取少量配好的饱和溶液品尝后,小宁认为溶液过甜,小雨仍坚持做最甜的冰棍。于是,二人倒出70g溶液,按如图方案(部分流程省略)分别制作冰棍。
下列说法正确的是_____。
A.b和d杯内,溶液的甜度:b=d
B.b和e杯内,溶液的甜度:b>e
C.冷却至10℃时,模具c内没有晶体析出
D.冷却至10℃时,模具f、g内均有晶体析出
三、计算题
17.某化学课外活动小组的同学为了测定某氮化镁样品中Mg3N2的质量分数,他们取氮化镁样品5.0g于烧杯中,加入100g某浓度的盐酸(足量),充分反应后(杂质不溶于水也不与盐酸反应),测得剩余固体的质量为1.0g。请计算:
(1)已知:Mg3N2与盐酸反应的生成物只有氯化镁和氯化铵,则在配平的该化学反应方程式中,HCl前面的化学计量数为________。
(2)氮化镁样品中Mg3N2的质量分数_____。(写出计算过程)
(3)此时所得溶液中氯化镁的质量分数_______。(写出计算过程)
18.日常生活中我们要科学地节约用水.现有一件刚用洗涤剂洗过的衣服,“拧干”后湿衣服上残留的溶液为100g,其中含洗涤剂的质量分数为,则:
该湿衣服上残留的洗涤剂的质量为________g.
现欲用5800g清水对这件湿衣服进行漂洗,有以下两种漂洗方法:方法一:用5800g清水一次性漂洗,“拧干”后残留的洗涤剂的质量为(用分数表示)________g.(假设每次“拧干”后湿衣服上残留的溶液为100g);方法二:将清水分成等质量的两份,分两次漂洗,“拧干”后残留的洗涤剂的质量为(用分数表示)________g.
由以上计算分析,两种漂洗的方法,哪一种效果好?________.
19.现有氢氧化镁和硫酸钡组成的固体混合物,某化学兴趣小组为确定其中硫酸钡的质量分数,将四等分混合物样品放入四个烧杯中,在分别加入一定量同浓度的稀盐酸进行4次实验,完全反应后测得数据如下表;(已知:①硫酸钡不溶于水,也不与酸反应。②)
实验 第一组 第二组 第三组 第四组
固体样品质量/g 20 20 20 20
稀盐酸质量/g 40 80 120 160
剩余固体质量/g 15.36 10.72 x 8.40
(1)表格中x的数值为
(2)该稀盐酸中溶质的质量分数为
(3)请分析实验数据,恰好完全反应后所得溶液中氯化镁的质量分数(保留到0.1%)
20.鲁巴同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质量为20.4g,为了分离出二氧化锰,她向残渣中加入40℃的水30g,充分溶解,第一次过滤后得到滤液A和8.4g残渣,她又向残渣中加入40℃的水10g,充分溶解,第二次过滤后得到滤液B和5.5g残渣(已知:氯酸钾、氯化钾易溶于水,二氧化锰难溶于水。假设在实验过程中药品无损失)。请回答下列问题:
(1)上述反应的方程式为 ;
(2)5.5g残渣的成分是 (填化学式);
(3)40℃时,在10g的水中最多能溶解氯化钾的质量为 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.C
6.A
7.C
8.B
9.B
10.C
11.C
12.(1)C
(2) 丙>乙>甲 甲 乙>丙>甲
13.(1)A
(2) 等于 恒温蒸发溶剂 饱和 280 降温结晶
(3) 丁 乙 戊 丙 搅拌,加速溶解 30 A
14.(1)15
(2)硝酸钾
(3)11:10
(4)将溶液降温至20℃,过滤
15.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
16.(1)204
(2)54
(3)加热或搅拌等(合理即可)
(4)AB
17.(1)8
(2)剩余固体为1.0g,所以氮化镁的质量=5.0g﹣1.0g=4.0g,氮化镁样品中Mg3N2的质量分数=;
(3)设:生成的氯化镁的质量为x。
Mg3N2+8HCl=2NH4Cl+3MgCl2
100 285
4.0g x
x=11.4g
此时所得溶液中氯化镁的质量分数为。
18.(1)1;(2);;(3)方法二
19.(1)8.40
(2)14.6%
(3)由(1)中的分析可知20g固体中含有的硫酸钡的质量为8.40g,氢氧化镁的质量就为20g-8.40g=11.6g,若使11.6g氢氧化镁恰好完全反应,设应加入该稀盐酸溶液的质量为n,生成的氯化镁的质量为z。
解得n=100g,z=19g
则恰好反应后氯化镁的质量分数为
答:恰好反应后所得溶液中氯化镁的质量分数为17.0%。
20.(1)2KClO32KCl+3O2↑
(2)MnO2
(3)4
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于溶液的说法中正确的是
A.溶液一定是混合物 B.某温度下蔗糖溶液密封放置一段时间后会析出固体
C.溶液中溶质只能有一种 D.溶液一定是无色透明的液体
2.在一定温度下,向盛有100g蔗糖溶液的烧杯中再加入5g蔗糖,充分搅拌后,一定保持不变的是
A.溶质的质量 B.溶液的质量 C.蔗糖的溶解度 D.溶质的质量分数
3.推理是化学学习中的常用方法,下列推理正确的是
A.溶液具有均一性和稳定性,所以均一、稳定的液体都是溶液
B.氯化钠溶液中的溶质是以钠离子和氯离子形式存在的,所以溶质均以离子形式分散到溶剂中
C.饱和溶液是指在一定温度下不能继续溶解该溶质的溶液,所以同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.溶质质量分数是溶质质量与溶液质量之比,所以饱和溶液析出晶体后溶质质量分数一定变小
4.下列洗涤方法中利用了乳化原理的是
A.用洗洁精洗去餐具上的油污
B.用汽油洗去手上的油污
C.用酒精洗去试管中的碘
D.用稀盐酸清洗装过澄清石灰水的试剂瓶
5.已知X物质与Y物质的溶解度都随温度的升高而增大,20℃时,10g水中最多溶解4g X物质,30℃时,20g水中最多溶解 8g Y物质,则20℃时X与Y的溶解度相比是( )
A.X=Y B.X<Y C.X>Y D.无法比较
6.在T1温度时,将一定质量的KNO3饱和溶液恒温蒸发部分水,然后再将溶液逐渐冷却至T2(T1>T2)。能够正确表示此过程中溶质质量分数(a%)与时间t的关系示意图是( )
A. B.
C. D.
7.逻辑推理是化学常用的思维方法。下列推理正确的是( )
A.用洗洁精洗油污是乳化作用,用汽油洗油污也是乳化作用
B.单质中只含一种元素,所以只含一种元素的物质一定是单质
C.在只含两种元素的化合物中,金属元素显正价,则非金属元素一定显负价
D.化学反应通常伴有能量的变化,所以人类利用的能量都是由化学反应提供的
8.如图所示,将饱和硫酸铜溶液滴在凹穴玻片上,一段时间后观察是否有晶体析出。关于该实验,下列说法正确的是( )
A.实验所用的饱和硫酸铜溶液最好是常温下的溶液
B.观察是否有晶体析出,可以用显微镜
C.实验主要采用蒸发结晶的方法析出晶体
D.滴到玻片上的溶液,一般需要10滴左右
9.15℃时,将质量都为xg的KNO3、KCl两种固体物质,分别加入到各盛有100g水的两个烧杯中,充分搅拌后恢复到15℃,现象如图甲所示,KNO3、KCl的溶解度曲线如图乙所示。下列说法正确的是
A.①中加入的固体是KNO3
B.固体质量:25.0
D.将KCl、KNO3的饱和溶液从45℃降温到15℃,析出晶体质量一定是KNO3>KCl
10.为探究硝酸钾的溶解性,进行了如图所示实验,结合硝酸钾在不同温度下的溶解度(下表),判断下列说法不正确的是
温度/ 10 20 30 40 50 60
溶解度 20.9 31.6 45.8 63.9 85.5 110.0
A.①③中的溶液均为不饱和溶液 B.②③中溶液的质量:③>②
C.④中析出晶体的质量是 D.溶液的溶质质量分数:③>②>④
11.化学小组用U形管设计了如下实验,其中能达到实验目的的是
A.证明分子在不断运动 B.可以随时控制反应的发生与停止
C.证明硝酸铵溶于水吸热 D.证明可燃物燃烧需要与氧气接触
A.A B.B C.C D.D
二、填空题
12.溶液与人类生产、生活密切相关。
(1)下列少量物质分别放入水中,充分搅拌,可以得到溶液的是______(填序号)。
A.植物油 B.面粉 C.白糖
(2)甲、乙、丙三种固体物质的溶解度曲线如图所示。
①t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 ;
②t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数最大的是 ;
③将t2℃时的甲、乙、丙三种物质饱和溶液降温至t1℃,所得三种溶液溶质质量分数由大到小的顺序是 。
13.认识溶液有助于我们更好的服务于生产、生活。
(1)在盛有水的烧杯中加入以下某种物质,形成溶液过程中,温度升高。这种物质是 (填字母)
A.氢氧化钠 B.硝酸铵 C.氯化钠
(2)下图为KNO3和NaCl的溶解度曲线,请回答下列问题:
①t1℃时,KNO3的溶解度 NaCl的溶解度(填“大于”、“等于”或“小于”)
②t2℃时,接近饱和的KNO3的饱和转化为饱和溶液,可以采取的方法是 (一种即可)。
③已知20℃时KNO3的溶解度为31.6g:80℃时,KNO3的溶解度为169g。在20℃时,向盛有200g水的烧杯中加入80g KNO3,充分溶解,得到该温度时KNO3的 (填“饱和”或“不饱和”)溶液:若使烧杯内物质缓慢升温至80℃,最终所得溶液的质量为 g。
④当KNO3,中混有少量NaCl时,若要提纯KNO3,可以采用 的方法。(填“降温结晶”或“蒸发结晶”)
(3)欲配制50g质量分数为16%的氯化钠溶液,如图是部分操作过程。
①正确的操作顺序是甲→ → → → →己(填序号)。
②丙操作中仪器a的作用为
③配好50g该溶液后,稀释成10%的溶液需要加入水的质量是 g。
④下列错误操作中,可能导致溶质质量分数偏小的是 (填序号)
A.甲中NaCl含有杂质
B.丁操作中砝码和氯化钠放错托盘(1g以下用游码)
C. 己操作中溶液有少量酒出
14.溶液是生产生活中常用的物质。
温度(℃) 20 30 40 60 80 100
溶解度(g/100g水) 氯化钠 36.0 36.3 36.6 37.3 38.4 39.8
硝酸钾 31.6 45.8 63.9 110 169 246
(1)为配制100g、15%的氯化钠溶液,需称取氯化钠 g。
(2)20℃时,分别配制等质量的氯化钠、硝酸钾的饱和溶液,所需水量较多的物质是 。
(3)60℃时,50g饱和硝酸钾溶液中,溶质与溶剂的质量比为 。
(4)某固体混合物含244gKNO3、36.3gNaCl。为得到尽可能多且纯度较高的硝酸钾,设计如下实验:在该固体中加入100g水,加热至100℃,固体全部溶解后,再 。(请将操作步骤补充完整)
15.如图是a、b、c三种物质的溶解度曲线,据图回答下列问题:
(1)三种物质的溶解度随着温度升高而减小的是 。
(2)t2℃时,物质a的溶解度与物质 的溶解度相等。
(3)t3℃时,把80g物质a加入200g水中充分搅拌、静置,形成的是 (填“饱和”或“不饱和”)溶液。
(4)t3℃时,将等质量a和b的饱和溶液降到t1℃时,析出晶体的质量关系正确的是______(填字母序号)。
A.a>b B.a=b C.a(5)如果a中混有少量固体b,若提纯a,一般采用 的方法。
16.小宁和小雨在家里配制蔗糖溶液,用于自制冰棍。结合蔗糖的溶解度表,回答下列问题:
温度/℃ 10 20 40 60
溶解度/g 191 204 238 287
(1)20℃时,蔗糖的溶解度为 g。
(2)20℃时,为了得到最甜的蔗糖溶液,二人决定配制80g蔗糖饱和溶液,则需要取用蔗糖的质量为 g(计算结果取整数)。
(3)配制过程中,能够加快蔗糖溶解的方法有 (答出一点即可)。
(4)取少量配好的饱和溶液品尝后,小宁认为溶液过甜,小雨仍坚持做最甜的冰棍。于是,二人倒出70g溶液,按如图方案(部分流程省略)分别制作冰棍。
下列说法正确的是_____。
A.b和d杯内,溶液的甜度:b=d
B.b和e杯内,溶液的甜度:b>e
C.冷却至10℃时,模具c内没有晶体析出
D.冷却至10℃时,模具f、g内均有晶体析出
三、计算题
17.某化学课外活动小组的同学为了测定某氮化镁样品中Mg3N2的质量分数,他们取氮化镁样品5.0g于烧杯中,加入100g某浓度的盐酸(足量),充分反应后(杂质不溶于水也不与盐酸反应),测得剩余固体的质量为1.0g。请计算:
(1)已知:Mg3N2与盐酸反应的生成物只有氯化镁和氯化铵,则在配平的该化学反应方程式中,HCl前面的化学计量数为________。
(2)氮化镁样品中Mg3N2的质量分数_____。(写出计算过程)
(3)此时所得溶液中氯化镁的质量分数_______。(写出计算过程)
18.日常生活中我们要科学地节约用水.现有一件刚用洗涤剂洗过的衣服,“拧干”后湿衣服上残留的溶液为100g,其中含洗涤剂的质量分数为,则:
该湿衣服上残留的洗涤剂的质量为________g.
现欲用5800g清水对这件湿衣服进行漂洗,有以下两种漂洗方法:方法一:用5800g清水一次性漂洗,“拧干”后残留的洗涤剂的质量为(用分数表示)________g.(假设每次“拧干”后湿衣服上残留的溶液为100g);方法二:将清水分成等质量的两份,分两次漂洗,“拧干”后残留的洗涤剂的质量为(用分数表示)________g.
由以上计算分析,两种漂洗的方法,哪一种效果好?________.
19.现有氢氧化镁和硫酸钡组成的固体混合物,某化学兴趣小组为确定其中硫酸钡的质量分数,将四等分混合物样品放入四个烧杯中,在分别加入一定量同浓度的稀盐酸进行4次实验,完全反应后测得数据如下表;(已知:①硫酸钡不溶于水,也不与酸反应。②)
实验 第一组 第二组 第三组 第四组
固体样品质量/g 20 20 20 20
稀盐酸质量/g 40 80 120 160
剩余固体质量/g 15.36 10.72 x 8.40
(1)表格中x的数值为
(2)该稀盐酸中溶质的质量分数为
(3)请分析实验数据,恰好完全反应后所得溶液中氯化镁的质量分数(保留到0.1%)
20.鲁巴同学在实验室用一定量的氯酸钾和二氧化锰混合物制取氧气,加热至固体质量不再减少时,称得固体残渣质量为20.4g,为了分离出二氧化锰,她向残渣中加入40℃的水30g,充分溶解,第一次过滤后得到滤液A和8.4g残渣,她又向残渣中加入40℃的水10g,充分溶解,第二次过滤后得到滤液B和5.5g残渣(已知:氯酸钾、氯化钾易溶于水,二氧化锰难溶于水。假设在实验过程中药品无损失)。请回答下列问题:
(1)上述反应的方程式为 ;
(2)5.5g残渣的成分是 (填化学式);
(3)40℃时,在10g的水中最多能溶解氯化钾的质量为 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.C
4.A
5.C
6.A
7.C
8.B
9.B
10.C
11.C
12.(1)C
(2) 丙>乙>甲 甲 乙>丙>甲
13.(1)A
(2) 等于 恒温蒸发溶剂 饱和 280 降温结晶
(3) 丁 乙 戊 丙 搅拌,加速溶解 30 A
14.(1)15
(2)硝酸钾
(3)11:10
(4)将溶液降温至20℃,过滤
15.(1)c
(2)b
(3)不饱和
(4)A
(5)降温结晶
16.(1)204
(2)54
(3)加热或搅拌等(合理即可)
(4)AB
17.(1)8
(2)剩余固体为1.0g,所以氮化镁的质量=5.0g﹣1.0g=4.0g,氮化镁样品中Mg3N2的质量分数=;
(3)设:生成的氯化镁的质量为x。
Mg3N2+8HCl=2NH4Cl+3MgCl2
100 285
4.0g x
x=11.4g
此时所得溶液中氯化镁的质量分数为。
18.(1)1;(2);;(3)方法二
19.(1)8.40
(2)14.6%
(3)由(1)中的分析可知20g固体中含有的硫酸钡的质量为8.40g,氢氧化镁的质量就为20g-8.40g=11.6g,若使11.6g氢氧化镁恰好完全反应,设应加入该稀盐酸溶液的质量为n,生成的氯化镁的质量为z。
解得n=100g,z=19g
则恰好反应后氯化镁的质量分数为
答:恰好反应后所得溶液中氯化镁的质量分数为17.0%。
20.(1)2KClO32KCl+3O2↑
(2)MnO2
(3)4
答案第1页,共2页
答案第1页,共2页
同课章节目录
