第2章化学反应的方向、限度与速率单元同步练习题--2023-2024学年高二化学鲁科版选择性必修1
文档属性
| 名称 | 第2章化学反应的方向、限度与速率单元同步练习题--2023-2024学年高二化学鲁科版选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 652.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 20:02:33 | ||
图片预览




文档简介
第2章 化学反应的方向、限度与速率 单元同步练习题
一、单选题
1.在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
A.
B.该反应的平衡常数表达式为
C.在时加入催化剂,平衡时
D.达到平衡状态后,充入纯氧,再次达到平衡后,
2.在恒温恒容的密闭容器中发生 ,T℃时,该反应的化学平衡常数为K,下列说法正确的是
A.其他条件相同,升高温度降低正反应速率、提高逆反应速率
B.T℃时,若时,则
C.若容器内CO(NH2)2保持不变,该可逆反应达到化学平衡状态
D.一定条件下,能完全转化为
3.T℃时,存在如下平衡:。该反应正、逆反应速率与的浓度关系为:,(是速率常数),且与的关系如图所示,下列说法正确的是
A.图中表示的是线II
B.T℃时,往刚性容器中充入一定量,平衡后测得为,则平衡时
C.T℃时,该反应的平衡常数
D.T℃时向恒容密闭容器中充入,某时刻,则此时的转化率为
4.用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
5.向一恒容密闭容器中加入1molCH4和一定量的H2O,发生反应:。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:Vb正>Vc正
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
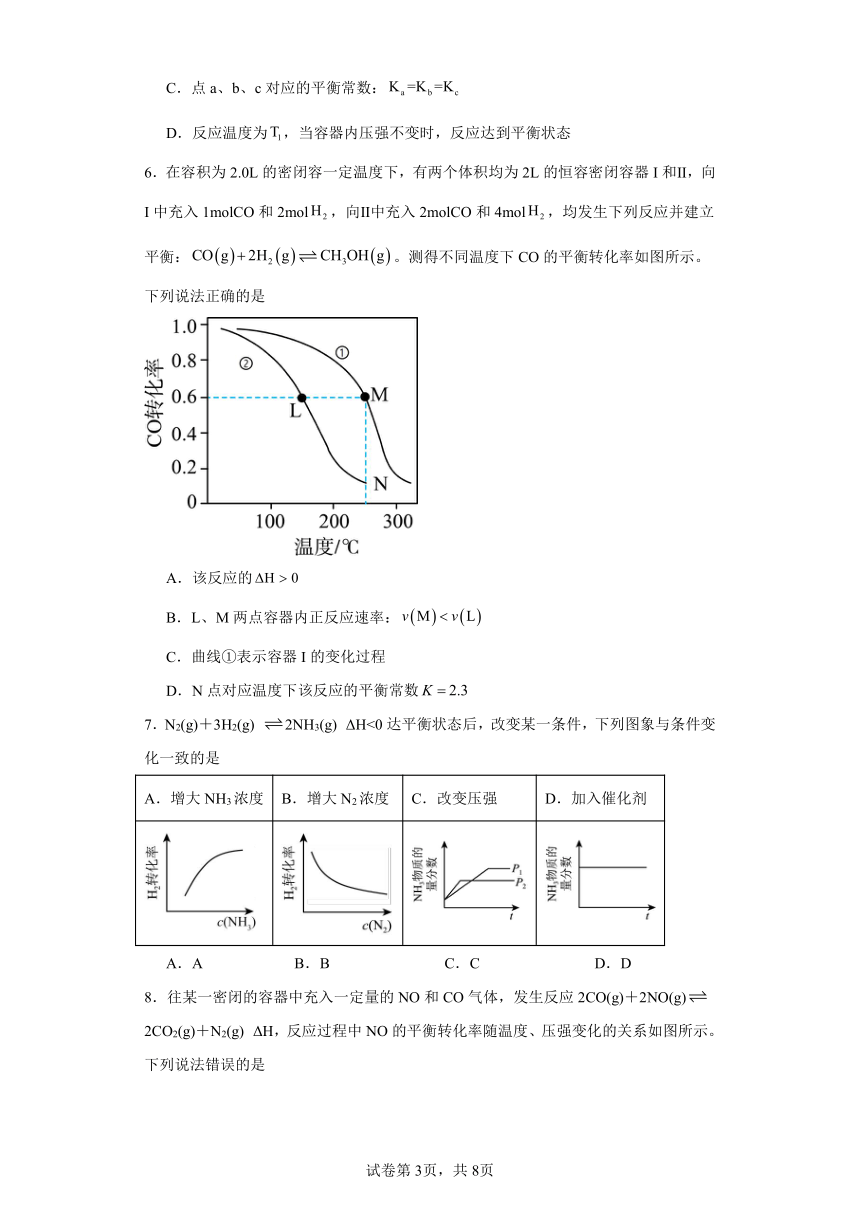
6.在容积为2.0L的密闭容一定温度下,有两个体积均为2L的恒容密闭容器I和Ⅱ,向I中充入1molCO和2mol,向Ⅱ中充入2molCO和4mol,均发生下列反应并建立平衡:。测得不同温度下CO的平衡转化率如图所示。下列说法正确的是
A.该反应的
B.L、M两点容器内正反应速率:
C.曲线①表示容器I的变化过程
D.N点对应温度下该反应的平衡常数
7.N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态后,改变某一条件,下列图象与条件变化一致的是
A.增大NH3浓度 B.增大N2浓度 C.改变压强 D.加入催化剂
A.A B.B C.C D.D
8.往某一密闭的容器中充入一定量的NO和CO气体,发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH,反应过程中NO的平衡转化率随温度、压强变化的关系如图所示。下列说法错误的是
A.该反应的反应物的总能量大于生成物的总能量
B.p1>p2
C.加入合适的催化剂,ΔH的大小和CO的平衡转化率均保持不变
D.适当地降低温度,可使该反应的平衡常数不变
9.如表所示,在三个初始温度均为的容器中进行反应: 。下列说法正确的是
容器编号 容器类型 初始体积 反应物的起始投入量/mol 平衡时n(C)/mol
A B C
甲 恒温恒容 1L 0 0 2 1.6
乙 恒容绝热 1L 2 1 0 a
丙 恒温恒容 3L 6 3 0 b
A.a>1.6
B.b>4.8
C.下该反应的平衡常数
D.平衡时A的正反应速率:
10.恒温下气体反应达到化学平衡,平衡常数。恒容时,若降低温度,D的浓度增大。下列说法错误的是
A.该反应的化学方程式为
B.增大不变
C.恒容时,向容器中充入,反应速率加快
D.正反应为放热反应
11.在一定温度下,恒容密闭容器中进行反应,下列说法正确的是
A.反应一段时间后只存在于和中
B.向容器中通入少量,反应速率减小
C.达到平衡状态时,与物质的量保持不变
D.容器内密度不再变化时,判定反应已经达到平衡状态
12.某温度时,在1L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化曲线如图所示。下列叙述正确的是
A.该反应的化学方程式为
B.达到平衡时,A和B浓度保持不变
C.4min时,该反应已处于化学平衡状态
D.0~4min,B的平均反应速率为0.1mol/(L min)
13.下列说法正确的是
A.某温度下,反应,在密闭容器中达到平衡,恒容下,充入一定量的,的平衡转化率减小
B.恒温恒容情况下,发生反应:,当混合气体质量保持不变时,说明反应已达到平衡
C.合成氨工业中,恒温恒容情况下,充入惰性气体,体系压强增大,反应速率增大
D.某温度下,可逆反应的平衡常数为,若缩小反应器的容积,能使平衡正向移动,则,并且增大
14.已知在瞬间即可达成化学平衡。NO2和N2O4混合气体体积由V压缩至时,相关数据变化如下表。根据表中数据得出若干结论,下列结论不正确的是
温度/L 气体的总压强/Pa NO2的物质的量浓度/mol·L-1
298 1.28×10-2
311 2.80×10-2
A.体积由V压缩至时,NO2的物质的量增大
B.正反应和逆反应的活化能均较低
C.体积缩小后混合气体的颜色加深
D.其它条件不变,温度升高,该反应逆向移动
二、非选择题
15.目前烟气脱硝采用的技术有无催化剂的选择性还原法(SNCR)和使用催化剂的选择性还原法(SCR)。若用NH3作还原剂,则主要反应均可表示为: ,其中体系温度对SNCR技术脱硝效率的影响如图所示:
(1)当体系温度过高时,SNCR技术脱硝效率会降低,其原因是 ;
(2)SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是 。
16.某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度):
(1)图像中和的关系是: (填“>、<或=”)。
(2)a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
17.肼()是一种应用广泛的化工原料。工业上先合成氨气:,再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是 (填“A”或“B”或“C”)
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 平衡常数K
变化情况
(3)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中含量(体积%)的变化情况,已知初始时。判断、压强的大小关系, (选填“>”、“<”或“=”)。
18.恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。[已知:2SO2(g)+O2(g)2SO3(g) ΔH=﹣196.9kJ mol﹣1]
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
A.升高温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2| (填“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.由图知,升高温度,的体积分数增大,故升高温度,平衡逆向移动,正反应为放热反应,,A错误;
B.由,得该反应的平衡常数表达式为,B正确;
C.由图知,时,催化剂能加快反应但不影响平衡的移动,不改变氧气含量,C正确;
D.达到平衡状态后,充入纯氧不影响平衡常数,,则再次达到平衡后,,,D正确;
故选A。
2.B
【详解】A.升高温度正反应速率和逆反应速率都增大,故A错误;
B.时平衡正向移动,,故B正确;
C.CO(NH2)2是固体,增加或减少CO(NH2)2平衡不发生移动;因此容器内CO(NH2)2保持不变,不能判断达到化学平衡状态,故C错误;
D.该反应是可逆反应,不可能完全转化,故D错误;
故答案为:B。
3.C
【详解】A.由图可知,lgc(NO2)和lgc(N2O4)均为0时,即c(NO2)和c(N2O4)均为1mol/L,由正逆反应速率的表达式可知,v正=100v逆,故表示lgv正~lgc(NO2)的线是Ⅰ,故A错误;
B.平衡后测得c(N2O4)为1.0mol/L,lgv逆=a,v逆=10a,故B错误;
C.lgc(NO2)和lgc(N2O4)均为0时,即c(NO2)和c(N2O4)均为1mol/L,lgv正=a+2,v正=10a+2=k正c2 (NO2)=k正,lgv逆=a,v逆=10a=k逆c(N2O4)=k逆,=100,当反应达到平衡状态时v正=v逆,则k正c2 (NO2)=k逆c(N2O4),该反应的平衡常数,故C正确;
D.由v正=k正c2(NO2),v正=4×10amol/(L min),c(NO2)=1mol/L时,lgv正=a+2,v正=10a+2=k正c2 (NO2)=k正,得c2(NO2)=,c(NO2)=0.2mol/L,c(NO2)=0.2mol/L,n(NO2)=0.4mol,故NO2的转化率=×100%=75%,故D错误;
故选:C。
4.B
【详解】A.该反应是一个气体体积增大的反应,因此上述反应,A错误;
B.上述反应平衡常数,B正确;
C.上述反应中消耗,转移电子的数目为,C错误;
D.实际应用中,加入尿素的量过多,导致尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,D错误;
故选B。
5.C
【详解】A.增大,平衡正向移动,根据勒夏特列原理甲烷的转化率减小,因此,A正确;
B.b、c是温度相同的平衡状态,相同甲烷浓度条件下c点水的浓度比b点大,Vb正>Vc正,B正确;
C.K只受温度影响,a和b相同投料比,但是b点甲烷转化率大于a点,因此,则,C错误;
D.恒容密闭容器中,反应正向体积增大,压强不变时说明各组分含量不再变化,达到平衡,D正确;
故选C。
6.D
【详解】A.由图知,升高温度,一氧化碳得转化率降低,平衡逆向移动,故正反向为放热反应,,A错误;
B.M点容器内反应物浓度比L点容器内反应物浓度大,且M点对应的反应温度更高,反应速率更快,即,B错误;
C.相同温度下,增大压强,CO的平衡转化率增大,故曲线①表示容器Ⅱ的转化过程,C错误;
D.N 点对应温度下反应的平衡常数与M点相同,由于CO的转化率为60%,故c(CO)=1mol×(1-60%)=0.4mol,c(H2)=2mol×(1-60%)=0.8mol,c(CH3OH)=1mol×60%=0.6mol,,D正确;
故选D。
7.D
【详解】A.增大氨气浓度平衡逆向移动,氢气的转化率减小,故A错误;
B.增大氮气的浓度,平衡正向移动,氢气的转化率增大,故B错误;
C.P2先达到平衡,因此P2>P1,正向体积减小,增大压强平衡正向移动氨气的物质的量分数增大,故C错误;
D.催化剂不影响平衡,加入催化剂后按期的物质的量分数不变,故D正确;
故选D。
8.D
【详解】A.根据图像知,升高温度,NO的平衡转化率减小,则说明平衡逆向移动,即该反应正反应方向为放热,反应物的总能量大于生成物的总能量,A正确;
B.反应为气体分子数减小的放热反应,则增大压强有利于平衡向正向移动,可提高NO的平衡转化率,由图像知,同一温度下,p1压强下NO的平衡转化率较p2的大,则说明压强:p1>p2,B正确;
C.合适的催化剂可降低反应的活化能,改变反应路径,但反应热和CO的平衡转化率不改变,C正确;
D.上述反应放热,则适当降低温度,平衡正向移动,反应的平衡常数会增大,D错误;
故选D。
9.C
【详解】A.该反应放热,甲与乙两个容器的投料比等效,绝热恒容与恒温恒容相比,相当于升高温度,平衡逆向进行,平衡时C的物质的量减小,a<1.6,A错误;
B.丙的投料比等效于甲的3倍,丙的容器体积也是甲的3倍,甲容器与丙容器均为恒温恒容,相同条件下达到平衡状态,b=4.8,B错误;
C.根据容器甲的反应列三段式,,平衡常数,C正确;
D.乙为恒温绝热容器,随着反应的进行,容器内温度升高,反应速率加快,则平衡时A的正反应速率:,D错误;
故选C。
10.C
【详解】A.根据平衡常数的计算式得出该反应的化学方程式为,A项正确;
B.增大,平衡正向移动,但只与温度有关,温度没变,因此K不变,B项正确;
C.恒容时,向容器中充入稀有气体Ne,各物质的浓度不变,反应速率不变,C项错误;
D.降低温度,D的浓度增大,平衡正向移动,正反应是放热反应,D项正确;
故选:C。
11.C
【详解】A.反应可逆,反应一段时间后18O存在于O2、SO2和SO3中,故A错误;
B.向容器中通入少量,逆反应的反应物浓度增大,逆反应速率增大,导致正反应速率也随着增大,故B错误;
C.达到平衡状态时,SO2与SO3物质的量保持不变,故C正确;
D.反应前后气体总质量不变、容器体积不变,密度是恒量,容器内密度不再变化时,反应不一定达到平衡状态,故D错误;
故选C。
12.B
【分析】由图像信息可知,随着时间的变化,A的物质的量在减少,B的物质的量在增加,但是A曲线与B曲线在4min时还有上升和下降的趋势,故在4min时并没有平衡,但是在8min时,两条曲线已变直,说明已经达到平衡;
【详解】A.由图可知A是反应物,B是生成物,达到平衡时,消耗的时间是一样的,A的变化量为0.6mol,B的变化量为0.3mol,变化量之比等于化学计量数之比,该反应的化学方程式为2A B,故A错误;
B.反应达到平衡时,A与B的浓度应该保持不变,故B正确;
C.4min 后A和B的浓度仍在变化,说明未达到平衡状态,8min时图像中的两条曲线都变直了,说明浓度不再发生改变,说明此时反应达到平衡,故C错误;
D.0~4min,B的平均反应速率为,故D错误;
故本题选B。
13.A
【详解】A.根据勒夏特列原理可知,充入一定量的,不能完全转化,则的平衡转化率减小,故A正确;
B.该反应都是气体物质参与,恒温恒容时,混合气体质量一直保持不变,不能说明反应已达到平衡,故B错误;
C.恒容下充入惰性气体He,反应物和产物浓度不变,则反应速率不变,故C错误;
D.化学平衡常数只受温度影响,与浓度无关,若缩小反应器的容积,能使平衡正向移动,则,但温度不变化学平衡常数K不变,故D错误;
故选:A。
14.D
【详解】A.体积为VL时,NO2的物质的量为1.28×10-2mol/L×VL=1.28×10-2Vmol,体积为时,NO2的物质的量为2.80×10-2mol/L×L=1.40×10-2Vmol,NO2的物质的量增大,A正确;
B.由于该反应在瞬间即可达成化学平衡,所以正反应和逆反应的活化能均较低,B正确;
C.体积缩小后,NO2的浓度增大,则混合气体的颜色加深,C正确;
D.由于该反应为吸热反应,则其它条件不变,温度升高,该反应正向移动,D错误;
故选D。
15.(1)正反应放热,升高温度,平衡逆向移动
(2)温度太高催化剂活性降低
【详解】(1)正反应放热,升高温度,平衡逆向移动,SNCR技术脱硝效率会降低;
(2)温度太高催化剂活性降低,所以SCR技术的反应温度不能太高。
16.(1)>
(2)c
【详解】(1)该反应为放热反应,温度升高,化学平衡向着吸热方向进行,即逆反应方向,从到生成物的量增加,平衡正移,故;
(2)由于该反应是放热反应,当温度升高时,平衡应向逆方向移动,所以a点未达到平衡,b、c、d点达到平衡状态,且c点氢气添加比例最高,的转化率最大。
17.(1)A
(2) 增大 减小
(3)<
【详解】(1)其它条件相同时,催化剂对反应速率加快倍数越大、所需温度越低越好,根据图知,A、B对反应速率加快倍数大于C,但是A所需温度小于B,且在较低温度下具备较高的催化活性,一方面可节约能源,另一方面低温有利于反应的转化,所以生产中适宜选择的催化剂是A,故答案为:A;
(2)压缩体积相当于增大压强,压强越大单位体积内活化分子个数越大,化学反应速率越快,温度越高活化分子百分数越大,化学反应速率越快;升高温度平衡逆向移动,生成物浓度减小、反应物浓度增大,则化学平衡常数减小,故答案为:增大;减小;
(3)温度一定时,增大压强平衡正向移动,NH3的体积分数增大,根据图知,温度一定时氨气的体积分数:pl<p2,则压强pl<p2,故答案为:<。
18.(1)S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1
(2)C
(3)大
(4) 升高温度 t3~t4
【分析】图1显示硫单质和氧气生成二氧化硫是放热反应,二氧化硫转化为三氧化硫是可逆反应且放热。燃烧热是指101kPa下,1mol纯物质完全燃烧生成指定化合物时所释放的热量。
【详解】(1)据图像,1mol S燃烧生成气态二氧化硫放出297kJ的热量,故S燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1,答案为:S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1;
(2)n(SO3)/n(SO2)比图1中增大,则反应正向移动,反应正向体积减小、放热,可以采用降低温度和增大压强的方式,故答案为:C;
(3)恒温恒容时,1mol SO2和2mol O2充分反应,比图中增加了氧气的浓度,平衡正向移动了,因此放出热量更多,放出热量的数值比大;答案为:大;
(4)t4平衡逆向移动,且速率整体增大,反应正向放热,因此是升高了温度;t2时平衡正向移动,t3达到平衡态,t4平衡逆向移动,t5达到新平衡后,平衡不再移动,因此t3~t4时三氧化硫含量最高,故答案为:升高温度、t3~t4。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
A.
B.该反应的平衡常数表达式为
C.在时加入催化剂,平衡时
D.达到平衡状态后,充入纯氧,再次达到平衡后,
2.在恒温恒容的密闭容器中发生 ,T℃时,该反应的化学平衡常数为K,下列说法正确的是
A.其他条件相同,升高温度降低正反应速率、提高逆反应速率
B.T℃时,若时,则
C.若容器内CO(NH2)2保持不变,该可逆反应达到化学平衡状态
D.一定条件下,能完全转化为
3.T℃时,存在如下平衡:。该反应正、逆反应速率与的浓度关系为:,(是速率常数),且与的关系如图所示,下列说法正确的是
A.图中表示的是线II
B.T℃时,往刚性容器中充入一定量,平衡后测得为,则平衡时
C.T℃时,该反应的平衡常数
D.T℃时向恒容密闭容器中充入,某时刻,则此时的转化率为
4.用尿素水解生成的催化还原,是柴油机车辆尾气净化的主要方法。反应为,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
5.向一恒容密闭容器中加入1molCH4和一定量的H2O,发生反应:。CH4的平衡转化率按不同投料比随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:Vb正>Vc正
C.点a、b、c对应的平衡常数:
D.反应温度为,当容器内压强不变时,反应达到平衡状态
6.在容积为2.0L的密闭容一定温度下,有两个体积均为2L的恒容密闭容器I和Ⅱ,向I中充入1molCO和2mol,向Ⅱ中充入2molCO和4mol,均发生下列反应并建立平衡:。测得不同温度下CO的平衡转化率如图所示。下列说法正确的是
A.该反应的
B.L、M两点容器内正反应速率:
C.曲线①表示容器I的变化过程
D.N点对应温度下该反应的平衡常数
7.N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态后,改变某一条件,下列图象与条件变化一致的是
A.增大NH3浓度 B.增大N2浓度 C.改变压强 D.加入催化剂
A.A B.B C.C D.D
8.往某一密闭的容器中充入一定量的NO和CO气体,发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH,反应过程中NO的平衡转化率随温度、压强变化的关系如图所示。下列说法错误的是
A.该反应的反应物的总能量大于生成物的总能量
B.p1>p2
C.加入合适的催化剂,ΔH的大小和CO的平衡转化率均保持不变
D.适当地降低温度,可使该反应的平衡常数不变
9.如表所示,在三个初始温度均为的容器中进行反应: 。下列说法正确的是
容器编号 容器类型 初始体积 反应物的起始投入量/mol 平衡时n(C)/mol
A B C
甲 恒温恒容 1L 0 0 2 1.6
乙 恒容绝热 1L 2 1 0 a
丙 恒温恒容 3L 6 3 0 b
A.a>1.6
B.b>4.8
C.下该反应的平衡常数
D.平衡时A的正反应速率:
10.恒温下气体反应达到化学平衡,平衡常数。恒容时,若降低温度,D的浓度增大。下列说法错误的是
A.该反应的化学方程式为
B.增大不变
C.恒容时,向容器中充入,反应速率加快
D.正反应为放热反应
11.在一定温度下,恒容密闭容器中进行反应,下列说法正确的是
A.反应一段时间后只存在于和中
B.向容器中通入少量,反应速率减小
C.达到平衡状态时,与物质的量保持不变
D.容器内密度不再变化时,判定反应已经达到平衡状态
12.某温度时,在1L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化曲线如图所示。下列叙述正确的是
A.该反应的化学方程式为
B.达到平衡时,A和B浓度保持不变
C.4min时,该反应已处于化学平衡状态
D.0~4min,B的平均反应速率为0.1mol/(L min)
13.下列说法正确的是
A.某温度下,反应,在密闭容器中达到平衡,恒容下,充入一定量的,的平衡转化率减小
B.恒温恒容情况下,发生反应:,当混合气体质量保持不变时,说明反应已达到平衡
C.合成氨工业中,恒温恒容情况下,充入惰性气体,体系压强增大,反应速率增大
D.某温度下,可逆反应的平衡常数为,若缩小反应器的容积,能使平衡正向移动,则,并且增大
14.已知在瞬间即可达成化学平衡。NO2和N2O4混合气体体积由V压缩至时,相关数据变化如下表。根据表中数据得出若干结论,下列结论不正确的是
温度/L 气体的总压强/Pa NO2的物质的量浓度/mol·L-1
298 1.28×10-2
311 2.80×10-2
A.体积由V压缩至时,NO2的物质的量增大
B.正反应和逆反应的活化能均较低
C.体积缩小后混合气体的颜色加深
D.其它条件不变,温度升高,该反应逆向移动
二、非选择题
15.目前烟气脱硝采用的技术有无催化剂的选择性还原法(SNCR)和使用催化剂的选择性还原法(SCR)。若用NH3作还原剂,则主要反应均可表示为: ,其中体系温度对SNCR技术脱硝效率的影响如图所示:
(1)当体系温度过高时,SNCR技术脱硝效率会降低,其原因是 ;
(2)SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是 。
16.某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度):
(1)图像中和的关系是: (填“>、<或=”)。
(2)a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
17.肼()是一种应用广泛的化工原料。工业上先合成氨气:,再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是 (填“A”或“B”或“C”)
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 平衡常数K
变化情况
(3)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中含量(体积%)的变化情况,已知初始时。判断、压强的大小关系, (选填“>”、“<”或“=”)。
18.恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。[已知:2SO2(g)+O2(g)2SO3(g) ΔH=﹣196.9kJ mol﹣1]
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
A.升高温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2| (填“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.由图知,升高温度,的体积分数增大,故升高温度,平衡逆向移动,正反应为放热反应,,A错误;
B.由,得该反应的平衡常数表达式为,B正确;
C.由图知,时,催化剂能加快反应但不影响平衡的移动,不改变氧气含量,C正确;
D.达到平衡状态后,充入纯氧不影响平衡常数,,则再次达到平衡后,,,D正确;
故选A。
2.B
【详解】A.升高温度正反应速率和逆反应速率都增大,故A错误;
B.时平衡正向移动,,故B正确;
C.CO(NH2)2是固体,增加或减少CO(NH2)2平衡不发生移动;因此容器内CO(NH2)2保持不变,不能判断达到化学平衡状态,故C错误;
D.该反应是可逆反应,不可能完全转化,故D错误;
故答案为:B。
3.C
【详解】A.由图可知,lgc(NO2)和lgc(N2O4)均为0时,即c(NO2)和c(N2O4)均为1mol/L,由正逆反应速率的表达式可知,v正=100v逆,故表示lgv正~lgc(NO2)的线是Ⅰ,故A错误;
B.平衡后测得c(N2O4)为1.0mol/L,lgv逆=a,v逆=10a,故B错误;
C.lgc(NO2)和lgc(N2O4)均为0时,即c(NO2)和c(N2O4)均为1mol/L,lgv正=a+2,v正=10a+2=k正c2 (NO2)=k正,lgv逆=a,v逆=10a=k逆c(N2O4)=k逆,=100,当反应达到平衡状态时v正=v逆,则k正c2 (NO2)=k逆c(N2O4),该反应的平衡常数,故C正确;
D.由v正=k正c2(NO2),v正=4×10amol/(L min),c(NO2)=1mol/L时,lgv正=a+2,v正=10a+2=k正c2 (NO2)=k正,得c2(NO2)=,c(NO2)=0.2mol/L,c(NO2)=0.2mol/L,n(NO2)=0.4mol,故NO2的转化率=×100%=75%,故D错误;
故选:C。
4.B
【详解】A.该反应是一个气体体积增大的反应,因此上述反应,A错误;
B.上述反应平衡常数,B正确;
C.上述反应中消耗,转移电子的数目为,C错误;
D.实际应用中,加入尿素的量过多,导致尿素水解生成的氨气过量,柴油机车辆排放的氨气对空气污染程度增大,D错误;
故选B。
5.C
【详解】A.增大,平衡正向移动,根据勒夏特列原理甲烷的转化率减小,因此,A正确;
B.b、c是温度相同的平衡状态,相同甲烷浓度条件下c点水的浓度比b点大,Vb正>Vc正,B正确;
C.K只受温度影响,a和b相同投料比,但是b点甲烷转化率大于a点,因此,则,C错误;
D.恒容密闭容器中,反应正向体积增大,压强不变时说明各组分含量不再变化,达到平衡,D正确;
故选C。
6.D
【详解】A.由图知,升高温度,一氧化碳得转化率降低,平衡逆向移动,故正反向为放热反应,,A错误;
B.M点容器内反应物浓度比L点容器内反应物浓度大,且M点对应的反应温度更高,反应速率更快,即,B错误;
C.相同温度下,增大压强,CO的平衡转化率增大,故曲线①表示容器Ⅱ的转化过程,C错误;
D.N 点对应温度下反应的平衡常数与M点相同,由于CO的转化率为60%,故c(CO)=1mol×(1-60%)=0.4mol,c(H2)=2mol×(1-60%)=0.8mol,c(CH3OH)=1mol×60%=0.6mol,,D正确;
故选D。
7.D
【详解】A.增大氨气浓度平衡逆向移动,氢气的转化率减小,故A错误;
B.增大氮气的浓度,平衡正向移动,氢气的转化率增大,故B错误;
C.P2先达到平衡,因此P2>P1,正向体积减小,增大压强平衡正向移动氨气的物质的量分数增大,故C错误;
D.催化剂不影响平衡,加入催化剂后按期的物质的量分数不变,故D正确;
故选D。
8.D
【详解】A.根据图像知,升高温度,NO的平衡转化率减小,则说明平衡逆向移动,即该反应正反应方向为放热,反应物的总能量大于生成物的总能量,A正确;
B.反应为气体分子数减小的放热反应,则增大压强有利于平衡向正向移动,可提高NO的平衡转化率,由图像知,同一温度下,p1压强下NO的平衡转化率较p2的大,则说明压强:p1>p2,B正确;
C.合适的催化剂可降低反应的活化能,改变反应路径,但反应热和CO的平衡转化率不改变,C正确;
D.上述反应放热,则适当降低温度,平衡正向移动,反应的平衡常数会增大,D错误;
故选D。
9.C
【详解】A.该反应放热,甲与乙两个容器的投料比等效,绝热恒容与恒温恒容相比,相当于升高温度,平衡逆向进行,平衡时C的物质的量减小,a<1.6,A错误;
B.丙的投料比等效于甲的3倍,丙的容器体积也是甲的3倍,甲容器与丙容器均为恒温恒容,相同条件下达到平衡状态,b=4.8,B错误;
C.根据容器甲的反应列三段式,,平衡常数,C正确;
D.乙为恒温绝热容器,随着反应的进行,容器内温度升高,反应速率加快,则平衡时A的正反应速率:,D错误;
故选C。
10.C
【详解】A.根据平衡常数的计算式得出该反应的化学方程式为,A项正确;
B.增大,平衡正向移动,但只与温度有关,温度没变,因此K不变,B项正确;
C.恒容时,向容器中充入稀有气体Ne,各物质的浓度不变,反应速率不变,C项错误;
D.降低温度,D的浓度增大,平衡正向移动,正反应是放热反应,D项正确;
故选:C。
11.C
【详解】A.反应可逆,反应一段时间后18O存在于O2、SO2和SO3中,故A错误;
B.向容器中通入少量,逆反应的反应物浓度增大,逆反应速率增大,导致正反应速率也随着增大,故B错误;
C.达到平衡状态时,SO2与SO3物质的量保持不变,故C正确;
D.反应前后气体总质量不变、容器体积不变,密度是恒量,容器内密度不再变化时,反应不一定达到平衡状态,故D错误;
故选C。
12.B
【分析】由图像信息可知,随着时间的变化,A的物质的量在减少,B的物质的量在增加,但是A曲线与B曲线在4min时还有上升和下降的趋势,故在4min时并没有平衡,但是在8min时,两条曲线已变直,说明已经达到平衡;
【详解】A.由图可知A是反应物,B是生成物,达到平衡时,消耗的时间是一样的,A的变化量为0.6mol,B的变化量为0.3mol,变化量之比等于化学计量数之比,该反应的化学方程式为2A B,故A错误;
B.反应达到平衡时,A与B的浓度应该保持不变,故B正确;
C.4min 后A和B的浓度仍在变化,说明未达到平衡状态,8min时图像中的两条曲线都变直了,说明浓度不再发生改变,说明此时反应达到平衡,故C错误;
D.0~4min,B的平均反应速率为,故D错误;
故本题选B。
13.A
【详解】A.根据勒夏特列原理可知,充入一定量的,不能完全转化,则的平衡转化率减小,故A正确;
B.该反应都是气体物质参与,恒温恒容时,混合气体质量一直保持不变,不能说明反应已达到平衡,故B错误;
C.恒容下充入惰性气体He,反应物和产物浓度不变,则反应速率不变,故C错误;
D.化学平衡常数只受温度影响,与浓度无关,若缩小反应器的容积,能使平衡正向移动,则,但温度不变化学平衡常数K不变,故D错误;
故选:A。
14.D
【详解】A.体积为VL时,NO2的物质的量为1.28×10-2mol/L×VL=1.28×10-2Vmol,体积为时,NO2的物质的量为2.80×10-2mol/L×L=1.40×10-2Vmol,NO2的物质的量增大,A正确;
B.由于该反应在瞬间即可达成化学平衡,所以正反应和逆反应的活化能均较低,B正确;
C.体积缩小后,NO2的浓度增大,则混合气体的颜色加深,C正确;
D.由于该反应为吸热反应,则其它条件不变,温度升高,该反应正向移动,D错误;
故选D。
15.(1)正反应放热,升高温度,平衡逆向移动
(2)温度太高催化剂活性降低
【详解】(1)正反应放热,升高温度,平衡逆向移动,SNCR技术脱硝效率会降低;
(2)温度太高催化剂活性降低,所以SCR技术的反应温度不能太高。
16.(1)>
(2)c
【详解】(1)该反应为放热反应,温度升高,化学平衡向着吸热方向进行,即逆反应方向,从到生成物的量增加,平衡正移,故;
(2)由于该反应是放热反应,当温度升高时,平衡应向逆方向移动,所以a点未达到平衡,b、c、d点达到平衡状态,且c点氢气添加比例最高,的转化率最大。
17.(1)A
(2) 增大 减小
(3)<
【详解】(1)其它条件相同时,催化剂对反应速率加快倍数越大、所需温度越低越好,根据图知,A、B对反应速率加快倍数大于C,但是A所需温度小于B,且在较低温度下具备较高的催化活性,一方面可节约能源,另一方面低温有利于反应的转化,所以生产中适宜选择的催化剂是A,故答案为:A;
(2)压缩体积相当于增大压强,压强越大单位体积内活化分子个数越大,化学反应速率越快,温度越高活化分子百分数越大,化学反应速率越快;升高温度平衡逆向移动,生成物浓度减小、反应物浓度增大,则化学平衡常数减小,故答案为:增大;减小;
(3)温度一定时,增大压强平衡正向移动,NH3的体积分数增大,根据图知,温度一定时氨气的体积分数:pl<p2,则压强pl<p2,故答案为:<。
18.(1)S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1
(2)C
(3)大
(4) 升高温度 t3~t4
【分析】图1显示硫单质和氧气生成二氧化硫是放热反应,二氧化硫转化为三氧化硫是可逆反应且放热。燃烧热是指101kPa下,1mol纯物质完全燃烧生成指定化合物时所释放的热量。
【详解】(1)据图像,1mol S燃烧生成气态二氧化硫放出297kJ的热量,故S燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1,答案为:S(s)+O2(g)=SO2(g) ΔH=-297kJ mol-1;
(2)n(SO3)/n(SO2)比图1中增大,则反应正向移动,反应正向体积减小、放热,可以采用降低温度和增大压强的方式,故答案为:C;
(3)恒温恒容时,1mol SO2和2mol O2充分反应,比图中增加了氧气的浓度,平衡正向移动了,因此放出热量更多,放出热量的数值比大;答案为:大;
(4)t4平衡逆向移动,且速率整体增大,反应正向放热,因此是升高了温度;t2时平衡正向移动,t3达到平衡态,t4平衡逆向移动,t5达到新平衡后,平衡不再移动,因此t3~t4时三氧化硫含量最高,故答案为:升高温度、t3~t4。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
