专题一气体制备 学案(含解析) 2024年高中化学学业水平测试(全国通用)
文档属性
| 名称 | 专题一气体制备 学案(含解析) 2024年高中化学学业水平测试(全国通用) |  | |
| 格式 | docx | ||
| 文件大小 | 878.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 20:22:43 | ||
图片预览



文档简介
专题一 气体制备
专题一 气体的制备与性质
【课标要求】
学习研究物质性质,探究反应规律,进行物质分离、检验和制备等不同类型化学实验及探究活动的核心思路与基本方法。体会实验条件控制对完成科学实验及探究活动的作用。
【学科素养】
树立安全意识,知道基本的安全措施和意外事故的紧急处理方法。
知道化学实验室常用仪器的名称、形状、主要用途、使用方法和操作原理,能识别简单的实验仪器装置图。
根据气体反应类型及气体的性质,理解其制备、净化、收集及尾气处理装置。
【基本知识解读】
一、气体的制备与性质
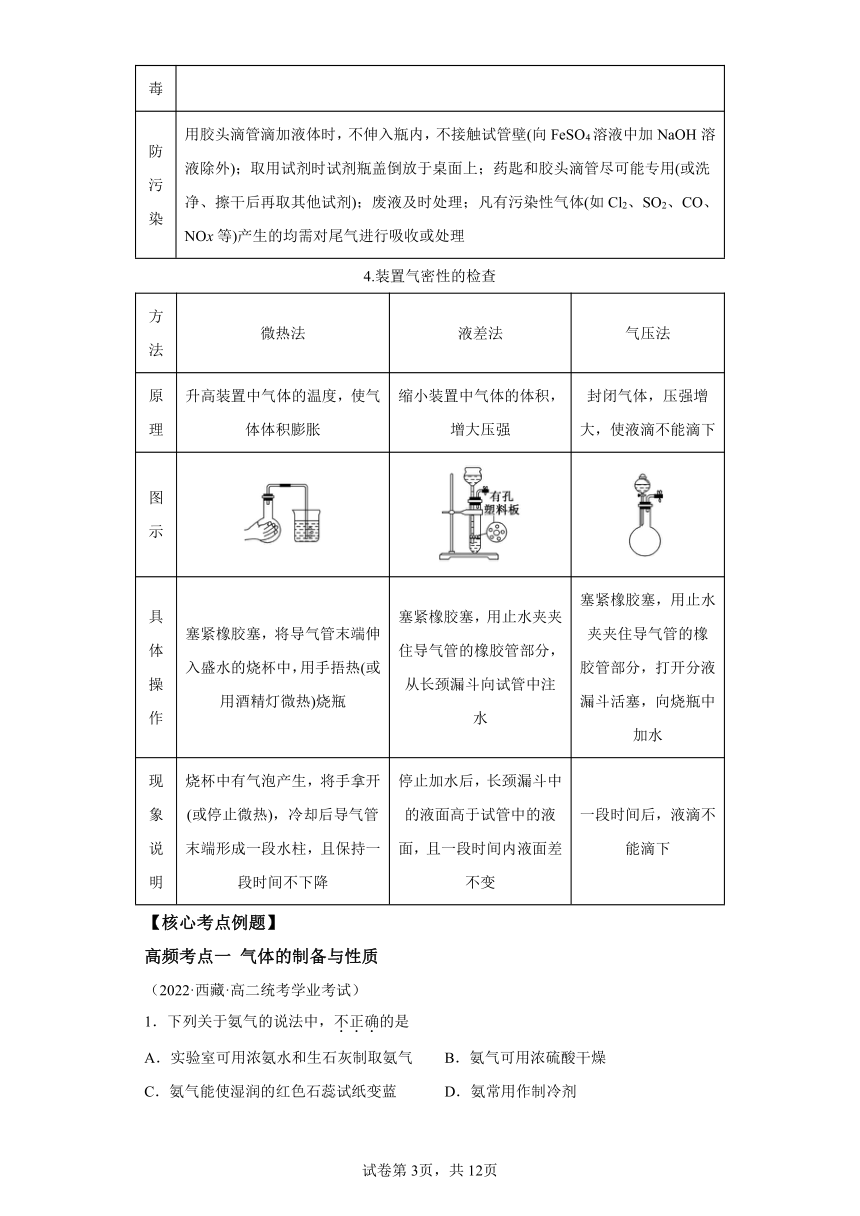
1.常见气体的实验室制取、尾气吸收装置
收 集 尾气吸收
O2 O2 NH3 —— NH3 NH3
H2 CO2 H2 —— —— ——
—— Cl2 —— Cl2 —— ——
【特别提醒】
制取气体实验的操作顺序 安装顺序 ①下到上;②左到右;③先塞后定
加试剂顺序 先固后液
其它操作顺序 先查气密性,后装药品(便于在装置漏气时进行调整和更换仪器),最后点酒精灯(所有装备工作完毕后).
实验装置 四部分 发生装置→净化装置→收集装置→尾气处理
2.物质的干燥
气体的干燥 ①浓硫酸:可干燥酸性气体、中性气体(如SO2、Cl2、H2、O2等),不能干燥碱性气体和还原性气体(如NH3、H2S等)
②碱石灰:可干燥碱性气体、中性气体(如NH3、H2、O2等),不能干燥酸性气体(如HCl)
③CaCl2:酸性、碱性、中性气体都可以干燥,但不能干燥NH3(CaCl2与NH3反应生成CaCl2·8NH3)
3.化学实验安全操作的“六防”
防爆炸 ①点燃可燃性气体(如H2、CO、CH4、C2H4)或用CO、H2还原Fe2O3、CuO之前,要验气体纯度②用H2或CO还原CuO时,应先通入H2或CO,在装置尾部收集气体并检验纯度,若尾部气体已纯净,说明装置中的空气已排尽,可对装置加热
防暴沸 配制硫酸的水溶液或硫酸的酒精溶液时,要将密度大的浓硫酸缓慢倒入水或酒精中;加热液体混合物时要加沸石或碎瓷片
防倒吸 用试管加热固体时,试管底部要略高于管口,如实验室制O2、NH3等;加热液体时试管口要向上倾斜;加热法制取并用排水法收集气体或吸收溶解度较大的气体时,要注意撤导管和熄灯顺序或加装安全瓶
防失火 ①可燃性物质如钾、钠、白磷等强还原剂要妥善保存,与强氧化剂要分开存放②使用易挥发性可燃物,如乙醇、乙醚、汽油等应防止蒸气逸出,添加易燃品一定要远离火源
防中毒 制取有毒气体(如Cl2、CO、SO2、H2S、NO2、NO)时,应在通风橱中进行,且进行尾气处理
防污染 用胶头滴管滴加液体时,不伸入瓶内,不接触试管壁(向FeSO4溶液中加NaOH溶液除外);取用试剂时试剂瓶盖倒放于桌面上;药匙和胶头滴管尽可能专用(或洗净、擦干后再取其他试剂);废液及时处理;凡有污染性气体(如Cl2、SO2、CO、NOx等)产生的均需对尾气进行吸收或处理
4.装置气密性的检查
方法 微热法 液差法 气压法
原理 升高装置中气体的温度,使气体体积膨胀 缩小装置中气体的体积,增大压强 封闭气体,压强增大,使液滴不能滴下
图示
具体操作 塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,打开分液漏斗活塞,向烧瓶中加水
现象说明 烧杯中有气泡产生,将手拿开(或停止微热),冷却后导气管末端形成一段水柱,且保持一段时间不下降 停止加水后,长颈漏斗中的液面高于试管中的液面,且一段时间内液面差不变 一段时间后,液滴不能滴下
【核心考点例题】
高频考点一 气体的制备与性质
(2022·西藏·高二统考学业考试)
1.下列关于氨气的说法中,不正确的是
A.实验室可用浓氨水和生石灰制取氨气 B.氨气可用浓硫酸干燥
C.氨气能使湿润的红色石蕊试纸变蓝 D.氨常用作制冷剂
(2023下·新疆乌鲁木齐·高二统考学业考试)
2.下列气体可用排水法收集的是
A.氧气 B.氨气 C.二氧化氮 D.二氧化硫
(2022·江苏南京·高二南京师范大学附属扬子中学校考学业考试)
3.下列气体可用排水集气法收集的是
A.O2 B.NO2 C.NH3 D.HCl
(2023·四川·高二统考学业考试)
4.下列气体可用如图所示方法收集的是
A.H2 B.Cl2 C.SO2 D.NO
(2022下·黑龙江·高二统考学业考试)
5.下列能用碱石灰干燥的是
A.HCl B.SO2 C.CO2 D.NH3
(2022上·辽宁·高一统考学业考试)
6.下列气体中,既可以用碱石灰干燥,又可以用浓硫酸干燥的是
A. B. C.HCl D.
(2020上·黑龙江·高一统考学业考试)
7.下列可用于实验室制备氢气的药品是
A.、盐酸 B.、稀
C.浓盐酸、 D.、
(2022下·江苏徐州·高一统考阶段练习)
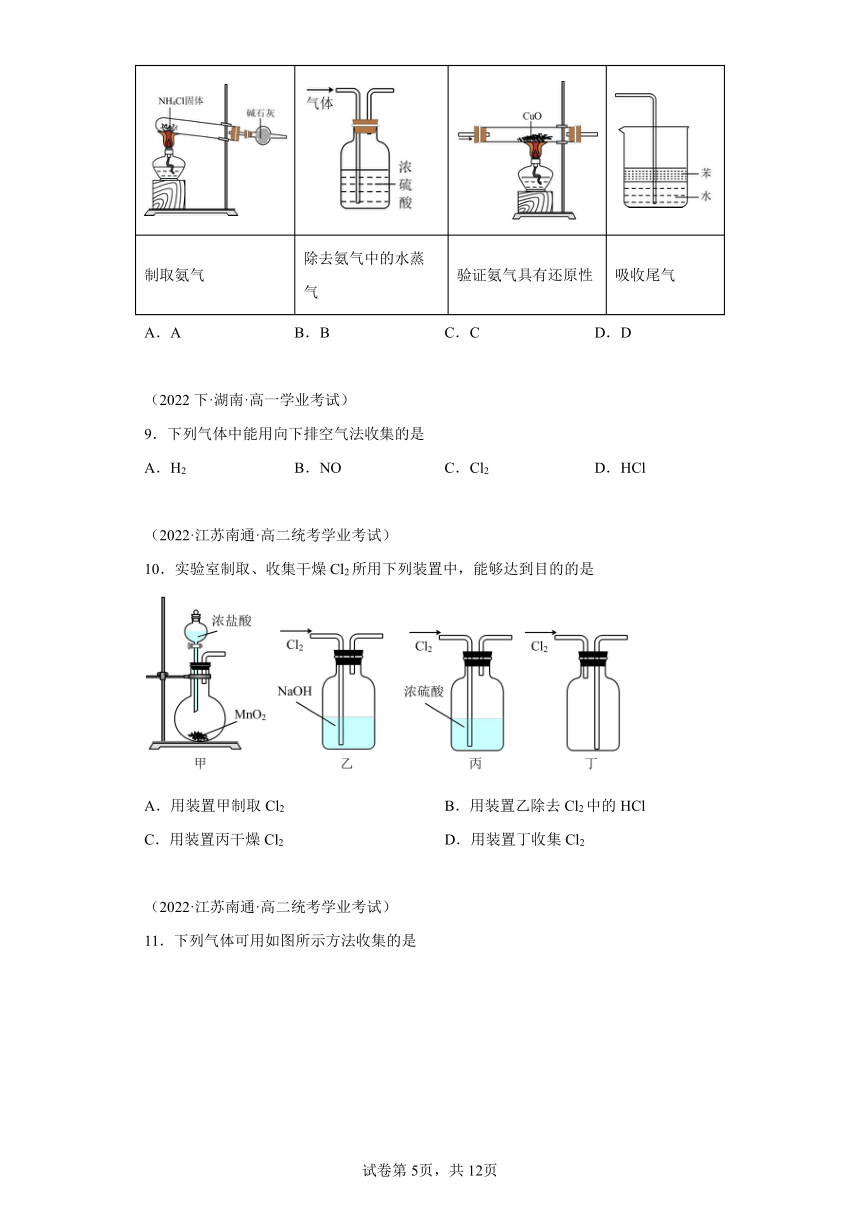
8.图中装置用于实验室制取氨气或验证氨气的化学性质,其中能达到实验目的的是
A B C D
制取氨气 除去氨气中的水蒸气 验证氨气具有还原性 吸收尾气
A.A B.B C.C D.D
(2022下·湖南·高一学业考试)
9.下列气体中能用向下排空气法收集的是
A.H2 B.NO C.Cl2 D.HCl
(2022·江苏南通·高二统考学业考试)
10.实验室制取、收集干燥Cl2所用下列装置中,能够达到目的的是
A.用装置甲制取Cl2 B.用装置乙除去Cl2中的HCl
C.用装置丙干燥Cl2 D.用装置丁收集Cl2
(2022·江苏南通·高二统考学业考试)
11.下列气体可用如图所示方法收集的是
A.NO2 B.H2 C.SO2 D.NH3
(2022·甘肃·高一统考学业考试)
12.下列实验方案不能达到实验目的的是
A.用装置①干燥 B.用装置②除去中的HCl
C.用装置③制备 D.用装置④收集NO气体
(2019·山东·高二统考学业考试)
13.不能利用如图所示装置进行的气体制备实验是
A.用生石灰和浓氨水制取氨气
B.用铜和浓硝酸制取二氧化氮
C.用二氧化锰和浓盐酸制取氯气
D.用石灰石和稀盐酸制取二氧化碳
(2021·西藏·高二统考学业考试)
14.化学是一门以实验为基础的科学。图中A~E是初中化学常见的实验装置,请回答:
(1)过氧化氢溶液分解制取氧气的化学方程式为 ;为控制反应的速率,应选择的发生装置是 (填序号);为干燥氧气,可将产生的气体通过装有 (填药品名称)的E装置。
(2)用如图所示装置收集氢气,a为进气口,请将图中的导管用实线补画完整 。
(2023·云南·高一统考学业考试)
15.某实验小组用下列图示装置制取氨气并探究其性质。
回答下列问题:
(1)甲装置试管A中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 ,试管A管口略向下倾斜的原因是 。
(2)已知 NH3+HCl=NH4Cl,若甲装置试管B中已集满氨气,用蘸有浓盐酸的玻璃棒靠近试管口的现象为 。
(3)实验室还可以用装置乙制取氨气,试剂可选用 (填字母)。
a.浓氨水和生石灰 b.浓氨水和无水氯化钙 c.浓氨水和氢氧化钠固体
(4)按丙装置图组装仪器后,将胶头滴管中的水挤出,打开止水夹,产生红色喷泉。则烧瓶中气体和烧杯中的液体可能为下列选项中的 (填字母)。
a.氨气和酚酞溶液 b.氯化氢和紫色石蕊溶液 c.氨气和紫色石蕊溶液
(2023下·黑龙江·高一统考学业考试)
16.铜与浓硫酸在加热条件下可发生化学反应,为检验部分产物的性质,某研究小组设计了如图所示的实验。请据此回答下列问题。
(1)铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+ +2H2O
(2)反应过程中观察到品红溶液 ,说明产物二氧化硫具有漂白性。
(3)反应过程中观察到酸性KMnO4溶液褪色,说明产物二氧化硫具有 性(选填“氧化”或“还原”)。
(4)浸A溶液的棉团的作用是吸收多余的尾气,防止污染空气,A是 (选填“Na2SO4”或“NaOH”)。
(5)工业生产中二氧化硫的大量排放使雨水的pH 5.6(选填“>”或“<”),会形成 ,使土壤、湖泊酸化,还能加速建筑物的腐蚀。
(6)实验室中的检验方法:向溶液中加入稀盐酸,然后加入 溶液(选填“BaCl2”或“MgCl2”),观察是否有白色沉淀生成。
(2021上·黑龙江·高二统考学业考试)
17.实验室通常用下图所示的装置来制取氨气。回答下列问题:
(1)完成下列化学方程式: 。
(2)待氨气生成后,将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是 。
(3)氨气的密度比空气的密度小,收集氨气应采取 (填“向上”或“向下”)排空气法。
(4)从发生装置中制得的氨气含有水蒸气,可用 (填“碱石灰”或“浓硫酸”)除去其中的水蒸气。
(5)将制得的氨气溶于水,其水溶液呈 性。
(2023·北京·高二统考学业考试)
18.某小组用和制取氨,并验证其性质。
(1)制取氨的化学方程式为 。
(2)制取氨应选用的发生装置是 (填序号)。
(3)收集氨的装置如下图。下列说法正确的是 (填字母)。
a.收集氨时试管口向下,是因为相同条件下氨的密度比空气的小
b.将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明氨已收集满
(4)将盛满氨的试管倒立在水中,试管内液面上升,液体几乎充满试管。说明氨具有的性质是 。
(2023·湖南·高一统考学业考试)
19.实验室常用氯化铵和熟石灰制取氨,其反应的化学方程式为:,某实验小组用下图所示装置制取氨。
请回答下列问题:
(1)仪器A的名称是 。
(2)B装置用于干燥氨,盛放的试剂是 (填“浓硫酸”或“碱石灰”)。
(3)C处虚线框中是排空气法收集氨的装置,应选用 (填“甲”或“乙”)。
(4)实验结束后,向D处烧杯中滴加几滴酚酞溶液,溶液呈 色(填“无”或“红”)。
(5)实验中若消耗了,则理论上可产生标准状况下的体积为 L。
(2023下·天津和平·高一统考学业考试)
20.根据所学相关知识完成下列问题。
Ⅰ.小组Ⅰ用下图装置制取Cl2并探究性质,回答下列问题:
(1)装置①用于制取Cl2,反应的化学方程式是
(2)装置②的作用是
(3)装置③中的现象是
(4)装置④中发生反应的离子方程式是
Ⅱ.小组Ⅱ利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
(5)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是
(6)当观察到②中溶液颜色变浅时,①中的现象是
(7)装置③的作用是
(8)②中的现象说明二氧化硫具有的性质是
Ⅲ.小组Ⅲ用图1所示装置制取氨,并探究其性质,回答下列问题:
(9)仪器a的名称是
(10)图1试管内发生反应的化学方程式是
(11)图1方框中的收集装置应为 (填图3中字母标号)。
(12)将蘸有浓盐酸的棉球放入收集满NH3的集气瓶中,迅速盖上玻璃片,可观察到的实验现象是
(13)甲同学设计了图2所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.CaO与水反应放出大量的热,加快一水合氨分解出氨气,故A正确;
B.氨气是碱性气体,不能用浓硫酸干燥,故B错误;
C.氨气溶于水,与水反应生成弱碱一水合氨,使红色石蕊试纸变蓝,故C正确;
D.液氨汽化时要吸收大量的热,使周围温度急剧降低,因此液氨可用作制冷剂,故D正确;
答案选B。
2.A
【详解】A.氧气难溶于水,且不与水反应,可用排水法收集,故A正确;
B.氨气极易溶于水,且与水反应生成一水合氨,不可用排水法收集,故B错误;
C.二氧化氮易溶于水,且能与水反应生成硝酸和NO,不可用排水法收集,故C错误;
D.二氧化硫易溶于水,且能与水反应生成亚硫酸,不可用排水法收集,故D错误;
答案选A。
3.A
【分析】用排水集气法收集的气体不能溶于水,也不能与水反应。
【详解】A.O2不易溶于水,也不与水反应,可以用排水集气法收集,A符合题意;
B.NO2与水反应,3NO2+H2O=2HNO3+NO,不能用排水集气法收集,B不符合题意;
C.NH3极易溶于水,不能用排水集气法收集,C不符合题意;
D.HCl极易溶于水,不能用排水集气法收集,D不符合题意;
故选A。
4.A
【分析】图示为向下排空气的方法收集气体,要求气体的密度比空气小,与空气的成分不能发生反应,据此分析解答。
【详解】A.H2的密度比空气小,与空气的成分不能发生反应,可以使用向下排空气的方法收集,A正确;
B.Cl2的密度比空气大,因此应该使用向上排空气的方法收集,B错误;
C.SO2的密度比空气大,因此应该使用向上排空气的方法收集,C错误;
D.NO容易与空气中的O2反应产生NO2,因此不能使用排空气的方法收集,D错误;
故合理选项是A。
5.D
【详解】碱石灰的主要成分为NaOH和CaO;
A.HCl属于酸性气体,能被碱石灰吸收,HCl不能用碱石灰干燥,A不选;
B.SO2能被碱石灰吸收,SO2不能用碱石灰干燥,B不选;
C.CO2属于酸性氧化物,能被碱石灰吸收,CO2不能用碱石灰干燥,C不选;
D.NH3属于碱性气体,不能被碱石灰吸收,NH3能用碱石灰干燥,D选;
答案选D。
6.B
【详解】不能用浓硫酸干燥;HCl、不能用碱石灰干燥,N2既可以用碱石灰干燥,又可以用浓硫酸干燥,故选B。
7.B
【详解】A.与盐酸反应生成二氧化碳气体,故A不符合题意;
B.与稀反应生成氢气,故B符合题意;
C.浓盐酸与在加热时生成氯气,故C不符合题意;
D.与混合物加热时生成氧气,故D不符合题意;
故选B。
8.C
【详解】A.氯化铵受热分解成氯化氢和氨气,在试管口氨气和氯化氢重新生成氯化铵固体,不能用来制备氨气,A错误;
B.氨气与浓硫酸会发生反应,不能用浓硫酸干燥氨气,B错误;
C.若装置中黑色固体变成红色,可以证明氨气具有还原性,C正确;
D.氨气极易溶于水,需要防止倒吸,苯不能起到防倒吸的作用,D错误;
故选C。
9.A
【分析】用向下排空气法收集的是密度比空气小的气体。
【详解】A.氢气密度比空气小,可用向下排空气法收集,A正确;
B.NO与氧气反应,只能用排水法收集,B错误;
C.Cl2密度比空气大,用向上排空气法收集,C错误;
D.HCl密度比空气大,用向上排空气法收集,D错误;
故选A。
10.C
【详解】A.二氧化锰和浓盐酸反应制取氯气需要加热,故A错误;
B.应该用饱和食盐水除去Cl2中的HCl,故B错误;
C.浓硫酸可以干燥氯气,故C正确;
D.氯气的密度大于空气,应用长管进短管处,故D错误;
故选C。
11.B
【分析】图为排水法收集气体,说明气体不溶于水,以此解答该题。
【详解】图为排水法收集气体,说明收集的气体不溶于水。题中各选项所给的物质中,NO2可以与水反应生成硝酸和NO,SO2 可以溶于水并与水反应生成亚硫酸,NH3极易溶于水且与水反应生成一水合氨。只有氢气不溶于水,故其可用排水法收集。
答案选B。
12.C
【详解】A.碱石灰是碱性干燥剂,可干燥碱性气体氨气,A正确;
B.饱和食盐水可降低氯气在水中的溶解度同时又可以吸收氯化氢,B正确;
C.实验室制氯气用到的是二氧化锰和浓盐酸加热,C错误;
D.NO难溶于水,可用排水法收集,D正确;
故选C。
13.C
【详解】A.浓氨水中存在平衡:NH3+H2ONH3·H2O+OH-,加入生石灰后生成Ca(OH)2使平衡逆向移动最终生成NH3,该装置可完成实验,故A不选;
B.铜和浓硝酸反应生成二氧化氮:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,该装置可完成实验,故B不选;
C.二氧化锰和浓盐酸制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,该反应需要加热,图中无加热装置,该装置不能完成实验,故C选;
D.石灰石和稀盐酸制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O,该装置可完成实验,故D不选;
综上所述,答案为C。
14.(1) 2H2O2 2H2O+O2↑ D 浓硫酸
(2)
【分析】制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。
【详解】(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,过氧化氢溶液分解制取氧气的化学方程式为2H2O2 2H2O+O2↑;分液漏斗可以控制反应的速率,为控制反应的速率,应选择的发生装置是D;氧气可以用浓硫酸干燥,为干燥氧气,可将产生的气体通过装有浓硫酸的E装置。故答案为:2H2O2 2H2O+O2↑;D;浓硫酸;
(2)用图示装置收集氢气,因为氢气的密度比空气小,需采用向下排空气法收集,a为进气口,因此a管要短;故答案为:。
15.(1) CaCl2+2NH3↑+2H2O 防止反应生成的水蒸气冷凝后又流回到试管底,使试管底因受热不均而破裂
(2)试管口有白烟产生
(3)ac
(4)ab
【分析】装置A中,采用固、固加热法制取氨气,发生反应为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,生成的NH3密度比空气小,采用向下排空气法收集,为尽快收集到纯净的氨气,试管口放一团疏松的棉花。
【详解】(1)甲装置试管A中,发生NH4Cl与Ca(OH)2的复分解反应,从而制得氨气,化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;为防止试管炸裂,试管A管口略向下倾斜,原因是:防止反应生成的水蒸气冷凝后又流回到试管底,使试管底因受热不均而破裂。
(2)已知 NH3+HCl=NH4Cl,若甲装置试管B中已集满氨气,则可用蘸有浓盐酸的玻璃棒靠近试管口进行检验,现象为:试管口有白烟产生。
(3)a.浓氨水滴入生石灰中,生石灰与水反应放热,降低氨气的溶解度,从而产生氨气,a符合题意;
b.无水氯化钙能与氨气作用生成八氨合氯化钙,不能产生氨气,b不符合题意;
c.浓氨水滴入氢氧化钠固体中,氢氧化钠溶于水放热,降低了氨气的溶解度,从而产生氨气,c符合题意;
故选ac。
(4)a.氨气溶于水生成氨水,显碱性,可使酚酞溶液变红,a符合题意;
b.氯化氢溶于水生成盐酸,显酸性,能使紫色石蕊溶液变红,b符合题意;
c.氨气溶于水生成的氨水显碱性,能使紫色石蕊溶液变蓝,c不符合题意;
故选ab。
【点睛】挥发性酸与挥发性碱挥发出的蒸气相遇,能产生白烟。
16.(1)SO2↑
(2)褪色
(3)还原
(4)NaOH
(5) < 酸雨
(6)BaCl2
【分析】利用图示装置验证铜与浓硫酸的反应产物,左侧试管为反应装置,中间盛有品红溶液的试管用来验证产物中SO2的存在,右侧盛有酸性KMnO4的试管用于验证SO2的还原性,同时也可以吸收SO2,右侧试管口的棉花需浸有NaOH,用来防止SO2进入到空气中污染空气。
【详解】(1)Cu与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
(2)由于反应生成SO2,SO2具有漂白性,可以使品红溶液褪色。
(3)实验中观察到酸性高锰酸钾溶液褪色,说明反应生成是SO2与酸性高锰酸钾溶液反应生成的硫酸根,可以说明SO2具有还原性。
(4)浸A溶液的棉团的作用是吸收多余的尾气,防止污染空气,A为NaOH溶液,SO2可以与NaOH反应生成Na2SO3。
(5)排放的SO2进入到空气中与空气中的水蒸气反应生成酸性物质,使雨水的pH小于5.6,使当地形成酸雨,加速建筑物的腐蚀,加速土壤酸化。
(6)硫酸根可以用盐酸酸化的BaCl2检验,向溶液中加入稀盐酸,可以排除溶液中含有的碳酸根、银离子等干扰离子,再加入BaCl2,若生成白色沉淀,则说明原溶液中含有硫酸根。
17.(1)CaCl2
(2)产生白烟
(3)向下
(4)碱石灰
(5)碱
【分析】本题以实验室制备氨气考查制备的原理,方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O,由于NH3能与酸反应,干燥氨气用碱石灰而不能用浓硫酸,氨气的密度小于空气,故收集NH3要用向下排空气法,NH3溶于水得到氨水,氨水呈碱性,据此分析解题。
【详解】(1)根据质量守恒可知,反应方程式为CaCl2,故答案为:CaCl2;
(2)由于浓盐酸易挥发出HCl,NH3+HCl=NH4Cl,故待氨气生成后,将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是产生白烟(NH4Cl固体小颗粒),故答案为:产生白烟;
(3)氨气的密度比空气的密度小,收集氨气应采取向下排空气法,故答案为:向下;
(4)由于NH3溶于水显碱性,能与硫酸反应,2NH3+H2SO4=(NH4)2SO4,故从发生装置中制得的氨气含有水蒸气,可用碱石灰除去其中的水蒸气,故答案为:碱石灰;
(5)将制得的氨气溶于水,由于NH3+H2O+OH-,其水溶液呈碱性,故答案为:碱。
18.(1)
(2)①
(3)ab
(4)易溶于水
【详解】(1)和共热生成氨气、氯化钙和水,实验室制取氨的化学方程式为。故答案为:;
(2)和制取氨,是属于固体、加热型装置,制取氨应选用的发生装置是①。故答案为:①;
(3)a.收集氨时试管口向下,是因为相同条件下氨的密度比空气的小,用向下排空集气法,故a正确;
b.氨气溶于水呈碱性,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明氨已收集满,故正确;
故答案为:ab;
(4)将盛满氨的试管倒立在水中,试管内液面上升,液体几乎充满试管。说明氨具有的性质是易溶于水,使试管内部压强大幅度减小,导致试管内液面上升,液体几乎充满试管。故答案为:易溶于水。
19.(1)酒精灯
(2)碱石灰
(3)乙
(4)红
(5)4.48
【分析】加热氯化铵和氢氧化钙混合物制取氨气,同时有水生成,即B是干燥装置,又氨气属于污染性气体且极易溶于水,所以D是尾气处理装置,同时也能防倒吸,据此回答。
【详解】(1)A属于加热仪器酒精灯;
(2)因氨气属于碱性气体,故使用碱石灰进行干燥;
(3)由于氨气密度比空气小,所以使用排空气集气时需要“短进长出”,即选乙;
(4)氨气溶于水,反应生成一水合氨,即水溶液显碱性,所以溶液呈红色;
(5)消耗,即其物质的量为0.2mol,根据氮原子守恒知,则理论上可产生物质的量为0.2mol,即标准状况下的体积为4.48L。
20.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)除去挥发的HCl
(3)有色布条褪色
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(6)品红溶液褪色(或变浅)
(7)吸收未反应的SO2,防止污染环境
(8)还原性
(9)酒精灯
(10)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(11)B
(12)集气瓶内产生大量白烟
(13)NH3极易溶于水,会导致倒吸
【分析】Ⅰ.在装置①中MnO2与浓盐酸发生反应制取Cl2,由于浓盐酸具有挥发性,挥发的HCl在装置②中被饱和食盐水除去,在装置③中利用湿润的有色布条检验潮湿氯气的漂白性,装置④用于除去多余Cl2,防止大气污染;
Ⅱ.在装置①中验证SO2的漂白性,在装置②中验证SO2的还原性,在装置③中用NaOH溶液除去多余SO2,防止大气污染;
Ⅲ.在装置①中用NH4Cl与Ca(OH)2混合加热制取NH3,在装置②中根据NH3的密度比空气小的性质,用向下排空气方法收集,但由于NH3极易溶于水,因此不能直接将导气管伸入到水中进行吸收,而应该使用倒扣漏斗,使漏斗边缘紧贴水面,就可以起到吸收多余氨气及防止倒吸的作用。
【详解】(1)在装置①中用MnO2与浓盐酸混合加热发生氧化还原反应制取Cl2,反应的化学方程式是:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,导致制取的Cl2会混有杂质HCl,装置②的饱和NaCl溶液的作用是除去挥发的HCl杂质;
(3)Cl2与H2O反应产生HCl和HClO,HClO具有强氧化性,会将有色物质氧化变为无色物质,因此看到装置③中的现象是湿润的有色布条褪色;
(4)Cl2是有毒气体,可根据其能够与碱反应的性质,用NaOH溶液进行尾气处理,防止污染大气,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)Cu与浓硫酸混合加热,发生氧化还原反应,产生CuSO4、SO2、H2O,该反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(6)SO2具有漂白性,能够与品红溶液作用,使溶液由红色变为无色;同时SO2具有强的还原性,会被酸性KMnO4溶液氧化变为H2SO4,KMnO4被还原为无色Mn2+,因此当观察到②中溶液颜色变浅时,①中的现象是溶液由红色变为无色(或溶液红色褪去);
(7)SO2是有毒气体,直接排放会导致大气污染,可根据SO2是酸性氧化物的性质,用NaOH溶液进行吸收,故装置③的作用是吸收未反应的SO2,防止污染环境;
(8)②中SO2通入酸性KMnO4溶液后,溶液紫色变浅的现象说明二氧化硫具有的性质是还原性;
(9)根据图示可知仪器a名称为酒精灯;
(10)图1试管内,用NH4Cl与Ca(OH)2混合加热制取NH3,发生反应的化学方程式是:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(11)在装置②中方框中的装置用于收集NH3,可根据NH3的密度比空气小的性质,用向下排空气方法收集,导气管连接方式是短进长出,故应该选择使用装置B;
(12)浓盐酸具有挥发性,挥发的HCl与NH3混合,在空中发生反应产生NH4Cl白色固体,因此可观察到的实验现象是产生白烟;
(13)由于NH3极易溶于水,若将盛有NH3的导气管直接伸入到水中,由于NH3溶于水,导致导气管内气体压强减小,水沿着导气管进入到收集装置,即产生倒吸现象,故甲同学设计了图2所示的装置进行尾气处理不合适。正确的方法 在导气管末端安装一个倒扣漏斗,使漏斗边缘紧贴水面,这样既有助于NH3的吸收,同时也可以防止倒吸现象的发生。
答案第1页,共2页
答案第1页,共2页
专题一 气体的制备与性质
【课标要求】
学习研究物质性质,探究反应规律,进行物质分离、检验和制备等不同类型化学实验及探究活动的核心思路与基本方法。体会实验条件控制对完成科学实验及探究活动的作用。
【学科素养】
树立安全意识,知道基本的安全措施和意外事故的紧急处理方法。
知道化学实验室常用仪器的名称、形状、主要用途、使用方法和操作原理,能识别简单的实验仪器装置图。
根据气体反应类型及气体的性质,理解其制备、净化、收集及尾气处理装置。
【基本知识解读】
一、气体的制备与性质
1.常见气体的实验室制取、尾气吸收装置
收 集 尾气吸收
O2 O2 NH3 —— NH3 NH3
H2 CO2 H2 —— —— ——
—— Cl2 —— Cl2 —— ——
【特别提醒】
制取气体实验的操作顺序 安装顺序 ①下到上;②左到右;③先塞后定
加试剂顺序 先固后液
其它操作顺序 先查气密性,后装药品(便于在装置漏气时进行调整和更换仪器),最后点酒精灯(所有装备工作完毕后).
实验装置 四部分 发生装置→净化装置→收集装置→尾气处理
2.物质的干燥
气体的干燥 ①浓硫酸:可干燥酸性气体、中性气体(如SO2、Cl2、H2、O2等),不能干燥碱性气体和还原性气体(如NH3、H2S等)
②碱石灰:可干燥碱性气体、中性气体(如NH3、H2、O2等),不能干燥酸性气体(如HCl)
③CaCl2:酸性、碱性、中性气体都可以干燥,但不能干燥NH3(CaCl2与NH3反应生成CaCl2·8NH3)
3.化学实验安全操作的“六防”
防爆炸 ①点燃可燃性气体(如H2、CO、CH4、C2H4)或用CO、H2还原Fe2O3、CuO之前,要验气体纯度②用H2或CO还原CuO时,应先通入H2或CO,在装置尾部收集气体并检验纯度,若尾部气体已纯净,说明装置中的空气已排尽,可对装置加热
防暴沸 配制硫酸的水溶液或硫酸的酒精溶液时,要将密度大的浓硫酸缓慢倒入水或酒精中;加热液体混合物时要加沸石或碎瓷片
防倒吸 用试管加热固体时,试管底部要略高于管口,如实验室制O2、NH3等;加热液体时试管口要向上倾斜;加热法制取并用排水法收集气体或吸收溶解度较大的气体时,要注意撤导管和熄灯顺序或加装安全瓶
防失火 ①可燃性物质如钾、钠、白磷等强还原剂要妥善保存,与强氧化剂要分开存放②使用易挥发性可燃物,如乙醇、乙醚、汽油等应防止蒸气逸出,添加易燃品一定要远离火源
防中毒 制取有毒气体(如Cl2、CO、SO2、H2S、NO2、NO)时,应在通风橱中进行,且进行尾气处理
防污染 用胶头滴管滴加液体时,不伸入瓶内,不接触试管壁(向FeSO4溶液中加NaOH溶液除外);取用试剂时试剂瓶盖倒放于桌面上;药匙和胶头滴管尽可能专用(或洗净、擦干后再取其他试剂);废液及时处理;凡有污染性气体(如Cl2、SO2、CO、NOx等)产生的均需对尾气进行吸收或处理
4.装置气密性的检查
方法 微热法 液差法 气压法
原理 升高装置中气体的温度,使气体体积膨胀 缩小装置中气体的体积,增大压强 封闭气体,压强增大,使液滴不能滴下
图示
具体操作 塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,打开分液漏斗活塞,向烧瓶中加水
现象说明 烧杯中有气泡产生,将手拿开(或停止微热),冷却后导气管末端形成一段水柱,且保持一段时间不下降 停止加水后,长颈漏斗中的液面高于试管中的液面,且一段时间内液面差不变 一段时间后,液滴不能滴下
【核心考点例题】
高频考点一 气体的制备与性质
(2022·西藏·高二统考学业考试)
1.下列关于氨气的说法中,不正确的是
A.实验室可用浓氨水和生石灰制取氨气 B.氨气可用浓硫酸干燥
C.氨气能使湿润的红色石蕊试纸变蓝 D.氨常用作制冷剂
(2023下·新疆乌鲁木齐·高二统考学业考试)
2.下列气体可用排水法收集的是
A.氧气 B.氨气 C.二氧化氮 D.二氧化硫
(2022·江苏南京·高二南京师范大学附属扬子中学校考学业考试)
3.下列气体可用排水集气法收集的是
A.O2 B.NO2 C.NH3 D.HCl
(2023·四川·高二统考学业考试)
4.下列气体可用如图所示方法收集的是
A.H2 B.Cl2 C.SO2 D.NO
(2022下·黑龙江·高二统考学业考试)
5.下列能用碱石灰干燥的是
A.HCl B.SO2 C.CO2 D.NH3
(2022上·辽宁·高一统考学业考试)
6.下列气体中,既可以用碱石灰干燥,又可以用浓硫酸干燥的是
A. B. C.HCl D.
(2020上·黑龙江·高一统考学业考试)
7.下列可用于实验室制备氢气的药品是
A.、盐酸 B.、稀
C.浓盐酸、 D.、
(2022下·江苏徐州·高一统考阶段练习)
8.图中装置用于实验室制取氨气或验证氨气的化学性质,其中能达到实验目的的是
A B C D
制取氨气 除去氨气中的水蒸气 验证氨气具有还原性 吸收尾气
A.A B.B C.C D.D
(2022下·湖南·高一学业考试)
9.下列气体中能用向下排空气法收集的是
A.H2 B.NO C.Cl2 D.HCl
(2022·江苏南通·高二统考学业考试)
10.实验室制取、收集干燥Cl2所用下列装置中,能够达到目的的是
A.用装置甲制取Cl2 B.用装置乙除去Cl2中的HCl
C.用装置丙干燥Cl2 D.用装置丁收集Cl2
(2022·江苏南通·高二统考学业考试)
11.下列气体可用如图所示方法收集的是
A.NO2 B.H2 C.SO2 D.NH3
(2022·甘肃·高一统考学业考试)
12.下列实验方案不能达到实验目的的是
A.用装置①干燥 B.用装置②除去中的HCl
C.用装置③制备 D.用装置④收集NO气体
(2019·山东·高二统考学业考试)
13.不能利用如图所示装置进行的气体制备实验是
A.用生石灰和浓氨水制取氨气
B.用铜和浓硝酸制取二氧化氮
C.用二氧化锰和浓盐酸制取氯气
D.用石灰石和稀盐酸制取二氧化碳
(2021·西藏·高二统考学业考试)
14.化学是一门以实验为基础的科学。图中A~E是初中化学常见的实验装置,请回答:
(1)过氧化氢溶液分解制取氧气的化学方程式为 ;为控制反应的速率,应选择的发生装置是 (填序号);为干燥氧气,可将产生的气体通过装有 (填药品名称)的E装置。
(2)用如图所示装置收集氢气,a为进气口,请将图中的导管用实线补画完整 。
(2023·云南·高一统考学业考试)
15.某实验小组用下列图示装置制取氨气并探究其性质。
回答下列问题:
(1)甲装置试管A中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 ,试管A管口略向下倾斜的原因是 。
(2)已知 NH3+HCl=NH4Cl,若甲装置试管B中已集满氨气,用蘸有浓盐酸的玻璃棒靠近试管口的现象为 。
(3)实验室还可以用装置乙制取氨气,试剂可选用 (填字母)。
a.浓氨水和生石灰 b.浓氨水和无水氯化钙 c.浓氨水和氢氧化钠固体
(4)按丙装置图组装仪器后,将胶头滴管中的水挤出,打开止水夹,产生红色喷泉。则烧瓶中气体和烧杯中的液体可能为下列选项中的 (填字母)。
a.氨气和酚酞溶液 b.氯化氢和紫色石蕊溶液 c.氨气和紫色石蕊溶液
(2023下·黑龙江·高一统考学业考试)
16.铜与浓硫酸在加热条件下可发生化学反应,为检验部分产物的性质,某研究小组设计了如图所示的实验。请据此回答下列问题。
(1)铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+ +2H2O
(2)反应过程中观察到品红溶液 ,说明产物二氧化硫具有漂白性。
(3)反应过程中观察到酸性KMnO4溶液褪色,说明产物二氧化硫具有 性(选填“氧化”或“还原”)。
(4)浸A溶液的棉团的作用是吸收多余的尾气,防止污染空气,A是 (选填“Na2SO4”或“NaOH”)。
(5)工业生产中二氧化硫的大量排放使雨水的pH 5.6(选填“>”或“<”),会形成 ,使土壤、湖泊酸化,还能加速建筑物的腐蚀。
(6)实验室中的检验方法:向溶液中加入稀盐酸,然后加入 溶液(选填“BaCl2”或“MgCl2”),观察是否有白色沉淀生成。
(2021上·黑龙江·高二统考学业考试)
17.实验室通常用下图所示的装置来制取氨气。回答下列问题:
(1)完成下列化学方程式: 。
(2)待氨气生成后,将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是 。
(3)氨气的密度比空气的密度小,收集氨气应采取 (填“向上”或“向下”)排空气法。
(4)从发生装置中制得的氨气含有水蒸气,可用 (填“碱石灰”或“浓硫酸”)除去其中的水蒸气。
(5)将制得的氨气溶于水,其水溶液呈 性。
(2023·北京·高二统考学业考试)
18.某小组用和制取氨,并验证其性质。
(1)制取氨的化学方程式为 。
(2)制取氨应选用的发生装置是 (填序号)。
(3)收集氨的装置如下图。下列说法正确的是 (填字母)。
a.收集氨时试管口向下,是因为相同条件下氨的密度比空气的小
b.将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明氨已收集满
(4)将盛满氨的试管倒立在水中,试管内液面上升,液体几乎充满试管。说明氨具有的性质是 。
(2023·湖南·高一统考学业考试)
19.实验室常用氯化铵和熟石灰制取氨,其反应的化学方程式为:,某实验小组用下图所示装置制取氨。
请回答下列问题:
(1)仪器A的名称是 。
(2)B装置用于干燥氨,盛放的试剂是 (填“浓硫酸”或“碱石灰”)。
(3)C处虚线框中是排空气法收集氨的装置,应选用 (填“甲”或“乙”)。
(4)实验结束后,向D处烧杯中滴加几滴酚酞溶液,溶液呈 色(填“无”或“红”)。
(5)实验中若消耗了,则理论上可产生标准状况下的体积为 L。
(2023下·天津和平·高一统考学业考试)
20.根据所学相关知识完成下列问题。
Ⅰ.小组Ⅰ用下图装置制取Cl2并探究性质,回答下列问题:
(1)装置①用于制取Cl2,反应的化学方程式是
(2)装置②的作用是
(3)装置③中的现象是
(4)装置④中发生反应的离子方程式是
Ⅱ.小组Ⅱ利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
(5)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是
(6)当观察到②中溶液颜色变浅时,①中的现象是
(7)装置③的作用是
(8)②中的现象说明二氧化硫具有的性质是
Ⅲ.小组Ⅲ用图1所示装置制取氨,并探究其性质,回答下列问题:
(9)仪器a的名称是
(10)图1试管内发生反应的化学方程式是
(11)图1方框中的收集装置应为 (填图3中字母标号)。
(12)将蘸有浓盐酸的棉球放入收集满NH3的集气瓶中,迅速盖上玻璃片,可观察到的实验现象是
(13)甲同学设计了图2所示的装置进行尾气处理,乙同学认为该设计不合理,其理由是
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.CaO与水反应放出大量的热,加快一水合氨分解出氨气,故A正确;
B.氨气是碱性气体,不能用浓硫酸干燥,故B错误;
C.氨气溶于水,与水反应生成弱碱一水合氨,使红色石蕊试纸变蓝,故C正确;
D.液氨汽化时要吸收大量的热,使周围温度急剧降低,因此液氨可用作制冷剂,故D正确;
答案选B。
2.A
【详解】A.氧气难溶于水,且不与水反应,可用排水法收集,故A正确;
B.氨气极易溶于水,且与水反应生成一水合氨,不可用排水法收集,故B错误;
C.二氧化氮易溶于水,且能与水反应生成硝酸和NO,不可用排水法收集,故C错误;
D.二氧化硫易溶于水,且能与水反应生成亚硫酸,不可用排水法收集,故D错误;
答案选A。
3.A
【分析】用排水集气法收集的气体不能溶于水,也不能与水反应。
【详解】A.O2不易溶于水,也不与水反应,可以用排水集气法收集,A符合题意;
B.NO2与水反应,3NO2+H2O=2HNO3+NO,不能用排水集气法收集,B不符合题意;
C.NH3极易溶于水,不能用排水集气法收集,C不符合题意;
D.HCl极易溶于水,不能用排水集气法收集,D不符合题意;
故选A。
4.A
【分析】图示为向下排空气的方法收集气体,要求气体的密度比空气小,与空气的成分不能发生反应,据此分析解答。
【详解】A.H2的密度比空气小,与空气的成分不能发生反应,可以使用向下排空气的方法收集,A正确;
B.Cl2的密度比空气大,因此应该使用向上排空气的方法收集,B错误;
C.SO2的密度比空气大,因此应该使用向上排空气的方法收集,C错误;
D.NO容易与空气中的O2反应产生NO2,因此不能使用排空气的方法收集,D错误;
故合理选项是A。
5.D
【详解】碱石灰的主要成分为NaOH和CaO;
A.HCl属于酸性气体,能被碱石灰吸收,HCl不能用碱石灰干燥,A不选;
B.SO2能被碱石灰吸收,SO2不能用碱石灰干燥,B不选;
C.CO2属于酸性氧化物,能被碱石灰吸收,CO2不能用碱石灰干燥,C不选;
D.NH3属于碱性气体,不能被碱石灰吸收,NH3能用碱石灰干燥,D选;
答案选D。
6.B
【详解】不能用浓硫酸干燥;HCl、不能用碱石灰干燥,N2既可以用碱石灰干燥,又可以用浓硫酸干燥,故选B。
7.B
【详解】A.与盐酸反应生成二氧化碳气体,故A不符合题意;
B.与稀反应生成氢气,故B符合题意;
C.浓盐酸与在加热时生成氯气,故C不符合题意;
D.与混合物加热时生成氧气,故D不符合题意;
故选B。
8.C
【详解】A.氯化铵受热分解成氯化氢和氨气,在试管口氨气和氯化氢重新生成氯化铵固体,不能用来制备氨气,A错误;
B.氨气与浓硫酸会发生反应,不能用浓硫酸干燥氨气,B错误;
C.若装置中黑色固体变成红色,可以证明氨气具有还原性,C正确;
D.氨气极易溶于水,需要防止倒吸,苯不能起到防倒吸的作用,D错误;
故选C。
9.A
【分析】用向下排空气法收集的是密度比空气小的气体。
【详解】A.氢气密度比空气小,可用向下排空气法收集,A正确;
B.NO与氧气反应,只能用排水法收集,B错误;
C.Cl2密度比空气大,用向上排空气法收集,C错误;
D.HCl密度比空气大,用向上排空气法收集,D错误;
故选A。
10.C
【详解】A.二氧化锰和浓盐酸反应制取氯气需要加热,故A错误;
B.应该用饱和食盐水除去Cl2中的HCl,故B错误;
C.浓硫酸可以干燥氯气,故C正确;
D.氯气的密度大于空气,应用长管进短管处,故D错误;
故选C。
11.B
【分析】图为排水法收集气体,说明气体不溶于水,以此解答该题。
【详解】图为排水法收集气体,说明收集的气体不溶于水。题中各选项所给的物质中,NO2可以与水反应生成硝酸和NO,SO2 可以溶于水并与水反应生成亚硫酸,NH3极易溶于水且与水反应生成一水合氨。只有氢气不溶于水,故其可用排水法收集。
答案选B。
12.C
【详解】A.碱石灰是碱性干燥剂,可干燥碱性气体氨气,A正确;
B.饱和食盐水可降低氯气在水中的溶解度同时又可以吸收氯化氢,B正确;
C.实验室制氯气用到的是二氧化锰和浓盐酸加热,C错误;
D.NO难溶于水,可用排水法收集,D正确;
故选C。
13.C
【详解】A.浓氨水中存在平衡:NH3+H2ONH3·H2O+OH-,加入生石灰后生成Ca(OH)2使平衡逆向移动最终生成NH3,该装置可完成实验,故A不选;
B.铜和浓硝酸反应生成二氧化氮:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,该装置可完成实验,故B不选;
C.二氧化锰和浓盐酸制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,该反应需要加热,图中无加热装置,该装置不能完成实验,故C选;
D.石灰石和稀盐酸制取二氧化碳:CaCO3+2HCl=CaCl2+CO2↑+H2O,该装置可完成实验,故D不选;
综上所述,答案为C。
14.(1) 2H2O2 2H2O+O2↑ D 浓硫酸
(2)
【分析】制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。
【详解】(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,过氧化氢溶液分解制取氧气的化学方程式为2H2O2 2H2O+O2↑;分液漏斗可以控制反应的速率,为控制反应的速率,应选择的发生装置是D;氧气可以用浓硫酸干燥,为干燥氧气,可将产生的气体通过装有浓硫酸的E装置。故答案为:2H2O2 2H2O+O2↑;D;浓硫酸;
(2)用图示装置收集氢气,因为氢气的密度比空气小,需采用向下排空气法收集,a为进气口,因此a管要短;故答案为:。
15.(1) CaCl2+2NH3↑+2H2O 防止反应生成的水蒸气冷凝后又流回到试管底,使试管底因受热不均而破裂
(2)试管口有白烟产生
(3)ac
(4)ab
【分析】装置A中,采用固、固加热法制取氨气,发生反应为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,生成的NH3密度比空气小,采用向下排空气法收集,为尽快收集到纯净的氨气,试管口放一团疏松的棉花。
【详解】(1)甲装置试管A中,发生NH4Cl与Ca(OH)2的复分解反应,从而制得氨气,化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;为防止试管炸裂,试管A管口略向下倾斜,原因是:防止反应生成的水蒸气冷凝后又流回到试管底,使试管底因受热不均而破裂。
(2)已知 NH3+HCl=NH4Cl,若甲装置试管B中已集满氨气,则可用蘸有浓盐酸的玻璃棒靠近试管口进行检验,现象为:试管口有白烟产生。
(3)a.浓氨水滴入生石灰中,生石灰与水反应放热,降低氨气的溶解度,从而产生氨气,a符合题意;
b.无水氯化钙能与氨气作用生成八氨合氯化钙,不能产生氨气,b不符合题意;
c.浓氨水滴入氢氧化钠固体中,氢氧化钠溶于水放热,降低了氨气的溶解度,从而产生氨气,c符合题意;
故选ac。
(4)a.氨气溶于水生成氨水,显碱性,可使酚酞溶液变红,a符合题意;
b.氯化氢溶于水生成盐酸,显酸性,能使紫色石蕊溶液变红,b符合题意;
c.氨气溶于水生成的氨水显碱性,能使紫色石蕊溶液变蓝,c不符合题意;
故选ab。
【点睛】挥发性酸与挥发性碱挥发出的蒸气相遇,能产生白烟。
16.(1)SO2↑
(2)褪色
(3)还原
(4)NaOH
(5) < 酸雨
(6)BaCl2
【分析】利用图示装置验证铜与浓硫酸的反应产物,左侧试管为反应装置,中间盛有品红溶液的试管用来验证产物中SO2的存在,右侧盛有酸性KMnO4的试管用于验证SO2的还原性,同时也可以吸收SO2,右侧试管口的棉花需浸有NaOH,用来防止SO2进入到空气中污染空气。
【详解】(1)Cu与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
(2)由于反应生成SO2,SO2具有漂白性,可以使品红溶液褪色。
(3)实验中观察到酸性高锰酸钾溶液褪色,说明反应生成是SO2与酸性高锰酸钾溶液反应生成的硫酸根,可以说明SO2具有还原性。
(4)浸A溶液的棉团的作用是吸收多余的尾气,防止污染空气,A为NaOH溶液,SO2可以与NaOH反应生成Na2SO3。
(5)排放的SO2进入到空气中与空气中的水蒸气反应生成酸性物质,使雨水的pH小于5.6,使当地形成酸雨,加速建筑物的腐蚀,加速土壤酸化。
(6)硫酸根可以用盐酸酸化的BaCl2检验,向溶液中加入稀盐酸,可以排除溶液中含有的碳酸根、银离子等干扰离子,再加入BaCl2,若生成白色沉淀,则说明原溶液中含有硫酸根。
17.(1)CaCl2
(2)产生白烟
(3)向下
(4)碱石灰
(5)碱
【分析】本题以实验室制备氨气考查制备的原理,方程式为:Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O,由于NH3能与酸反应,干燥氨气用碱石灰而不能用浓硫酸,氨气的密度小于空气,故收集NH3要用向下排空气法,NH3溶于水得到氨水,氨水呈碱性,据此分析解题。
【详解】(1)根据质量守恒可知,反应方程式为CaCl2,故答案为:CaCl2;
(2)由于浓盐酸易挥发出HCl,NH3+HCl=NH4Cl,故待氨气生成后,将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是产生白烟(NH4Cl固体小颗粒),故答案为:产生白烟;
(3)氨气的密度比空气的密度小,收集氨气应采取向下排空气法,故答案为:向下;
(4)由于NH3溶于水显碱性,能与硫酸反应,2NH3+H2SO4=(NH4)2SO4,故从发生装置中制得的氨气含有水蒸气,可用碱石灰除去其中的水蒸气,故答案为:碱石灰;
(5)将制得的氨气溶于水,由于NH3+H2O+OH-,其水溶液呈碱性,故答案为:碱。
18.(1)
(2)①
(3)ab
(4)易溶于水
【详解】(1)和共热生成氨气、氯化钙和水,实验室制取氨的化学方程式为。故答案为:;
(2)和制取氨,是属于固体、加热型装置,制取氨应选用的发生装置是①。故答案为:①;
(3)a.收集氨时试管口向下,是因为相同条件下氨的密度比空气的小,用向下排空集气法,故a正确;
b.氨气溶于水呈碱性,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明氨已收集满,故正确;
故答案为:ab;
(4)将盛满氨的试管倒立在水中,试管内液面上升,液体几乎充满试管。说明氨具有的性质是易溶于水,使试管内部压强大幅度减小,导致试管内液面上升,液体几乎充满试管。故答案为:易溶于水。
19.(1)酒精灯
(2)碱石灰
(3)乙
(4)红
(5)4.48
【分析】加热氯化铵和氢氧化钙混合物制取氨气,同时有水生成,即B是干燥装置,又氨气属于污染性气体且极易溶于水,所以D是尾气处理装置,同时也能防倒吸,据此回答。
【详解】(1)A属于加热仪器酒精灯;
(2)因氨气属于碱性气体,故使用碱石灰进行干燥;
(3)由于氨气密度比空气小,所以使用排空气集气时需要“短进长出”,即选乙;
(4)氨气溶于水,反应生成一水合氨,即水溶液显碱性,所以溶液呈红色;
(5)消耗,即其物质的量为0.2mol,根据氮原子守恒知,则理论上可产生物质的量为0.2mol,即标准状况下的体积为4.48L。
20.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)除去挥发的HCl
(3)有色布条褪色
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(6)品红溶液褪色(或变浅)
(7)吸收未反应的SO2,防止污染环境
(8)还原性
(9)酒精灯
(10)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(11)B
(12)集气瓶内产生大量白烟
(13)NH3极易溶于水,会导致倒吸
【分析】Ⅰ.在装置①中MnO2与浓盐酸发生反应制取Cl2,由于浓盐酸具有挥发性,挥发的HCl在装置②中被饱和食盐水除去,在装置③中利用湿润的有色布条检验潮湿氯气的漂白性,装置④用于除去多余Cl2,防止大气污染;
Ⅱ.在装置①中验证SO2的漂白性,在装置②中验证SO2的还原性,在装置③中用NaOH溶液除去多余SO2,防止大气污染;
Ⅲ.在装置①中用NH4Cl与Ca(OH)2混合加热制取NH3,在装置②中根据NH3的密度比空气小的性质,用向下排空气方法收集,但由于NH3极易溶于水,因此不能直接将导气管伸入到水中进行吸收,而应该使用倒扣漏斗,使漏斗边缘紧贴水面,就可以起到吸收多余氨气及防止倒吸的作用。
【详解】(1)在装置①中用MnO2与浓盐酸混合加热发生氧化还原反应制取Cl2,反应的化学方程式是:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,导致制取的Cl2会混有杂质HCl,装置②的饱和NaCl溶液的作用是除去挥发的HCl杂质;
(3)Cl2与H2O反应产生HCl和HClO,HClO具有强氧化性,会将有色物质氧化变为无色物质,因此看到装置③中的现象是湿润的有色布条褪色;
(4)Cl2是有毒气体,可根据其能够与碱反应的性质,用NaOH溶液进行尾气处理,防止污染大气,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)Cu与浓硫酸混合加热,发生氧化还原反应,产生CuSO4、SO2、H2O,该反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(6)SO2具有漂白性,能够与品红溶液作用,使溶液由红色变为无色;同时SO2具有强的还原性,会被酸性KMnO4溶液氧化变为H2SO4,KMnO4被还原为无色Mn2+,因此当观察到②中溶液颜色变浅时,①中的现象是溶液由红色变为无色(或溶液红色褪去);
(7)SO2是有毒气体,直接排放会导致大气污染,可根据SO2是酸性氧化物的性质,用NaOH溶液进行吸收,故装置③的作用是吸收未反应的SO2,防止污染环境;
(8)②中SO2通入酸性KMnO4溶液后,溶液紫色变浅的现象说明二氧化硫具有的性质是还原性;
(9)根据图示可知仪器a名称为酒精灯;
(10)图1试管内,用NH4Cl与Ca(OH)2混合加热制取NH3,发生反应的化学方程式是:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(11)在装置②中方框中的装置用于收集NH3,可根据NH3的密度比空气小的性质,用向下排空气方法收集,导气管连接方式是短进长出,故应该选择使用装置B;
(12)浓盐酸具有挥发性,挥发的HCl与NH3混合,在空中发生反应产生NH4Cl白色固体,因此可观察到的实验现象是产生白烟;
(13)由于NH3极易溶于水,若将盛有NH3的导气管直接伸入到水中,由于NH3溶于水,导致导气管内气体压强减小,水沿着导气管进入到收集装置,即产生倒吸现象,故甲同学设计了图2所示的装置进行尾气处理不合适。正确的方法 在导气管末端安装一个倒扣漏斗,使漏斗边缘紧贴水面,这样既有助于NH3的吸收,同时也可以防止倒吸现象的发生。
答案第1页,共2页
答案第1页,共2页
同课章节目录
