合格考真题汇编8金属元素及其化合物二 练习 2024年高中化学学业水平测试(全国通用)(含解析)
文档属性
| 名称 | 合格考真题汇编8金属元素及其化合物二 练习 2024年高中化学学业水平测试(全国通用)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 516.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 20:45:00 | ||
图片预览




文档简介
合格考真题汇编8金属元素及其化合物二
(2023下·宁夏银川·高一六盘山学业考试)
1.工业上由下列物质冶炼制取金属单质时,一般采用热还原法的是
A.HgO B.NaCl C. D.
(2023·广东·高三学业考试)
2.2022年10月,长征五号B运载火箭成功将“梦天”实验舱送入预定轨道。该火箭用到大量铝合金材料,下列性质与铝合金材料的航天应用无关的是
A.低密度 B.耐酸蚀 C.耐磨损 D.强韧性
(2023下·黑龙江·高一统考学业考试)
3.长江以南的低山丘陵区普遍存在着红色土壤,有人说主要因其含铁质(三价铁)相对较多。某研究小组设计简单实验验证该说法是否正确,应选择的试剂是
A.KCl B.KNO3 C.K2SO4 D.KSCN
(2023下·天津·高一统考学业考试)
4.铁丝与氧气或水蒸气反应的共同产物是( )
A.FeO B. C. D.和Fe3O4
(2023下·黑龙江·高一统考学业考试)
5.向盛有溶液的试管中,滴入几滴KSCN溶液,溶液呈
A.无色 B.红色 C.白色 D.蓝色
(2023下·天津·高一统考学业考试)
6.下列物质中,不能由单质直接化合生成的是
A. B. C.HCl D.
(2023下·黑龙江·高一统考学业考试)
7.若检验某溶液中是否含有,应加入的试剂是
A.溶液 B.稀硫酸 C.稀硝酸 D.酸性高锰酸钾溶液
(2023·湖南怀化学业考试)
8.下列物质,不属于合金的是
A.硬铝 B.青铜 C.钢 D.水银
(2023·湖南株洲学业考试)
9.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
A.MgO B. C. D.CuO
(2023下·天津和平·高一统考学业考试)
10.下列说法中,不正确的是
A.向AlCl3溶液中滴加氨水可产生白色沉淀
B.透过蓝色钴玻璃观察钾元素的焰色为紫色
C.铁能在高温条件与水蒸气反应生成H2
D.常温下,铁遇浓硝酸发生钝化,故铜遇浓硝酸也发生钝化
(2023下·浙江宁波·高一统考学业考试)
11.生产生活中,化学无处不在,下列说法错误的是
A.海水中元素种类多样,其中Na,Mg,Br,Au等都是大量元素
B.利用NH4NO3 和水合碳酸钠反应,吸收热量,可制作冰袋
C.常用铝热反应来修复铁轨
D.石油的分馏是物理变化,每种馏分为混合物
(2023·湖北·高二统考学业考试)
12.铝热反应的原理为,该反应可用于铺设高铁无缝钢轨的施工现场焊接钢轨,下列关于该反应的说法错误的是
A.化学能转化为热能 B.铝作为还原剂
C.铁为氧化产物 D.若生成铁至少需要铝
(2023·天津河北·高一统考学业考试)
13.下列金属冶炼的化学反应原理不正确的是
A.
B.
C.(熔融)
D.
(2023·天津河北·高一统考学业考试)
14.下列关于铝及其化合物的说法中,不正确的是
A.铝是地壳中含量最多的金属元素 B.铝表面容易生成一层致密的氧化铝保护膜
C.氧化铝属于两性氧化物 D.氧化铝与水反应生成氢氧化铝
(2023下·广东湛江·学业考试)
15.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
(2023下·四川雅安·高一雅安学业考试)
16.下列离子方程式中正确的是
A.氢氧化钡溶液与稀硫酸反应:
B.将铜片插入硝酸银溶液中:
C.氧化铝与氢氧化钠溶液反应:
D.氯化亚铁溶液与氢氧化钠溶液反应:
(2022下·天津·高一学业考试)
17.下列冶炼金属的方法错误的是
A.电解熔融NaCl制钠 B.加热HgO制汞
C.高温下用CO还原制铁 D.高温下用还原制铝
(2023下·黑龙江哈尔滨·高一学业考试)
18.下列关于铁及其化合物性质和用途的叙述中,错误的是
A.俗称铁红,常用作红色油漆和涂料
B.打印机或复印机使用的墨粉中添加是利用其磁性
C.铁的氧化物都不溶于水,也不与水反应
D.铁与水蒸气在高温下的反应产物为和
(2023·北京丰台·高一统考学业考试)
19.印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如下。
下列说法不正确的是
A.腐蚀池中发生反应的化学方程式是:
B.腐蚀后的废液中,主要的金属阳离子有
C.置换池中发生的主要反应为:和
D.再生池中加入的试剂应为还原剂
(2023下·辽宁·高一统考学业考试)
20.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料,其主要成分为CuCO3 Cu(OH)2,下列说法中错误的是
A.孔雀石颜料中含有重金属离子,使用时勿入口中
B.孔雀石颜料耐酸和碱腐蚀
C.孔雀石颜料不易被空气氧化
D.保存《千里江山图》需控制温度和湿度
(2023·北京海淀·高一统考学业考试)
21.下列物质间的转化不能一步完成的是
A.
B.
C.
D.
(2023·北京海淀·高一统考学业考试)
22.下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
(2023下·黑龙江哈尔滨·学业考试)
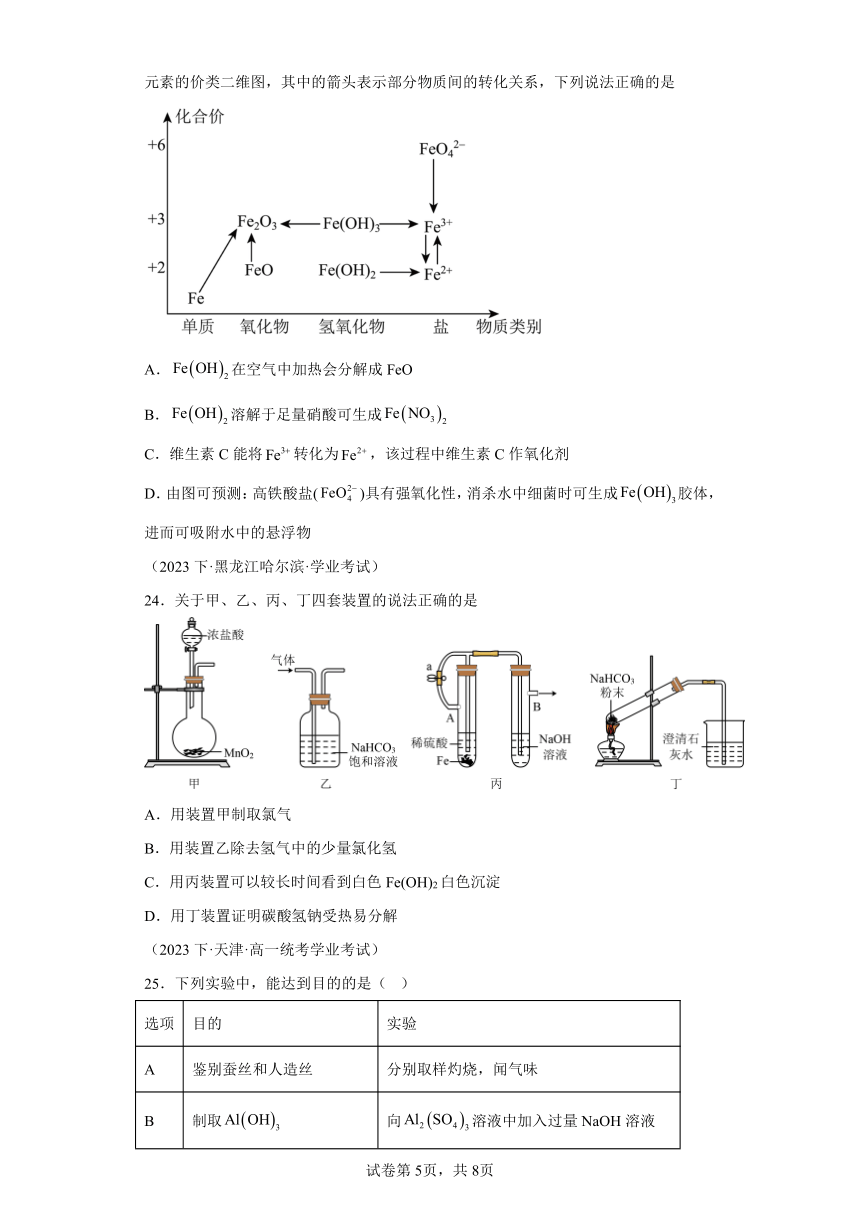
23.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是
A.在空气中加热会分解成FeO
B.溶解于足量硝酸可生成
C.维生素C能将转化为,该过程中维生素C作氧化剂
D.由图可预测:高铁酸盐()具有强氧化性,消杀水中细菌时可生成胶体,进而可吸附水中的悬浮物
(2023下·黑龙江哈尔滨·学业考试)
24.关于甲、乙、丙、丁四套装置的说法正确的是
A.用装置甲制取氯气
B.用装置乙除去氢气中的少量氯化氢
C.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀
D.用丁装置证明碳酸氢钠受热易分解
(2023下·天津·高一统考学业考试)
25.下列实验中,能达到目的的是( )
选项 目的 实验
A 鉴别蚕丝和人造丝 分别取样灼烧,闻气味
B 制取 向溶液中加入过量NaOH溶液
C 验证氧化性: 向KBr溶液加入氯水,向KI溶液加入氯水 观察溶液颜色的变化
D 鉴别乙醇和乙酸 分别取样,滴加酚酞
A.A B.B C.C D.D
(2023·湖南·高一统考学业考试)
26.化学是一门实用性很强的科学。请根据题意填空:
(1)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有 (填“钠”或“钾”)元素;
(2)在金属元素中,有一类金属既可单独使用,也可用于生产合金。在合金中加入该类金属,能大大改善合金的性能,因而,该类金属又被称为“冶金工业的维生素”。则该类金属是 (填“稀土金属”或“碱土金属”);
(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有 (填“Fe2O3”或“Fe3O4”)。
(2023下·湖南郴州·高一统考学业考试)
27.钠、铝和硫是中学化学常见的三种重要元素。请回答下列问题:
(1)钠在空气中燃烧生成 (填“”或“”);
(2)能溶于强酸或强碱溶液生成盐和水,则是一种 (填“酸性”、“碱性”或“两性”)氧化物;
(3)加热时,浓硫酸可与木炭反应,请配平反应的化学方程式: 。
(浓)
(2023·天津河北·高一统考学业考试)
28.下表列出了①~⑨九种元素在周期表中的位置。
族 周期 IA 0
1 ① IIA IIIA IVA VA VIA VIIA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
请按要求回答下列问题:
(1)元素⑦的原子结构示意图: ,元素⑤与⑧组成的化合物的电子式: 。
(2)元素⑤~⑧中原子半径最大的是 (填元素符号)。
(3)元素①~⑨中化学性质最不活泼的是 (填元素符号)。
(4)元素③的氢化物,分子的空间构型呈 形。
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是 (填化学式),X和Y反应的离子方程式: 。
(6)元素①与②所形成的最简单有机物分子中含有 个电子。元素①与②所形成的最简单烯烃为Z,写出Z与水在催化剂、加热、加压条件下反应的化学方程式: ,该反应生成物的官能团是 (填名称),反应类型为 。
(2023下·宁夏银川·高一六盘山学业考试)
29.印刷电路的废腐蚀液含有大量、和,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含 1.5mol/L, 3.0mol/L, 1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显 (填“红色”或“蓝色”、“紫色”),证明废液含有。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
(3)操作Ⅰ是 ,该操作需用到的玻璃仪器有烧杯、普通漏斗和 。
(4)溶液中加入Fe粉,发生反应的离子方程式为 。
(2023下·黑龙江哈尔滨·高一学业考试)
30.某实验小组同学对印刷电路板制作过程中()产生的废液X进行回收处理,流程如图所示:
(1)若制作过程中有与Cu反应,转移电子数约为 。
(2)若向废液X中滴加KSCN溶液变红,证明废液X中含有的离子是 。
(3)实验室中进行操作①或②时,需用到的玻璃仪器有 、 和 。
(4)溶液A与铁粉反应的化学方程式为 。
(5)溶液B与氯气反应的离子方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.工业可以采用加热分解HgO的方法来制备汞,A不符合题意;
B.工业上一般通过电解熔融的氯化钠的方法制备钠单质,B不符合题意;
C.工业上一般通过热还原法由氧化铁制备铁单质,C符合题意;
D.工业上可以采用加热分解Ag2O的方法来制备银,D不符合题意;
故选C。
2.B
【详解】A.铝合金材料的密度比较小,用于航天应用可以减少能源的使用,因此与其低密度的性质有关,A不符合题意;
B.铝合金与空气及酸接触时,会在金属表面产生一层致密的氧化物保护膜,阻止金属的进一步氧化,因此具有一定的抗腐蚀能力,其用于制航天器与其耐酸蚀的性质无关,B符合题意;
C.铝合金材料比其成分金属具有强的抗腐蚀能力,因此该耐磨损的性质可用于航天事业,C不符合题意;
D.铝合金材料具有一定的韧性,抗应变能力强,其强韧性可应用于作航天器,D不符合题意;
故合理选项是B。
3.D
【详解】验证土壤中是否含有Fe3+,可以使用KSCN溶液检验,向蒸馏水中加入少量的土壤后搅拌,土壤中的离子可以进入到蒸馏水中,过滤后得到澄清溶液,向溶液中滴加KSCN溶液,若溶液变成红色,则说明土壤中含有Fe3+,故答案选D。
4.B
【详解】铁丝在氧气中燃烧,生成四氧化三铁;红热的铁与水蒸气在高温条件下反应,生成四氧化三铁和氢气,则共同产物为四氧化三铁(),
故A、C、D选项错误,答案选B。
5.B
【详解】向盛有溶液的试管中,滴入几滴KSCN溶液,溶液中的反应为:,生成血红色溶液。答案选B。
6.A
【详解】A.Cl2具有强氧化性,Fe与Cl2反应生成FeCl3,不能生成FeCl2,故A符合题意;
B.Cu与S反应生成Cu2S,故B不符合题意;
C.H2与Cl2点燃或光照时,化合生成HCl,故C不符合题意;
D.S和O2化合生成SO2,故D不符合题意;
故选A。
7.A
【详解】A.Fe3++SCN-=Fe(SCN)3,出现血红色,A符合题意;
B.铁离子在硫酸溶液中无现象,B不符合题意;
C.铁离子与硝酸无反应现象,C不符合题意;
D.铁离子与高锰酸钾无反应现象,D不符合题意;
故答案为:A。
8.D
【详解】A.硬铝属于铝合金,A错误;
B.青铜是铜合金,B错误;
C.钢是铁合金,C错误;
D.水银是金属汞,是单质,不是合金,D正确。
答案选D。
9.B
【详解】MgO、、CuO都为碱性氧化物,都能与盐酸反应,不与氢氧化钠反应,是两性氧化物,既能与盐酸反应,又能与氢氧化钠溶液反应,故B符合题意。
综上所述,答案为B。
10.D
【详解】A.AlCl3与氨水发生反应AlCl3+3NH3 H2O=Al(OH)3↓+3NH4Cl,向AlCl3溶液中滴加氨水产生白色Al(OH)3沉淀,A项正确;
B.观察钾元素的焰色要透过蓝色钴玻璃,焰色为紫色,B项正确;
C.铁在高温下与水蒸气反应生成Fe3O4和H2,C项正确;
D.常温下,铁遇浓硝酸发生钝化,Cu遇浓硝酸反应生成Cu(NO3)2、NO2和H2O,Cu遇浓硝酸不会发生钝化,D项错误;
答案选D。
11.A
【详解】A.海水中元素种类多样,Cl、S、Ca、K、C、Sr、B、F、Na、Mg、Br等11种元素总含量超过99%,称为大量元素,其余元素为微量,如Au,故A说法错误;
B.硝酸铵与Na2CO3·10H2O反应为吸热反应,从外界吸收能量,达到降温,因此可制作冰袋,故B说法正确;
C.铝热反应利用铝单质强还原性,能将铁置换出来,同时该反应放出大量的热,使铁熔化,因此常用铝热反应来修复铁轨,故C说法正确;
D.石油分馏利用沸点不同进行分离,属于物理变化,得到馏分为沸点相近的混合物,故D说法正确;
答案为A。
12.C
【详解】A.该反应为铝热反应,反应过程中放出大量的热,化学能转化为热能,故A正确;
B.Al转化为氧化铝,Al元素化合价升高,铝作为还原剂,故B正确;
C.转化为Fe单质,该过程中Fe的化合价由+3价降低为0价,Fe为还原产物,故C错误;
D.由反应可知1molAl完全反应生成1molFe,则生成铁至少需要铝,故D正确;
故选:C。
13.A
【分析】金属冶炼的方法与金属的活泼性相关,金属越是活泼,越难冶炼,其中活泼金属Na、Mg、Al要用电解法来冶炼,而Fe、Cu可用还原法来冶炼,Ag是不活泼金属,用加热分解法。
【详解】A.Mg是活泼金属,利用电解熔融的氯化镁获得金属Mg,MgCl2(熔融)Mg+Cl2↑,A错误;
B.Ag是不活泼金属,用加热分解法,直接加热氧化银分解得到金属银,2Ag2O4Ag+O2↑,B正确;
C.Al是活泼金属,利用电解熔融的氧化铝获得金属Al,2Al2O3(熔融) 4Al+3O2↑, C正确;
D.Fe是较活泼金属,利用热还原法来获得Fe,可以使用的还原剂CO,Fe2O3+3CO2Fe+3CO2,D正确;
故答案为:A。
14.D
【详解】A.铝是地壳中含量最多的金属元素,故A正确;
B.铝是活泼金属,铝表面容易生成一层致密的氧化铝保护膜,故B正确;
C.氧化铝与强酸、强碱都能反应,属于两性氧化物,故C正确;
D.氧化铝与水不反应,故D错误;
选D。
15.B
【详解】①金属钠在纯氧中燃烧生成淡黄色Na2O2;
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,最终生成红褐色Fe(OH)3沉淀;
③FeCl3溶液中滴入KSCN溶液,溶液变为血红色;
④无水硫酸铜放入医用酒精中,无水硫酸铜结合水生成蓝色;
红色、红褐色、淡黄色、蓝色顺序排列的是③②①④,选B。
16.D
【详解】A.二者还反应生成硫酸钡沉淀,离子方程式为Ba2+++2OH-+2H+═2H2O+BaSO4↓,故A错误;
B.电荷不守恒,离子方程式为Cu+2Ag+═Cu2++2Ag,故B错误;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-═2+H2O,故C错误;
D.氯化亚铁溶液与氢氧化钠溶液反应生成氢氧化亚铁沉淀,离子方程式为:,故D正确;
故选:D。
17.D
【分析】根据金属活动性顺序的不同可选择不同的冶炼方法冶炼金属,非常活泼的K、Ca、Na、Mg、Al的冶炼可采用电解法,相对活泼的金属如Fe的冶炼可采用热还原法,金属Cu、Hg可采用加热法,不活泼的Pt、Au等采用物理方法获得。
【详解】A.工业上利用电解熔融NaCl制钠和氯气,A正确;
B.加热HgO可生成Hg和氧气,B正确;
C.高温下可用CO还原生成铁单质和CO2,用此法可冶炼铁,C正确;
D.工业采用电解氧化铝的方法制备铝,不能用氢气还原制铝,D错误;
故选D。
18.D
【详解】A.Fe2O3为红棕色,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料,选项A正确;
B.打印机或复印机使用的墨粉中添加是利用其磁性,选项B正确;
C.铁的氧化物均不溶于水,均不能与水反应,选项C正确;
D.铁与水蒸气在高温^下反应生成Fe3O4和氢气,不能生成Fe2O3,选项D错误;
答案选D。
19.D
【分析】腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,腐蚀液中加铁粉,置换池中铁和氯化铁反应生成氯化亚铁、铁和氯化铜反应生成氯化亚铁和铜,再生池中氯化亚铁和氯气反应生成氯化铁。
【详解】A.腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,发生反应的化学方程式是:,故A正确;
B.腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,腐蚀后的废液中,主要的金属阳离子有,故B正确;
C.置换池中铁和氯化铁反应生成氯化亚铁、铁和氯化铜反应生成氯化亚铁和铜,发生的主要反应为:和,故C正确;
D.再生池中氯化亚铁和氯气发生氧化反应生成氯化铁,加入的试剂应为氧化剂,故D错误;
选D。
20.B
【详解】A.CuCO3 Cu(OH)2中含有的铜离子属于重金属离子,有毒,食用会危害人体健康,A选项正确;
B.CuCO3 Cu(OH)2中含有的碳酸根离子、氢氧根离子与酸反应,不与碱反应,则孔雀石颜料耐碱不耐酸,B选项错误;
C.元素的低价态具有还原性,可以被氧化,而CuCO3 Cu(OH)2中除O元素外,C、H、Cu均为最高价,无还原性,不能被空气中氧气氧化,C选项正确;
D.CuCO3 Cu(OH)2不稳定,受热易分解,纸张中的纤维素在一定条件下能水解,所以保存《千里江山图》需控制温度和湿度,D选项正确;
答案选B。
21.A
【详解】A.Cu与O2加热生成CuO,CuO是碱性氧化物不能一步变成Cu(OH)2,A符合题意;
B. Fe与盐酸反应生成FeCl2,FeCl2加碱生成Fe(OH)2,Fe(OH)2在空气中被氧化生成Fe(OH)3,Fe(OH)3与盐酸反应生成FeCl3,以上反应均能一步完成,B不符合题意;
C.电解熔融NaCl或NaCl溶液得到Cl2,Cl2与石灰乳Ca(OH)2反应制取漂白粉有效成分Ca(ClO)2,Ca(ClO)2与酸反应生成HClO,HClO光照或加热分解生成HCl,以上反应均能一步实现,C不符合题意;
D.Na与O2加热生成Na2O2,Na2O2与水反应生成NaOH,过量NaOH与CO2反应生成Na2CO3,Na2CO3溶液与CO2反应生成NaHCO3,以上反应均能一步实现,D不符合题意;
故答案选A。
22.B
【详解】A. 向溶液中通入氯气,将为,溶液变为黄色,该反应的离子方程式:,A正确;
B. Cu和稀反应放出的是NO,不是,正确的离子方程式为:,B错误;
C. 向溶液中滴加NaOH溶液,和反应生成沉淀,离子方程式为:,C正确;
D.与水反应生成氢氧化钠和氧气,离子方程式为: ,D正确;
故答案选B。
【点睛】离子方程式正误判断规律(三“看”),第一看:符不符(即是否符合反应事实);第二看:平不平(即元素守恒、电荷守恒、电子守恒);第三看:拆不拆(即离子、分子形式的书写是不是有问题)。
23.D
【详解】A.中+2价铁易被氧化到+3价,即在空气中加热会分解成氧化铁,A错误;
B.硝酸具有强氧化性,即溶解于足量硝酸可生成,B错误;
C.维生素C能将转化为,该过程中维生素C失去电子作还原剂,C错误;
D.高铁酸盐()具有强氧化性,消杀水中细菌时得电子生成三价铁离子,其水解可生成胶体,进而可吸附水中的悬浮物,D正确;
故选D。
24.C
【详解】A.MnO2与浓盐酸混合制取Cl2需要在加热条件下进行,装置中缺少加热装置,因此不能用于制取Cl2,A项错误;
B.HCl溶于水产生盐酸,盐酸与NaHCO3发生产生CO2气体,导致Cl2中含有新杂质CO2气体,不能达到目的,B项错误;
C.试管中Fe与H2SO4反应产生FeSO4和H2,产生的H2将试管A、B及导气管中空气排出,待其中没有空气后,关闭阀门a,反应产生的H2又将A中新制取的FeSO4压入B试管中,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,由于处于H2的惰性环境,产生的Fe(OH)2不会被氧化,因此可以较长时间观察到Fe(OH)2白色沉淀,C项正确;
D.固体加热时为防止产生的水蒸气冷凝回流,试管口应该略向下倾斜,D项错误;
答案选C。
25.A
【详解】A.蚕丝的成分为蛋白质,灼烧有烧焦羽毛的气味,人造丝灼烧有芹菜味,可鉴别,故A正确;
B.加入过量NaOH溶液,生成偏铝酸钠,应选氨水制备,故B错误;
C.不能比较溴、碘的氧化性,该实验只能说明氯气的氧化性最强,故C错误;
D.二者遇酚酞均为无色,现象相同,不能鉴别,故D错误;
答案选A。
26.(1)钠
(2)稀土金属
(3)Fe3O4
【详解】(1)钠元素的颜色反应为黄色,故据此他判断汤汁中含有钠元素;
(2)合金中加入适量的稀土金属,能大大改善合金的性能,加入的稀土元素的种类及相对量的多少不同,物质的性质不同,因此稀土元素被称为“冶金工业的维生素";
(3)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁化学式为Fe3O4。
27.(1)
(2)两性
(3) 2
【详解】(1)钠在空气中燃烧生成;
(2)既能溶于强酸,也能溶于强碱溶液生成盐和水,则是一种两性氧化物;
(3)C元素化合价从0价升高至+4价,S元素化合价从+6降低至+4价,由得失电子守恒,含S元素的物质系数配2,含C元素的配1,则配平化学方程式为。
28.(1)
(2)Na
(3)Ar
(4)V
(5) Al(OH)3
(6) 10 羟基 加成反应
【分析】根据元素在周期表中的位置,①是H元素;②是C元素;③是O元素;④是F元素;⑤是Na元素;⑥是Al元素;⑦是Si元素;⑧是Cl元素;⑨是Kr元素;
【详解】(1)⑦是Si元素,Si原子结构示意图为 ,元素⑤与⑧组成离子化合物NaCl,电子式为 。
(2)同周期元素从左到右半径依次减小,元素⑤~⑧中原子半径最大的是Na。
(3)Ar原子最外层有8个电子,不易得电子也不易失电子,性质稳定,元素①~⑨中化学性质最不活泼的是Ar。
(4)元素③的氢化物是H2O,分子的空间构型呈V形。
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,其中属于两性氢氧化物的是Al(OH)3,NaOH和Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式为 。
(6)元素①与②所形成的最简单有机物是CH4,分子中含10个电子。元素①与②所形成的最简单烯烃为Z是乙烯,乙烯与水在催化剂、加热、加压条件下反应生成乙醇,化学方程式为 ,乙醇中的官能团是羟基,反应类型为加成反应。
29.(1)红色
(2)HCl
(3) 过滤 玻璃棒
(4)2Fe3++Fe=3Fe2+
【分析】由题给流程可知,向废腐蚀液中加入过量铁粉,过量铁粉先后与氯化铁、氯化铜和盐酸反应得到氯化亚铁溶液和铜,过滤得到含有铁粉的铜和氯化亚铁溶液;向氯化亚铁溶液中通入氯气,将氯化亚铁氧化为氯化铁得到氯化铁溶液。
【详解】(1)向少量废腐蚀液中滴入硫氰化钾溶液,若溶液变为红色,说明废液中含有氯化铁;
(2)由分析可知,过滤得到的铜中含有过量的铁粉,加入盐酸将铁粉转化为氯化亚铁可以除去铜中的杂质铁粉,故答案为:HCl;
(3)由分析可知,操作Ⅰ是过滤,过滤需用到的玻璃仪器有烧杯、普通漏斗和玻璃棒,故答案为:玻璃棒;
(4)氯化铁可以和单质铁反应生成氯化亚铁,离子方程式为:2Fe3++Fe=3Fe2+。
30.(1)
(2)
(3) 烧杯 漏斗 玻璃棒
(4)
(5)
【分析】废液X加过量铁粉,铁把氯化铁还原为氯化亚铁,铁置换出铜,固体混合物中含有铁、铜;氯化亚铁通入过量氯气生成氯化铁,A是氯化铁;固体混合物加盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不溶于盐酸,溶液B是氯化亚铁。
【详解】(1)制作过程中发生反应,铁元素化合价由+3降低为+2,有与Cu反应,转移1mol电子,电子数约为;
(2)Fe3+遇KSCN溶液变红,若向废液X中滴加KSCN溶液变红,证明废液X中含有的离子是Fe3+。
(3)操作①或②都是固液分离,操作为过滤,过滤装置图为,需用到的玻璃仪器有烧杯、漏斗和玻璃棒。
(4)A是氯化铁,氯化铁溶液与铁粉反应生成氯化亚铁,反应的化学方程式为;
(5)B氯化亚铁,氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
(2023下·宁夏银川·高一六盘山学业考试)
1.工业上由下列物质冶炼制取金属单质时,一般采用热还原法的是
A.HgO B.NaCl C. D.
(2023·广东·高三学业考试)
2.2022年10月,长征五号B运载火箭成功将“梦天”实验舱送入预定轨道。该火箭用到大量铝合金材料,下列性质与铝合金材料的航天应用无关的是
A.低密度 B.耐酸蚀 C.耐磨损 D.强韧性
(2023下·黑龙江·高一统考学业考试)
3.长江以南的低山丘陵区普遍存在着红色土壤,有人说主要因其含铁质(三价铁)相对较多。某研究小组设计简单实验验证该说法是否正确,应选择的试剂是
A.KCl B.KNO3 C.K2SO4 D.KSCN
(2023下·天津·高一统考学业考试)
4.铁丝与氧气或水蒸气反应的共同产物是( )
A.FeO B. C. D.和Fe3O4
(2023下·黑龙江·高一统考学业考试)
5.向盛有溶液的试管中,滴入几滴KSCN溶液,溶液呈
A.无色 B.红色 C.白色 D.蓝色
(2023下·天津·高一统考学业考试)
6.下列物质中,不能由单质直接化合生成的是
A. B. C.HCl D.
(2023下·黑龙江·高一统考学业考试)
7.若检验某溶液中是否含有,应加入的试剂是
A.溶液 B.稀硫酸 C.稀硝酸 D.酸性高锰酸钾溶液
(2023·湖南怀化学业考试)
8.下列物质,不属于合金的是
A.硬铝 B.青铜 C.钢 D.水银
(2023·湖南株洲学业考试)
9.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是
A.MgO B. C. D.CuO
(2023下·天津和平·高一统考学业考试)
10.下列说法中,不正确的是
A.向AlCl3溶液中滴加氨水可产生白色沉淀
B.透过蓝色钴玻璃观察钾元素的焰色为紫色
C.铁能在高温条件与水蒸气反应生成H2
D.常温下,铁遇浓硝酸发生钝化,故铜遇浓硝酸也发生钝化
(2023下·浙江宁波·高一统考学业考试)
11.生产生活中,化学无处不在,下列说法错误的是
A.海水中元素种类多样,其中Na,Mg,Br,Au等都是大量元素
B.利用NH4NO3 和水合碳酸钠反应,吸收热量,可制作冰袋
C.常用铝热反应来修复铁轨
D.石油的分馏是物理变化,每种馏分为混合物
(2023·湖北·高二统考学业考试)
12.铝热反应的原理为,该反应可用于铺设高铁无缝钢轨的施工现场焊接钢轨,下列关于该反应的说法错误的是
A.化学能转化为热能 B.铝作为还原剂
C.铁为氧化产物 D.若生成铁至少需要铝
(2023·天津河北·高一统考学业考试)
13.下列金属冶炼的化学反应原理不正确的是
A.
B.
C.(熔融)
D.
(2023·天津河北·高一统考学业考试)
14.下列关于铝及其化合物的说法中,不正确的是
A.铝是地壳中含量最多的金属元素 B.铝表面容易生成一层致密的氧化铝保护膜
C.氧化铝属于两性氧化物 D.氧化铝与水反应生成氢氧化铝
(2023下·广东湛江·学业考试)
15.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
(2023下·四川雅安·高一雅安学业考试)
16.下列离子方程式中正确的是
A.氢氧化钡溶液与稀硫酸反应:
B.将铜片插入硝酸银溶液中:
C.氧化铝与氢氧化钠溶液反应:
D.氯化亚铁溶液与氢氧化钠溶液反应:
(2022下·天津·高一学业考试)
17.下列冶炼金属的方法错误的是
A.电解熔融NaCl制钠 B.加热HgO制汞
C.高温下用CO还原制铁 D.高温下用还原制铝
(2023下·黑龙江哈尔滨·高一学业考试)
18.下列关于铁及其化合物性质和用途的叙述中,错误的是
A.俗称铁红,常用作红色油漆和涂料
B.打印机或复印机使用的墨粉中添加是利用其磁性
C.铁的氧化物都不溶于水,也不与水反应
D.铁与水蒸气在高温下的反应产物为和
(2023·北京丰台·高一统考学业考试)
19.印刷电路板(PCB)是用腐蚀液将覆铜板上的部分铜腐蚀掉而制得。一种用FeCl3溶液制作PCB并将腐蚀后废液回收再生的流程如下。
下列说法不正确的是
A.腐蚀池中发生反应的化学方程式是:
B.腐蚀后的废液中,主要的金属阳离子有
C.置换池中发生的主要反应为:和
D.再生池中加入的试剂应为还原剂
(2023下·辽宁·高一统考学业考试)
20.宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料,其主要成分为CuCO3 Cu(OH)2,下列说法中错误的是
A.孔雀石颜料中含有重金属离子,使用时勿入口中
B.孔雀石颜料耐酸和碱腐蚀
C.孔雀石颜料不易被空气氧化
D.保存《千里江山图》需控制温度和湿度
(2023·北京海淀·高一统考学业考试)
21.下列物质间的转化不能一步完成的是
A.
B.
C.
D.
(2023·北京海淀·高一统考学业考试)
22.下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++2OH-=Cu(OH)2↓
D.Na2O2是重要的供氧剂:2Na2O2+2H2O=4Na++4OH-+O2↑
(2023下·黑龙江哈尔滨·学业考试)
23.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是
A.在空气中加热会分解成FeO
B.溶解于足量硝酸可生成
C.维生素C能将转化为,该过程中维生素C作氧化剂
D.由图可预测:高铁酸盐()具有强氧化性,消杀水中细菌时可生成胶体,进而可吸附水中的悬浮物
(2023下·黑龙江哈尔滨·学业考试)
24.关于甲、乙、丙、丁四套装置的说法正确的是
A.用装置甲制取氯气
B.用装置乙除去氢气中的少量氯化氢
C.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀
D.用丁装置证明碳酸氢钠受热易分解
(2023下·天津·高一统考学业考试)
25.下列实验中,能达到目的的是( )
选项 目的 实验
A 鉴别蚕丝和人造丝 分别取样灼烧,闻气味
B 制取 向溶液中加入过量NaOH溶液
C 验证氧化性: 向KBr溶液加入氯水,向KI溶液加入氯水 观察溶液颜色的变化
D 鉴别乙醇和乙酸 分别取样,滴加酚酞
A.A B.B C.C D.D
(2023·湖南·高一统考学业考试)
26.化学是一门实用性很强的科学。请根据题意填空:
(1)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有 (填“钠”或“钾”)元素;
(2)在金属元素中,有一类金属既可单独使用,也可用于生产合金。在合金中加入该类金属,能大大改善合金的性能,因而,该类金属又被称为“冶金工业的维生素”。则该类金属是 (填“稀土金属”或“碱土金属”);
(3)中国古代最早的指南针“司南”,其具有磁性作用是因为主要含有 (填“Fe2O3”或“Fe3O4”)。
(2023下·湖南郴州·高一统考学业考试)
27.钠、铝和硫是中学化学常见的三种重要元素。请回答下列问题:
(1)钠在空气中燃烧生成 (填“”或“”);
(2)能溶于强酸或强碱溶液生成盐和水,则是一种 (填“酸性”、“碱性”或“两性”)氧化物;
(3)加热时,浓硫酸可与木炭反应,请配平反应的化学方程式: 。
(浓)
(2023·天津河北·高一统考学业考试)
28.下表列出了①~⑨九种元素在周期表中的位置。
族 周期 IA 0
1 ① IIA IIIA IVA VA VIA VIIA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
请按要求回答下列问题:
(1)元素⑦的原子结构示意图: ,元素⑤与⑧组成的化合物的电子式: 。
(2)元素⑤~⑧中原子半径最大的是 (填元素符号)。
(3)元素①~⑨中化学性质最不活泼的是 (填元素符号)。
(4)元素③的氢化物,分子的空间构型呈 形。
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为X和Y,其中属于两性氢氧化物的是 (填化学式),X和Y反应的离子方程式: 。
(6)元素①与②所形成的最简单有机物分子中含有 个电子。元素①与②所形成的最简单烯烃为Z,写出Z与水在催化剂、加热、加压条件下反应的化学方程式: ,该反应生成物的官能团是 (填名称),反应类型为 。
(2023下·宁夏银川·高一六盘山学业考试)
29.印刷电路的废腐蚀液含有大量、和,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含 1.5mol/L, 3.0mol/L, 1.0mol/L,HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
(1)取少量废腐蚀液于试管中,滴入1~2滴KSCN溶液,若溶液显 (填“红色”或“蓝色”、“紫色”),证明废液含有。
(2)上述方法获得的铜粉中含有杂质,除杂所需试剂是 (填化学式)。
(3)操作Ⅰ是 ,该操作需用到的玻璃仪器有烧杯、普通漏斗和 。
(4)溶液中加入Fe粉,发生反应的离子方程式为 。
(2023下·黑龙江哈尔滨·高一学业考试)
30.某实验小组同学对印刷电路板制作过程中()产生的废液X进行回收处理,流程如图所示:
(1)若制作过程中有与Cu反应,转移电子数约为 。
(2)若向废液X中滴加KSCN溶液变红,证明废液X中含有的离子是 。
(3)实验室中进行操作①或②时,需用到的玻璃仪器有 、 和 。
(4)溶液A与铁粉反应的化学方程式为 。
(5)溶液B与氯气反应的离子方程式为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.工业可以采用加热分解HgO的方法来制备汞,A不符合题意;
B.工业上一般通过电解熔融的氯化钠的方法制备钠单质,B不符合题意;
C.工业上一般通过热还原法由氧化铁制备铁单质,C符合题意;
D.工业上可以采用加热分解Ag2O的方法来制备银,D不符合题意;
故选C。
2.B
【详解】A.铝合金材料的密度比较小,用于航天应用可以减少能源的使用,因此与其低密度的性质有关,A不符合题意;
B.铝合金与空气及酸接触时,会在金属表面产生一层致密的氧化物保护膜,阻止金属的进一步氧化,因此具有一定的抗腐蚀能力,其用于制航天器与其耐酸蚀的性质无关,B符合题意;
C.铝合金材料比其成分金属具有强的抗腐蚀能力,因此该耐磨损的性质可用于航天事业,C不符合题意;
D.铝合金材料具有一定的韧性,抗应变能力强,其强韧性可应用于作航天器,D不符合题意;
故合理选项是B。
3.D
【详解】验证土壤中是否含有Fe3+,可以使用KSCN溶液检验,向蒸馏水中加入少量的土壤后搅拌,土壤中的离子可以进入到蒸馏水中,过滤后得到澄清溶液,向溶液中滴加KSCN溶液,若溶液变成红色,则说明土壤中含有Fe3+,故答案选D。
4.B
【详解】铁丝在氧气中燃烧,生成四氧化三铁;红热的铁与水蒸气在高温条件下反应,生成四氧化三铁和氢气,则共同产物为四氧化三铁(),
故A、C、D选项错误,答案选B。
5.B
【详解】向盛有溶液的试管中,滴入几滴KSCN溶液,溶液中的反应为:,生成血红色溶液。答案选B。
6.A
【详解】A.Cl2具有强氧化性,Fe与Cl2反应生成FeCl3,不能生成FeCl2,故A符合题意;
B.Cu与S反应生成Cu2S,故B不符合题意;
C.H2与Cl2点燃或光照时,化合生成HCl,故C不符合题意;
D.S和O2化合生成SO2,故D不符合题意;
故选A。
7.A
【详解】A.Fe3++SCN-=Fe(SCN)3,出现血红色,A符合题意;
B.铁离子在硫酸溶液中无现象,B不符合题意;
C.铁离子与硝酸无反应现象,C不符合题意;
D.铁离子与高锰酸钾无反应现象,D不符合题意;
故答案为:A。
8.D
【详解】A.硬铝属于铝合金,A错误;
B.青铜是铜合金,B错误;
C.钢是铁合金,C错误;
D.水银是金属汞,是单质,不是合金,D正确。
答案选D。
9.B
【详解】MgO、、CuO都为碱性氧化物,都能与盐酸反应,不与氢氧化钠反应,是两性氧化物,既能与盐酸反应,又能与氢氧化钠溶液反应,故B符合题意。
综上所述,答案为B。
10.D
【详解】A.AlCl3与氨水发生反应AlCl3+3NH3 H2O=Al(OH)3↓+3NH4Cl,向AlCl3溶液中滴加氨水产生白色Al(OH)3沉淀,A项正确;
B.观察钾元素的焰色要透过蓝色钴玻璃,焰色为紫色,B项正确;
C.铁在高温下与水蒸气反应生成Fe3O4和H2,C项正确;
D.常温下,铁遇浓硝酸发生钝化,Cu遇浓硝酸反应生成Cu(NO3)2、NO2和H2O,Cu遇浓硝酸不会发生钝化,D项错误;
答案选D。
11.A
【详解】A.海水中元素种类多样,Cl、S、Ca、K、C、Sr、B、F、Na、Mg、Br等11种元素总含量超过99%,称为大量元素,其余元素为微量,如Au,故A说法错误;
B.硝酸铵与Na2CO3·10H2O反应为吸热反应,从外界吸收能量,达到降温,因此可制作冰袋,故B说法正确;
C.铝热反应利用铝单质强还原性,能将铁置换出来,同时该反应放出大量的热,使铁熔化,因此常用铝热反应来修复铁轨,故C说法正确;
D.石油分馏利用沸点不同进行分离,属于物理变化,得到馏分为沸点相近的混合物,故D说法正确;
答案为A。
12.C
【详解】A.该反应为铝热反应,反应过程中放出大量的热,化学能转化为热能,故A正确;
B.Al转化为氧化铝,Al元素化合价升高,铝作为还原剂,故B正确;
C.转化为Fe单质,该过程中Fe的化合价由+3价降低为0价,Fe为还原产物,故C错误;
D.由反应可知1molAl完全反应生成1molFe,则生成铁至少需要铝,故D正确;
故选:C。
13.A
【分析】金属冶炼的方法与金属的活泼性相关,金属越是活泼,越难冶炼,其中活泼金属Na、Mg、Al要用电解法来冶炼,而Fe、Cu可用还原法来冶炼,Ag是不活泼金属,用加热分解法。
【详解】A.Mg是活泼金属,利用电解熔融的氯化镁获得金属Mg,MgCl2(熔融)Mg+Cl2↑,A错误;
B.Ag是不活泼金属,用加热分解法,直接加热氧化银分解得到金属银,2Ag2O4Ag+O2↑,B正确;
C.Al是活泼金属,利用电解熔融的氧化铝获得金属Al,2Al2O3(熔融) 4Al+3O2↑, C正确;
D.Fe是较活泼金属,利用热还原法来获得Fe,可以使用的还原剂CO,Fe2O3+3CO2Fe+3CO2,D正确;
故答案为:A。
14.D
【详解】A.铝是地壳中含量最多的金属元素,故A正确;
B.铝是活泼金属,铝表面容易生成一层致密的氧化铝保护膜,故B正确;
C.氧化铝与强酸、强碱都能反应,属于两性氧化物,故C正确;
D.氧化铝与水不反应,故D错误;
选D。
15.B
【详解】①金属钠在纯氧中燃烧生成淡黄色Na2O2;
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,最终生成红褐色Fe(OH)3沉淀;
③FeCl3溶液中滴入KSCN溶液,溶液变为血红色;
④无水硫酸铜放入医用酒精中,无水硫酸铜结合水生成蓝色;
红色、红褐色、淡黄色、蓝色顺序排列的是③②①④,选B。
16.D
【详解】A.二者还反应生成硫酸钡沉淀,离子方程式为Ba2+++2OH-+2H+═2H2O+BaSO4↓,故A错误;
B.电荷不守恒,离子方程式为Cu+2Ag+═Cu2++2Ag,故B错误;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为:Al2O3+2OH-═2+H2O,故C错误;
D.氯化亚铁溶液与氢氧化钠溶液反应生成氢氧化亚铁沉淀,离子方程式为:,故D正确;
故选:D。
17.D
【分析】根据金属活动性顺序的不同可选择不同的冶炼方法冶炼金属,非常活泼的K、Ca、Na、Mg、Al的冶炼可采用电解法,相对活泼的金属如Fe的冶炼可采用热还原法,金属Cu、Hg可采用加热法,不活泼的Pt、Au等采用物理方法获得。
【详解】A.工业上利用电解熔融NaCl制钠和氯气,A正确;
B.加热HgO可生成Hg和氧气,B正确;
C.高温下可用CO还原生成铁单质和CO2,用此法可冶炼铁,C正确;
D.工业采用电解氧化铝的方法制备铝,不能用氢气还原制铝,D错误;
故选D。
18.D
【详解】A.Fe2O3为红棕色,俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料,选项A正确;
B.打印机或复印机使用的墨粉中添加是利用其磁性,选项B正确;
C.铁的氧化物均不溶于水,均不能与水反应,选项C正确;
D.铁与水蒸气在高温^下反应生成Fe3O4和氢气,不能生成Fe2O3,选项D错误;
答案选D。
19.D
【分析】腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,腐蚀液中加铁粉,置换池中铁和氯化铁反应生成氯化亚铁、铁和氯化铜反应生成氯化亚铁和铜,再生池中氯化亚铁和氯气反应生成氯化铁。
【详解】A.腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,发生反应的化学方程式是:,故A正确;
B.腐蚀池中氯化铁和铜反应生成氯化亚铁和氯化铜,腐蚀后的废液中,主要的金属阳离子有,故B正确;
C.置换池中铁和氯化铁反应生成氯化亚铁、铁和氯化铜反应生成氯化亚铁和铜,发生的主要反应为:和,故C正确;
D.再生池中氯化亚铁和氯气发生氧化反应生成氯化铁,加入的试剂应为氧化剂,故D错误;
选D。
20.B
【详解】A.CuCO3 Cu(OH)2中含有的铜离子属于重金属离子,有毒,食用会危害人体健康,A选项正确;
B.CuCO3 Cu(OH)2中含有的碳酸根离子、氢氧根离子与酸反应,不与碱反应,则孔雀石颜料耐碱不耐酸,B选项错误;
C.元素的低价态具有还原性,可以被氧化,而CuCO3 Cu(OH)2中除O元素外,C、H、Cu均为最高价,无还原性,不能被空气中氧气氧化,C选项正确;
D.CuCO3 Cu(OH)2不稳定,受热易分解,纸张中的纤维素在一定条件下能水解,所以保存《千里江山图》需控制温度和湿度,D选项正确;
答案选B。
21.A
【详解】A.Cu与O2加热生成CuO,CuO是碱性氧化物不能一步变成Cu(OH)2,A符合题意;
B. Fe与盐酸反应生成FeCl2,FeCl2加碱生成Fe(OH)2,Fe(OH)2在空气中被氧化生成Fe(OH)3,Fe(OH)3与盐酸反应生成FeCl3,以上反应均能一步完成,B不符合题意;
C.电解熔融NaCl或NaCl溶液得到Cl2,Cl2与石灰乳Ca(OH)2反应制取漂白粉有效成分Ca(ClO)2,Ca(ClO)2与酸反应生成HClO,HClO光照或加热分解生成HCl,以上反应均能一步实现,C不符合题意;
D.Na与O2加热生成Na2O2,Na2O2与水反应生成NaOH,过量NaOH与CO2反应生成Na2CO3,Na2CO3溶液与CO2反应生成NaHCO3,以上反应均能一步实现,D不符合题意;
故答案选A。
22.B
【详解】A. 向溶液中通入氯气,将为,溶液变为黄色,该反应的离子方程式:,A正确;
B. Cu和稀反应放出的是NO,不是,正确的离子方程式为:,B错误;
C. 向溶液中滴加NaOH溶液,和反应生成沉淀,离子方程式为:,C正确;
D.与水反应生成氢氧化钠和氧气,离子方程式为: ,D正确;
故答案选B。
【点睛】离子方程式正误判断规律(三“看”),第一看:符不符(即是否符合反应事实);第二看:平不平(即元素守恒、电荷守恒、电子守恒);第三看:拆不拆(即离子、分子形式的书写是不是有问题)。
23.D
【详解】A.中+2价铁易被氧化到+3价,即在空气中加热会分解成氧化铁,A错误;
B.硝酸具有强氧化性,即溶解于足量硝酸可生成,B错误;
C.维生素C能将转化为,该过程中维生素C失去电子作还原剂,C错误;
D.高铁酸盐()具有强氧化性,消杀水中细菌时得电子生成三价铁离子,其水解可生成胶体,进而可吸附水中的悬浮物,D正确;
故选D。
24.C
【详解】A.MnO2与浓盐酸混合制取Cl2需要在加热条件下进行,装置中缺少加热装置,因此不能用于制取Cl2,A项错误;
B.HCl溶于水产生盐酸,盐酸与NaHCO3发生产生CO2气体,导致Cl2中含有新杂质CO2气体,不能达到目的,B项错误;
C.试管中Fe与H2SO4反应产生FeSO4和H2,产生的H2将试管A、B及导气管中空气排出,待其中没有空气后,关闭阀门a,反应产生的H2又将A中新制取的FeSO4压入B试管中,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,由于处于H2的惰性环境,产生的Fe(OH)2不会被氧化,因此可以较长时间观察到Fe(OH)2白色沉淀,C项正确;
D.固体加热时为防止产生的水蒸气冷凝回流,试管口应该略向下倾斜,D项错误;
答案选C。
25.A
【详解】A.蚕丝的成分为蛋白质,灼烧有烧焦羽毛的气味,人造丝灼烧有芹菜味,可鉴别,故A正确;
B.加入过量NaOH溶液,生成偏铝酸钠,应选氨水制备,故B错误;
C.不能比较溴、碘的氧化性,该实验只能说明氯气的氧化性最强,故C错误;
D.二者遇酚酞均为无色,现象相同,不能鉴别,故D错误;
答案选A。
26.(1)钠
(2)稀土金属
(3)Fe3O4
【详解】(1)钠元素的颜色反应为黄色,故据此他判断汤汁中含有钠元素;
(2)合金中加入适量的稀土金属,能大大改善合金的性能,加入的稀土元素的种类及相对量的多少不同,物质的性质不同,因此稀土元素被称为“冶金工业的维生素";
(3)古代中国四大发明之一的司南是由天然磁石制成的,磁铁成分主要是四氧化三铁化学式为Fe3O4。
27.(1)
(2)两性
(3) 2
【详解】(1)钠在空气中燃烧生成;
(2)既能溶于强酸,也能溶于强碱溶液生成盐和水,则是一种两性氧化物;
(3)C元素化合价从0价升高至+4价,S元素化合价从+6降低至+4价,由得失电子守恒,含S元素的物质系数配2,含C元素的配1,则配平化学方程式为。
28.(1)
(2)Na
(3)Ar
(4)V
(5) Al(OH)3
(6) 10 羟基 加成反应
【分析】根据元素在周期表中的位置,①是H元素;②是C元素;③是O元素;④是F元素;⑤是Na元素;⑥是Al元素;⑦是Si元素;⑧是Cl元素;⑨是Kr元素;
【详解】(1)⑦是Si元素,Si原子结构示意图为 ,元素⑤与⑧组成离子化合物NaCl,电子式为 。
(2)同周期元素从左到右半径依次减小,元素⑤~⑧中原子半径最大的是Na。
(3)Ar原子最外层有8个电子,不易得电子也不易失电子,性质稳定,元素①~⑨中化学性质最不活泼的是Ar。
(4)元素③的氢化物是H2O,分子的空间构型呈V形。
(5)元素⑤和⑥的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,其中属于两性氢氧化物的是Al(OH)3,NaOH和Al(OH)3反应生成偏铝酸钠和水,反应的离子方程式为 。
(6)元素①与②所形成的最简单有机物是CH4,分子中含10个电子。元素①与②所形成的最简单烯烃为Z是乙烯,乙烯与水在催化剂、加热、加压条件下反应生成乙醇,化学方程式为 ,乙醇中的官能团是羟基,反应类型为加成反应。
29.(1)红色
(2)HCl
(3) 过滤 玻璃棒
(4)2Fe3++Fe=3Fe2+
【分析】由题给流程可知,向废腐蚀液中加入过量铁粉,过量铁粉先后与氯化铁、氯化铜和盐酸反应得到氯化亚铁溶液和铜,过滤得到含有铁粉的铜和氯化亚铁溶液;向氯化亚铁溶液中通入氯气,将氯化亚铁氧化为氯化铁得到氯化铁溶液。
【详解】(1)向少量废腐蚀液中滴入硫氰化钾溶液,若溶液变为红色,说明废液中含有氯化铁;
(2)由分析可知,过滤得到的铜中含有过量的铁粉,加入盐酸将铁粉转化为氯化亚铁可以除去铜中的杂质铁粉,故答案为:HCl;
(3)由分析可知,操作Ⅰ是过滤,过滤需用到的玻璃仪器有烧杯、普通漏斗和玻璃棒,故答案为:玻璃棒;
(4)氯化铁可以和单质铁反应生成氯化亚铁,离子方程式为:2Fe3++Fe=3Fe2+。
30.(1)
(2)
(3) 烧杯 漏斗 玻璃棒
(4)
(5)
【分析】废液X加过量铁粉,铁把氯化铁还原为氯化亚铁,铁置换出铜,固体混合物中含有铁、铜;氯化亚铁通入过量氯气生成氯化铁,A是氯化铁;固体混合物加盐酸,铁和盐酸反应生成氯化亚铁和氢气,铜不溶于盐酸,溶液B是氯化亚铁。
【详解】(1)制作过程中发生反应,铁元素化合价由+3降低为+2,有与Cu反应,转移1mol电子,电子数约为;
(2)Fe3+遇KSCN溶液变红,若向废液X中滴加KSCN溶液变红,证明废液X中含有的离子是Fe3+。
(3)操作①或②都是固液分离,操作为过滤,过滤装置图为,需用到的玻璃仪器有烧杯、漏斗和玻璃棒。
(4)A是氯化铁,氯化铁溶液与铁粉反应生成氯化亚铁,反应的化学方程式为;
(5)B氯化亚铁,氯化亚铁与氯气反应生成氯化铁,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
同课章节目录
