合格考真题汇编13化学反应与能量 练习 2024年高中化学学业水平测试(全国通用)(含解析)
文档属性
| 名称 | 合格考真题汇编13化学反应与能量 练习 2024年高中化学学业水平测试(全国通用)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 421.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 20:47:07 | ||
图片预览




文档简介
合格考真题汇编13化学反应与能量
1.自热火锅由于其加热方便快捷,深受人们的喜爱。其原理是发热包中的氧化钙与水发生了放热反应。下列属于放热反应的是
A.水煤气的制备 B.酸碱中和反应 C.碳酸钙高温分解 D.氢氧化钡与氯化铵反应
(2023·天津·高一统考学业考试)
2.下列反应属于放热反应的是
A.煅烧石灰石 B.通电分解水 C.木炭燃烧 D.小苏打受热分解
(2023·云南·高一统考学业考试)
3.市面上销售的食品“自嗨锅”,只需向其中加入水便可烹煮食物。从化学反应过程中的能量变化角度分析,加入水时发生的化学反应属于
A.放热反应 B.吸热反应 C.分解反应 D.水解反应
(2023·湖南·高一统考学业考试)
4.下列反应中,属于吸热反应的是
A.盐酸与碳酸氢钠的反应 B.盐酸与镁条的反应
C.天然气在氧气中的燃烧 D.硫酸与氢氧化钠的反应
(2023·湖南·高一统考学业考试)
5.下列过程发生的反应中,属于吸热反应的是
A.木炭燃烧 B.将晶体与晶体混合并搅拌
C.钠与水反应 D.稀硫酸中滴加NaOH溶液
(2023下·辽宁·高一统考学业考试)
6.在含少量生石灰粉的试管中滴入水,试管壁发热。该反应为
A.放热反应 B.吸热反应 C.分解反应 D.复分解反应
(2023下·黑龙江·高一统考学业考试)
7.下列属于放热反应的是
A.高温煅烧石灰石 B.汽油的燃烧
C.碳与水蒸气的反应 D.碳酸氢钠受热分解
(2023·天津红桥·高一统考学业考试)
8.是一种常用的阻燃剂,添加在可燃物中的受热分解的化学反应如下:,从而降低可燃物温度达到着火点以下,达到阻燃的目的,该反应属于
A.氧化还原反应 B.复分解反应 C.离子反应 D.吸热反应
(2023下·陕西·高二学业考试)
9.下列对能量变化的认识正确的是
A.白炽灯工作时,电能转化为化学能 B.干电池工作时,化学能转化为电能
C.酒精燃烧时,化学能主要转化为热能 D.化学反应时,化学键断裂会放出能量
(2023下·新疆乌鲁木齐·高二统考学业考试)
10.下列说法中正确的是
A.化学反应一定是放热反应
B.能量变化是化学反应的基本特征之一
C.化学反应中能量变化的大小与反应物的质量多少无关
D.反应物的总能量小于生成物的总能量的化学反应是放热反应
(2022·山东·高一统考学业考试)
11.下列有关放热反应的说法错误的是
A.化学键断裂吸收的能量比化学键形成释放的能量少
B.反应物的总能量比生成物的总能量高
C.燃烧的过程发生放热反应
D.分解反应均为放热反应
(2023下·天津和平·高一统考学业考试)
12.下列关于化学反应与能量的说法中,不正确的是
A.镁条与盐酸的反应属于放热反应
B.盐酸与氢氧化钠的反应属于吸热反应
C.与NH4Cl的反应属于吸热反应
D.化学键的断裂与形成是化学反应中能量变化的主要原因
(2022·广东·高一统考学业考试)
13.北京冬奥会火炬“飞扬”以H2为燃料,下列有关说法不正确的是
A.H2在高压条件下可液化储存 B.H2燃烧过程零碳排放
C.H2燃烧时化学能全转化为光能 D.钠盐可使火焰呈黄色
(2023下·北京海淀·高一统考学业考试)
14.已知:,测得反应过程中溶液温度升高。下列关于该反应的说法中,正确的是
A.属于吸热反应 B.属于非氧化还原反应
C.反应物的总能量低于生成物的总能量 D.能量变化与化学键的断裂和形成有关
(2022上·北京·高二统考学业考试)
15.天然气(主要成分为CH4)燃烧时发生反应:CH4+2O2CO2+2H2O。下列关于该反应的说法中,不正确的是
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量低于生成物的总能量
D.能量变化与化学键的断裂和形成有关
(2022·山东·高二统考学业考试)
16.已知为放热反应,有关该反应的说法正确的是
A.在常温下一定能快速进行
B.该反应中的能量变化与化学键变化无关
C.与足量反应可生成
D.和的总能量一定高于的能量
(2023下·四川雅安·高一学业考试)
17.工业上制盐酸,可先利用在中燃烧生成(放热反应),下列说法正确的是
A.形成键吸收能量
B.反应放热是由于离子键的变化引起的
C.反应物的总能量大于生成物的总能量
D.和的质量与反应放热的多少无关
(2023·北京丰台·高一统考学业考试)
18.下列关于化学反应与能量的说法中,不正确的是
A.Na2O2与水的反应属于放热反应
B.化学键的断裂与形成是化学反应中能量变化的主要原因
C.与NH4Cl的反应属于放热反应
D.反应物的总能量高于生成物的总能量,反应时向环境中释放能量
(2022上·湖南·高一校联考学业考试)
19.将Ba(OH)2·8H2O晶体和NH4Cl晶体放入烧杯中快速搅拌,用手触摸杯壁下部,感受到温度降低。下列说法正确的是
A.该过程吸收了热量
B.该过程只发生物理变化
C.反物的总能量高于生成物的总能量
D.反应能量的变化与化学键的断裂和形成无关
(2022·江苏南京·高二学业考试)
20.犹记2008夏的热烈,拥抱2022冬的激情。北京冬奥会全部场馆将100%使用太阳能、氢能等清洁能源供电,着力打造“绿色冬奥”,下列有关H2的说法正确的是
A.电解水是获取氢气的途径之一 B.升高温度可使氢气转化为液态
C.反应2H2+O22H2O吸收能量 D.断开H-H键释放能量
(2022上·江苏·高二校联考学业考试)
21.已知反应:为放热反应。下列关于该反应的说法正确的是
A.M的能量一定低于X
B.Y的能量一定高于N
C.该反应为放热反应,故常温下反应一定可以发生
D.X和Y的总能量一定高于M和N的总能量
(2023·北京·高二统考学业考试)
22.一氧化碳是一种可燃性气体,燃烧时发生反应:。下列关于该反应的说法不正确的是
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量低于生成物的总能量
D.化学键的断裂与形成是该反应中能量变化的主要原因
(2023下·浙江·高一统考学业考试)
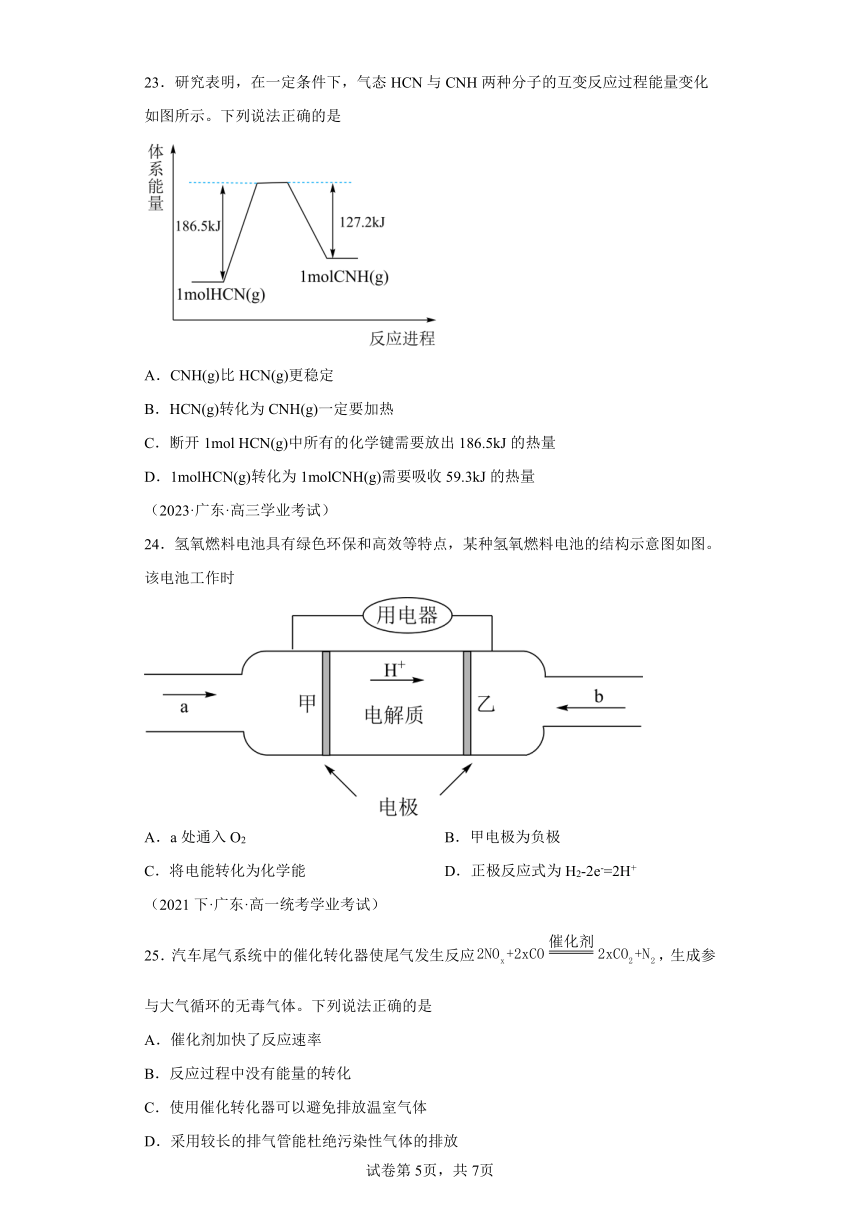
23.研究表明,在一定条件下,气态HCN与CNH两种分子的互变反应过程能量变化如图所示。下列说法正确的是
A.CNH(g)比HCN(g)更稳定
B.HCN(g)转化为CNH(g)一定要加热
C.断开1mol HCN(g)中所有的化学键需要放出186.5kJ的热量
D.1molHCN(g)转化为1molCNH(g)需要吸收59.3kJ的热量
(2023·广东·高三学业考试)
24.氢氧燃料电池具有绿色环保和高效等特点,某种氢氧燃料电池的结构示意图如图。该电池工作时
A.a处通入O2 B.甲电极为负极
C.将电能转化为化学能 D.正极反应式为H2-2e-=2H+
(2021下·广东·高一统考学业考试)
25.汽车尾气系统中的催化转化器使尾气发生反应,生成参与大气循环的无毒气体。下列说法正确的是
A.催化剂加快了反应速率
B.反应过程中没有能量的转化
C.使用催化转化器可以避免排放温室气体
D.采用较长的排气管能杜绝污染性气体的排放
(2022·海南·高一统考学业考试)
26.如图所示试管中有2 mL 2mol/L盐酸,加入打磨光亮的镁条,测得温度升高。该反应现象表明化学能主要转化为
A.光能 B.电能 C.热能 D.机械能
(2023下·天津·高一统考学业考试)
27.下列反应中能量变化与图一致的是
A.氢气在氯气中燃烧
B.镁条与稀硫酸的反应
C.盐酸和氢氧化钠溶液的反应
D.与反应
(2022上·江苏盐城·高二统考学业考试)
28.下列图示变化为吸热反应的是
A. B.
C. D.
(2023·四川·高一统考学业考试)
29.化学反应的能量变化是人类获取能量的重要途径.某化学反应的能量变化加图所示。下列有关该反应的说法正确的是
A.该反应是吸热反应 B.可能是盐酸与NaHCO3的反应
C.能量变化只与化学键断裂有关 D.生成物的总能量低于反应物的总能量
(2023·上海·高二统考学业考试)
30.以煤炭为原料制备氢气是一种常用的方法,总反应为:(正反应为吸热反应)
(1)上述反应中,反应物的总能量 生成物的总能量。
A.大于 B.小于 C.等于
(2)下列措施中,能加快上述反应的反应速率的是___________。
A.将煤炭粉碎 B.通入氦气 C.降低温度 D.加入催化剂
(3)能说明上述反应一定达到化学平衡状态的是
A.保持不变 B.
C.物质的总质量不变 D.
(4)一定温度下,在2L密闭容器中加入足量的C(s)和3molH2O(g),反应至5min时,H2O(g)的物质的量变为1mol,0~5min内H2O(g)的平均反应速率 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.水煤气的制备反应为吸热反应,A不符合题意;
B.酸碱中和反应为放热反应,B符合题意;
C.碳酸钙的分解反应为吸热反应,C不符合题意;
D.氢氧化钡与氯化铵的反应为吸热反应,D不符合题意,D不符合题意;
故答案选B。
【点睛】常见的吸热反应有:1、大多数分解反应;2、盐水解反应;3、碳作还原剂的反应;4、氢氧化钡与氯化铵的反应;5、水煤气反应。
常见的放热反应有:1、金属和水或酸反应;2、酸碱中和反应;3、一切燃烧;4、大多数化合反应和置换反应;5、缓慢氧化反应。
2.C
【详解】A.煅烧石灰石是分解反应是吸热反应,A不符合题意;
B.通电分解水是分解反应是吸热反应,B不符合题意;
C.木炭燃烧过程中放出大量的热,是放热反应,C符合题意;
D.小苏打受热分解是分解反应是吸热反应,D不符合题意;
故选C。
3.A
【详解】根据题中信息可知,加入水便可烹煮食物,说明该反应过程中是放热反应,故A符合题意;
答案为A。
4.A
【详解】A.盐酸与碳酸氢钠的反应属于吸热反应,A正确;
B.盐酸与镁条的反应属于放热反应,B错误;
C.天然气在氧气中的燃烧属于放热反应,C错误;
D.硫酸与氢氧化钠的反应属于放热反应,D错误;
故选A。
5.B
【详解】A.木炭燃烧是燃烧反应,是典型的放热反应,故A不符合题意;
B.铵盐和碱的反应是吸热反应,将晶体与晶体混合并搅拌属于吸热反应,故B符合题意;
C.钠与水反应是金属和水的反应,是典型的放热反应,故C不符合题意;
D.稀硫酸中滴加NaOH溶液会发生酸碱中和反应,属于典型的放热反应,故D不符合题意;
故答案为B。
6.A
【详解】氧化钙与水反应的化学方程式为:CaO+H2O=Ca(OH)2,为化合反应,试管壁发热,反应为放热反应,答案选A。
7.B
【详解】A.高温煅烧石灰石为吸热反应,A错误;
B.汽油的燃烧为放热反应,B错误;
C.碳与水蒸气的反应为吸热反应,C错误;
D.碳酸氢钠受热分解为吸热反应,D错误;
故选B。
8.D
【详解】由方程式可知,氢氧化铝受热分解生成氧化铝和水的反应为分解反应,该反应为反应物总能量高于生成物生成物总能量的吸热反应,故选C。
9.BC
【详解】A.白炽灯工作时,电能转化为光能和热能,A错误;
B.干电池工作时,化学能转化为电能,B正确;
C.酒精燃烧时发生化学变化,化学能主要转化为热能,C正确;
D.化学反应时,化学键断裂需要吸收能量,D错误;
故选BC。
10.B
【详解】A.化学反应有的是放热反应有的是吸热反应,故A错误;
B.化学反应一定伴随能量变化,能量变化是化学反应的基本特征之一,故B正确;
C.化学反应中能量变化的大小与反应物的质量多少有关,故C错误;
D.反应物的总能量大于生成物的总能量的化学反应是放热反应,故D错误;
选B。
11.D
【详解】A.断键吸热少成键放热多的反应为放热反应,符合题意;
B.放热反应,反应物总能量高于产物总能量,符合题意;
C.燃烧反应为放热反应,符合题意;
D.分解反应大多数为吸热反应,不符合题意;
故选D。
12.B
【详解】A.镁条与盐酸反应生成MgCl2和H2、同时放热,该反应属于放热反应,A项正确;
B.酸碱中和反应为放热反应,盐酸与氢氧化钠的反应属于放热反应,B项错误;
C.Ba(OH)2 8H2O与NH4Cl反应生成BaCl2、NH3和H2O,同时吸热,该反应为吸热反应,C项正确;
D.化学反应的本质是旧化学键的断裂和新化学键的形成过程,断裂反应物中的化学键吸收能量、形成生成物中的化学键放出能量,故化学键的断裂与形成是化学反应中能量变化的主要原因,D项正确;
答案选B。
13.C
【详解】A.H2在高压条件下可转化为液氢储存,A项正确;
B.H2燃烧生成水,该过程零碳排放,B项正确;
C.H2燃烧时化学能主要转化为热能,部分转化为光能,C项错误;
D.钠元素的焰色反应为黄色,则钠盐可使火焰呈黄色,D项正确;
答案选C。
14.D
【详解】A.溶液温度升高,故为放热反应,A错误;
B.锌元素的化合价升高,氢离子的化合价降低,是氧化还原反应,B错误;
C.该反应为放热反应,故反应物的总能量高于生成物的总能量,C错误;
D.化学反应的本质是旧键的断裂和新键的形成,化学键断裂会吸收能量,化学键形成会放出能量,故能量变化与化学键的断裂和形成有关,D正确;
故选D。
15.C
【详解】A.燃烧属于放热反应,A正确;
B.CH4燃烧时,存在化合价的升降,属于氧化还原反应,B正确;
C.属于放热反应,反应物的总能量高于生成物的总能量,C错误;
D.能量变化与化学键的断裂和形成有关,断键要吸热,形成化学键要放热,D正确;
故答案为:C。
16.D
【详解】A.放热反应不一定在常温下能快速进行,故A错误;
B.该反应中的能量变化与化学键断裂和形成有关,故B错误;
C.该反应是可逆反应,因此与足量反应不可能生成,故C错误;
D.该反应是放热反应,因此和的总能量一定高于的能量,故D正确。
综上所述,答案为D。
17.C
【详解】A.化学键的形成放出能量,故形成H-Cl键放出能量,故A错误;
B.反应放热是由于化学键的断裂和形成能量不同,从而使化学反应的能量发生变化,故B错误;
C.此反应放热,故反应物的总能量大于生成物的总能量,故C正确;
D.化学反应的热效应与反应物的量成正比,反应物的质量越多,则反应吸收或放出的热量越多,故D错误;
故选:C。
18.C
【详解】A.Na2O2与水的反应过程中放出大量的热,属于放热反应,A项正确;
B.化学键的断裂需要吸收能量,化学键的形成能够放出能量,化学键的断裂与形成是化学反应中能量变化的主要原因,B项正确;
C.Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,C项错误;
D.反应物的总能量高于生成物的总能量的反应为放热反应,反应过程中要向外界释放能量,D项正确;
答案选C。
19.A
【详解】A.手触摸杯壁下部,感受到温度降低,所以该过程吸收了热量,故A正确;
B.Ba(OH)2·8H2O晶体和NH4Cl发生复分解反应生成氯化钡、氨气、水,该过程发生了化学变化,故B错误;
C.反应吸热,反应物能量低于生成物能量,故C错误;
D.化学反应的能量变化的本质就是因为化学键的断裂和形成,断键吸热、成键放热,故D错误;
选A。
20.A
【详解】A.电解水生成氢气和氧气,是获取氢气的途径之一,故A正确;
B.降低温度可使氢气转化为液态氢,故B错误;
C.氢气在氧气中燃烧的反应是放热反应,反应时放出热量,故C错误;
D.破坏化学键需要吸收能量,则断开氢氢键时需要吸收能量,故D错误;
故选A。
21.D
【分析】X+Y= M + N为放热反应,说明反应物的能量高于生成物的总能量,即X和Y的总能量一定高于M和N的总能量。
【详解】A.该反应为放热反应,说明反应物的能量高于生成物的总能量,不能说明M的能量一定低于X,故A错误;
B.该反应为放热反应,说明反应物的能量高于生成物的总能量,不能说明Y的能量一定高于N,故B错误;
C.放热反应常温下不一定发生,比如C的燃烧属于放热反应,通常下不反应,需加热或点燃后才反应,故C错误;
D.根据分析,X和Y的总能量一定高于M和N的总能量,故D正确;
故选D。
22.C
【详解】A.燃烧放热,属于放热反应,故A正确;
B.反应,CO中C元素化合价升高,氧气中氧元素价态降低,属于氧化还原反应,故B正确;
C.属于放热反应,反应物的总能量高于生成物的总能量,故C错误;
D.断键吸热、成键放热,化学键的断裂与形成是该反应中能量变化的主要原因,故D正确;
选C。
23.D
【详解】A.从图中可知,HCN(g)的能量低于CNH(g)的能量,则HCN(g)比CNH(g)更稳定,A错误;
B.HCN(g)转化为CNH(g)为吸热反应,但是吸热反应不一定要加热,如八水合氢氧化钡与氯化铵反应为吸热反应,但是不需要加热就能进行,B错误;
C.从图中可知,断开1molHCN(g)中所有的化学键需要吸收186.5kJ的热量,C错误;
D.从图中可知,1molHCN(g)转化为1molCNH(g)需要吸收的热量为186.5kJ-127.2kJ=59.3kJ,D正确;
故答案选D。
24.B
【详解】A.根据图示可知:H+从甲电极区流向乙电极区,则a通入H2,b通入O2,A错误;
B.在甲电极上通入H2,失去电子发生氧化反应产生H+,故甲电极为负极,B正确;
C.该装置是原电池,是将化学能转化为电能的装置,C错误;
D.负极反应式为H2-2e-=2H+,正极反应式为O2+4e-+4H+=2H2O,D错误;
故合理选项是B。
25.A
【详解】A.催化剂能降低反应的活化能,加快化学反应速率,故A正确;
B.反应过程中有化学键的断裂和化学键的形成,一定有能量的转化,故B错误;
C.二氧化碳是形成温室效应的主要原因,由方程式可知,反应中二氧化碳生成,则使用催化转化器不能避免排放温室气体,故C错误;
D.采用较长的排气管能使废气的反应时间延长,减少污染性气体的排放,但不能杜绝污染性气体的排放,故D错误;
故选A。
26.C
【详解】A.该过程没有发光,不是光能,A错误;
B.该过程没有产生电流,不是电能,B错误;
C.该过程测的温度升高,故为热能,C正确;
D.该过程没有机械运动,不是机械能,D错误;
故选C。
27.D
【分析】该图所示生成物总能量高于反应物总能量,所示反应为吸热反应。
【详解】A.氢气在氯气中的燃烧为放热反应,故A错误;
B.金属单质与酸反应生成氢气的反应为放热反应,故B错误;
C.盐酸和氢氧化钠溶液发生中和反应,中和反应为放热反应,故C错误;
D.与的反应为吸热反应,故D正确;
故选:D。
28.A
【详解】A.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,故A选;
B.中和反应为放热反应,故B不选;
C.燃烧反应为放热反应,故C不选;
D.由图可知反应物的总能量高于生成物,因此该反应为放热反应,故D不选;
综上所述,答案为A。
29.D
【详解】A.反应物的总能量高于生成物的总能量,为放热反应,故A错误;
B.盐酸与NaHCO3的反应为吸热反应,而图像为放热反应,故B错误;
C.能量的变化与化学键的断裂和形成都有关系,故C错误;
D.由图象可知,生成物的总能量低于反应物的总能量,故D正确;
故选D。
30.(1)B
(2)AD
(3)AB
(4)
【详解】(1)正反应为吸热反应,则反应物的总能量小于生成物的总能量,故选B;
(2)A.将煤炭粉碎可增大反应物接触面积,能加快反应速率,故A选;
B.通入氦气,反应物浓度不变,反应速率不变,故B不选;
C.降低温度,反应速率减慢,故C不选;
D.加入催化剂,可降低反应活化能,提高反应速率,故D选;
故选AD;
(3)A.反应从开始至平衡过程中,氢气的物质的量发生变化,当保持不变,说明反应达到化学平衡状态,故A选;
B.当正逆反应速率相等时,反应达到平衡,不同物质的反应速率与系数成正比,则,反应达到化学平衡状态,故B选;
C.根据质量守恒定律,反应前后质量不变,因此物质的总质量一直保持不变,不能说明达到平衡状态,故C不选;
D.与起始加入量和转化率有关,不能说明反应到达平衡状态,故D不选;
故选AB;
(4)0~5min内H2O(g)的平均反应速率。
答案第1页,共2页
答案第1页,共2页
1.自热火锅由于其加热方便快捷,深受人们的喜爱。其原理是发热包中的氧化钙与水发生了放热反应。下列属于放热反应的是
A.水煤气的制备 B.酸碱中和反应 C.碳酸钙高温分解 D.氢氧化钡与氯化铵反应
(2023·天津·高一统考学业考试)
2.下列反应属于放热反应的是
A.煅烧石灰石 B.通电分解水 C.木炭燃烧 D.小苏打受热分解
(2023·云南·高一统考学业考试)
3.市面上销售的食品“自嗨锅”,只需向其中加入水便可烹煮食物。从化学反应过程中的能量变化角度分析,加入水时发生的化学反应属于
A.放热反应 B.吸热反应 C.分解反应 D.水解反应
(2023·湖南·高一统考学业考试)
4.下列反应中,属于吸热反应的是
A.盐酸与碳酸氢钠的反应 B.盐酸与镁条的反应
C.天然气在氧气中的燃烧 D.硫酸与氢氧化钠的反应
(2023·湖南·高一统考学业考试)
5.下列过程发生的反应中,属于吸热反应的是
A.木炭燃烧 B.将晶体与晶体混合并搅拌
C.钠与水反应 D.稀硫酸中滴加NaOH溶液
(2023下·辽宁·高一统考学业考试)
6.在含少量生石灰粉的试管中滴入水,试管壁发热。该反应为
A.放热反应 B.吸热反应 C.分解反应 D.复分解反应
(2023下·黑龙江·高一统考学业考试)
7.下列属于放热反应的是
A.高温煅烧石灰石 B.汽油的燃烧
C.碳与水蒸气的反应 D.碳酸氢钠受热分解
(2023·天津红桥·高一统考学业考试)
8.是一种常用的阻燃剂,添加在可燃物中的受热分解的化学反应如下:,从而降低可燃物温度达到着火点以下,达到阻燃的目的,该反应属于
A.氧化还原反应 B.复分解反应 C.离子反应 D.吸热反应
(2023下·陕西·高二学业考试)
9.下列对能量变化的认识正确的是
A.白炽灯工作时,电能转化为化学能 B.干电池工作时,化学能转化为电能
C.酒精燃烧时,化学能主要转化为热能 D.化学反应时,化学键断裂会放出能量
(2023下·新疆乌鲁木齐·高二统考学业考试)
10.下列说法中正确的是
A.化学反应一定是放热反应
B.能量变化是化学反应的基本特征之一
C.化学反应中能量变化的大小与反应物的质量多少无关
D.反应物的总能量小于生成物的总能量的化学反应是放热反应
(2022·山东·高一统考学业考试)
11.下列有关放热反应的说法错误的是
A.化学键断裂吸收的能量比化学键形成释放的能量少
B.反应物的总能量比生成物的总能量高
C.燃烧的过程发生放热反应
D.分解反应均为放热反应
(2023下·天津和平·高一统考学业考试)
12.下列关于化学反应与能量的说法中,不正确的是
A.镁条与盐酸的反应属于放热反应
B.盐酸与氢氧化钠的反应属于吸热反应
C.与NH4Cl的反应属于吸热反应
D.化学键的断裂与形成是化学反应中能量变化的主要原因
(2022·广东·高一统考学业考试)
13.北京冬奥会火炬“飞扬”以H2为燃料,下列有关说法不正确的是
A.H2在高压条件下可液化储存 B.H2燃烧过程零碳排放
C.H2燃烧时化学能全转化为光能 D.钠盐可使火焰呈黄色
(2023下·北京海淀·高一统考学业考试)
14.已知:,测得反应过程中溶液温度升高。下列关于该反应的说法中,正确的是
A.属于吸热反应 B.属于非氧化还原反应
C.反应物的总能量低于生成物的总能量 D.能量变化与化学键的断裂和形成有关
(2022上·北京·高二统考学业考试)
15.天然气(主要成分为CH4)燃烧时发生反应:CH4+2O2CO2+2H2O。下列关于该反应的说法中,不正确的是
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量低于生成物的总能量
D.能量变化与化学键的断裂和形成有关
(2022·山东·高二统考学业考试)
16.已知为放热反应,有关该反应的说法正确的是
A.在常温下一定能快速进行
B.该反应中的能量变化与化学键变化无关
C.与足量反应可生成
D.和的总能量一定高于的能量
(2023下·四川雅安·高一学业考试)
17.工业上制盐酸,可先利用在中燃烧生成(放热反应),下列说法正确的是
A.形成键吸收能量
B.反应放热是由于离子键的变化引起的
C.反应物的总能量大于生成物的总能量
D.和的质量与反应放热的多少无关
(2023·北京丰台·高一统考学业考试)
18.下列关于化学反应与能量的说法中,不正确的是
A.Na2O2与水的反应属于放热反应
B.化学键的断裂与形成是化学反应中能量变化的主要原因
C.与NH4Cl的反应属于放热反应
D.反应物的总能量高于生成物的总能量,反应时向环境中释放能量
(2022上·湖南·高一校联考学业考试)
19.将Ba(OH)2·8H2O晶体和NH4Cl晶体放入烧杯中快速搅拌,用手触摸杯壁下部,感受到温度降低。下列说法正确的是
A.该过程吸收了热量
B.该过程只发生物理变化
C.反物的总能量高于生成物的总能量
D.反应能量的变化与化学键的断裂和形成无关
(2022·江苏南京·高二学业考试)
20.犹记2008夏的热烈,拥抱2022冬的激情。北京冬奥会全部场馆将100%使用太阳能、氢能等清洁能源供电,着力打造“绿色冬奥”,下列有关H2的说法正确的是
A.电解水是获取氢气的途径之一 B.升高温度可使氢气转化为液态
C.反应2H2+O22H2O吸收能量 D.断开H-H键释放能量
(2022上·江苏·高二校联考学业考试)
21.已知反应:为放热反应。下列关于该反应的说法正确的是
A.M的能量一定低于X
B.Y的能量一定高于N
C.该反应为放热反应,故常温下反应一定可以发生
D.X和Y的总能量一定高于M和N的总能量
(2023·北京·高二统考学业考试)
22.一氧化碳是一种可燃性气体,燃烧时发生反应:。下列关于该反应的说法不正确的是
A.属于放热反应
B.属于氧化还原反应
C.反应物的总能量低于生成物的总能量
D.化学键的断裂与形成是该反应中能量变化的主要原因
(2023下·浙江·高一统考学业考试)
23.研究表明,在一定条件下,气态HCN与CNH两种分子的互变反应过程能量变化如图所示。下列说法正确的是
A.CNH(g)比HCN(g)更稳定
B.HCN(g)转化为CNH(g)一定要加热
C.断开1mol HCN(g)中所有的化学键需要放出186.5kJ的热量
D.1molHCN(g)转化为1molCNH(g)需要吸收59.3kJ的热量
(2023·广东·高三学业考试)
24.氢氧燃料电池具有绿色环保和高效等特点,某种氢氧燃料电池的结构示意图如图。该电池工作时
A.a处通入O2 B.甲电极为负极
C.将电能转化为化学能 D.正极反应式为H2-2e-=2H+
(2021下·广东·高一统考学业考试)
25.汽车尾气系统中的催化转化器使尾气发生反应,生成参与大气循环的无毒气体。下列说法正确的是
A.催化剂加快了反应速率
B.反应过程中没有能量的转化
C.使用催化转化器可以避免排放温室气体
D.采用较长的排气管能杜绝污染性气体的排放
(2022·海南·高一统考学业考试)
26.如图所示试管中有2 mL 2mol/L盐酸,加入打磨光亮的镁条,测得温度升高。该反应现象表明化学能主要转化为
A.光能 B.电能 C.热能 D.机械能
(2023下·天津·高一统考学业考试)
27.下列反应中能量变化与图一致的是
A.氢气在氯气中燃烧
B.镁条与稀硫酸的反应
C.盐酸和氢氧化钠溶液的反应
D.与反应
(2022上·江苏盐城·高二统考学业考试)
28.下列图示变化为吸热反应的是
A. B.
C. D.
(2023·四川·高一统考学业考试)
29.化学反应的能量变化是人类获取能量的重要途径.某化学反应的能量变化加图所示。下列有关该反应的说法正确的是
A.该反应是吸热反应 B.可能是盐酸与NaHCO3的反应
C.能量变化只与化学键断裂有关 D.生成物的总能量低于反应物的总能量
(2023·上海·高二统考学业考试)
30.以煤炭为原料制备氢气是一种常用的方法,总反应为:(正反应为吸热反应)
(1)上述反应中,反应物的总能量 生成物的总能量。
A.大于 B.小于 C.等于
(2)下列措施中,能加快上述反应的反应速率的是___________。
A.将煤炭粉碎 B.通入氦气 C.降低温度 D.加入催化剂
(3)能说明上述反应一定达到化学平衡状态的是
A.保持不变 B.
C.物质的总质量不变 D.
(4)一定温度下,在2L密闭容器中加入足量的C(s)和3molH2O(g),反应至5min时,H2O(g)的物质的量变为1mol,0~5min内H2O(g)的平均反应速率 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.水煤气的制备反应为吸热反应,A不符合题意;
B.酸碱中和反应为放热反应,B符合题意;
C.碳酸钙的分解反应为吸热反应,C不符合题意;
D.氢氧化钡与氯化铵的反应为吸热反应,D不符合题意,D不符合题意;
故答案选B。
【点睛】常见的吸热反应有:1、大多数分解反应;2、盐水解反应;3、碳作还原剂的反应;4、氢氧化钡与氯化铵的反应;5、水煤气反应。
常见的放热反应有:1、金属和水或酸反应;2、酸碱中和反应;3、一切燃烧;4、大多数化合反应和置换反应;5、缓慢氧化反应。
2.C
【详解】A.煅烧石灰石是分解反应是吸热反应,A不符合题意;
B.通电分解水是分解反应是吸热反应,B不符合题意;
C.木炭燃烧过程中放出大量的热,是放热反应,C符合题意;
D.小苏打受热分解是分解反应是吸热反应,D不符合题意;
故选C。
3.A
【详解】根据题中信息可知,加入水便可烹煮食物,说明该反应过程中是放热反应,故A符合题意;
答案为A。
4.A
【详解】A.盐酸与碳酸氢钠的反应属于吸热反应,A正确;
B.盐酸与镁条的反应属于放热反应,B错误;
C.天然气在氧气中的燃烧属于放热反应,C错误;
D.硫酸与氢氧化钠的反应属于放热反应,D错误;
故选A。
5.B
【详解】A.木炭燃烧是燃烧反应,是典型的放热反应,故A不符合题意;
B.铵盐和碱的反应是吸热反应,将晶体与晶体混合并搅拌属于吸热反应,故B符合题意;
C.钠与水反应是金属和水的反应,是典型的放热反应,故C不符合题意;
D.稀硫酸中滴加NaOH溶液会发生酸碱中和反应,属于典型的放热反应,故D不符合题意;
故答案为B。
6.A
【详解】氧化钙与水反应的化学方程式为:CaO+H2O=Ca(OH)2,为化合反应,试管壁发热,反应为放热反应,答案选A。
7.B
【详解】A.高温煅烧石灰石为吸热反应,A错误;
B.汽油的燃烧为放热反应,B错误;
C.碳与水蒸气的反应为吸热反应,C错误;
D.碳酸氢钠受热分解为吸热反应,D错误;
故选B。
8.D
【详解】由方程式可知,氢氧化铝受热分解生成氧化铝和水的反应为分解反应,该反应为反应物总能量高于生成物生成物总能量的吸热反应,故选C。
9.BC
【详解】A.白炽灯工作时,电能转化为光能和热能,A错误;
B.干电池工作时,化学能转化为电能,B正确;
C.酒精燃烧时发生化学变化,化学能主要转化为热能,C正确;
D.化学反应时,化学键断裂需要吸收能量,D错误;
故选BC。
10.B
【详解】A.化学反应有的是放热反应有的是吸热反应,故A错误;
B.化学反应一定伴随能量变化,能量变化是化学反应的基本特征之一,故B正确;
C.化学反应中能量变化的大小与反应物的质量多少有关,故C错误;
D.反应物的总能量大于生成物的总能量的化学反应是放热反应,故D错误;
选B。
11.D
【详解】A.断键吸热少成键放热多的反应为放热反应,符合题意;
B.放热反应,反应物总能量高于产物总能量,符合题意;
C.燃烧反应为放热反应,符合题意;
D.分解反应大多数为吸热反应,不符合题意;
故选D。
12.B
【详解】A.镁条与盐酸反应生成MgCl2和H2、同时放热,该反应属于放热反应,A项正确;
B.酸碱中和反应为放热反应,盐酸与氢氧化钠的反应属于放热反应,B项错误;
C.Ba(OH)2 8H2O与NH4Cl反应生成BaCl2、NH3和H2O,同时吸热,该反应为吸热反应,C项正确;
D.化学反应的本质是旧化学键的断裂和新化学键的形成过程,断裂反应物中的化学键吸收能量、形成生成物中的化学键放出能量,故化学键的断裂与形成是化学反应中能量变化的主要原因,D项正确;
答案选B。
13.C
【详解】A.H2在高压条件下可转化为液氢储存,A项正确;
B.H2燃烧生成水,该过程零碳排放,B项正确;
C.H2燃烧时化学能主要转化为热能,部分转化为光能,C项错误;
D.钠元素的焰色反应为黄色,则钠盐可使火焰呈黄色,D项正确;
答案选C。
14.D
【详解】A.溶液温度升高,故为放热反应,A错误;
B.锌元素的化合价升高,氢离子的化合价降低,是氧化还原反应,B错误;
C.该反应为放热反应,故反应物的总能量高于生成物的总能量,C错误;
D.化学反应的本质是旧键的断裂和新键的形成,化学键断裂会吸收能量,化学键形成会放出能量,故能量变化与化学键的断裂和形成有关,D正确;
故选D。
15.C
【详解】A.燃烧属于放热反应,A正确;
B.CH4燃烧时,存在化合价的升降,属于氧化还原反应,B正确;
C.属于放热反应,反应物的总能量高于生成物的总能量,C错误;
D.能量变化与化学键的断裂和形成有关,断键要吸热,形成化学键要放热,D正确;
故答案为:C。
16.D
【详解】A.放热反应不一定在常温下能快速进行,故A错误;
B.该反应中的能量变化与化学键断裂和形成有关,故B错误;
C.该反应是可逆反应,因此与足量反应不可能生成,故C错误;
D.该反应是放热反应,因此和的总能量一定高于的能量,故D正确。
综上所述,答案为D。
17.C
【详解】A.化学键的形成放出能量,故形成H-Cl键放出能量,故A错误;
B.反应放热是由于化学键的断裂和形成能量不同,从而使化学反应的能量发生变化,故B错误;
C.此反应放热,故反应物的总能量大于生成物的总能量,故C正确;
D.化学反应的热效应与反应物的量成正比,反应物的质量越多,则反应吸收或放出的热量越多,故D错误;
故选:C。
18.C
【详解】A.Na2O2与水的反应过程中放出大量的热,属于放热反应,A项正确;
B.化学键的断裂需要吸收能量,化学键的形成能够放出能量,化学键的断裂与形成是化学反应中能量变化的主要原因,B项正确;
C.Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,C项错误;
D.反应物的总能量高于生成物的总能量的反应为放热反应,反应过程中要向外界释放能量,D项正确;
答案选C。
19.A
【详解】A.手触摸杯壁下部,感受到温度降低,所以该过程吸收了热量,故A正确;
B.Ba(OH)2·8H2O晶体和NH4Cl发生复分解反应生成氯化钡、氨气、水,该过程发生了化学变化,故B错误;
C.反应吸热,反应物能量低于生成物能量,故C错误;
D.化学反应的能量变化的本质就是因为化学键的断裂和形成,断键吸热、成键放热,故D错误;
选A。
20.A
【详解】A.电解水生成氢气和氧气,是获取氢气的途径之一,故A正确;
B.降低温度可使氢气转化为液态氢,故B错误;
C.氢气在氧气中燃烧的反应是放热反应,反应时放出热量,故C错误;
D.破坏化学键需要吸收能量,则断开氢氢键时需要吸收能量,故D错误;
故选A。
21.D
【分析】X+Y= M + N为放热反应,说明反应物的能量高于生成物的总能量,即X和Y的总能量一定高于M和N的总能量。
【详解】A.该反应为放热反应,说明反应物的能量高于生成物的总能量,不能说明M的能量一定低于X,故A错误;
B.该反应为放热反应,说明反应物的能量高于生成物的总能量,不能说明Y的能量一定高于N,故B错误;
C.放热反应常温下不一定发生,比如C的燃烧属于放热反应,通常下不反应,需加热或点燃后才反应,故C错误;
D.根据分析,X和Y的总能量一定高于M和N的总能量,故D正确;
故选D。
22.C
【详解】A.燃烧放热,属于放热反应,故A正确;
B.反应,CO中C元素化合价升高,氧气中氧元素价态降低,属于氧化还原反应,故B正确;
C.属于放热反应,反应物的总能量高于生成物的总能量,故C错误;
D.断键吸热、成键放热,化学键的断裂与形成是该反应中能量变化的主要原因,故D正确;
选C。
23.D
【详解】A.从图中可知,HCN(g)的能量低于CNH(g)的能量,则HCN(g)比CNH(g)更稳定,A错误;
B.HCN(g)转化为CNH(g)为吸热反应,但是吸热反应不一定要加热,如八水合氢氧化钡与氯化铵反应为吸热反应,但是不需要加热就能进行,B错误;
C.从图中可知,断开1molHCN(g)中所有的化学键需要吸收186.5kJ的热量,C错误;
D.从图中可知,1molHCN(g)转化为1molCNH(g)需要吸收的热量为186.5kJ-127.2kJ=59.3kJ,D正确;
故答案选D。
24.B
【详解】A.根据图示可知:H+从甲电极区流向乙电极区,则a通入H2,b通入O2,A错误;
B.在甲电极上通入H2,失去电子发生氧化反应产生H+,故甲电极为负极,B正确;
C.该装置是原电池,是将化学能转化为电能的装置,C错误;
D.负极反应式为H2-2e-=2H+,正极反应式为O2+4e-+4H+=2H2O,D错误;
故合理选项是B。
25.A
【详解】A.催化剂能降低反应的活化能,加快化学反应速率,故A正确;
B.反应过程中有化学键的断裂和化学键的形成,一定有能量的转化,故B错误;
C.二氧化碳是形成温室效应的主要原因,由方程式可知,反应中二氧化碳生成,则使用催化转化器不能避免排放温室气体,故C错误;
D.采用较长的排气管能使废气的反应时间延长,减少污染性气体的排放,但不能杜绝污染性气体的排放,故D错误;
故选A。
26.C
【详解】A.该过程没有发光,不是光能,A错误;
B.该过程没有产生电流,不是电能,B错误;
C.该过程测的温度升高,故为热能,C正确;
D.该过程没有机械运动,不是机械能,D错误;
故选C。
27.D
【分析】该图所示生成物总能量高于反应物总能量,所示反应为吸热反应。
【详解】A.氢气在氯气中的燃烧为放热反应,故A错误;
B.金属单质与酸反应生成氢气的反应为放热反应,故B错误;
C.盐酸和氢氧化钠溶液发生中和反应,中和反应为放热反应,故C错误;
D.与的反应为吸热反应,故D正确;
故选:D。
28.A
【详解】A.Ba(OH)2·8H2O与NH4Cl的反应为吸热反应,故A选;
B.中和反应为放热反应,故B不选;
C.燃烧反应为放热反应,故C不选;
D.由图可知反应物的总能量高于生成物,因此该反应为放热反应,故D不选;
综上所述,答案为A。
29.D
【详解】A.反应物的总能量高于生成物的总能量,为放热反应,故A错误;
B.盐酸与NaHCO3的反应为吸热反应,而图像为放热反应,故B错误;
C.能量的变化与化学键的断裂和形成都有关系,故C错误;
D.由图象可知,生成物的总能量低于反应物的总能量,故D正确;
故选D。
30.(1)B
(2)AD
(3)AB
(4)
【详解】(1)正反应为吸热反应,则反应物的总能量小于生成物的总能量,故选B;
(2)A.将煤炭粉碎可增大反应物接触面积,能加快反应速率,故A选;
B.通入氦气,反应物浓度不变,反应速率不变,故B不选;
C.降低温度,反应速率减慢,故C不选;
D.加入催化剂,可降低反应活化能,提高反应速率,故D选;
故选AD;
(3)A.反应从开始至平衡过程中,氢气的物质的量发生变化,当保持不变,说明反应达到化学平衡状态,故A选;
B.当正逆反应速率相等时,反应达到平衡,不同物质的反应速率与系数成正比,则,反应达到化学平衡状态,故B选;
C.根据质量守恒定律,反应前后质量不变,因此物质的总质量一直保持不变,不能说明达到平衡状态,故C不选;
D.与起始加入量和转化率有关,不能说明反应到达平衡状态,故D不选;
故选AB;
(4)0~5min内H2O(g)的平均反应速率。
答案第1页,共2页
答案第1页,共2页
同课章节目录
