2.3 氧化还原反应 同步训练(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 氧化还原反应 同步训练(含解析) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 214.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-24 23:28:21 | ||
图片预览




文档简介
2.3 氧化还原反应 同步训练
一、单选题
1.下列水环境修复过程中未发生氧化还原反应的是( )
A.用处理工业废水
B.用改善室内游泳池的水体环境
C.用明矾处理含悬浮物质较多的废水
D.用纳米零价铁处理含、较多的废水
2.下列反应中,既属于氧化还原反应又属于置换反应的是()。
A.CuO+H2 Cu+H2O B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO 2Fe+3CO2 D.2Na+Cl2 2NaCl
3.含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是( )
A.反应①利用了H2Te的还原性
B.反应②中H2O作氧化剂
C.反应③利用了H2O2的氧化性
D.H2Te2O5转化为H2Te4O9发生了氧化还原反应
4.水与下列物质反应时,水表现出氧化性的是( )
A. B. C. D.
5.下列氧化还原反应中,水作为还原剂的是( )
A.H2O+CaO=Ca(OH)2 B.CO+ H2OCO2+H2
C.Cl2+H2O=HCl+ HClO D.2F2 +2H2O=4HF+O2
6.已知氧化性顺序是:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组合不合理的是( )
A.Fe3+、Br-、Cl- B.Fe3+、Cl-
C.Fe2+、Cl-、I- D.Fe2+、Br-、Cl-、I-
7.处理含氰(CN-)废水涉及以下反应,其中无毒的OCN-中碳元素为+4价。
CN-+OH-+Cl2→OCN-+Cl-+H2O(未配平) 反应Ⅰ
2OCN-+4OH-+3Cl2=2CO2+N2+6Cl-+2H2O 反应Ⅱ
下列说法中正确的是( )
A.反应I中碳元素被还原
B.反应II中CO2为氧化产物
C.处理过程中,每产生1 mol N2,消耗3 molCl2
D.处理I中CN-与Cl2按物质的量比例1:1进行反应
8.下列说法中,正确的是( )
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
9.几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I﹣>Fe2+>H2O2.据此判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
B.H2O2+H2SO4=SO2↑+O2↑+2H2O
C.SO2+I2+2H2O=H2SO4+2HI
D.2Fe3++2I﹣=2Fe2++I2
10.火法炼锌: ,下列说法正确的是( )
A.被还原的元素只有Zn
B. 在反应中失去电子
C.还原剂与氧化剂的物质的量之比为1∶2
D.氧化产物与还原产物的物质的量之比为1∶1
11.下列反应中的氨与反应4NH3+5O2 4NO+6H2O中的氨作用相同的是( )
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO 3Cu+ N2+3H2O
C.NH3+ HNO3=NH4NO3 D.3SiH4 +4NH3 =Si3 N4+12H2
12.已知氧化性:Cl2>Br2>Fe3+>I2,判断下列化学方程式一定错误的是( )
A.2FeCl3+2KI→2FeCl2+2KCl+I2 B.6FeCl2+3Br2→4FeCl3+2FeBr3
C.FeBr2+Cl2→FeCl2+Br2 D.FeI2+Cl2→FeCl2+I2
13.高铁酸钠(Na2FeO4,其中铁为+6价)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为。下列说法错误的是( )
A.是氧化剂,发生还原反应
B.此条件下,氧化性:
C.
D.被还原为
14.下列反应中出现的颜色变化不是由于氧化还原反应引起的是
A.向氢氧化镁悬浊液中滴加氯化铵溶液,白色沉淀溶解
B.向溶液中加入足量粉,溶液蓝色消失
C.乙醇使酸性高锰酸钾溶液褪色
D.在空气中加热,白色变为淡黄色
15.下列反应中,H2O2只作氧化剂的是( )
A.H2O2+SO2=H2SO4 B.CaO+H2O2 = CaO2+H2O
C.H2O2+Cl2=2HCl+O2 D.2H2O2 2H2O+O2↑
16.据最新报道,科学家发现了如下反应:O2+PtF6═O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是( )
A.O2 是氧化剂,PtF6 是还原剂
B.O2(PtF6)中氧元素的化合价为+1
C.O2(PtF6)中不存在共价键
D.每生成1mol O2(PtF6)则转移1mol电子
二、综合题
17.已知反应:
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③[ ]K2Cr2O7+[ ]FeSO4+[ ] =[ ]Fe2(SO4)3+[ ]Cr2(SO4)3+[ ]K2SO4+[ ]H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: .
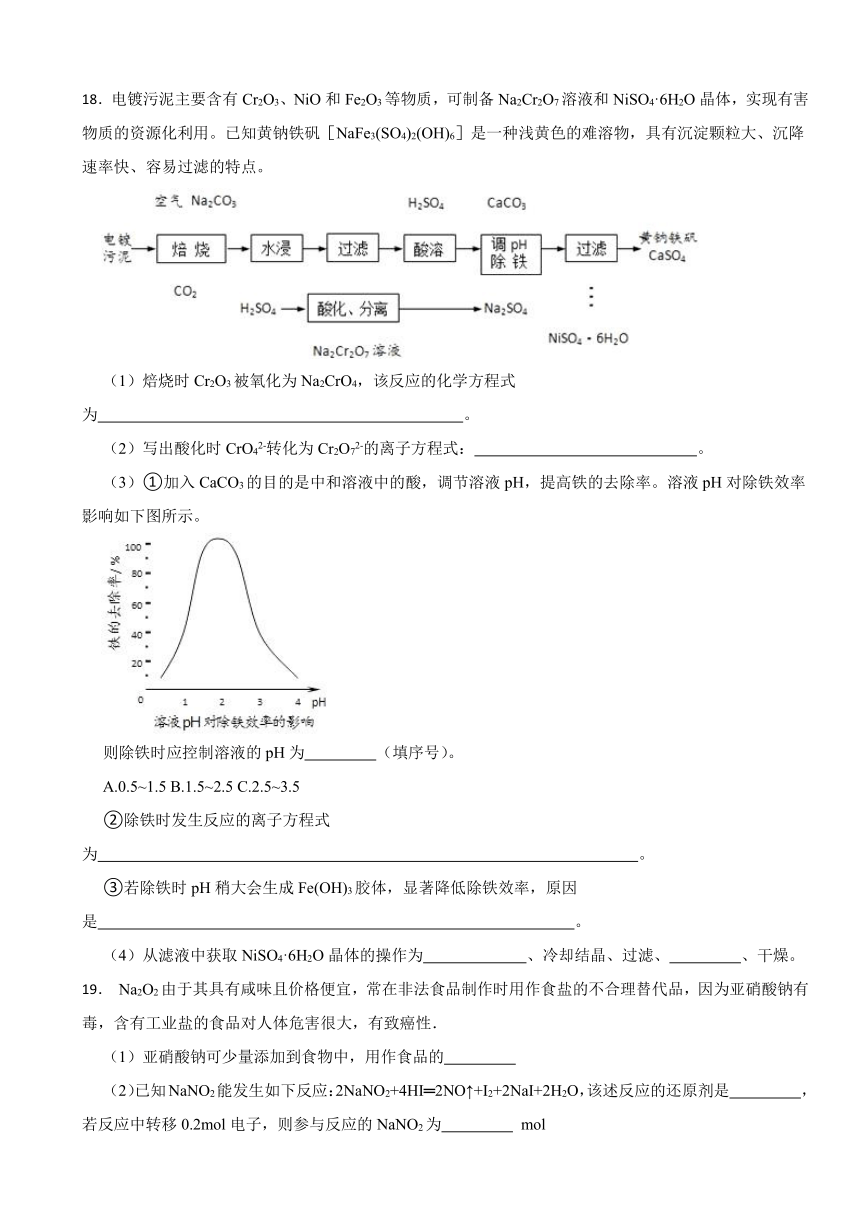
18.电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为 。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式: 。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。
则除铁时应控制溶液的pH为 (填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为 。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是 。
(4)从滤液中获取NiSO4·6H2O晶体的操作为 、冷却结晶、过滤、 、干燥。
19. Na2O2由于其具有咸味且价格便宜,常在非法食品制作时用作食盐的不合理替代品,因为亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.
(1)亚硝酸钠可少量添加到食物中,用作食品的
(2)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,该述反应的还原剂是 ,若反应中转移0.2mol电子,则参与反应的NaNO2为 mol
(3)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:
A.水 B.碘化钾淀粉试纸 C.淀粉
D.食醋 E.白酒
(4)实验室模拟用以下反应合成亚硝酸盐
C6H12O6+12HNO3=3HOOC﹣COOH+9NO2+3NO↑+9H2O
NO+NO2+2NaOH=2NaNO2+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
其中第一个反应要控制反应液的温度在35~60℃条件下进行,原因是 ,第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、 ,且第三种离子与NO2﹣的浓度之比为 .
(5)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种气体,该气体在空气中迅速变色,写出亚硝酸钠与亚铁离子反应的离子方程式 .
20.化学实验中,如果使某步反应中的有害产物作为另一步的反应物,形成一个循环,就能实现不再向环境排放该有害物质。例如:
(1)配平步骤①的反应方程式,并用单线桥标出电子转移的方向和数目。
__HCl=_NaCl+___
该反应中被还原的原子与被氧化的原子个数之比为 ;每生成1mol的氧化产物,被氧化的还原剂的质量为 g。
(2)为实现步骤⑥的转化,可在碱性条件下加入,被还原为,其离子方程式为 ;还原性: (填“>”、“<”或“=”)。
(3)在上述有编号的步骤中,除了⑥外,还需用氧化剂的步骤是 (填序号)。
21.若将12.8gCu跟一定物质的量浓度硝酸反应,铜消耗完时,
(1)总共转移的电子为多少mol?
(2)若将反应得到的气体与一定体积(标况下)的O2混合通入水中,恰好完全吸收,则O2的体积是多少?
答案解析部分
1.【答案】C
【解析】【解答】A.中Fe为+6价,有强氧化性,处理工业废水时转化为+3价的Fe,发生氧化还原反应,A不选;
B.有氧化性,在消毒水是转化为Cl-,发生氧化还原反应,B不选;
C.明矾[KAl(SO4)2]在水中形成Al(OH)3胶体,吸附悬浮物,过程中无化合价变化,不发生氧化还原反应,C选;
D.Fe单质置换、为单质Cu、Ag,有化合价变化,发生氧化还原反应,D不选;
故答案为:C。
【分析】A、高铁酸钾具有强氧化性;
B、次氯酸钠具有强氧化性可以杀菌消毒;
C、明矾的净水为胶体的吸附作用;
D、铁可以和铜离子、银离子发生酯化反应生成相应单质。
2.【答案】A
【解析】【解答】A、是氧化还原也是置换反应,符合题意,选A;
B、不是氧化还原反应,不是置换反应,不选B;
C、是氧化还原反应,但不是置换反应,不选C;
D、是氧化还原反应,是化合反应,不是置换反应,不选D。
【分析】置换反应一定是氧化还原反应,置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应。
B、是复分解反应;
C、是氧化还原反应,但两种反应物均是化合物,没单质,不是置换反应;
D、是氧化还原反应,是化合反应,不是置换反应。
3.【答案】D
【解析】【解答】A.H2Te被O2氧化生成Te,体现H2Te具有还原性,故A不符合题意;
B.反应②中Te与H2O反应H2TeO3,Te元素化合价升高,是还原剂,则H2O为氧化剂,应有H2生成,故B不符合题意;
C.反应③中H2TeO3→H6TeO6,Te元素化合价升高,发生氧化反应,则H2O2作氧化剂,体现氧化性,故C不符合题意;
D.H2Te2O5转化为H2Te4O9时不存在元素化合价的变化,未发生氧化还原反应,故D符合题意;
故答案为:D。
【分析】A、碲化合价升高,具有还原性;
B、水和碲反应,碲化合价升高,被氧化,水体现为氧化性;
C、碲元素的化合价升高,被氧化,过氧化氢体现为还原性;
D、碲元素反应前后都为+4价,价态不变,不是氧化还原反应。
4.【答案】B
【解析】【解答】A.由反应Cl2+H2O=HCl+HClO,知Cl2与水反应时,H2O中没有元素化合价改变,故H2O既不作氧化剂也不是还原剂,A不符合题意;
B.由反应2Na+2H2O=2NaOH+H2↑,知H2O中氢元素化合价降低生成H2,故H2O作氧化剂,B符合题意;
C.Na2O+H2O=2NaOH,该反应不是氧化还原反应,C不符合题意;
D.由反应2Na2O2+2H2O=4NaOH+O2↑,知该反应为Na2O2自身歧化反应,故H2O在反应中既不是氧化剂也不是还原剂,D不符合题意;
故答案为:B。
【分析】水体现为氧化性,主要是氢元素化合价降低;
A、水中氢元素化合价不变;
B、水中氢元素化合价降低;
C、水中氢元素化合价不变;
D、水中氢元素化合价不变。
5.【答案】D
【解析】【解答】A.反应H2O+CaO=Ca(OH)2中没有元素化合价的变化,不是氧化还原反应,A不符合题意;
B.反应CO+ H2OCO2+H2中,H2O中H的化合价由+1价降为0价,是氧化剂,B不符合题意;
C.反应Cl2+H2OHCl+ HClO中,H2O中H和O的化合价均未变化,既不是氧化剂也不是还原剂,C不符合题意;
D.反应2F2 +2H2O=4HF+O2中,H2O中O的化合价由-2价升为0价,是还原剂,D符合题意;
故答案为:D。
【分析】结合化合价升降,判断是否为氧化还原反应, 水作为还原剂说明水中的氧元素化合价升高
6.【答案】C
【解析】【解答】A.溶液中存在Fe3+、Br-、Cl-,说明I-、Fe2+被完全氧化,符合反应发生的先后顺序,故A不符合题意;
B.溶液中只存在Fe3+、Cl-,说明I-、Fe2+、Br-被完全氧化,符合反应发生的先后顺序,故B不符合题意;
C.溶液中存在Fe2+、Cl-、I-,说明碘离子没有被完全氧化,溶液中还存在溴离子,不符合反应发生的先后顺序,故C符合题意;
D.溶液中存在Fe2+、Br-、Cl-、I-,说明I-没有被完全氧化,则Fe2+、Br-未被氧化,仍存在溶液中,符合反应发生的先后顺序,故D不符合题意;
故答案为:C。
【分析】已知氧化性顺序是:Cl2>Br2>Fe3+>I2,氧化性强的先与还原性强的物质反应,则发生反应的先后顺序为:Cl2+2I-=I2+2Cl-,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-=Br2+2Cl-,I-、Fe2+、Br-依次被氧化。
7.【答案】D
【解析】【解答】A.在反应Ⅰ中碳元素的化合价由CN-中的+2变为OCN-中的+4,化合价升高,被氧化,故A不符合题意;
B.在反应II中,OCN-中碳元素的化合价为+4,生成物中二氧化碳的化合价也是+4,碳元素化合价反应前后没有发生变化,二氧化碳既不是氧化产物,也不是还原产物,故B不符合题意;
C.由上述分析可得处理过程的总反应为:2CN-+8OH-+5Cl2=10Cl-+4H2O+2CO2+N2,根据反应方程式可知:每产生1 mol N2,消耗5 molCl2,故C不符合题意;
D.将反应Ⅰ配平后的方程式为:CN-+2OH-+Cl2=OCN-+2Cl-+H2O,根据方程式可知CN-与Cl2按物质的量比例1:1进行反应,故D符合题意;
故答案为:D。
【分析】A.反应Ⅰ中碳元素的化合价由CN-中的+2变为OCN-中的+4,化合价升高;
B.反应II中,碳元素化合价没有发生变化,都是+4价;
C.将两个方程式联合起来的总方程式可判断生成1mol氮气需要氯气的物质的量;;
D.根据方程式Ⅰ进行分析即可。
8.【答案】B
【解析】【解答】氧化剂本身被还原,生成还原产物,A错;还原剂在反应时所含元素的化合价升高,C错;在一个反应中,氧化剂和还原剂可能是同一物质,如氯酸钾分解制备氧气,氯酸钾既是氧化剂又是还原剂,D错。
故答案为:B
【分析】A.氧化剂反应后生成还原产物;
B.在氧化还原反应中氧化剂得电子;
C.氧化还原反应中还原剂失电子化合价升高;
D.同一反应中,氧化剂和还原剂可能是同种物质.
9.【答案】B
【解析】【解答】解:A.因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,能发生,故A不选;
B.因该反应中O元素的化合价升高,S元素的化合价降低,则H2O2为还原剂,还原性强弱为H2O2>SO2,与已知的还原性强弱不一致,不能发生,故B选;
C.因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>HI,与已知的还原性强弱一致,反应能发生,故C不选;
D.因该反应中Fe元素的化合价降低,I元素的化合价升高,则I﹣为还原剂,还原性强弱为I﹣>Fe2+,与已知的还原性强弱一致,能发生,故D不选.
故选B.
【分析】根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是SO2>I﹣>Fe2+>>H2O2来判断反应能否发生.
10.【答案】D
【解析】【解答】A.由反应方程式可知,Zn的化合价由+2价变成0价,C的化合价由+4变成+2,0变成+2,所以被还原的元素有Zn和C,A不符合题意;
B.Zn的化合价由+2价变成0价,反应过程中得到电子,B不符合题意;
C.由反应方程式可知还原剂为C,氧化剂为ZnCO3,还原剂与氧化剂的物质的量之比为2∶1,C不符合题意;
D.由反应方程式可知氧化产物为CO,系数为2,还原产物为Zn和CO,系数分别为1,故氧化产物与还原产物的物质的量之比为1∶1,D符合题意;
故答案为:D。
【分析】根据方程式标出化合价即可找出氧化剂和还原剂和还原产物和氧化产物,即可找出物质的量之间的关系结合选项进行判断即可
11.【答案】B
【解析】【解答】A.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,A不符合题意;
B.该反应中,氮元素由-3价变为0价,化合价升高,被氧化,体现还原性,B符合题意;
C.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,C不符合题意;
D.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,D不符合题意;
故答案为:B
【分析】题干反应中氮元素的化合价升高,被氧化,体现还原性;据此结合选项中所给反应中氮元素的化合价变化,进行分析。
12.【答案】C
【解析】【解答】A、根据2FeCl3+2KI=2FeCl2+2KCl+I2可以知道氧化性是Fe3+>I2,符合题干已知条件,所以化学方程式成立,故A不符合题意;
B、根据6FeCl2+3Br2=4FeCl3+2FeBr3可以知道氧化性是Br2>Fe3+,符合题干已知条件,所以化学方程式成立,故B不符合题意;
C、亚铁离子的还原性强于溴离子,所以氯气与溴化亚铁反应首先氧化亚铁离子,后氧化溴离子,故C符合题意;
D、根据FeI2+Cl2=FeCl2+I2可以知道氧化性是Cl2>I2,符合题干已知条件,所以化学方程式成立,故D不符合题意;
故答案为:C。
【分析】根据化学方程式,只要根据氧化还原反应中还原剂的还原性强于还原产物的还原性,氧化剂的氧化性强于氧化产物的氧化性得出的结果符合题干已知条件的,说明反应成立,由此分析解答。
13.【答案】D
【解析】【解答】A.在反应中,中的Cl元素由+1价降为-1价,则是氧化剂,发生还原反应,A不符合题意;
B.此条件下,是氧化剂,是氧化产物,所以氧化性:,B不符合题意;
C.在该反应中,中的Cl元素由+1价降低为-1价,化合价降低2价,Fe3+中的Fe元素由+3价升高到+6价,化合价升高3价,依据得失电子守恒的原则,,C不符合题意;
D.转化为时,Fe元素的化合价升高,失电子作还原剂,被氧化,D符合题意;
故答案为:D。
【分析】根据得失电子守恒和质量守恒可知,,该反应中,中的Cl元素由+1价降为-1价,为氧化剂,Fe元素的化合价升高,为还原剂。
14.【答案】A
【解析】【解答】A.,加入氯化铵,铵根与OH-结合,,与氧化还原无关,A符合题意;
B.,发生氧化还原,B不符合题意;
C.乙醇具有还原性,高锰酸钾具有强氧化性,发生氧化还原,C不符合题意;
D.,发生氧化还原,D不符合题意;
故答案为:A。
【分析】利用氧化还原反应中有元素化合价发生变化判断。
15.【答案】A
【解析】【解答】A.该反应中双氧水中O元素化合价从-1价降为-2,做氧化剂,故A符合题意;
B.该反应中双氧水中各元素化合价均未变化,仅做反应物,故B不符合题意;
C.该反应中双氧水中O元素化合价从-1价升高到0价,做还原剂,故C不符合题意;
D.该反应中双氧水中O元素化合价从-1价变为0价和-2价,既是氧化剂又是还原剂,故D不符合题意;
故答案为A。
【分析】氧化还原反应中氧化剂得电子发生还原反应化合价降低,还原剂失电子发生氧化反应化合价升高。
16.【答案】D
【解析】【解答】解:O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价、则O元素化合价为+0.5价,
O2+PtF6═O2(PtF6)中O元素化合价由0价变为+0.5价、Pt元素化合价由+6价变为+5价,
A.得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以O2 是还原剂,PtF6 是氧化剂,故A错误;
B.O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价,由化合物中各元素化合价的代数和为0确定O元素化合价为+0.5价,故B错误;
C.非金属元素之间易形成共价键,该化合物中O原子之间存在共价键,故C错误;
D.每生成1mol O2(PtF6)则转移电子的物质的量=1mol×2(0.5﹣0)=1mol,故D正确;
故选D.
【分析】O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价、则O元素化合价为+0.5价,
O2+PtF6═O2(PtF6)中O元素化合价由0价变为+0.5价、Pt元素化合价由+6价变为+5价,
A.得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂;
B.O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价,由化合物中各元素化合价的代数和为0确定O元素化合价;
C.非金属元素之间易形成共价键;
D.每生成1mol O2(PtF6)则转移电子的物质的量=1mol×2(0.5﹣0).
17.【答案】(1)②③
(2)K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
(3)K2Cr2O7>Fe3+>I2
【解析】【解答】解:(1)①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,反应中各元素化合价都不变,不是氧化还原反应;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4,反应中铁元素化合价降低,碘元素化合价升高,属于氧化还原反应;
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,反应中Cr元素化合价降低,二价铁离子化合价升高,属于氧化还原反应;
故答案为:②③;(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,要使氧化剂得到电子总数等于还原剂失去电子总数,则K2Cr2O7系数为1,FeSO4系数为6,依据原子个数守恒,反应方程式:K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
故答案为:1;6;7H2SO4;3;1;1;7;(3)Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中三价铁为氧化剂,碘单质为氧化产物,所以氧化性:Fe3+>I2;
K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,K2Cr2O7为氧化剂,Fe3+为氧化产物,所以氧化性:K2Cr2O7>Fe3+>I2;
所以K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:K2Cr2O7>Fe3+>I2;
故答案为:K2Cr2O7>Fe3+>I2.
【分析】(1)氧化还原反应的判断依据:有化合价变化;(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;(3)依据氧化还原反应中氧化剂氧化性大于氧化产物氧化性判断解答.
18.【答案】(1)2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑
(2)2CrO42-+2H+=Cr2O72-+H2O
(3)B;3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6↓+3CaSO4↓+3CO2↑;生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤蒸发浓缩
(4)蒸发浓缩;洗涤
【解析】【解答】将电镀污泥、碳酸钠和空气焙烧,发生反应2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑,然后水浸Na2CrO4溶于水、NiO和Fe2O3难溶于水,然后过滤得到滤液,向滤液中加入稀硫酸,发生反应2CrO42-+2H+=Cr2O72-+H2O,然后利用物质的溶解度不同分离得到硫酸钠和Na2Cr2O7溶液;向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4 6H2O晶体;
(1)通过以上分析知,三氧化二铬和碳酸钠、氧气在高温下反应方程式为2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑;
(2)根据以上分析知,酸性条件下CrO42-和氢离子反应生成Cr2O72-和水,离子方程式为2CrO42-+2H+=Cr2O72-+H2O;
(3)①根据图2知,pH在0-3左右,pH越大铁元素的去除率越高,pH>3后,pH越大铁元素的去除率减小,铁的去除率在pH为1.5-2.5时较高,故选B;②根据以上分析知,发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑;③胶体颗粒小,沉淀速率慢且不容易过滤,导致除铁效率低;(4)从溶液中获取晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩增大溶液浓度,洗涤除去杂质。
【分析】根据制备流程分析每一步物质的转化关系,结合氧化还原反应的规律和离子方程式的书写以及物质的分离方法等进行分析即可。
19.【答案】(1)防腐剂
(2)HI;0.2
(3)B;D
(4)避免硝酸分解,降低原料利用率;NO3﹣;3:1
(5)Fe2++NO2﹣+2H+=Fe3++NO↑+H2O
【解析】【解答】解:(1)亚硝酸钠可少量添加到食物中,用作食品的防腐剂,故答案为:防腐剂;(2)2NaNO2+4HI═2NO↑+I2+2NaI+2H2O中,I元素的化合价升高,反应的还原剂是HI,若反应中转移0.2mol电子,则参与反应的NaNO2为 =0.2mol,
故答案为:HI;0.2;(3)结合(2)中反应可知鉴别NaNO2和NaCl,选择含碘离子的物质及淀粉,则选择试剂为BD,均与NaCl不反应,故答案为:BD;(4)根据上面的分析可知,A中有硝酸参加反应,硝酸受热易分解,降低了原料利用率,所以反应温度不宜高于60℃;不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH﹣外还有两种阴离子,其中一种是NO2﹣,另一种为NO3﹣,根据反应C6H12O6+12HNO3═3HOOC﹣COOH+9NO2↑+3NO↑+9H2O可知,得到的NO和NO2的体积比为1:3,根据反应NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO3+NaNO2+H2O可得反应NO+3NO2+4NaOH═3NaNO2+NaNO3+2H2O,所以溶液中NO2﹣与NO3﹣的物质的量之比为3:1,
故答案为:避免硝酸分解,降低原料利用率;NO3﹣;3:1;(5)亚硝酸钠能氧化酸性条件下的Fe2+,生成铁离子和一氧化氮,一氧化氮在空气中迅速变色生成二氧化氮,反应的离子方程式为Fe2++NO2﹣+2H+=Fe3++NO↑+H2O,
故答案为:Fe2++NO2﹣+2H+=Fe3++NO↑+H2O.
【分析】(1)亚硝酸钠作防腐剂;(2)2NaNO2+4HI═2NO↑+I2+2NaI+2H2O中,I元素的化合价升高,结合元素的化合价计算转移电子;(3)结合(2)中反应可知鉴别NaNO2和NaCl,选择含碘离子的物质及淀粉;(4)第一个反应要控制反应液的温度在35~60℃条件下进行,防止硝酸分解;第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、NO3﹣,结合反应计算离子浓度比;(5)气体为NO,可知反应生成铁离子、NO和水.
20.【答案】(1);1∶3;73
(2);<
(3)④
【解析】【解答】(1)中Cr元素化合价由+6降低为+3,HCl中Cl元素化合价由-1升高为0,根据得失电子守恒配平方程式,并用单线桥标出电子转移的方向和数目为 ;Cr元素化合价由+6降低为+3被还原,Cl元素化合价由-1升高为0被氧化,根据得失电子守恒,被还原的原子与被氧化的原子个数之比为1:3;HCl中Cl元素化合价由-1升高为0被氧化,HCl是还原剂,氧化产物是Cl2,每生成1mol的氧化产物,有2molHCl被氧化,被氧化的HCl的质量为73g。
(2)被还原为,被氧化为,根据得失电子守恒、电荷守恒配平反应离子方程式为;反应中是氧化剂、是还原剂,还原性:<。
(3)反应④中Cr元素化合价升高,CrCl3发生氧化反应,需用氧化剂。
【分析】(1)依据元素化合价变化,根据得失电子守恒配平;氧化剂元素化合价降低,得到电子被还原,得到还原产物; 还原剂元素化合价升高,失去电子,被氧化,得到氧化产物;
(2)根据反应物和产物的化学式,利用电子得失守恒、电荷守恒、原子守恒书写;根据氧化性比较:氧化剂>氧化产物;依据还原性:还原剂>还原产物;
(3)依据元素化合价升高,需要加入氧化剂;元素化合价降低,需要加入还原剂。
21.【答案】(1)解:n(Cu)= =0.2mol,铜消耗完时转移电子为0.2mol×(2﹣0)=0.4mol,
答:总共转移的电子为0.4mol;
(2)解:将反应得到的气体与一定体积(标况下)的O2混合通入水中,恰好完全吸收,可知Cu失去电子=氧气得到电子,则O2的体积是 ×22.4L/mol=2.24L,
答:O2的体积是2.24L.
【解析】【分析】n(Cu)= =0.2mol,与硝酸反应Cu失去电子,结合元素的化合价及电子守恒计算.
一、单选题
1.下列水环境修复过程中未发生氧化还原反应的是( )
A.用处理工业废水
B.用改善室内游泳池的水体环境
C.用明矾处理含悬浮物质较多的废水
D.用纳米零价铁处理含、较多的废水
2.下列反应中,既属于氧化还原反应又属于置换反应的是()。
A.CuO+H2 Cu+H2O B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO 2Fe+3CO2 D.2Na+Cl2 2NaCl
3.含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是( )
A.反应①利用了H2Te的还原性
B.反应②中H2O作氧化剂
C.反应③利用了H2O2的氧化性
D.H2Te2O5转化为H2Te4O9发生了氧化还原反应
4.水与下列物质反应时,水表现出氧化性的是( )
A. B. C. D.
5.下列氧化还原反应中,水作为还原剂的是( )
A.H2O+CaO=Ca(OH)2 B.CO+ H2OCO2+H2
C.Cl2+H2O=HCl+ HClO D.2F2 +2H2O=4HF+O2
6.已知氧化性顺序是:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组合不合理的是( )
A.Fe3+、Br-、Cl- B.Fe3+、Cl-
C.Fe2+、Cl-、I- D.Fe2+、Br-、Cl-、I-
7.处理含氰(CN-)废水涉及以下反应,其中无毒的OCN-中碳元素为+4价。
CN-+OH-+Cl2→OCN-+Cl-+H2O(未配平) 反应Ⅰ
2OCN-+4OH-+3Cl2=2CO2+N2+6Cl-+2H2O 反应Ⅱ
下列说法中正确的是( )
A.反应I中碳元素被还原
B.反应II中CO2为氧化产物
C.处理过程中,每产生1 mol N2,消耗3 molCl2
D.处理I中CN-与Cl2按物质的量比例1:1进行反应
8.下列说法中,正确的是( )
A.氧化剂本身被还原,生成氧化产物
B.氧化剂是在反应中得到电子(或电子对偏向)的物质
C.还原剂在反应时所含元素的化合价降低
D.在一个反应中,氧化剂和还原剂不可能是同一物质
9.几种物质在酸性溶液中的还原性强弱顺序如下:SO2>I﹣>Fe2+>H2O2.据此判断下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+
B.H2O2+H2SO4=SO2↑+O2↑+2H2O
C.SO2+I2+2H2O=H2SO4+2HI
D.2Fe3++2I﹣=2Fe2++I2
10.火法炼锌: ,下列说法正确的是( )
A.被还原的元素只有Zn
B. 在反应中失去电子
C.还原剂与氧化剂的物质的量之比为1∶2
D.氧化产物与还原产物的物质的量之比为1∶1
11.下列反应中的氨与反应4NH3+5O2 4NO+6H2O中的氨作用相同的是( )
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO 3Cu+ N2+3H2O
C.NH3+ HNO3=NH4NO3 D.3SiH4 +4NH3 =Si3 N4+12H2
12.已知氧化性:Cl2>Br2>Fe3+>I2,判断下列化学方程式一定错误的是( )
A.2FeCl3+2KI→2FeCl2+2KCl+I2 B.6FeCl2+3Br2→4FeCl3+2FeBr3
C.FeBr2+Cl2→FeCl2+Br2 D.FeI2+Cl2→FeCl2+I2
13.高铁酸钠(Na2FeO4,其中铁为+6价)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为。下列说法错误的是( )
A.是氧化剂,发生还原反应
B.此条件下,氧化性:
C.
D.被还原为
14.下列反应中出现的颜色变化不是由于氧化还原反应引起的是
A.向氢氧化镁悬浊液中滴加氯化铵溶液,白色沉淀溶解
B.向溶液中加入足量粉,溶液蓝色消失
C.乙醇使酸性高锰酸钾溶液褪色
D.在空气中加热,白色变为淡黄色
15.下列反应中,H2O2只作氧化剂的是( )
A.H2O2+SO2=H2SO4 B.CaO+H2O2 = CaO2+H2O
C.H2O2+Cl2=2HCl+O2 D.2H2O2 2H2O+O2↑
16.据最新报道,科学家发现了如下反应:O2+PtF6═O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是( )
A.O2 是氧化剂,PtF6 是还原剂
B.O2(PtF6)中氧元素的化合价为+1
C.O2(PtF6)中不存在共价键
D.每生成1mol O2(PtF6)则转移1mol电子
二、综合题
17.已知反应:
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4;
③[ ]K2Cr2O7+[ ]FeSO4+[ ] =[ ]Fe2(SO4)3+[ ]Cr2(SO4)3+[ ]K2SO4+[ ]H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)配平反应③的化学方程式;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: .
18.电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为 。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式: 。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。
则除铁时应控制溶液的pH为 (填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为 。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是 。
(4)从滤液中获取NiSO4·6H2O晶体的操作为 、冷却结晶、过滤、 、干燥。
19. Na2O2由于其具有咸味且价格便宜,常在非法食品制作时用作食盐的不合理替代品,因为亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.
(1)亚硝酸钠可少量添加到食物中,用作食品的
(2)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,该述反应的还原剂是 ,若反应中转移0.2mol电子,则参与反应的NaNO2为 mol
(3)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:
A.水 B.碘化钾淀粉试纸 C.淀粉
D.食醋 E.白酒
(4)实验室模拟用以下反应合成亚硝酸盐
C6H12O6+12HNO3=3HOOC﹣COOH+9NO2+3NO↑+9H2O
NO+NO2+2NaOH=2NaNO2+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
其中第一个反应要控制反应液的温度在35~60℃条件下进行,原因是 ,第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、 ,且第三种离子与NO2﹣的浓度之比为 .
(5)亚硝酸钠能氧化酸性条件下的Fe2+,同时产生一种气体,该气体在空气中迅速变色,写出亚硝酸钠与亚铁离子反应的离子方程式 .
20.化学实验中,如果使某步反应中的有害产物作为另一步的反应物,形成一个循环,就能实现不再向环境排放该有害物质。例如:
(1)配平步骤①的反应方程式,并用单线桥标出电子转移的方向和数目。
__HCl=_NaCl+___
该反应中被还原的原子与被氧化的原子个数之比为 ;每生成1mol的氧化产物,被氧化的还原剂的质量为 g。
(2)为实现步骤⑥的转化,可在碱性条件下加入,被还原为,其离子方程式为 ;还原性: (填“>”、“<”或“=”)。
(3)在上述有编号的步骤中,除了⑥外,还需用氧化剂的步骤是 (填序号)。
21.若将12.8gCu跟一定物质的量浓度硝酸反应,铜消耗完时,
(1)总共转移的电子为多少mol?
(2)若将反应得到的气体与一定体积(标况下)的O2混合通入水中,恰好完全吸收,则O2的体积是多少?
答案解析部分
1.【答案】C
【解析】【解答】A.中Fe为+6价,有强氧化性,处理工业废水时转化为+3价的Fe,发生氧化还原反应,A不选;
B.有氧化性,在消毒水是转化为Cl-,发生氧化还原反应,B不选;
C.明矾[KAl(SO4)2]在水中形成Al(OH)3胶体,吸附悬浮物,过程中无化合价变化,不发生氧化还原反应,C选;
D.Fe单质置换、为单质Cu、Ag,有化合价变化,发生氧化还原反应,D不选;
故答案为:C。
【分析】A、高铁酸钾具有强氧化性;
B、次氯酸钠具有强氧化性可以杀菌消毒;
C、明矾的净水为胶体的吸附作用;
D、铁可以和铜离子、银离子发生酯化反应生成相应单质。
2.【答案】A
【解析】【解答】A、是氧化还原也是置换反应,符合题意,选A;
B、不是氧化还原反应,不是置换反应,不选B;
C、是氧化还原反应,但不是置换反应,不选C;
D、是氧化还原反应,是化合反应,不是置换反应,不选D。
【分析】置换反应一定是氧化还原反应,置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应。
B、是复分解反应;
C、是氧化还原反应,但两种反应物均是化合物,没单质,不是置换反应;
D、是氧化还原反应,是化合反应,不是置换反应。
3.【答案】D
【解析】【解答】A.H2Te被O2氧化生成Te,体现H2Te具有还原性,故A不符合题意;
B.反应②中Te与H2O反应H2TeO3,Te元素化合价升高,是还原剂,则H2O为氧化剂,应有H2生成,故B不符合题意;
C.反应③中H2TeO3→H6TeO6,Te元素化合价升高,发生氧化反应,则H2O2作氧化剂,体现氧化性,故C不符合题意;
D.H2Te2O5转化为H2Te4O9时不存在元素化合价的变化,未发生氧化还原反应,故D符合题意;
故答案为:D。
【分析】A、碲化合价升高,具有还原性;
B、水和碲反应,碲化合价升高,被氧化,水体现为氧化性;
C、碲元素的化合价升高,被氧化,过氧化氢体现为还原性;
D、碲元素反应前后都为+4价,价态不变,不是氧化还原反应。
4.【答案】B
【解析】【解答】A.由反应Cl2+H2O=HCl+HClO,知Cl2与水反应时,H2O中没有元素化合价改变,故H2O既不作氧化剂也不是还原剂,A不符合题意;
B.由反应2Na+2H2O=2NaOH+H2↑,知H2O中氢元素化合价降低生成H2,故H2O作氧化剂,B符合题意;
C.Na2O+H2O=2NaOH,该反应不是氧化还原反应,C不符合题意;
D.由反应2Na2O2+2H2O=4NaOH+O2↑,知该反应为Na2O2自身歧化反应,故H2O在反应中既不是氧化剂也不是还原剂,D不符合题意;
故答案为:B。
【分析】水体现为氧化性,主要是氢元素化合价降低;
A、水中氢元素化合价不变;
B、水中氢元素化合价降低;
C、水中氢元素化合价不变;
D、水中氢元素化合价不变。
5.【答案】D
【解析】【解答】A.反应H2O+CaO=Ca(OH)2中没有元素化合价的变化,不是氧化还原反应,A不符合题意;
B.反应CO+ H2OCO2+H2中,H2O中H的化合价由+1价降为0价,是氧化剂,B不符合题意;
C.反应Cl2+H2OHCl+ HClO中,H2O中H和O的化合价均未变化,既不是氧化剂也不是还原剂,C不符合题意;
D.反应2F2 +2H2O=4HF+O2中,H2O中O的化合价由-2价升为0价,是还原剂,D符合题意;
故答案为:D。
【分析】结合化合价升降,判断是否为氧化还原反应, 水作为还原剂说明水中的氧元素化合价升高
6.【答案】C
【解析】【解答】A.溶液中存在Fe3+、Br-、Cl-,说明I-、Fe2+被完全氧化,符合反应发生的先后顺序,故A不符合题意;
B.溶液中只存在Fe3+、Cl-,说明I-、Fe2+、Br-被完全氧化,符合反应发生的先后顺序,故B不符合题意;
C.溶液中存在Fe2+、Cl-、I-,说明碘离子没有被完全氧化,溶液中还存在溴离子,不符合反应发生的先后顺序,故C符合题意;
D.溶液中存在Fe2+、Br-、Cl-、I-,说明I-没有被完全氧化,则Fe2+、Br-未被氧化,仍存在溶液中,符合反应发生的先后顺序,故D不符合题意;
故答案为:C。
【分析】已知氧化性顺序是:Cl2>Br2>Fe3+>I2,氧化性强的先与还原性强的物质反应,则发生反应的先后顺序为:Cl2+2I-=I2+2Cl-,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-=Br2+2Cl-,I-、Fe2+、Br-依次被氧化。
7.【答案】D
【解析】【解答】A.在反应Ⅰ中碳元素的化合价由CN-中的+2变为OCN-中的+4,化合价升高,被氧化,故A不符合题意;
B.在反应II中,OCN-中碳元素的化合价为+4,生成物中二氧化碳的化合价也是+4,碳元素化合价反应前后没有发生变化,二氧化碳既不是氧化产物,也不是还原产物,故B不符合题意;
C.由上述分析可得处理过程的总反应为:2CN-+8OH-+5Cl2=10Cl-+4H2O+2CO2+N2,根据反应方程式可知:每产生1 mol N2,消耗5 molCl2,故C不符合题意;
D.将反应Ⅰ配平后的方程式为:CN-+2OH-+Cl2=OCN-+2Cl-+H2O,根据方程式可知CN-与Cl2按物质的量比例1:1进行反应,故D符合题意;
故答案为:D。
【分析】A.反应Ⅰ中碳元素的化合价由CN-中的+2变为OCN-中的+4,化合价升高;
B.反应II中,碳元素化合价没有发生变化,都是+4价;
C.将两个方程式联合起来的总方程式可判断生成1mol氮气需要氯气的物质的量;;
D.根据方程式Ⅰ进行分析即可。
8.【答案】B
【解析】【解答】氧化剂本身被还原,生成还原产物,A错;还原剂在反应时所含元素的化合价升高,C错;在一个反应中,氧化剂和还原剂可能是同一物质,如氯酸钾分解制备氧气,氯酸钾既是氧化剂又是还原剂,D错。
故答案为:B
【分析】A.氧化剂反应后生成还原产物;
B.在氧化还原反应中氧化剂得电子;
C.氧化还原反应中还原剂失电子化合价升高;
D.同一反应中,氧化剂和还原剂可能是同种物质.
9.【答案】B
【解析】【解答】解:A.因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,能发生,故A不选;
B.因该反应中O元素的化合价升高,S元素的化合价降低,则H2O2为还原剂,还原性强弱为H2O2>SO2,与已知的还原性强弱不一致,不能发生,故B选;
C.因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>HI,与已知的还原性强弱一致,反应能发生,故C不选;
D.因该反应中Fe元素的化合价降低,I元素的化合价升高,则I﹣为还原剂,还原性强弱为I﹣>Fe2+,与已知的还原性强弱一致,能发生,故D不选.
故选B.
【分析】根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是SO2>I﹣>Fe2+>>H2O2来判断反应能否发生.
10.【答案】D
【解析】【解答】A.由反应方程式可知,Zn的化合价由+2价变成0价,C的化合价由+4变成+2,0变成+2,所以被还原的元素有Zn和C,A不符合题意;
B.Zn的化合价由+2价变成0价,反应过程中得到电子,B不符合题意;
C.由反应方程式可知还原剂为C,氧化剂为ZnCO3,还原剂与氧化剂的物质的量之比为2∶1,C不符合题意;
D.由反应方程式可知氧化产物为CO,系数为2,还原产物为Zn和CO,系数分别为1,故氧化产物与还原产物的物质的量之比为1∶1,D符合题意;
故答案为:D。
【分析】根据方程式标出化合价即可找出氧化剂和还原剂和还原产物和氧化产物,即可找出物质的量之间的关系结合选项进行判断即可
11.【答案】B
【解析】【解答】A.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,A不符合题意;
B.该反应中,氮元素由-3价变为0价,化合价升高,被氧化,体现还原性,B符合题意;
C.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,C不符合题意;
D.该反应中氮元素的化合价不变,既不体现氧化性,也不体现还原性,D不符合题意;
故答案为:B
【分析】题干反应中氮元素的化合价升高,被氧化,体现还原性;据此结合选项中所给反应中氮元素的化合价变化,进行分析。
12.【答案】C
【解析】【解答】A、根据2FeCl3+2KI=2FeCl2+2KCl+I2可以知道氧化性是Fe3+>I2,符合题干已知条件,所以化学方程式成立,故A不符合题意;
B、根据6FeCl2+3Br2=4FeCl3+2FeBr3可以知道氧化性是Br2>Fe3+,符合题干已知条件,所以化学方程式成立,故B不符合题意;
C、亚铁离子的还原性强于溴离子,所以氯气与溴化亚铁反应首先氧化亚铁离子,后氧化溴离子,故C符合题意;
D、根据FeI2+Cl2=FeCl2+I2可以知道氧化性是Cl2>I2,符合题干已知条件,所以化学方程式成立,故D不符合题意;
故答案为:C。
【分析】根据化学方程式,只要根据氧化还原反应中还原剂的还原性强于还原产物的还原性,氧化剂的氧化性强于氧化产物的氧化性得出的结果符合题干已知条件的,说明反应成立,由此分析解答。
13.【答案】D
【解析】【解答】A.在反应中,中的Cl元素由+1价降为-1价,则是氧化剂,发生还原反应,A不符合题意;
B.此条件下,是氧化剂,是氧化产物,所以氧化性:,B不符合题意;
C.在该反应中,中的Cl元素由+1价降低为-1价,化合价降低2价,Fe3+中的Fe元素由+3价升高到+6价,化合价升高3价,依据得失电子守恒的原则,,C不符合题意;
D.转化为时,Fe元素的化合价升高,失电子作还原剂,被氧化,D符合题意;
故答案为:D。
【分析】根据得失电子守恒和质量守恒可知,,该反应中,中的Cl元素由+1价降为-1价,为氧化剂,Fe元素的化合价升高,为还原剂。
14.【答案】A
【解析】【解答】A.,加入氯化铵,铵根与OH-结合,,与氧化还原无关,A符合题意;
B.,发生氧化还原,B不符合题意;
C.乙醇具有还原性,高锰酸钾具有强氧化性,发生氧化还原,C不符合题意;
D.,发生氧化还原,D不符合题意;
故答案为:A。
【分析】利用氧化还原反应中有元素化合价发生变化判断。
15.【答案】A
【解析】【解答】A.该反应中双氧水中O元素化合价从-1价降为-2,做氧化剂,故A符合题意;
B.该反应中双氧水中各元素化合价均未变化,仅做反应物,故B不符合题意;
C.该反应中双氧水中O元素化合价从-1价升高到0价,做还原剂,故C不符合题意;
D.该反应中双氧水中O元素化合价从-1价变为0价和-2价,既是氧化剂又是还原剂,故D不符合题意;
故答案为A。
【分析】氧化还原反应中氧化剂得电子发生还原反应化合价降低,还原剂失电子发生氧化反应化合价升高。
16.【答案】D
【解析】【解答】解:O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价、则O元素化合价为+0.5价,
O2+PtF6═O2(PtF6)中O元素化合价由0价变为+0.5价、Pt元素化合价由+6价变为+5价,
A.得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以O2 是还原剂,PtF6 是氧化剂,故A错误;
B.O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价,由化合物中各元素化合价的代数和为0确定O元素化合价为+0.5价,故B错误;
C.非金属元素之间易形成共价键,该化合物中O原子之间存在共价键,故C错误;
D.每生成1mol O2(PtF6)则转移电子的物质的量=1mol×2(0.5﹣0)=1mol,故D正确;
故选D.
【分析】O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价、则O元素化合价为+0.5价,
O2+PtF6═O2(PtF6)中O元素化合价由0价变为+0.5价、Pt元素化合价由+6价变为+5价,
A.得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂;
B.O2(PtF6)为离子化合物,其中Pt的化合价为+5,F的化合价为﹣1价,由化合物中各元素化合价的代数和为0确定O元素化合价;
C.非金属元素之间易形成共价键;
D.每生成1mol O2(PtF6)则转移电子的物质的量=1mol×2(0.5﹣0).
17.【答案】(1)②③
(2)K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
(3)K2Cr2O7>Fe3+>I2
【解析】【解答】解:(1)①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,反应中各元素化合价都不变,不是氧化还原反应;
②Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4,反应中铁元素化合价降低,碘元素化合价升高,属于氧化还原反应;
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,反应中Cr元素化合价降低,二价铁离子化合价升高,属于氧化还原反应;
故答案为:②③;(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,要使氧化剂得到电子总数等于还原剂失去电子总数,则K2Cr2O7系数为1,FeSO4系数为6,依据原子个数守恒,反应方程式:K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
故答案为:1;6;7H2SO4;3;1;1;7;(3)Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中三价铁为氧化剂,碘单质为氧化产物,所以氧化性:Fe3+>I2;
K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,K2Cr2O7为氧化剂,Fe3+为氧化产物,所以氧化性:K2Cr2O7>Fe3+>I2;
所以K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序:K2Cr2O7>Fe3+>I2;
故答案为:K2Cr2O7>Fe3+>I2.
【分析】(1)氧化还原反应的判断依据:有化合价变化;(2)反应中Cr元素化合价变化:+6价降为+3价,1molK2Cr2O7参加反应得到6mol电子;Fe元素化合价变化:+2价升高到+3价,1mol硫酸亚铁参加反应失去1mol电子,依据氧化还原反应得失电子守恒、原子个数守恒书写方程式;(3)依据氧化还原反应中氧化剂氧化性大于氧化产物氧化性判断解答.
18.【答案】(1)2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑
(2)2CrO42-+2H+=Cr2O72-+H2O
(3)B;3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6↓+3CaSO4↓+3CO2↑;生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤蒸发浓缩
(4)蒸发浓缩;洗涤
【解析】【解答】将电镀污泥、碳酸钠和空气焙烧,发生反应2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑,然后水浸Na2CrO4溶于水、NiO和Fe2O3难溶于水,然后过滤得到滤液,向滤液中加入稀硫酸,发生反应2CrO42-+2H+=Cr2O72-+H2O,然后利用物质的溶解度不同分离得到硫酸钠和Na2Cr2O7溶液;向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4 6H2O晶体;
(1)通过以上分析知,三氧化二铬和碳酸钠、氧气在高温下反应方程式为2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2↑;
(2)根据以上分析知,酸性条件下CrO42-和氢离子反应生成Cr2O72-和水,离子方程式为2CrO42-+2H+=Cr2O72-+H2O;
(3)①根据图2知,pH在0-3左右,pH越大铁元素的去除率越高,pH>3后,pH越大铁元素的去除率减小,铁的去除率在pH为1.5-2.5时较高,故选B;②根据以上分析知,发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑;③胶体颗粒小,沉淀速率慢且不容易过滤,导致除铁效率低;(4)从溶液中获取晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩增大溶液浓度,洗涤除去杂质。
【分析】根据制备流程分析每一步物质的转化关系,结合氧化还原反应的规律和离子方程式的书写以及物质的分离方法等进行分析即可。
19.【答案】(1)防腐剂
(2)HI;0.2
(3)B;D
(4)避免硝酸分解,降低原料利用率;NO3﹣;3:1
(5)Fe2++NO2﹣+2H+=Fe3++NO↑+H2O
【解析】【解答】解:(1)亚硝酸钠可少量添加到食物中,用作食品的防腐剂,故答案为:防腐剂;(2)2NaNO2+4HI═2NO↑+I2+2NaI+2H2O中,I元素的化合价升高,反应的还原剂是HI,若反应中转移0.2mol电子,则参与反应的NaNO2为 =0.2mol,
故答案为:HI;0.2;(3)结合(2)中反应可知鉴别NaNO2和NaCl,选择含碘离子的物质及淀粉,则选择试剂为BD,均与NaCl不反应,故答案为:BD;(4)根据上面的分析可知,A中有硝酸参加反应,硝酸受热易分解,降低了原料利用率,所以反应温度不宜高于60℃;不经过任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除OH﹣外还有两种阴离子,其中一种是NO2﹣,另一种为NO3﹣,根据反应C6H12O6+12HNO3═3HOOC﹣COOH+9NO2↑+3NO↑+9H2O可知,得到的NO和NO2的体积比为1:3,根据反应NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO3+NaNO2+H2O可得反应NO+3NO2+4NaOH═3NaNO2+NaNO3+2H2O,所以溶液中NO2﹣与NO3﹣的物质的量之比为3:1,
故答案为:避免硝酸分解,降低原料利用率;NO3﹣;3:1;(5)亚硝酸钠能氧化酸性条件下的Fe2+,生成铁离子和一氧化氮,一氧化氮在空气中迅速变色生成二氧化氮,反应的离子方程式为Fe2++NO2﹣+2H+=Fe3++NO↑+H2O,
故答案为:Fe2++NO2﹣+2H+=Fe3++NO↑+H2O.
【分析】(1)亚硝酸钠作防腐剂;(2)2NaNO2+4HI═2NO↑+I2+2NaI+2H2O中,I元素的化合价升高,结合元素的化合价计算转移电子;(3)结合(2)中反应可知鉴别NaNO2和NaCl,选择含碘离子的物质及淀粉;(4)第一个反应要控制反应液的温度在35~60℃条件下进行,防止硝酸分解;第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、NO3﹣,结合反应计算离子浓度比;(5)气体为NO,可知反应生成铁离子、NO和水.
20.【答案】(1);1∶3;73
(2);<
(3)④
【解析】【解答】(1)中Cr元素化合价由+6降低为+3,HCl中Cl元素化合价由-1升高为0,根据得失电子守恒配平方程式,并用单线桥标出电子转移的方向和数目为 ;Cr元素化合价由+6降低为+3被还原,Cl元素化合价由-1升高为0被氧化,根据得失电子守恒,被还原的原子与被氧化的原子个数之比为1:3;HCl中Cl元素化合价由-1升高为0被氧化,HCl是还原剂,氧化产物是Cl2,每生成1mol的氧化产物,有2molHCl被氧化,被氧化的HCl的质量为73g。
(2)被还原为,被氧化为,根据得失电子守恒、电荷守恒配平反应离子方程式为;反应中是氧化剂、是还原剂,还原性:<。
(3)反应④中Cr元素化合价升高,CrCl3发生氧化反应,需用氧化剂。
【分析】(1)依据元素化合价变化,根据得失电子守恒配平;氧化剂元素化合价降低,得到电子被还原,得到还原产物; 还原剂元素化合价升高,失去电子,被氧化,得到氧化产物;
(2)根据反应物和产物的化学式,利用电子得失守恒、电荷守恒、原子守恒书写;根据氧化性比较:氧化剂>氧化产物;依据还原性:还原剂>还原产物;
(3)依据元素化合价升高,需要加入氧化剂;元素化合价降低,需要加入还原剂。
21.【答案】(1)解:n(Cu)= =0.2mol,铜消耗完时转移电子为0.2mol×(2﹣0)=0.4mol,
答:总共转移的电子为0.4mol;
(2)解:将反应得到的气体与一定体积(标况下)的O2混合通入水中,恰好完全吸收,可知Cu失去电子=氧气得到电子,则O2的体积是 ×22.4L/mol=2.24L,
答:O2的体积是2.24L.
【解析】【分析】n(Cu)= =0.2mol,与硝酸反应Cu失去电子,结合元素的化合价及电子守恒计算.
