安徽省县中联盟2023-2024学年高二上学期12月联考化学试卷(含解析)
文档属性
| 名称 | 安徽省县中联盟2023-2024学年高二上学期12月联考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 371.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-25 09:28:32 | ||
图片预览


文档简介
2023~2024学年安徽县中联盟高二12月联考
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:鲁科版选择性必修1第1章~第3章第2节。
5.可能用到的相对原子质量:H1 C12 O16
一、选择题(本大题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1.下列变化中的能量改变方式与其他三项不同的是
A.钠与水反应 B.煤气燃烧
C.氧化钙溶于水 D.碳酸钙受热分解
2.下列化学用语对事实的表述正确的是
A.电解精炼铜阴极的电极反应式:Cu-2e-=Cu2+
B.明矾溶液呈酸性:Al3++3H2OAl(OH)3+3H+
C.钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+
D.Na2CO3溶液能去油污的原理:+2H2OH2CO3+2OH-
3.2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应。已知c[SO3(g)]随时间变化情况如图所示,在0~10min内用O2表示的平均反应速率为0.04mol·L-1·min-1,则a等于
A.0.8 B.1.0 C.0.4 D.0.6
4.一定温度下,向0.1mol/L的CH3COOH溶液中加入CH3COONa晶体或加水稀释时,下列各量保持不变的是
A.溶液的pH B.CH3COOH的电离程度
C.溶液的导电能力 D.
5.已知断裂1mol某些化学键所需的能量如下表所示:
化学键 C-H C-C C=C H-H
断裂1mol化学键所需的能量/kJ/mol 413 347 614 436
下列说法正确的是
A.断裂C-H键所需的能量一定小于断裂H-H键所需的能量
B.由上表数据可以计算出H2的摩尔燃烧焓
C.乙烷脱氢制备乙烯的热化学方程式为C2H6(g)=C2H4(g)+H2(g) △H=+123kJ/mol
D.乙烯加氢制备乙烷只有在高温下才能自发进行
6.可逆反应A(?)+aB(g)C(g)+2D(g)(a为正整数) △H。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
A.T1>T2、p1>p2 B.a不可能大于3
C.该反应的△H>0 D.反应过程中,始终有v(C)=2v(D)
7.某温度下气体反应体系达到化学平衡,其平衡常数K=,恒容时,若温度升高,C的浓度增加。下列说法正确的是
A.其他条件不变,增大压强,平衡左移
B.该反应的热化学方程式为2A(g)+B(g)C(g)+2D(g) △H<0
C.增大c(A)、c(B),K增大
D.平衡时,向体系中再加入C,逆反应速率逐渐增大
8.常温常压下,某烧碱溶液与0.1molNO2(不考虑存在N2O4)恰好完全反应,得到pH=9的NaNO2、NaNO3的混合溶液。设NA代表阿伏加德罗常数的值,下列说法正确的是
A.原烧碱溶液中含Na+的数目为0.1NA
B.NO2的体积为2.24L
C.所得溶液中含OH-的数目为1×10-5NA
D.所得溶液中的数目为0.05NA
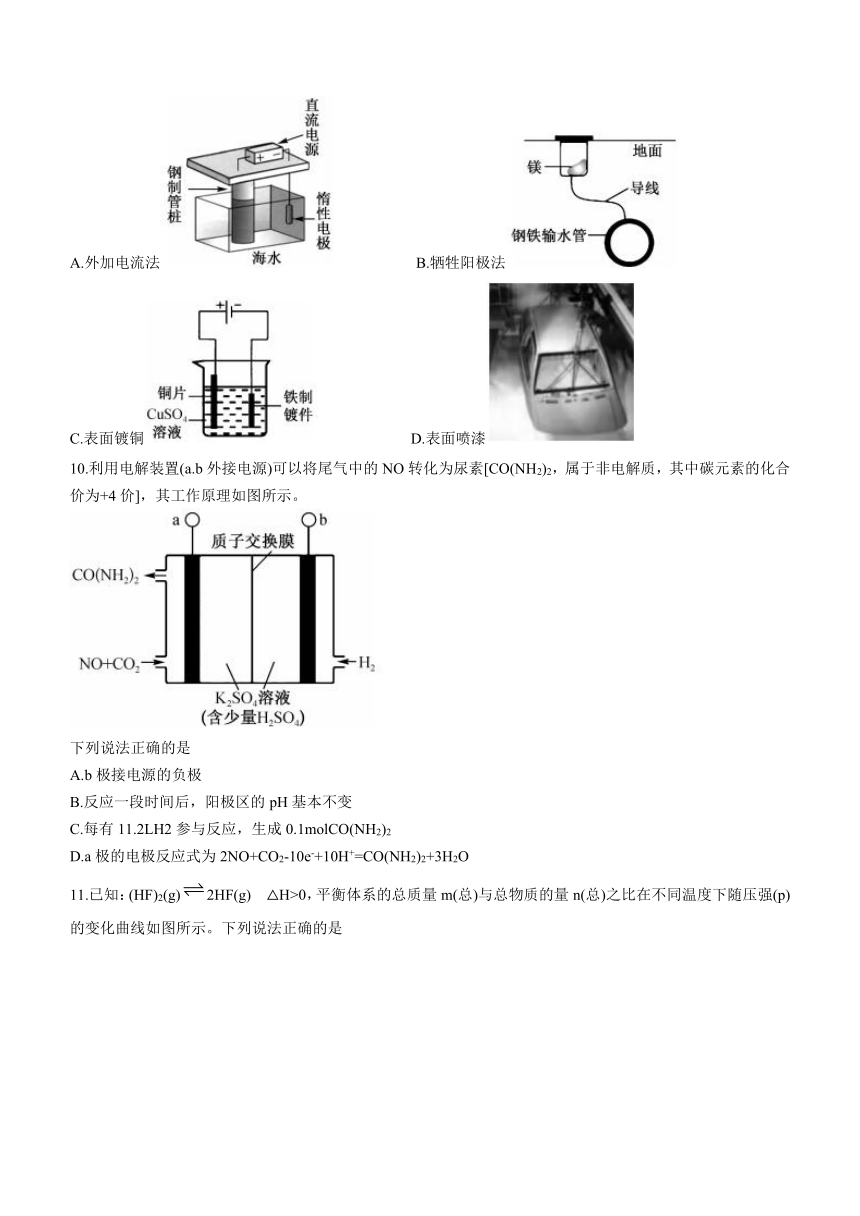
9.下列铁制品防护的装置或方法中错误的是
A.外加电流法 B.牺牲阳极法
C.表面镀铜 D.表面喷漆
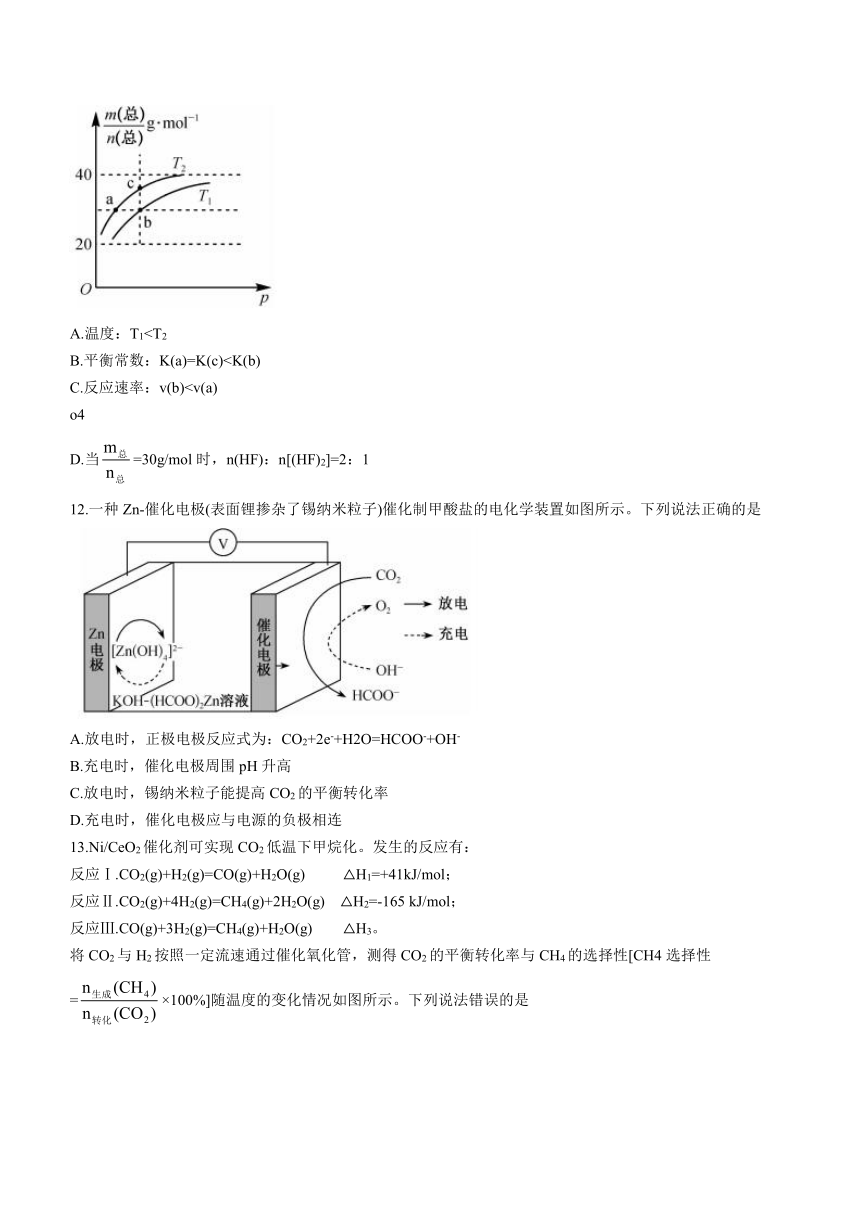
10.利用电解装置(a.b外接电源)可以将尾气中的NO转化为尿素[CO(NH2)2,属于非电解质,其中碳元素的化合价为+4价],其工作原理如图所示。
下列说法正确的是
A.b极接电源的负极
B.反应一段时间后,阳极区的pH基本不变
C.每有11.2LH2参与反应,生成0.1molCO(NH2)2
D.a极的电极反应式为2NO+CO2-10e-+10H+=CO(NH2)2+3H2O
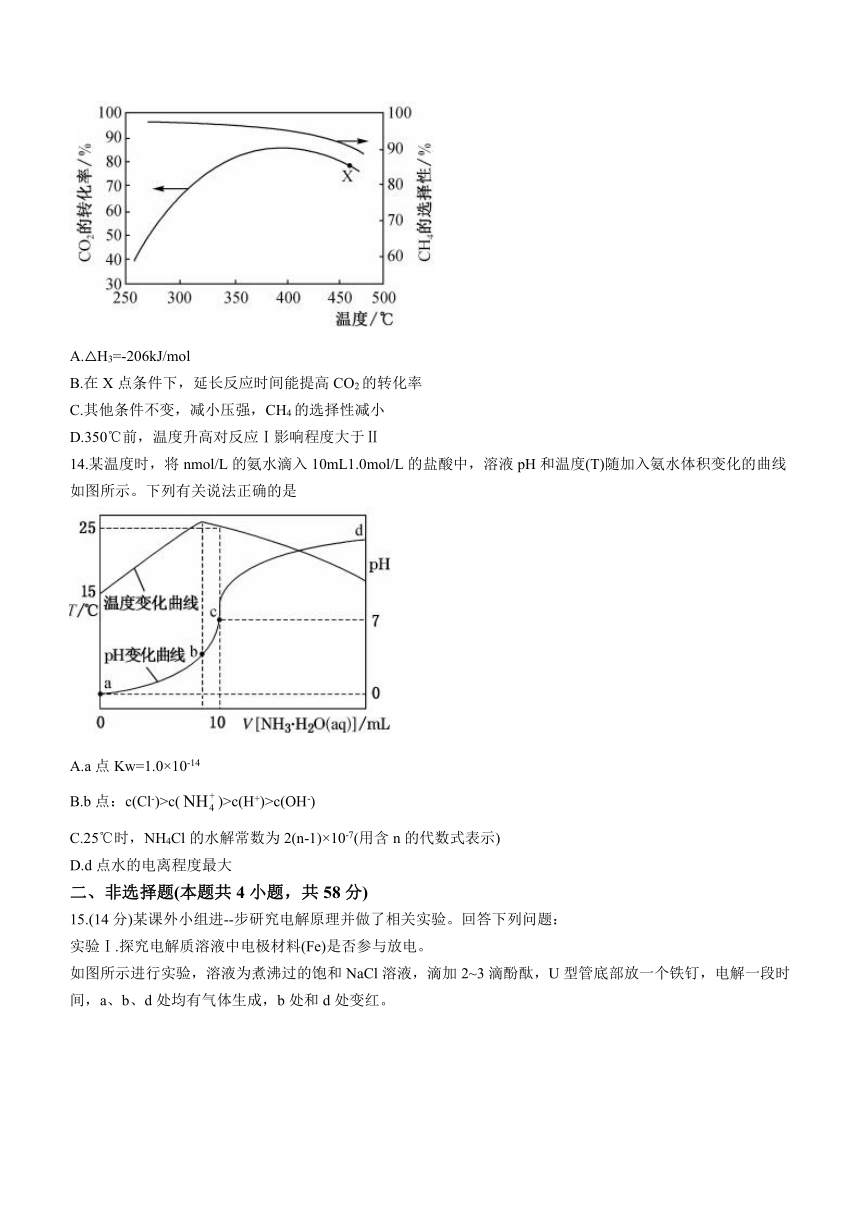
11.已知:(HF)2(g)2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强(p)的变化曲线如图所示。下列说法正确的是
A.温度:T1B.平衡常数:K(a)=K(c)C.反应速率:v(b)o4
D.当=30g/mol时,n(HF):n[(HF)2]=2:1
12.一种Zn-催化电极(表面锂掺杂了锡纳米粒子)催化制甲酸盐的电化学装置如图所示。下列说法正确的是
A.放电时,正极电极反应式为:CO2+2e-+H2O=HCOO-+OH-
B.充电时,催化电极周围pH升高
C.放电时,锡纳米粒子能提高CO2的平衡转化率
D.充电时,催化电极应与电源的负极相连
13.Ni/CeO2催化剂可实现CO2低温下甲烷化。发生的反应有:
反应Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ/mol;
反应Ⅱ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165 kJ/mol;
反应Ⅲ.CO(g)+3H2(g)=CH4(g)+H2O(g) △H3。
将CO2与H2按照一定流速通过催化氧化管,测得CO2的平衡转化率与CH4的选择性[CH4选择性=×100%]随温度的变化情况如图所示。下列说法错误的是
A.△H3=-206kJ/mol
B.在X点条件下,延长反应时间能提高CO2的转化率
C.其他条件不变,减小压强,CH4的选择性减小
D.350℃前,温度升高对反应Ⅰ影响程度大于Ⅱ
14.某温度时,将nmol/L的氨水滴入10mL1.0mol/L的盐酸中,溶液pH和温度(T)随加入氨水体积变化的曲线如图所示。下列有关说法正确的是
A.a点Kw=1.0×10-14
B.b点:c(Cl-)>c()>c(H+)>c(OH-)
C.25℃时,NH4Cl的水解常数为2(n-1)×10-7(用含n的代数式表示)
D.d点水的电离程度最大
二、非选择题(本题共4小题,共58分)
15.(14分)某课外小组进--步研究电解原理并做了相关实验。回答下列问题:
实验Ⅰ.探究电解质溶液中电极材料(Fe)是否参与放电。
如图所示进行实验,溶液为煮沸过的饱和NaCl溶液,滴加2~3滴酚酞,U型管底部放一个铁钉,电解一段时间,a、b、d处均有气体生成,b处和d处变红。
(1)①结合电极反应解释b处酚酞变红的原因:____________。
②写出c处的电极反应式:____________。
实验发现:电解质溶液中的铁钉参与放电。
实验Ⅱ.探究电压对电极反应的影响
某同学使用石墨电极在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,实验记录如下(a、b、c代表电压值,a>c>b):
序号 电压/V 阳极现象 检验阳极产物
ⅰ x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2
ⅱ a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2
ⅲ b>x>0 无明显现象 无Fe3+、无Cl2
(2)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应的方程式:______________。
(3)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_______性(填“氧化”或“还原”)。
(4)ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl2
ⅴ c>x≥2b 无明显现象 无Cl2
①NaCl溶液的浓度是_______mol/L。
②ⅳ中检测Cl2的实验方法:取少量阳极附近的溶液,___________,证明生成氯气。
③与ii相比,可以得出如下结论(写出两点):____________________。
16.(15分)随着研究的深入,科学家们开拓了甲烷在制氢、消除H2S污染等方面的应用。回答下列问题:
(1)在催化剂的作用下,水蒸气将CH4氧化,反应过程中能量与反应过程的关系如图1所示。该反应的热化学方程式为___________。若在恒温恒容条件下,可作为该反应达到平衡状态的判断依据是___________ (填字母)。
A.混合气体密度不变 B.容器内压强不变
C.3v正(CH4)=v逆(H2) D.CH4与H2O(g)的反应速率之比保持不变
(2)CH4消除H2S污染的反应为CH4(g)+2H2S(g)==CS2(g)+4H2(g) △H<0。在恒压条件下,以n(CH4):n(H2S)=1:2组成的混合气体发生反应,达到平衡状态时,四种组分物质的量分数随温度的变化如图2所示。
①图2中表示CH4、CS2变化的曲线分别是________(填“a”“b”“c”或“d”)。
②M点对应温度下,H2S的转化率是__________。
(3)甲烷部分催化氧化制备乙炔和氢气,反应原理为2CH4(g)C2H2(g)+3H2(g) △H=+754.8kJ/mol。
①该反应在________ (填“较高”或“较低”)温度下能自发进行。
②一定温度下,将1molCH4充入10L固定容积的容器中发生上述反应,实验测得反应前容器内压强为p0kPa,容器内各气体分压与时间的关系如图3所示。6~8min时,H2的浓度为______mol/L,反应的平衡常数Kc=______;若8min时改变的条件是缩小容器容积到5L,其中C2H2分压与时间的关系可用图中曲线________(填“L1”“L2”“L3”或“L4”)表示。
17.(15分)SO2、H2S、Na2S等均是重要的含硫化合物。回答下列问题:
(1)Na2S的水溶液呈________(填“酸”“碱”或“中”)性,原因是_________________(用离子方程式表示)。在配制Na2S溶液时,为了防止其发生水解,可以加入少量的________(填化学式)。
(2)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡________ (填“正向”或“逆向”)移动;若要使H2S溶液中c(HS-)增大且使其电离平衡逆向移动,可以加入______(填化学式)固体。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。试计算溶液中c():c()=________(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:
①负极电极反应式为_____________。
②相同条件下,放电过程中消耗的SO2和O2的体积之比为________。
18.(14分)甲醇(CH3OH)是重要的化工原料及能源物质。回答下列问题:
(1)1g液态甲醇(CH3OH)完全燃烧生成CO2和液态水时放热23kJ。则表示甲醇摩尔燃烧焓的热化学方程式为________________。
(2)某温度下在2L恒容密闭容器中加入CH3OH(g)发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g),测得有关数据如下。
反应时间/min 0 1 2 3 4
n(CH3OH)/mol 1.0 0.6 0.4 0.3 0.3
①反应在2min内以CH3OH(g)表示的化学反应速率为_________mol·L-1·min-1。
②该温度下反应的平衡常数为_______ (结果保留两位小数)。
(3)如图是甲醇燃料电池工作示意图,其中A.B.D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①图1甲装置是________ (填“原电池”或“电解池”),通入甲醇这一极的电极反应式为________________。
②该装置刚开始工作时,图1乙装置中总反应的化学方程式为________________________。
③丙装置D电极反应式为_________,溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图2中②线表示的是________ (填离子符号)的变化。
2023~2024学年安徽县中联盟高二12月联考
化学试题参考答案、提示及评分细则
一、选择题:本大题共14小题,每题3分,总共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 D B A D C B D A A B B A B B
1.D
【解析】钠与水反应、煤气燃烧、氧化钙溶于水与水发生反应均放热,碳酸钙受热分解吸热,D项符合题意。
2.B
【解析】电解精炼铜时,在阴极,溶液中的Cu2+得电子生成Cu,阴极反应为Cu2++2e-=Cu,A项错误;
A13+水解生成Al(OH)3,溶液呈酸性,B项正确;Fe失电子生成Fe2+,电极反应式为Fe-2e-=Fe2+,C项错误;Na2CO3在溶液中能发生水解,生成OH-等,其原理为+H2O=+OH-,D项错误。
3.A
【解析】由速率之比等于化学计量数之比可知,v(SO3)=2×0.04mol·L-1·min-1=0.08 mol·L-1·min-1,a=10min×0.08 mol·L-1·min-1=0.8mol/L,A项正确。
4.D【解析】=,Ka仅与温度有关,D项符合题意。
5.C
【解析】由于C-H键与H-H键的物质的量未知,无法确定断裂C-H键所需的能量是否一定小于断裂H-H键所需的能量,A项错误;缺少O-H、O=O键的键能,无法计算H2的摩尔燃烧焓,B项错误;根据(413×6+347-436-4×413-614)kJ/mol=+123 kJ/mol,C项正确;乙烯加氢制乙烷的△H<0,△S<0,根据△G=△H-T△S<0可知,乙烯加氢制备乙烷在低温下可自发进行,D项错误。
6.B
【解析】先拐先平数值大,由图可知:T17.D
【解析】由平衡常数表达式可知,该反应为C(g)+2D(g)2A(g)+B(g),升高温度,C的浓度增加,则△H<0,其他条件不变,增大压强,平衡不移动,A项、B项错误;温度不变,K不变,C项错误;增大反应物的浓度,正反应速率先增大后逐渐减小,逆反应速率逐渐增大,D项正确。
8.A【解析】2NO2+2NaOH=NaNO2+NaNO3+H2O,0.1molNO2和0.1molNaOH恰好反应,所以原烧碱溶液中含Na+的数目为0.1NA,A项正确;常温常压不是标准状况,0.1molNO2体积不是2.24L,B项错误;因为常温常压得到pH=9的混合溶液,所以c(OH-)=10-5mol/L,溶液体积未知,不能计算OH-的数目,C项错误;反应生成0.05molNaNOr,因为亚硝酸根离子水解,所得溶液中的数目小于0.05NA,D项错误。
9.A
【解析】外加电流法,被保护的金属钢制管桩应与电源负极相连,A项错误;镁比铁活泼,此为牺牲阳极法,B项正确;铁上镀铜,铁质镀件接电源负极,铜接电源正极,硫酸铜作电镀液,C项正确;在铁表面喷漆能与空气、水隔开,D项正确。
10.B
【解析】分析图可知:H2失去电子,发生氧化反应,NO得到电子,发生还原反应,a极接电源的负极,b极接电源的正极,A项错误;阳极电极反应式为H2-2e-=2H+,根据闭合回路中电量守恒,同时会有等量的H+通过质子交换膜从阳极区进入阴极区,因此阳极区的pH基本不变,B项正确;未指明11.2LH2是否处于标准状况下,无法判断所生成CO(NH2)2的物质的量,C项错误;a极发生还原反应,其电极反应式为2NO+CO2+10e-+10H+=CO(NH2)2+3H2O,D项错误。
11.B
【解析】当压强相等时,升高温度,平衡向正反应方向移动,气体物质的量增加,减小,根据图像可知,T1>T2,A项错误;a、c均在T2温度下,化学平衡常数只受温度的影响,因此K(a)=K(c),升高温度,平衡向正反应方向移动,根据A选项分析,K(b)>K(c),B项正确;b点温度、压强高于a点温度、压强,温度升高、压强增大,反应速率加快,即v(b)>v(a),C项错误;=30g/mol,即气体平均摩尔质量为30g·mol-1,设HF的物质的量为amol,(HF)2的物质的量为bmol,则有=30,解得a:b=1:1,D项错误。
12.A
【解析】放电时,正极电极反应式为CO2+2e-+H2O=HCOO-+OH-,A项正确;充电时,消耗了OH-,pH降低,B项错误;催化剂不能提高CO2的平衡转化率,C项错误;充电时,催化电极应与电源的正极相连,D项错误。
13.B
【解析】根据盖斯定律可知,反应Ⅲ=Ⅱ-Ⅰ,可得△H3=△H2-△H1=-206kJ/mol,A项正确;由图可知,X点反应已达到平衡状态,延长反应时间,二氧化碳的转化率不变,B项错误;其他条件不变,减小压强,反应Ⅰ平衡不移动,反应Ⅱ、Ⅲ平衡逆向移动,CH4的选择性减小,C项正确;其他条件不变,350℃前,升高温度,CO2转化率增大,CH4选择性略微下降,说明温度升高对反应Ⅰ影响程度大于Ⅱ,D项正确。
14.B
【解析】水的离子积常数与温度有关,温度越低,水的离子积常数越小,a点时溶液温度(15℃)小于25℃,则水的离子积Kw<1.0×10-14,A项错误;b点时为NH4Cl溶液,其pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(),溶液中离子浓度大小为:c(Cl-)>c()>c(H+)>c(OH-),B项正确;根据图像可知,25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7mol/L,c()=c(Cl-)=0.5mol/L,根据元素质量守恒可知:c(NH3·H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl的水解常数为K==(n-1)×10-7,C项错误;b点溶液温度最高,说明此时两溶液恰好反应生成NH4Cl,水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大,D项错误。
二、非选择题:本题共4小题,共58分。
15.【答案】(除标注外,每空2分,共14分)
(1)①b处发生的电极反应为2H2O+2e-=2OH-+H2↑,水电离的氢离子放电,促进水的电离,溶液显碱性,使酚酞变红②Fe-2e-=Fe2+
(2)2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-
(3)还原
(4)①0.2;②滴在淀粉碘化钾试纸上,试纸变蓝;③x≥cV时,Cl-在阳极放电产生Cl2;当电压cV>x≥bV时,Fe2+在阳极放电生成Fe3+
16.【答案】(除标注外,每空2分,共15分)
(1)CH4(g)+H2O(g)CO(g)+3H2(g) △H=+204kJ/mol;BC
(2)①d(1分);b(1分);②20%
(3)①较高(1分);②0.06;0.0012或1.2×10-3;L2
17.【答案】(除标注外,每空2分,共15分)
(1)碱(1分);S2-+H2OHS-+OH-,HS-+H2OH2S+OH-;NaOH
(2)正向(1分);NaHS(或其他合理答案)
(3)正向(1分);60
(4)①SO2+2H2O-2e-=+4H+②2:1
18.【答案】(除标注外,每空2分,共14分)
(1)CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H=-736kJ/mol
(2)①0.15(1分);②1.36
(3)①原电池(1分);CH3OH-6e-+8OH-=+6H2O
②2CuSO4+2H2O2Cu+O2↑+2H2SO4
③Fe3++e-=Fe2+;Fe2+
化学试题
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:鲁科版选择性必修1第1章~第3章第2节。
5.可能用到的相对原子质量:H1 C12 O16
一、选择题(本大题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是符合题目要求的)
1.下列变化中的能量改变方式与其他三项不同的是
A.钠与水反应 B.煤气燃烧
C.氧化钙溶于水 D.碳酸钙受热分解
2.下列化学用语对事实的表述正确的是
A.电解精炼铜阴极的电极反应式:Cu-2e-=Cu2+
B.明矾溶液呈酸性:Al3++3H2OAl(OH)3+3H+
C.钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+
D.Na2CO3溶液能去油污的原理:+2H2OH2CO3+2OH-
3.2SO2(g)+O2(g)2SO3(g)是工业制硫酸的重要反应。已知c[SO3(g)]随时间变化情况如图所示,在0~10min内用O2表示的平均反应速率为0.04mol·L-1·min-1,则a等于
A.0.8 B.1.0 C.0.4 D.0.6
4.一定温度下,向0.1mol/L的CH3COOH溶液中加入CH3COONa晶体或加水稀释时,下列各量保持不变的是
A.溶液的pH B.CH3COOH的电离程度
C.溶液的导电能力 D.
5.已知断裂1mol某些化学键所需的能量如下表所示:
化学键 C-H C-C C=C H-H
断裂1mol化学键所需的能量/kJ/mol 413 347 614 436
下列说法正确的是
A.断裂C-H键所需的能量一定小于断裂H-H键所需的能量
B.由上表数据可以计算出H2的摩尔燃烧焓
C.乙烷脱氢制备乙烯的热化学方程式为C2H6(g)=C2H4(g)+H2(g) △H=+123kJ/mol
D.乙烯加氢制备乙烷只有在高温下才能自发进行
6.可逆反应A(?)+aB(g)C(g)+2D(g)(a为正整数) △H。反应过程中,当其他条件不变时,C的百分含量与温度(T)和压强(p)的关系如图所示。下列说法正确的是
A.T1>T2、p1>p2 B.a不可能大于3
C.该反应的△H>0 D.反应过程中,始终有v(C)=2v(D)
7.某温度下气体反应体系达到化学平衡,其平衡常数K=,恒容时,若温度升高,C的浓度增加。下列说法正确的是
A.其他条件不变,增大压强,平衡左移
B.该反应的热化学方程式为2A(g)+B(g)C(g)+2D(g) △H<0
C.增大c(A)、c(B),K增大
D.平衡时,向体系中再加入C,逆反应速率逐渐增大
8.常温常压下,某烧碱溶液与0.1molNO2(不考虑存在N2O4)恰好完全反应,得到pH=9的NaNO2、NaNO3的混合溶液。设NA代表阿伏加德罗常数的值,下列说法正确的是
A.原烧碱溶液中含Na+的数目为0.1NA
B.NO2的体积为2.24L
C.所得溶液中含OH-的数目为1×10-5NA
D.所得溶液中的数目为0.05NA
9.下列铁制品防护的装置或方法中错误的是
A.外加电流法 B.牺牲阳极法
C.表面镀铜 D.表面喷漆
10.利用电解装置(a.b外接电源)可以将尾气中的NO转化为尿素[CO(NH2)2,属于非电解质,其中碳元素的化合价为+4价],其工作原理如图所示。
下列说法正确的是
A.b极接电源的负极
B.反应一段时间后,阳极区的pH基本不变
C.每有11.2LH2参与反应,生成0.1molCO(NH2)2
D.a极的电极反应式为2NO+CO2-10e-+10H+=CO(NH2)2+3H2O
11.已知:(HF)2(g)2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强(p)的变化曲线如图所示。下列说法正确的是
A.温度:T1
D.当=30g/mol时,n(HF):n[(HF)2]=2:1
12.一种Zn-催化电极(表面锂掺杂了锡纳米粒子)催化制甲酸盐的电化学装置如图所示。下列说法正确的是
A.放电时,正极电极反应式为:CO2+2e-+H2O=HCOO-+OH-
B.充电时,催化电极周围pH升高
C.放电时,锡纳米粒子能提高CO2的平衡转化率
D.充电时,催化电极应与电源的负极相连
13.Ni/CeO2催化剂可实现CO2低温下甲烷化。发生的反应有:
反应Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ/mol;
反应Ⅱ.CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165 kJ/mol;
反应Ⅲ.CO(g)+3H2(g)=CH4(g)+H2O(g) △H3。
将CO2与H2按照一定流速通过催化氧化管,测得CO2的平衡转化率与CH4的选择性[CH4选择性=×100%]随温度的变化情况如图所示。下列说法错误的是
A.△H3=-206kJ/mol
B.在X点条件下,延长反应时间能提高CO2的转化率
C.其他条件不变,减小压强,CH4的选择性减小
D.350℃前,温度升高对反应Ⅰ影响程度大于Ⅱ
14.某温度时,将nmol/L的氨水滴入10mL1.0mol/L的盐酸中,溶液pH和温度(T)随加入氨水体积变化的曲线如图所示。下列有关说法正确的是
A.a点Kw=1.0×10-14
B.b点:c(Cl-)>c()>c(H+)>c(OH-)
C.25℃时,NH4Cl的水解常数为2(n-1)×10-7(用含n的代数式表示)
D.d点水的电离程度最大
二、非选择题(本题共4小题,共58分)
15.(14分)某课外小组进--步研究电解原理并做了相关实验。回答下列问题:
实验Ⅰ.探究电解质溶液中电极材料(Fe)是否参与放电。
如图所示进行实验,溶液为煮沸过的饱和NaCl溶液,滴加2~3滴酚酞,U型管底部放一个铁钉,电解一段时间,a、b、d处均有气体生成,b处和d处变红。
(1)①结合电极反应解释b处酚酞变红的原因:____________。
②写出c处的电极反应式:____________。
实验发现:电解质溶液中的铁钉参与放电。
实验Ⅱ.探究电压对电极反应的影响
某同学使用石墨电极在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,实验记录如下(a、b、c代表电压值,a>c>b):
序号 电压/V 阳极现象 检验阳极产物
ⅰ x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2
ⅱ a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2
ⅲ b>x>0 无明显现象 无Fe3+、无Cl2
(2)ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应的方程式:______________。
(3)由ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_______性(填“氧化”或“还原”)。
(4)ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证,电解pH=1的NaCl溶液做对照实验,记录如下:
序号 电压/V 阳极现象 检验阳极产物
ⅳ a>x≥c 无明显现象 有Cl2
ⅴ c>x≥2b 无明显现象 无Cl2
①NaCl溶液的浓度是_______mol/L。
②ⅳ中检测Cl2的实验方法:取少量阳极附近的溶液,___________,证明生成氯气。
③与ii相比,可以得出如下结论(写出两点):____________________。
16.(15分)随着研究的深入,科学家们开拓了甲烷在制氢、消除H2S污染等方面的应用。回答下列问题:
(1)在催化剂的作用下,水蒸气将CH4氧化,反应过程中能量与反应过程的关系如图1所示。该反应的热化学方程式为___________。若在恒温恒容条件下,可作为该反应达到平衡状态的判断依据是___________ (填字母)。
A.混合气体密度不变 B.容器内压强不变
C.3v正(CH4)=v逆(H2) D.CH4与H2O(g)的反应速率之比保持不变
(2)CH4消除H2S污染的反应为CH4(g)+2H2S(g)==CS2(g)+4H2(g) △H<0。在恒压条件下,以n(CH4):n(H2S)=1:2组成的混合气体发生反应,达到平衡状态时,四种组分物质的量分数随温度的变化如图2所示。
①图2中表示CH4、CS2变化的曲线分别是________(填“a”“b”“c”或“d”)。
②M点对应温度下,H2S的转化率是__________。
(3)甲烷部分催化氧化制备乙炔和氢气,反应原理为2CH4(g)C2H2(g)+3H2(g) △H=+754.8kJ/mol。
①该反应在________ (填“较高”或“较低”)温度下能自发进行。
②一定温度下,将1molCH4充入10L固定容积的容器中发生上述反应,实验测得反应前容器内压强为p0kPa,容器内各气体分压与时间的关系如图3所示。6~8min时,H2的浓度为______mol/L,反应的平衡常数Kc=______;若8min时改变的条件是缩小容器容积到5L,其中C2H2分压与时间的关系可用图中曲线________(填“L1”“L2”“L3”或“L4”)表示。
17.(15分)SO2、H2S、Na2S等均是重要的含硫化合物。回答下列问题:
(1)Na2S的水溶液呈________(填“酸”“碱”或“中”)性,原因是_________________(用离子方程式表示)。在配制Na2S溶液时,为了防止其发生水解,可以加入少量的________(填化学式)。
(2)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡________ (填“正向”或“逆向”)移动;若要使H2S溶液中c(HS-)增大且使其电离平衡逆向移动,可以加入______(填化学式)固体。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡________(填“正向”“逆向”或“不”)移动。试计算溶液中c():c()=________(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:
①负极电极反应式为_____________。
②相同条件下,放电过程中消耗的SO2和O2的体积之比为________。
18.(14分)甲醇(CH3OH)是重要的化工原料及能源物质。回答下列问题:
(1)1g液态甲醇(CH3OH)完全燃烧生成CO2和液态水时放热23kJ。则表示甲醇摩尔燃烧焓的热化学方程式为________________。
(2)某温度下在2L恒容密闭容器中加入CH3OH(g)发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g),测得有关数据如下。
反应时间/min 0 1 2 3 4
n(CH3OH)/mol 1.0 0.6 0.4 0.3 0.3
①反应在2min内以CH3OH(g)表示的化学反应速率为_________mol·L-1·min-1。
②该温度下反应的平衡常数为_______ (结果保留两位小数)。
(3)如图是甲醇燃料电池工作示意图,其中A.B.D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
①图1甲装置是________ (填“原电池”或“电解池”),通入甲醇这一极的电极反应式为________________。
②该装置刚开始工作时,图1乙装置中总反应的化学方程式为________________________。
③丙装置D电极反应式为_________,溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图2中②线表示的是________ (填离子符号)的变化。
2023~2024学年安徽县中联盟高二12月联考
化学试题参考答案、提示及评分细则
一、选择题:本大题共14小题,每题3分,总共42分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
选项 D B A D C B D A A B B A B B
1.D
【解析】钠与水反应、煤气燃烧、氧化钙溶于水与水发生反应均放热,碳酸钙受热分解吸热,D项符合题意。
2.B
【解析】电解精炼铜时,在阴极,溶液中的Cu2+得电子生成Cu,阴极反应为Cu2++2e-=Cu,A项错误;
A13+水解生成Al(OH)3,溶液呈酸性,B项正确;Fe失电子生成Fe2+,电极反应式为Fe-2e-=Fe2+,C项错误;Na2CO3在溶液中能发生水解,生成OH-等,其原理为+H2O=+OH-,D项错误。
3.A
【解析】由速率之比等于化学计量数之比可知,v(SO3)=2×0.04mol·L-1·min-1=0.08 mol·L-1·min-1,a=10min×0.08 mol·L-1·min-1=0.8mol/L,A项正确。
4.D【解析】=,Ka仅与温度有关,D项符合题意。
5.C
【解析】由于C-H键与H-H键的物质的量未知,无法确定断裂C-H键所需的能量是否一定小于断裂H-H键所需的能量,A项错误;缺少O-H、O=O键的键能,无法计算H2的摩尔燃烧焓,B项错误;根据(413×6+347-436-4×413-614)kJ/mol=+123 kJ/mol,C项正确;乙烯加氢制乙烷的△H<0,△S<0,根据△G=△H-T△S<0可知,乙烯加氢制备乙烷在低温下可自发进行,D项错误。
6.B
【解析】先拐先平数值大,由图可知:T1
【解析】由平衡常数表达式可知,该反应为C(g)+2D(g)2A(g)+B(g),升高温度,C的浓度增加,则△H<0,其他条件不变,增大压强,平衡不移动,A项、B项错误;温度不变,K不变,C项错误;增大反应物的浓度,正反应速率先增大后逐渐减小,逆反应速率逐渐增大,D项正确。
8.A【解析】2NO2+2NaOH=NaNO2+NaNO3+H2O,0.1molNO2和0.1molNaOH恰好反应,所以原烧碱溶液中含Na+的数目为0.1NA,A项正确;常温常压不是标准状况,0.1molNO2体积不是2.24L,B项错误;因为常温常压得到pH=9的混合溶液,所以c(OH-)=10-5mol/L,溶液体积未知,不能计算OH-的数目,C项错误;反应生成0.05molNaNOr,因为亚硝酸根离子水解,所得溶液中的数目小于0.05NA,D项错误。
9.A
【解析】外加电流法,被保护的金属钢制管桩应与电源负极相连,A项错误;镁比铁活泼,此为牺牲阳极法,B项正确;铁上镀铜,铁质镀件接电源负极,铜接电源正极,硫酸铜作电镀液,C项正确;在铁表面喷漆能与空气、水隔开,D项正确。
10.B
【解析】分析图可知:H2失去电子,发生氧化反应,NO得到电子,发生还原反应,a极接电源的负极,b极接电源的正极,A项错误;阳极电极反应式为H2-2e-=2H+,根据闭合回路中电量守恒,同时会有等量的H+通过质子交换膜从阳极区进入阴极区,因此阳极区的pH基本不变,B项正确;未指明11.2LH2是否处于标准状况下,无法判断所生成CO(NH2)2的物质的量,C项错误;a极发生还原反应,其电极反应式为2NO+CO2+10e-+10H+=CO(NH2)2+3H2O,D项错误。
11.B
【解析】当压强相等时,升高温度,平衡向正反应方向移动,气体物质的量增加,减小,根据图像可知,T1>T2,A项错误;a、c均在T2温度下,化学平衡常数只受温度的影响,因此K(a)=K(c),升高温度,平衡向正反应方向移动,根据A选项分析,K(b)>K(c),B项正确;b点温度、压强高于a点温度、压强,温度升高、压强增大,反应速率加快,即v(b)>v(a),C项错误;=30g/mol,即气体平均摩尔质量为30g·mol-1,设HF的物质的量为amol,(HF)2的物质的量为bmol,则有=30,解得a:b=1:1,D项错误。
12.A
【解析】放电时,正极电极反应式为CO2+2e-+H2O=HCOO-+OH-,A项正确;充电时,消耗了OH-,pH降低,B项错误;催化剂不能提高CO2的平衡转化率,C项错误;充电时,催化电极应与电源的正极相连,D项错误。
13.B
【解析】根据盖斯定律可知,反应Ⅲ=Ⅱ-Ⅰ,可得△H3=△H2-△H1=-206kJ/mol,A项正确;由图可知,X点反应已达到平衡状态,延长反应时间,二氧化碳的转化率不变,B项错误;其他条件不变,减小压强,反应Ⅰ平衡不移动,反应Ⅱ、Ⅲ平衡逆向移动,CH4的选择性减小,C项正确;其他条件不变,350℃前,升高温度,CO2转化率增大,CH4选择性略微下降,说明温度升高对反应Ⅰ影响程度大于Ⅱ,D项正确。
14.B
【解析】水的离子积常数与温度有关,温度越低,水的离子积常数越小,a点时溶液温度(15℃)小于25℃,则水的离子积Kw<1.0×10-14,A项错误;b点时为NH4Cl溶液,其pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(),溶液中离子浓度大小为:c(Cl-)>c()>c(H+)>c(OH-),B项正确;根据图像可知,25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7mol/L,c()=c(Cl-)=0.5mol/L,根据元素质量守恒可知:c(NH3·H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl的水解常数为K==(n-1)×10-7,C项错误;b点溶液温度最高,说明此时两溶液恰好反应生成NH4Cl,水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大,D项错误。
二、非选择题:本题共4小题,共58分。
15.【答案】(除标注外,每空2分,共14分)
(1)①b处发生的电极反应为2H2O+2e-=2OH-+H2↑,水电离的氢离子放电,促进水的电离,溶液显碱性,使酚酞变红②Fe-2e-=Fe2+
(2)2Cl--2e-=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl-
(3)还原
(4)①0.2;②滴在淀粉碘化钾试纸上,试纸变蓝;③x≥cV时,Cl-在阳极放电产生Cl2;当电压cV>x≥bV时,Fe2+在阳极放电生成Fe3+
16.【答案】(除标注外,每空2分,共15分)
(1)CH4(g)+H2O(g)CO(g)+3H2(g) △H=+204kJ/mol;BC
(2)①d(1分);b(1分);②20%
(3)①较高(1分);②0.06;0.0012或1.2×10-3;L2
17.【答案】(除标注外,每空2分,共15分)
(1)碱(1分);S2-+H2OHS-+OH-,HS-+H2OH2S+OH-;NaOH
(2)正向(1分);NaHS(或其他合理答案)
(3)正向(1分);60
(4)①SO2+2H2O-2e-=+4H+②2:1
18.【答案】(除标注外,每空2分,共14分)
(1)CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H=-736kJ/mol
(2)①0.15(1分);②1.36
(3)①原电池(1分);CH3OH-6e-+8OH-=+6H2O
②2CuSO4+2H2O2Cu+O2↑+2H2SO4
③Fe3++e-=Fe2+;Fe2+
同课章节目录
