湖南省怀化市第一中学2023-2024学年高一上学期12月月考化学试题(含答案)
文档属性
| 名称 | 湖南省怀化市第一中学2023-2024学年高一上学期12月月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 298.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-25 10:11:21 | ||
图片预览

文档简介
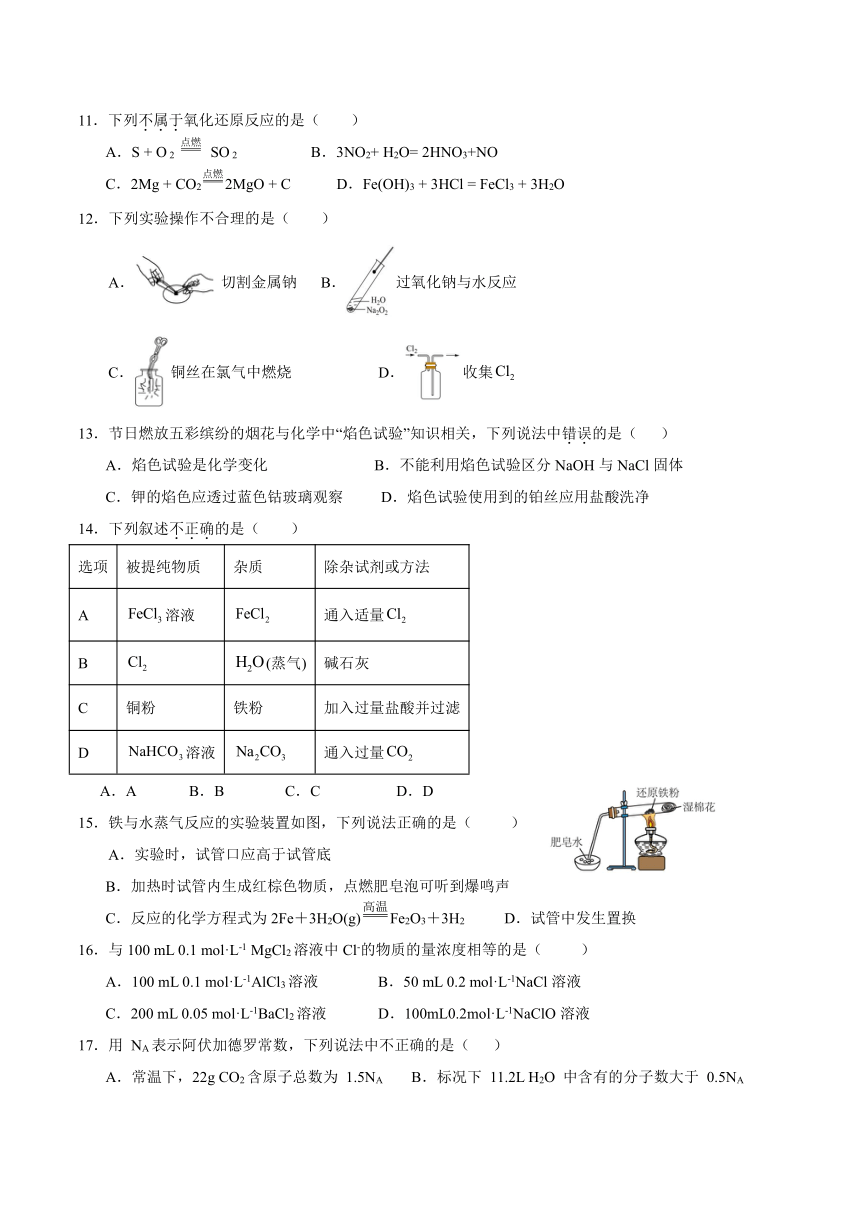
怀化市第一中学高一化学12月月考化学试题卷
相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 Fe-56
一、选择题(每小题只有一个正确答案,每小题3分,共54分)
1.下列物质的俗称与化学式对应不正确的是( )
A.苏打— B.软锰矿主要成分— C.磁性氧化铁— D.纯碱—
2.某仓库中金属钠着火,可以用于灭火的是( )
A.煤油 B.湿泥沙 C.泡沫灭火器 D.干石粉
3.下列物质属于盐的是( )
A. B.酒精 C. D.
4.下列分散系中,能产生“丁达尔效应”的是( )
A.食盐水 B.烟 C.石灰乳 D.硫酸铜溶液
5.下列转化不能通过化合反应一步实现的是( )
A. B. C. D.
6.下列变化过程中,加入氧化剂才能实现的是( )
A. B. C. D.
7.下列有关物质用途的说法中,不正确的是( )
A.Cl2用于自来水消毒 B.Fe3O4用作红色油漆和涂料
C.用铝罐车运送浓硫酸 D.Na2O2可用作供氧剂
8.下列电离方程式正确的是( )
A. B.
C. D.
9.下列溶液中,能大量共存的离子组是( )
A.遇酚酞试剂变红的溶液:K+、Mg2+、NO、SO
B.遇紫色石蕊试剂变红的溶液:K+、Na+、CO、Cl
C.常温下酸性溶液:Ba2+、NH、NO、Cl
D.无色透明溶液中:K+、Na+、MnO、SO
10.下列离子方程式书写错误的是( )
A.溶液中通入
B.溶液与盐酸的反应:
C.钠与水的反应:
D.大理石中加入盐酸:
11.下列不属于氧化还原反应的是( )
A.S + O 2 SO 2 B.3NO2+ H2O= 2HNO3+NO
C.2Mg + CO22MgO + C D.Fe(OH)3 + 3HCl = FeCl3 + 3H2O
下列实验操作不合理的是( )
A.切割金属钠 B.过氧化钠与水反应
C.铜丝在氯气中燃烧 D.收集
13.节日燃放五彩缤纷的烟花与化学中“焰色试验”知识相关,下列说法中错误的是( )
A.焰色试验是化学变化 B.不能利用焰色试验区分NaOH与NaCl固体
C.钾的焰色应透过蓝色钴玻璃观察 D.焰色试验使用到的铂丝应用盐酸洗净
14.下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A 溶液 通入适量
B (蒸气) 碱石灰
C 铜粉 铁粉 加入过量盐酸并过滤
D 溶液 通入过量
A.A B.B C.C D.D
15.铁与水蒸气反应的实验装置如图,下列说法正确的是( )
A.实验时,试管口应高于试管底
B.加热时试管内生成红棕色物质,点燃肥皂泡可听到爆鸣声
C.反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D.试管中发生置换
16.与100 mL 0.1 mol·L-1 MgCl2溶液中Cl-的物质的量浓度相等的是( )
A.100 mL 0.1 mol·L-1AlCl3溶液 B.50 mL 0.2 mol·L-1NaCl溶液
C.200 mL 0.05 mol·L-1BaCl2溶液 D.100mL0.2mol·L-1NaClO溶液
17.用 NA表示阿伏加德罗常数,下列说法中不正确的是( )
A.常温下,22g CO2含原子总数为 1.5NA B.标况下 11.2L H2O 中含有的分子数大于 0.5NA
C.1mol Na2O2固体中含离子总数为 4NA
D.1mol Na 与足量氧气反应生成 Na2O 和 Na2O2的混合物,钠失去 NA个电子
18.次氯酸钠具有强氧化性,强碱性溶液中可将Fe3+氧化为一种常见的高效水处理剂,离子方程式为2Fe(OH)3+3ClO +4OH =2FeO+3Cl +5H2O。下列说法中错误的是( )
A.还原性:Fe(OH)3>Cl B.由反应可知每2molFe(OH)3完全反应时,反应中转移6mol电子
C.Na2FeO4能杀菌消毒,是由于它有强氧化性 D.反应中氧化剂与还原剂的物质的量之比为2:3
二、非选择题(每空2分,共46分)
19.(12分)请按要求回答下列问题:
(1)按照物质的分类方法,应属于 (填序号)。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质
写出在水中的电离方程式 。
铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是 (填字母)。A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中 是还原剂
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是 。
④含硫酸亚铁的药片可治疗缺铁性贫血,可用 溶液检验该硫酸亚铁药片是否变质。
(10分)某化学实验室需要硫酸溶液。根据溶液的配制情况回答下列问题:
如图所示的仪器中配制溶液需要用到的是 (填序号),
(2)现用质量分数为98%、密度为的浓硫酸来配制、的稀硫酸。计算所需浓硫酸的体积为 (保留1位小数),现有① ② ③ ④四种规格的量筒,你选用的量筒是 (填代号)。
(3)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为:②→①→③→ → → → →④(填序号)。
(4)在配制过程中,下列操作能引起误差偏低的有 。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水 ④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线 ⑥定容时,俯视刻度线
21.(12分)黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】研究黑木耳中含铁物质的水溶性:称取a g黑木耳,洗净切碎,用蒸水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】研究黑木耳中铁的含量:称取a g黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
回答下列问题:(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质 溶于水(选填“能”或“不能”)。
(2)取少量滤液,滴入KSCN溶液,溶液变红。则滤液中铁元素存在形式有、 (填离子符号)。
(3)滤液与Fe生成A的离子方程式是 。
(4)由A转化为B可加入的试剂X可以是 (填字母) a.() b. c.
(5)由C转化成D的现象是:白色沉淀迅速变为灰绿色,最终变为 。
(6)将a g黑木耳中的铁元素经流程A→C-D进行完全转化,将D经过一系列处理,得到b g红棕色固体。若流程中加入的铁反应掉c g,则该黑木耳中铁元素的质量分数为 (用含a、b、c的代数式表示)。
22.(12分)氯化铁是一种常见水处理剂,实验室通过下列装置制取少量氯化铁:
已知:①氯化铁的熔点306℃、沸点316℃,
②氯化铁易升华,易吸收空气里的水分而变质。
③氯化铁的摩尔质量为。
仪器G的名称是 ,
C中装入的试剂是 。
(2)A中发生的化学方程式是 。装置F的作用是
(3)实验时,先点燃 处(填“A”或“D”)的酒精灯。
(4)有同学提出改进意见:B处增加长颈漏斗,下端插入液面下(如图)。
该改进意见主要考虑实验安全,则该改进的作用是 。试卷第1页,共3页
怀化市第一中学高一化学12月月考化学试题卷参考答案
一、选择题(54分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D A B D B B A C D
题号 11 12 13 14 15 16 17 18
答案 D D A B D B C D
二.非选择题(46分)
19.(12分)(1) ②④⑤⑥ (2)
(3) ① B ②维生素C ③ Fe+2H+=Fe2++H2↑ ④ KSCN
20.(10分)(1)
(2) 13.6 ②(1分)
(3) ⑧⑤ ⑥⑦ (4) ④ ⑤
21.(12分)(1) 难 (2) Fe3+ (3) 2Fe3++Fe=3 Fe2+
(4) bc (5) 红褐色 (6)
22.(12分)(1) (球形)干燥管(1分) 浓硫酸或浓
(2) (浓) 吸收过量的
(3)A (4) 通过观察长颈漏斗液面变化,分析DE处是否发生堵塞
答案第1页,共2页
相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 Fe-56
一、选择题(每小题只有一个正确答案,每小题3分,共54分)
1.下列物质的俗称与化学式对应不正确的是( )
A.苏打— B.软锰矿主要成分— C.磁性氧化铁— D.纯碱—
2.某仓库中金属钠着火,可以用于灭火的是( )
A.煤油 B.湿泥沙 C.泡沫灭火器 D.干石粉
3.下列物质属于盐的是( )
A. B.酒精 C. D.
4.下列分散系中,能产生“丁达尔效应”的是( )
A.食盐水 B.烟 C.石灰乳 D.硫酸铜溶液
5.下列转化不能通过化合反应一步实现的是( )
A. B. C. D.
6.下列变化过程中,加入氧化剂才能实现的是( )
A. B. C. D.
7.下列有关物质用途的说法中,不正确的是( )
A.Cl2用于自来水消毒 B.Fe3O4用作红色油漆和涂料
C.用铝罐车运送浓硫酸 D.Na2O2可用作供氧剂
8.下列电离方程式正确的是( )
A. B.
C. D.
9.下列溶液中,能大量共存的离子组是( )
A.遇酚酞试剂变红的溶液:K+、Mg2+、NO、SO
B.遇紫色石蕊试剂变红的溶液:K+、Na+、CO、Cl
C.常温下酸性溶液:Ba2+、NH、NO、Cl
D.无色透明溶液中:K+、Na+、MnO、SO
10.下列离子方程式书写错误的是( )
A.溶液中通入
B.溶液与盐酸的反应:
C.钠与水的反应:
D.大理石中加入盐酸:
11.下列不属于氧化还原反应的是( )
A.S + O 2 SO 2 B.3NO2+ H2O= 2HNO3+NO
C.2Mg + CO22MgO + C D.Fe(OH)3 + 3HCl = FeCl3 + 3H2O
下列实验操作不合理的是( )
A.切割金属钠 B.过氧化钠与水反应
C.铜丝在氯气中燃烧 D.收集
13.节日燃放五彩缤纷的烟花与化学中“焰色试验”知识相关,下列说法中错误的是( )
A.焰色试验是化学变化 B.不能利用焰色试验区分NaOH与NaCl固体
C.钾的焰色应透过蓝色钴玻璃观察 D.焰色试验使用到的铂丝应用盐酸洗净
14.下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A 溶液 通入适量
B (蒸气) 碱石灰
C 铜粉 铁粉 加入过量盐酸并过滤
D 溶液 通入过量
A.A B.B C.C D.D
15.铁与水蒸气反应的实验装置如图,下列说法正确的是( )
A.实验时,试管口应高于试管底
B.加热时试管内生成红棕色物质,点燃肥皂泡可听到爆鸣声
C.反应的化学方程式为2Fe+3H2O(g)Fe2O3+3H2 D.试管中发生置换
16.与100 mL 0.1 mol·L-1 MgCl2溶液中Cl-的物质的量浓度相等的是( )
A.100 mL 0.1 mol·L-1AlCl3溶液 B.50 mL 0.2 mol·L-1NaCl溶液
C.200 mL 0.05 mol·L-1BaCl2溶液 D.100mL0.2mol·L-1NaClO溶液
17.用 NA表示阿伏加德罗常数,下列说法中不正确的是( )
A.常温下,22g CO2含原子总数为 1.5NA B.标况下 11.2L H2O 中含有的分子数大于 0.5NA
C.1mol Na2O2固体中含离子总数为 4NA
D.1mol Na 与足量氧气反应生成 Na2O 和 Na2O2的混合物,钠失去 NA个电子
18.次氯酸钠具有强氧化性,强碱性溶液中可将Fe3+氧化为一种常见的高效水处理剂,离子方程式为2Fe(OH)3+3ClO +4OH =2FeO+3Cl +5H2O。下列说法中错误的是( )
A.还原性:Fe(OH)3>Cl B.由反应可知每2molFe(OH)3完全反应时,反应中转移6mol电子
C.Na2FeO4能杀菌消毒,是由于它有强氧化性 D.反应中氧化剂与还原剂的物质的量之比为2:3
二、非选择题(每空2分,共46分)
19.(12分)请按要求回答下列问题:
(1)按照物质的分类方法,应属于 (填序号)。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质
写出在水中的电离方程式 。
铁元素是人体内一种微量元素,主要以Fe2+的形式存在。请回答下列问题:
①下列微粒中,既有氧化性又有还原性的是 (填字母)。A.Fe B.Fe2+ C.Fe3+
②维生素C可使食物中的Fe3+转化为Fe2+,在此过程中 是还原剂
③某种麦片中含有微量的细小铁粉,食用该麦片后,铁粉与胃酸反应的离子方程式是 。
④含硫酸亚铁的药片可治疗缺铁性贫血,可用 溶液检验该硫酸亚铁药片是否变质。
(10分)某化学实验室需要硫酸溶液。根据溶液的配制情况回答下列问题:
如图所示的仪器中配制溶液需要用到的是 (填序号),
(2)现用质量分数为98%、密度为的浓硫酸来配制、的稀硫酸。计算所需浓硫酸的体积为 (保留1位小数),现有① ② ③ ④四种规格的量筒,你选用的量筒是 (填代号)。
(3)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为:②→①→③→ → → → →④(填序号)。
(4)在配制过程中,下列操作能引起误差偏低的有 。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水 ④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线 ⑥定容时,俯视刻度线
21.(12分)黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】研究黑木耳中含铁物质的水溶性:称取a g黑木耳,洗净切碎,用蒸水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】研究黑木耳中铁的含量:称取a g黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
回答下列问题:(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质 溶于水(选填“能”或“不能”)。
(2)取少量滤液,滴入KSCN溶液,溶液变红。则滤液中铁元素存在形式有、 (填离子符号)。
(3)滤液与Fe生成A的离子方程式是 。
(4)由A转化为B可加入的试剂X可以是 (填字母) a.() b. c.
(5)由C转化成D的现象是:白色沉淀迅速变为灰绿色,最终变为 。
(6)将a g黑木耳中的铁元素经流程A→C-D进行完全转化,将D经过一系列处理,得到b g红棕色固体。若流程中加入的铁反应掉c g,则该黑木耳中铁元素的质量分数为 (用含a、b、c的代数式表示)。
22.(12分)氯化铁是一种常见水处理剂,实验室通过下列装置制取少量氯化铁:
已知:①氯化铁的熔点306℃、沸点316℃,
②氯化铁易升华,易吸收空气里的水分而变质。
③氯化铁的摩尔质量为。
仪器G的名称是 ,
C中装入的试剂是 。
(2)A中发生的化学方程式是 。装置F的作用是
(3)实验时,先点燃 处(填“A”或“D”)的酒精灯。
(4)有同学提出改进意见:B处增加长颈漏斗,下端插入液面下(如图)。
该改进意见主要考虑实验安全,则该改进的作用是 。试卷第1页,共3页
怀化市第一中学高一化学12月月考化学试题卷参考答案
一、选择题(54分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A D A B D B B A C D
题号 11 12 13 14 15 16 17 18
答案 D D A B D B C D
二.非选择题(46分)
19.(12分)(1) ②④⑤⑥ (2)
(3) ① B ②维生素C ③ Fe+2H+=Fe2++H2↑ ④ KSCN
20.(10分)(1)
(2) 13.6 ②(1分)
(3) ⑧⑤ ⑥⑦ (4) ④ ⑤
21.(12分)(1) 难 (2) Fe3+ (3) 2Fe3++Fe=3 Fe2+
(4) bc (5) 红褐色 (6)
22.(12分)(1) (球形)干燥管(1分) 浓硫酸或浓
(2) (浓) 吸收过量的
(3)A (4) 通过观察长颈漏斗液面变化,分析DE处是否发生堵塞
答案第1页,共2页
同课章节目录
