科粤版化学九年级下册 7.4结晶现象同步练习 (含答案)
文档属性
| 名称 | 科粤版化学九年级下册 7.4结晶现象同步练习 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 774.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 12:19:46 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
7.4结晶现象
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.如下图是甲、乙丙三种物质的溶解度曲线,下列叙述正确的是
A.t2℃时,甲、丙两种溶液的溶质质量分数相等
B.将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质质量分数都变大
C.t3℃时,组成为N点的甲溶液可通过增加溶质变为M点的溶液
D.将t3℃时的甲、乙饱和溶液降温到t2℃,甲析出晶体的质量一定大于乙
2.NaCl 和 KNO3 在不同温度时的溶解度如下表。下列说法正确的是
温度/C 0 20 40 60
NaCI的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100 g氯化钠溶液中最多能溶解36.0g NaCl
B.40℃时,KNO3饱和溶液的溶质质量分数等于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
3.下列关于过滤操作的叙述不正确的是
A.滤纸的边缘要低于漏斗口 B.玻璃棒的作用是搅拌
C.玻璃棒要靠在三层滤纸的一边 D.漏斗下端的管口要紧靠烧杯内壁
4.下列操作正确的是
A. B. C. D.
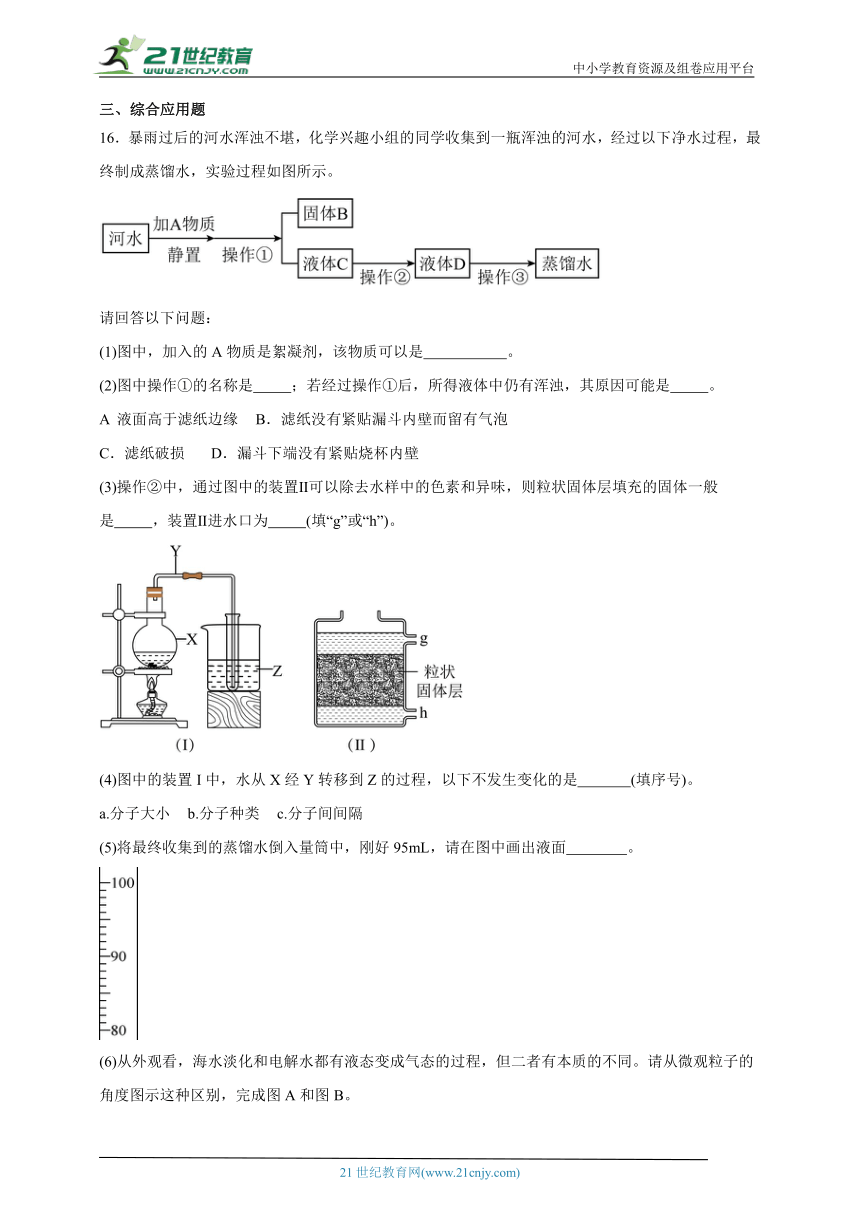
5.甲、乙、丙三种固体物质的溶解度曲线如图所示,从图中获取的信息正确的是
A.t2℃时,将甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系为甲>乙=丙
B.升温可以使丙的饱和溶液变为不饱和溶液
C.t1℃时,甲、乙、丙三种溶液所含溶质的质量可能相同
D.t2℃时,将100g甲的饱和溶液降温到t1℃,可析出15g甲固体
6.如图是A、B、C三种物质的溶解度曲线,下列分析不正确的是( )
A.50℃时三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:3
C.将C的饱和溶液变为不饱和溶液,可采用降温的方法
D.将50℃时三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
7.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是
A.甲物质的溶解度比乙物质的溶解度大
B.甲物质溶液从t2℃降到t1℃,一定有晶体析出
C.t1℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.若甲物质中混有少量乙物质,可用蒸发结晶的方法提纯甲
8.下列是小军同学设计的实验方案,不能达到目的的是
选项 实验目的 实验方案
A 鉴别O2、CO2、H2 将燃着的木条分别伸入瓶中,观察现象
B 检验甲烷中的碳元素 点燃甲烷,在火焰上方罩一个干冷烧杯
C 除去CO中的CO2 将气体通过灼热的炭粉
D 分离食盐水和泥沙 过滤
A.A B.B C.C D.D
9.将5℃恰好饱和的氢氧化钙溶液,升温至38℃(忽略水的蒸发),不可能出现的情况是
A.溶液变浑浊 B.溶液变为不饱和
C.溶质质量分数变小 D.溶质质变小
10.泰山豆腐制作历史源远流长,乾隆年间修订的《泰安县志》曾这样记载:“凌晨街街梆子响,晚间户户豆腐香,泰城家家豆腐坊。”下列豆腐制作的流程中,属于过滤操作的是
A.磨豆浆 B.渗滤除渣 C.煮豆浆 D.压制成型
二、判断题
11.不饱和溶液变成饱和溶液后溶剂质量一定减少( )
12.通过过滤的方法可除去水中难溶性杂质( )
13.过滤中玻璃棒的作用是引流( )
14.过滤能除去天然水中的所有杂质( )
15.若除去食盐水中的泥沙,可采用过滤的方法( )
三、综合应用题
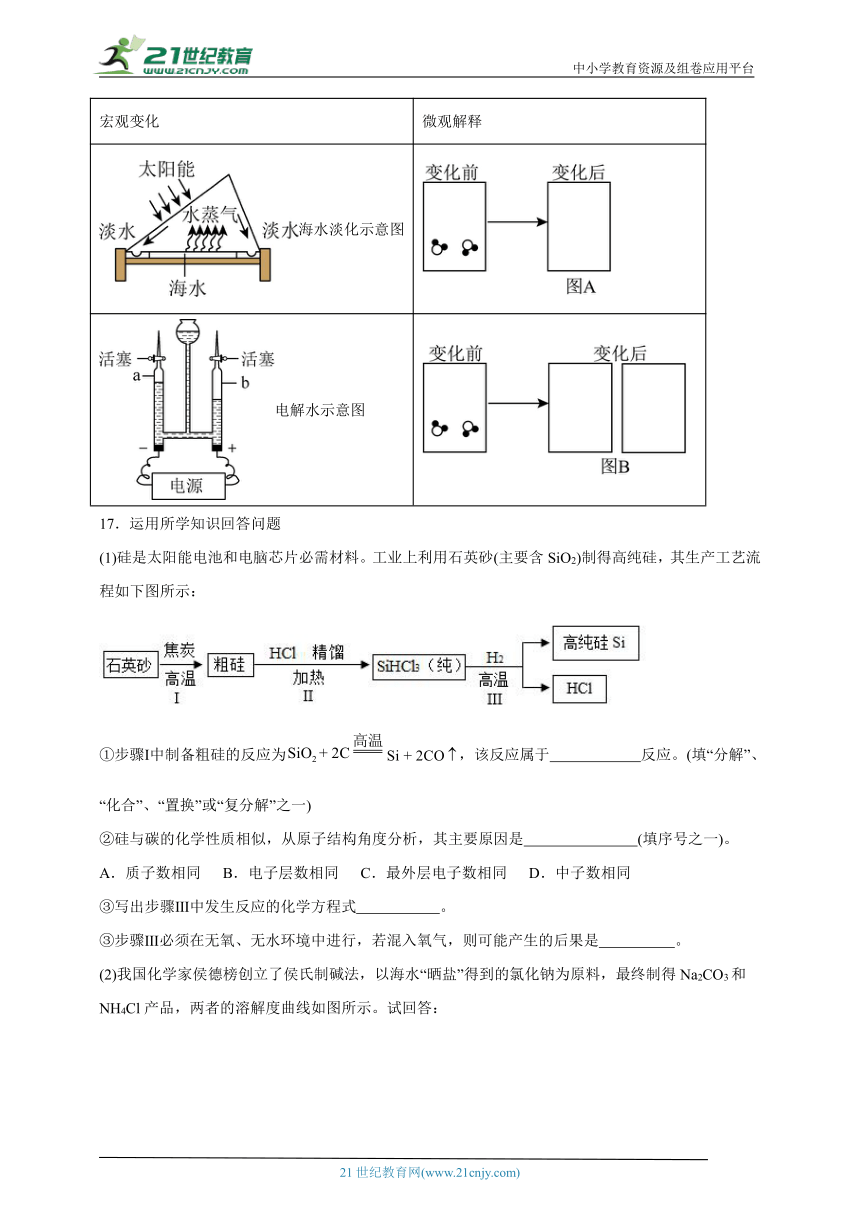
16.暴雨过后的河水浑浊不堪,化学兴趣小组的同学收集到一瓶浑浊的河水,经过以下净水过程,最终制成蒸馏水,实验过程如图所示。
请回答以下问题:
(1)图中,加入的A物质是絮凝剂,该物质可以是 。
(2)图中操作①的名称是 ;若经过操作①后,所得液体中仍有浑浊,其原因可能是 。
A 液面高于滤纸边缘 B.滤纸没有紧贴漏斗内壁而留有气泡
C.滤纸破损 D.漏斗下端没有紧贴烧杯内壁
(3)操作②中,通过图中的装置Ⅱ可以除去水样中的色素和异味,则粒状固体层填充的固体一般是 ,装置Ⅱ进水口为 (填“g”或“h”)。
(4)图中的装置I中,水从X经Y转移到Z的过程,以下不发生变化的是 (填序号)。
a.分子大小 b.分子种类 c.分子间间隔
(5)将最终收集到的蒸馏水倒入量筒中,刚好95mL,请在图中画出液面 。
(6)从外观看,海水淡化和电解水都有液态变成气态的过程,但二者有本质的不同。请从微观粒子的角度图示这种区别,完成图A和图B。
宏观变化 微观解释
海水淡化示意图
电解水示意图
17.运用所学知识回答问题
(1)硅是太阳能电池和电脑芯片必需材料。工业上利用石英砂(主要含SiO2)制得高纯硅,其生产工艺流程如下图所示:
①步骤Ⅰ中制备粗硅的反应为,该反应属于 反应。(填“分解”、“化合”、“置换”或“复分解”之一)
②硅与碳的化学性质相似,从原子结构角度分析,其主要原因是 (填序号之一)。
A.质子数相同 B.电子层数相同 C.最外层电子数相同 D.中子数相同
③写出步骤Ⅲ中发生反应的化学方程式 。
③步骤Ⅲ必须在无氧、无水环境中进行,若混入氧气,则可能产生的后果是 。
(2)我国化学家侯德榜创立了侯氏制碱法,以海水“晒盐”得到的氯化钠为原料,最终制得Na2CO3和NH4Cl产品,两者的溶解度曲线如图所示。试回答:
①t1℃时,NH4Cl饱和溶液的溶质质量分数 Na2CO3饱和溶液的溶质质量分数(填“大于”、“小于”或“等于”之一)。
②若使某NH4Cl不饱和溶液转化为饱和溶液,下列方法中不可行 的是 (填序号之一)。
A.加NH4Cl固体 B.降低温度 C.加适量水 D.恒温蒸发
③t1℃时,一小试管内盛有Na2CO3饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛水的烧杯中(如图所示),向烧杯的水中加入某固体物质X,发现试管内的Na2CO3固体 逐渐溶解。根据所学知识推断,所加物质X可能是 ,(选填“NaOH”、“NaCl”或“NH4NO3”之一)请结合溶解度曲线分析,小试管内固体物质逐渐溶解的原因是 。
18.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是 ;b管内生成的气体是 ;检验a管内产生气体的方法是 。生成气体的体积比是 ,该实验说明水是由氢、氧元素组成的理论依据是 ;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量 mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为 g。
乙方案:该方案的实验目的是 ,氢气在氧气中燃烧,反应的化学方程式是 ,现象 ;该实验能否达到实验目的,并阐述理由 。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是 。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是 g。若升温至60℃,形成的溶液为 (填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为 。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是 。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为 。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是 。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
四、未知
19.图甲是A、B、C三种固体物质的溶解度曲线图.
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 .P点所表示的含义为 .
(2)t℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有 , , .
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪些? .
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大小关系是 .
参考答案:
1.C
2.D
3.B
4.B
5.C
6.D
7.C
8.B
9.B
10.B
11.错误
12.正确
13.正确
14.错误
15.正确
16.(1)明矾
(2) 过滤 AC/CA
(3) 活性炭 h
(4)ab/ba
(5)
(6)
17.(1) 置换反应 C
可能会发生爆炸,或反应生成的硅重新被氧化
(2) 大于 ABD NaOH
氢氧化钠溶于水放出大量的热,溶液温度升高,碳酸钠的溶解度增加
18. 有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
19. A t1℃时,B、C物质的溶解度相等 增加溶质 降低温度 蒸发溶剂 A、B B、C、A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
7.4结晶现象
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.如下图是甲、乙丙三种物质的溶解度曲线,下列叙述正确的是
A.t2℃时,甲、丙两种溶液的溶质质量分数相等
B.将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质质量分数都变大
C.t3℃时,组成为N点的甲溶液可通过增加溶质变为M点的溶液
D.将t3℃时的甲、乙饱和溶液降温到t2℃,甲析出晶体的质量一定大于乙
2.NaCl 和 KNO3 在不同温度时的溶解度如下表。下列说法正确的是
温度/C 0 20 40 60
NaCI的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100 g氯化钠溶液中最多能溶解36.0g NaCl
B.40℃时,KNO3饱和溶液的溶质质量分数等于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
3.下列关于过滤操作的叙述不正确的是
A.滤纸的边缘要低于漏斗口 B.玻璃棒的作用是搅拌
C.玻璃棒要靠在三层滤纸的一边 D.漏斗下端的管口要紧靠烧杯内壁
4.下列操作正确的是
A. B. C. D.
5.甲、乙、丙三种固体物质的溶解度曲线如图所示,从图中获取的信息正确的是
A.t2℃时,将甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数的大小关系为甲>乙=丙
B.升温可以使丙的饱和溶液变为不饱和溶液
C.t1℃时,甲、乙、丙三种溶液所含溶质的质量可能相同
D.t2℃时,将100g甲的饱和溶液降温到t1℃,可析出15g甲固体
6.如图是A、B、C三种物质的溶解度曲线,下列分析不正确的是( )
A.50℃时三种物质的溶解度由大到小的顺序是A>B>C
B.50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:3
C.将C的饱和溶液变为不饱和溶液,可采用降温的方法
D.将50℃时三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
7.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是
A.甲物质的溶解度比乙物质的溶解度大
B.甲物质溶液从t2℃降到t1℃,一定有晶体析出
C.t1℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.若甲物质中混有少量乙物质,可用蒸发结晶的方法提纯甲
8.下列是小军同学设计的实验方案,不能达到目的的是
选项 实验目的 实验方案
A 鉴别O2、CO2、H2 将燃着的木条分别伸入瓶中,观察现象
B 检验甲烷中的碳元素 点燃甲烷,在火焰上方罩一个干冷烧杯
C 除去CO中的CO2 将气体通过灼热的炭粉
D 分离食盐水和泥沙 过滤
A.A B.B C.C D.D
9.将5℃恰好饱和的氢氧化钙溶液,升温至38℃(忽略水的蒸发),不可能出现的情况是
A.溶液变浑浊 B.溶液变为不饱和
C.溶质质量分数变小 D.溶质质变小
10.泰山豆腐制作历史源远流长,乾隆年间修订的《泰安县志》曾这样记载:“凌晨街街梆子响,晚间户户豆腐香,泰城家家豆腐坊。”下列豆腐制作的流程中,属于过滤操作的是
A.磨豆浆 B.渗滤除渣 C.煮豆浆 D.压制成型
二、判断题
11.不饱和溶液变成饱和溶液后溶剂质量一定减少( )
12.通过过滤的方法可除去水中难溶性杂质( )
13.过滤中玻璃棒的作用是引流( )
14.过滤能除去天然水中的所有杂质( )
15.若除去食盐水中的泥沙,可采用过滤的方法( )
三、综合应用题
16.暴雨过后的河水浑浊不堪,化学兴趣小组的同学收集到一瓶浑浊的河水,经过以下净水过程,最终制成蒸馏水,实验过程如图所示。
请回答以下问题:
(1)图中,加入的A物质是絮凝剂,该物质可以是 。
(2)图中操作①的名称是 ;若经过操作①后,所得液体中仍有浑浊,其原因可能是 。
A 液面高于滤纸边缘 B.滤纸没有紧贴漏斗内壁而留有气泡
C.滤纸破损 D.漏斗下端没有紧贴烧杯内壁
(3)操作②中,通过图中的装置Ⅱ可以除去水样中的色素和异味,则粒状固体层填充的固体一般是 ,装置Ⅱ进水口为 (填“g”或“h”)。
(4)图中的装置I中,水从X经Y转移到Z的过程,以下不发生变化的是 (填序号)。
a.分子大小 b.分子种类 c.分子间间隔
(5)将最终收集到的蒸馏水倒入量筒中,刚好95mL,请在图中画出液面 。
(6)从外观看,海水淡化和电解水都有液态变成气态的过程,但二者有本质的不同。请从微观粒子的角度图示这种区别,完成图A和图B。
宏观变化 微观解释
海水淡化示意图
电解水示意图
17.运用所学知识回答问题
(1)硅是太阳能电池和电脑芯片必需材料。工业上利用石英砂(主要含SiO2)制得高纯硅,其生产工艺流程如下图所示:
①步骤Ⅰ中制备粗硅的反应为,该反应属于 反应。(填“分解”、“化合”、“置换”或“复分解”之一)
②硅与碳的化学性质相似,从原子结构角度分析,其主要原因是 (填序号之一)。
A.质子数相同 B.电子层数相同 C.最外层电子数相同 D.中子数相同
③写出步骤Ⅲ中发生反应的化学方程式 。
③步骤Ⅲ必须在无氧、无水环境中进行,若混入氧气,则可能产生的后果是 。
(2)我国化学家侯德榜创立了侯氏制碱法,以海水“晒盐”得到的氯化钠为原料,最终制得Na2CO3和NH4Cl产品,两者的溶解度曲线如图所示。试回答:
①t1℃时,NH4Cl饱和溶液的溶质质量分数 Na2CO3饱和溶液的溶质质量分数(填“大于”、“小于”或“等于”之一)。
②若使某NH4Cl不饱和溶液转化为饱和溶液,下列方法中不可行 的是 (填序号之一)。
A.加NH4Cl固体 B.降低温度 C.加适量水 D.恒温蒸发
③t1℃时,一小试管内盛有Na2CO3饱和溶液,试管底部还存有少许Na2CO3固体,将小试管放入盛水的烧杯中(如图所示),向烧杯的水中加入某固体物质X,发现试管内的Na2CO3固体 逐渐溶解。根据所学知识推断,所加物质X可能是 ,(选填“NaOH”、“NaCl”或“NH4NO3”之一)请结合溶解度曲线分析,小试管内固体物质逐渐溶解的原因是 。
18.水是我们熟悉的物质。
①为了测定水的组成,进行如下探究:
甲方案:电解水时玻璃管内的现象是 ;b管内生成的气体是 ;检验a管内产生气体的方法是 。生成气体的体积比是 ,该实验说明水是由氢、氧元素组成的理论依据是 ;
电解水时,常加入少量氢氧化钠使电解水反应容易进行,而氢氧化钠本身的质量和化学性质不发生变化。若水电解装置中盛有一定量的氢氧化钠溶液,通电一段时间后,产生了16g氧气,管内溶液中氢氧化钠的质量分数由 2.7%变为3.0%。试计算
Ⅰ.参加反应的水的物质的量 mol(根据化学方程式列式计算)。
Ⅱ.电解前氢氧化钠溶液的质量为 g。
乙方案:该方案的实验目的是 ,氢气在氧气中燃烧,反应的化学方程式是 ,现象 ;该实验能否达到实验目的,并阐述理由 。
②下表是KNO3 、NaCl在不同温度下的部分溶解度数据。
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32.0 45.8 64.0 85.5 110.0 138.0 169.0 202.0 246.0
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
Ⅰ. 以上两种物质溶解度的变化受温度影响较小的是 。
Ⅱ. 在40℃时,将40gKNO3溶解在50g水中,形成溶液的质量是 g。若升温至60℃,形成的溶液为 (填“饱和”或“不饱和”)溶液,该溶液的溶质质量分数为 。
Ⅲ.根据表中数据,找出60.0g水能够溶解66.0g KNO3的温度范围是 。
Ⅳ. 固体KNO3中混有少量NaCl,欲提纯KNO3所需的实验步骤为 。
Ⅴ.气体在水中的溶解度也有一定的变化规律。下图为不同温度下,某气体的溶解度与温度的关系。
图中P1与P2表示气压,则P1与P2的关系是 。
A P1>P2
B P1=P2
C P1<P2
D 无法确定
四、未知
19.图甲是A、B、C三种固体物质的溶解度曲线图.
(1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 .P点所表示的含义为 .
(2)t℃时,将C物质的不饱和溶液转变成饱和溶液可采取的方法有 , , .
(3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入硝酸铵,再加入适量的水,此时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪些? .
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数由大小关系是 .
参考答案:
1.C
2.D
3.B
4.B
5.C
6.D
7.C
8.B
9.B
10.B
11.错误
12.正确
13.正确
14.错误
15.正确
16.(1)明矾
(2) 过滤 AC/CA
(3) 活性炭 h
(4)ab/ba
(5)
(6)
17.(1) 置换反应 C
可能会发生爆炸,或反应生成的硅重新被氧化
(2) 大于 ABD NaOH
氢氧化钠溶于水放出大量的热,溶液温度升高,碳酸钠的溶解度增加
18. 有大量气泡,液面下降 氢气或H2 将带火星的木条伸到尖嘴导管处,余烬木条复燃 V(H2):V (O2)=2:1 (合理得分) 质量守恒定律 1 mol 180g 用化合的方法测定水的组成 2H2+O22H2O 剧烈燃烧,产生蓝色(淡蓝色)火焰,集气瓶内壁有水珠 不能,因为用排水法收集氧气,会带有大量水分。(前后对应正确,给分) 氯化钠或NaCl 82 不饱和 4/9或44.4% t≥60℃ 溶解、蒸发浓缩、冷却热饱和溶液、过滤(洗涤)、烘干 C
19. A t1℃时,B、C物质的溶解度相等 增加溶质 降低温度 蒸发溶剂 A、B B、C、A
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
