科粤版化学九年级下册 8.1溶液的酸碱性同步练习 (含答案)
文档属性
| 名称 | 科粤版化学九年级下册 8.1溶液的酸碱性同步练习 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 556.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 12:20:40 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
8.1溶液的酸碱性
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下表中是常温下人体内的一些液体和排泄物的正常pH范围,其中一定是酸性的是
名称 血浆 尿液 胃液 胰液
pH范围 7.35~7.45 4.7~8.4 0.9~1.5 7.5~8.0
A.血浆 B.尿液 C.胃液 D.胰液
2.一些常见食物的近似pH如表所示:
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
下列说法中错误的是
A.苹果汁和葡萄汁显酸性
B.牛奶和鸡蛋清显碱性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮苹果汁和葡萄汁
3.某同学测定了几种常见物质的近似pH,其中显酸性的是
A.糖水pH=7 B.肥皂水pH=10 C.苹果汁pH=3 D.草木灰水pH=11
4.下列实验操作符合规范要求的是
A.“高锰酸钾制取氧气” 实验中,排水法收集好气体后应先将导管移出水槽再停止加热
B.“粗盐的提纯”实验中,过滤时将悬浊液直接倒入漏斗里
C.“配制50g溶质质量分数15%的氯化钠溶液”实验中,用10mL量筒量取蒸馏水
D.“溶液的酸碱性”实验中,测定溶液pH时应先将试纸湿润
5.下表数据是一些物质的pH,其中一定呈酸性的是( )
物质 牙膏 矿泉水 苹果汁 肥皂水
pH 8~9 6.5~7.5 2.9~3.3 9.8~10.2
A.牙膏
B.矿泉水
C.苹果汁
D.肥皂水
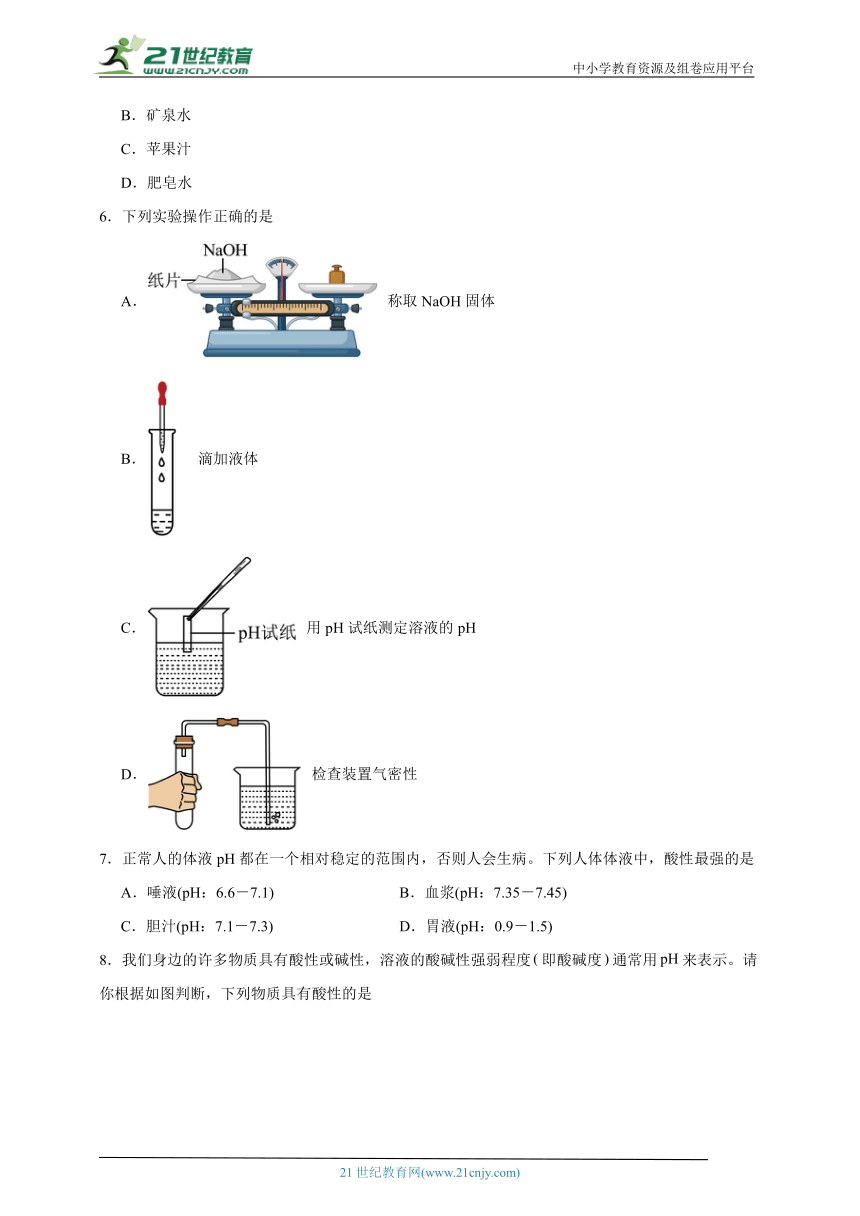
6.下列实验操作正确的是
A. 称取NaOH固体
B. 滴加液体
C. 用pH试纸测定溶液的pH
D. 检查装置气密性
7.正常人的体液pH都在一个相对稳定的范围内,否则人会生病。下列人体体液中,酸性最强的是
A.唾液(pH:6.6-7.1) B.血浆(pH:7.35-7.45)
C.胆汁(pH:7.1-7.3) D.胃液(pH:0.9-1.5)
8.我们身边的许多物质具有酸性或碱性,溶液的酸碱性强弱程度即酸碱度通常用来表示。请你根据如图判断,下列物质具有酸性的是
A.牙膏 B.肥皂 C.醋 D.炉具清洁剂
9.小明同学在家里发现厕所洗洁精的标签上标注该洗洁精的pH为3.5,他为了验证一下是否属实,于是取了一张pH试纸将其润湿,然后把洗洁精滴在试纸上测定,则他测定的pH可能是
A.pH=2 B.pH=3.5 C.pH=4.5 D.pH=4
10.正常雨水的pH约为5.6,这与空气中的某种成分有关。该气体是
A. B. C. D.
二、判断题
11.用pH试纸测得某溶液的pH为5.5( )
12.用湿润的玻璃棒蘸取待测液,测得的pH偏大( )
13.用pH试纸只能粗略地测定溶液的酸碱度,测得的pH是整数而不能是小数。
14.纯水的pH为0( )
15.若将pH试纸润湿,再测量稀硫酸的pH,则数值偏小( )
三、综合应用题
16.小华利用周末与妈妈一起打扫房间,她发现了许多与化学有关的现象和问题。请你与她一起分析,并回答有关问题:
(1)清理卫生间的过程中,她使用了洗洁精、洁厕灵和84消毒液三种清洁剂,查阅资料得知其有效成分如表所示:
名称 洗洁精 洁厕灵 84消毒液
有效成分 表面活性剂、NaOH HCl NaClO
①据其有效成分可知洗洁精呈 (填“酸性”、“碱性”或“中性”),若用pH试纸测定洗洁精的pH,应该 (填大于7、小于7或等于7);
②84消毒液中的NaClO在类别上属于(选填序号) ,其中氯元素的化合价为 ;(A酸B碱C盐D氧化物E有机物F无机物G化合物H单质)
③小华认为洁厕灵可用于铁制品表面除锈,发生反应的化学方程式为 ;该反应所属基本反应类型为 。
④查阅资料知:洁厕灵与84消毒液混合发生反应:NaClO+2HCl=NaCl+X↑+H2O,则X的化学式为 ,X是一种有毒的气体,常有因此而发生中毒的事件,所以不可以把洁厕灵与84消毒液混合使用。
(2)接着她们又对厨房进行了清理:
①在调料柜中发现了两包标签模糊的白色粉末状物质,妈妈回忆说是淀粉和纯碱,小华做了一个简单的实验就将二者区分开了。她的实验方法是 ;
②妈妈发现一口铝锅表面发黄,就用钢丝球进行擦洗。小华发现后立即予以制止,她的理由是 。
(3)打扫过程中小华发现家中好几部报废的手机。科学的迅速发展,导致手机产品的更迭加速。我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。能否回收其中的铜?为此小华与班级化学兴趣小组设计并进行了如下实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
①将电路板粉碎成粉末的目的是 。
②步骤A所得滤液中的溶质除硫酸外,还有 。
③步骤B中的实验现象是:固体部分溶解, 。
④步骤D中反应的化学方程式是 。
17.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为 (填“酸性”“碱性”“中性”),而且逐渐 (填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为 (填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是 。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为 t。
18.某冶炼厂用含氯化铜和盐酸的废液生产干燥的氢氧化铜,工程师设计了如下图流程,并用实验探究最佳工艺。试回答相关问题。
(1)不同种助剂对产品洗涤(达到相同效果)的实验结果见表。
助剂种类 过滤时间/min 滤渣状态 洗涤用水量/g
A 13 密实 639.8
B 12 密实 589.3
C 13 蓬松 326.5
D 13 较蓬松 350.0
根据表格可知,遵循绿色化学中的“减量”原则,助剂应该选用 (填助剂种类)。选择该助剂还有什么优点?
(2)调节pH对Cu2+回收率及产品纯度的影响见图1所示。
所以该工艺中需要调节pH至 为最佳。当pH逐步提高到14过滤,观察到沉淀量 同时溶液呈深蓝色的现象,说明Cu2+回收率明显下降。
(3)工艺中“搅拌1.5h”的目的是 。
(4)对实验产品进行热重分析,测得加热温度与样品质量的关系如图2所示:取干燥的产品98 g,当温度高于80℃时开始出现黑色固体氧化铜,同时生成另一种氧化物。持续升温到185℃时完全变黑且质量恒定,请计算x的值(写出计算过程)。
参考答案:
1.C
2.B
3.C
4.A
5.C
6.D
7.D
8.C
9.D
10.A
11.错误
12.错误
13.正确
14.错误
15.错误
16. 碱性 大于7 C、F、G +1 复分解反应 Cl2 取少量于杯子中,加几滴食醋,有气泡产生为纯碱,另一包为淀粉(或取少量于杯子中,加几滴碘酒,变蓝色为淀粉,另一包为纯碱;或取少量进行灼烧,可燃烧的为淀粉,另一包为纯碱;或取少量于杯子中,加足量水搅拌,能完全溶解的为纯碱,另一包为淀粉)等合理即可。 铝制品表面有一层致密而坚固的氧化膜可以保护铝制品不被腐蚀(合理即可) 增大与硫酸的接触面积使反应更充分 硫酸铝和硫酸亚铁 溶液由无色变为蓝色
17. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
18.(1) C 便于对滤渣进行洗涤,除去残留的杂质
(2) 13 减少
(3)增加反应物的接触面积,使反应更快更充分
(4)解:根据题意可知,185℃时完全变黑且质量恒定,则剩余固体全部为氧化铜。化学反应前后元素的种类不变,则氧化铜中铜元素的质量与氢氧化铜中铜元素的质量相同。
98g氢氧化铜中铜元素的质量为
含有64g铜的氧化铜的质量为
所以图中x的值为80。
答:x的值为80。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
8.1溶液的酸碱性
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下表中是常温下人体内的一些液体和排泄物的正常pH范围,其中一定是酸性的是
名称 血浆 尿液 胃液 胰液
pH范围 7.35~7.45 4.7~8.4 0.9~1.5 7.5~8.0
A.血浆 B.尿液 C.胃液 D.胰液
2.一些常见食物的近似pH如表所示:
食物 苹果汁 葡萄汁 牛奶 鸡蛋清
pH 2.9~3.3 3.5~4.5 6.3~6.6 7.6~8.0
下列说法中错误的是
A.苹果汁和葡萄汁显酸性
B.牛奶和鸡蛋清显碱性
C.苹果汁比葡萄汁的酸性强
D.胃酸过多的人应少饮苹果汁和葡萄汁
3.某同学测定了几种常见物质的近似pH,其中显酸性的是
A.糖水pH=7 B.肥皂水pH=10 C.苹果汁pH=3 D.草木灰水pH=11
4.下列实验操作符合规范要求的是
A.“高锰酸钾制取氧气” 实验中,排水法收集好气体后应先将导管移出水槽再停止加热
B.“粗盐的提纯”实验中,过滤时将悬浊液直接倒入漏斗里
C.“配制50g溶质质量分数15%的氯化钠溶液”实验中,用10mL量筒量取蒸馏水
D.“溶液的酸碱性”实验中,测定溶液pH时应先将试纸湿润
5.下表数据是一些物质的pH,其中一定呈酸性的是( )
物质 牙膏 矿泉水 苹果汁 肥皂水
pH 8~9 6.5~7.5 2.9~3.3 9.8~10.2
A.牙膏
B.矿泉水
C.苹果汁
D.肥皂水
6.下列实验操作正确的是
A. 称取NaOH固体
B. 滴加液体
C. 用pH试纸测定溶液的pH
D. 检查装置气密性
7.正常人的体液pH都在一个相对稳定的范围内,否则人会生病。下列人体体液中,酸性最强的是
A.唾液(pH:6.6-7.1) B.血浆(pH:7.35-7.45)
C.胆汁(pH:7.1-7.3) D.胃液(pH:0.9-1.5)
8.我们身边的许多物质具有酸性或碱性,溶液的酸碱性强弱程度即酸碱度通常用来表示。请你根据如图判断,下列物质具有酸性的是
A.牙膏 B.肥皂 C.醋 D.炉具清洁剂
9.小明同学在家里发现厕所洗洁精的标签上标注该洗洁精的pH为3.5,他为了验证一下是否属实,于是取了一张pH试纸将其润湿,然后把洗洁精滴在试纸上测定,则他测定的pH可能是
A.pH=2 B.pH=3.5 C.pH=4.5 D.pH=4
10.正常雨水的pH约为5.6,这与空气中的某种成分有关。该气体是
A. B. C. D.
二、判断题
11.用pH试纸测得某溶液的pH为5.5( )
12.用湿润的玻璃棒蘸取待测液,测得的pH偏大( )
13.用pH试纸只能粗略地测定溶液的酸碱度,测得的pH是整数而不能是小数。
14.纯水的pH为0( )
15.若将pH试纸润湿,再测量稀硫酸的pH,则数值偏小( )
三、综合应用题
16.小华利用周末与妈妈一起打扫房间,她发现了许多与化学有关的现象和问题。请你与她一起分析,并回答有关问题:
(1)清理卫生间的过程中,她使用了洗洁精、洁厕灵和84消毒液三种清洁剂,查阅资料得知其有效成分如表所示:
名称 洗洁精 洁厕灵 84消毒液
有效成分 表面活性剂、NaOH HCl NaClO
①据其有效成分可知洗洁精呈 (填“酸性”、“碱性”或“中性”),若用pH试纸测定洗洁精的pH,应该 (填大于7、小于7或等于7);
②84消毒液中的NaClO在类别上属于(选填序号) ,其中氯元素的化合价为 ;(A酸B碱C盐D氧化物E有机物F无机物G化合物H单质)
③小华认为洁厕灵可用于铁制品表面除锈,发生反应的化学方程式为 ;该反应所属基本反应类型为 。
④查阅资料知:洁厕灵与84消毒液混合发生反应:NaClO+2HCl=NaCl+X↑+H2O,则X的化学式为 ,X是一种有毒的气体,常有因此而发生中毒的事件,所以不可以把洁厕灵与84消毒液混合使用。
(2)接着她们又对厨房进行了清理:
①在调料柜中发现了两包标签模糊的白色粉末状物质,妈妈回忆说是淀粉和纯碱,小华做了一个简单的实验就将二者区分开了。她的实验方法是 ;
②妈妈发现一口铝锅表面发黄,就用钢丝球进行擦洗。小华发现后立即予以制止,她的理由是 。
(3)打扫过程中小华发现家中好几部报废的手机。科学的迅速发展,导致手机产品的更迭加速。我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。能否回收其中的铜?为此小华与班级化学兴趣小组设计并进行了如下实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
①将电路板粉碎成粉末的目的是 。
②步骤A所得滤液中的溶质除硫酸外,还有 。
③步骤B中的实验现象是:固体部分溶解, 。
④步骤D中反应的化学方程式是 。
17.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为 (填“酸性”“碱性”“中性”),而且逐渐 (填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为 (填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是 。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为 t。
18.某冶炼厂用含氯化铜和盐酸的废液生产干燥的氢氧化铜,工程师设计了如下图流程,并用实验探究最佳工艺。试回答相关问题。
(1)不同种助剂对产品洗涤(达到相同效果)的实验结果见表。
助剂种类 过滤时间/min 滤渣状态 洗涤用水量/g
A 13 密实 639.8
B 12 密实 589.3
C 13 蓬松 326.5
D 13 较蓬松 350.0
根据表格可知,遵循绿色化学中的“减量”原则,助剂应该选用 (填助剂种类)。选择该助剂还有什么优点?
(2)调节pH对Cu2+回收率及产品纯度的影响见图1所示。
所以该工艺中需要调节pH至 为最佳。当pH逐步提高到14过滤,观察到沉淀量 同时溶液呈深蓝色的现象,说明Cu2+回收率明显下降。
(3)工艺中“搅拌1.5h”的目的是 。
(4)对实验产品进行热重分析,测得加热温度与样品质量的关系如图2所示:取干燥的产品98 g,当温度高于80℃时开始出现黑色固体氧化铜,同时生成另一种氧化物。持续升温到185℃时完全变黑且质量恒定,请计算x的值(写出计算过程)。
参考答案:
1.C
2.B
3.C
4.A
5.C
6.D
7.D
8.C
9.D
10.A
11.错误
12.错误
13.正确
14.错误
15.错误
16. 碱性 大于7 C、F、G +1 复分解反应 Cl2 取少量于杯子中,加几滴食醋,有气泡产生为纯碱,另一包为淀粉(或取少量于杯子中,加几滴碘酒,变蓝色为淀粉,另一包为纯碱;或取少量进行灼烧,可燃烧的为淀粉,另一包为纯碱;或取少量于杯子中,加足量水搅拌,能完全溶解的为纯碱,另一包为淀粉)等合理即可。 铝制品表面有一层致密而坚固的氧化膜可以保护铝制品不被腐蚀(合理即可) 增大与硫酸的接触面积使反应更充分 硫酸铝和硫酸亚铁 溶液由无色变为蓝色
17. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
18.(1) C 便于对滤渣进行洗涤,除去残留的杂质
(2) 13 减少
(3)增加反应物的接触面积,使反应更快更充分
(4)解:根据题意可知,185℃时完全变黑且质量恒定,则剩余固体全部为氧化铜。化学反应前后元素的种类不变,则氧化铜中铜元素的质量与氢氧化铜中铜元素的质量相同。
98g氢氧化铜中铜元素的质量为
含有64g铜的氧化铜的质量为
所以图中x的值为80。
答:x的值为80。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
