人教版化学九年级上册 第三单元 物质构成的奥秘同步练习(含解析)
文档属性
| 名称 | 人教版化学九年级上册 第三单元 物质构成的奥秘同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 852.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 18:24:40 | ||
图片预览

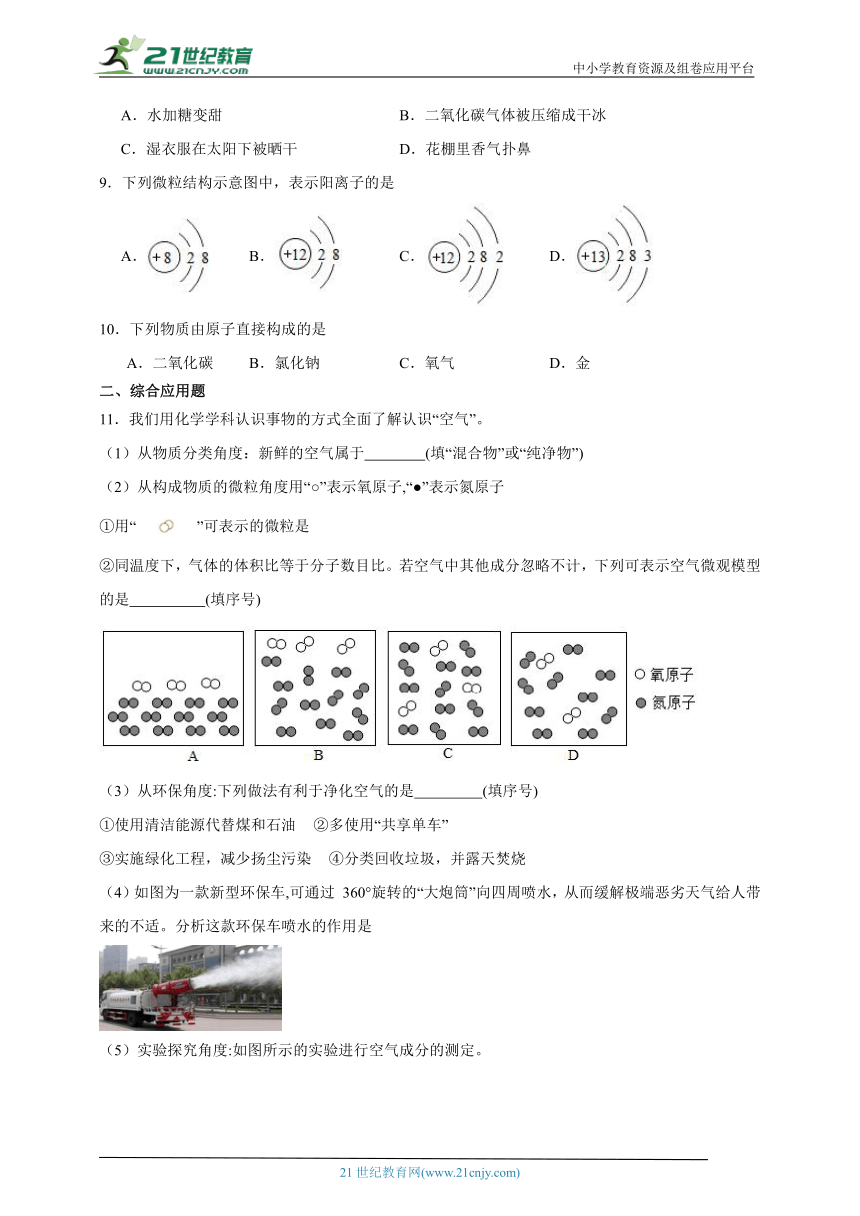
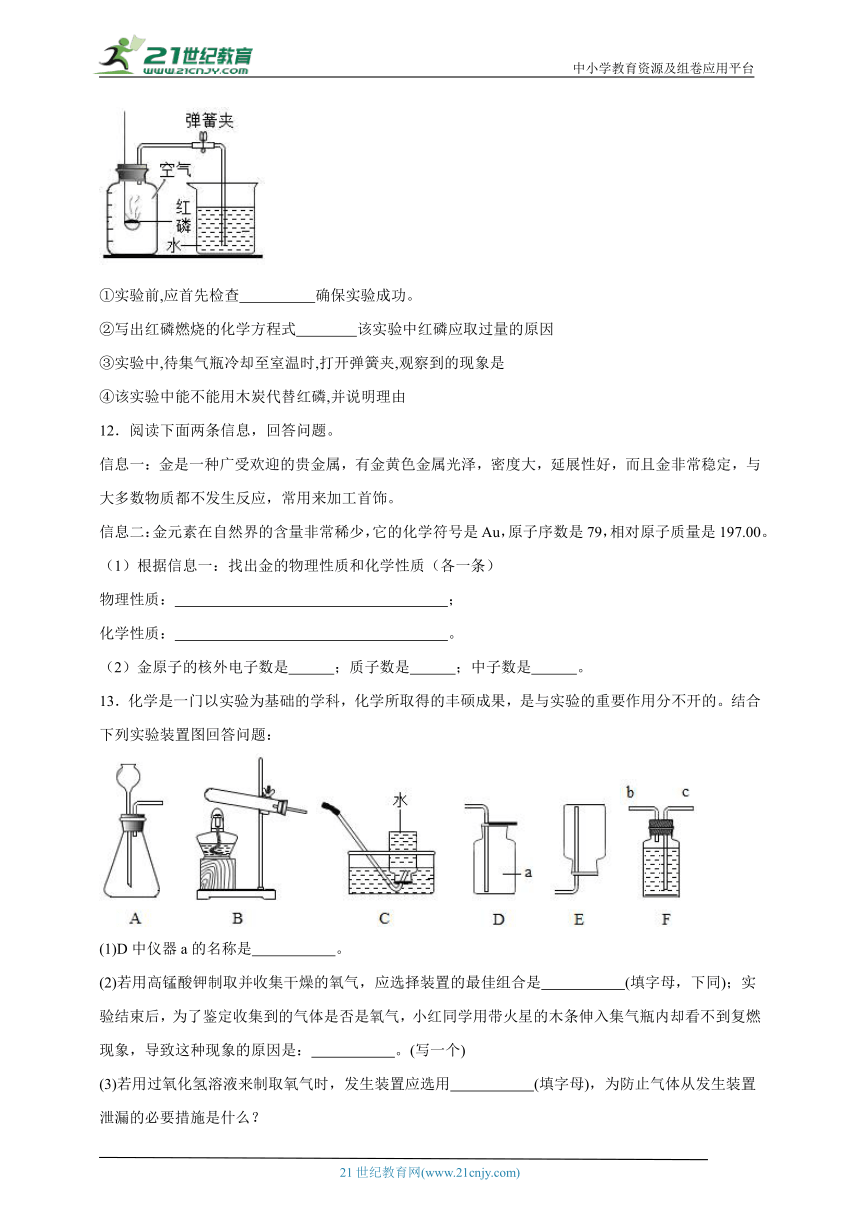
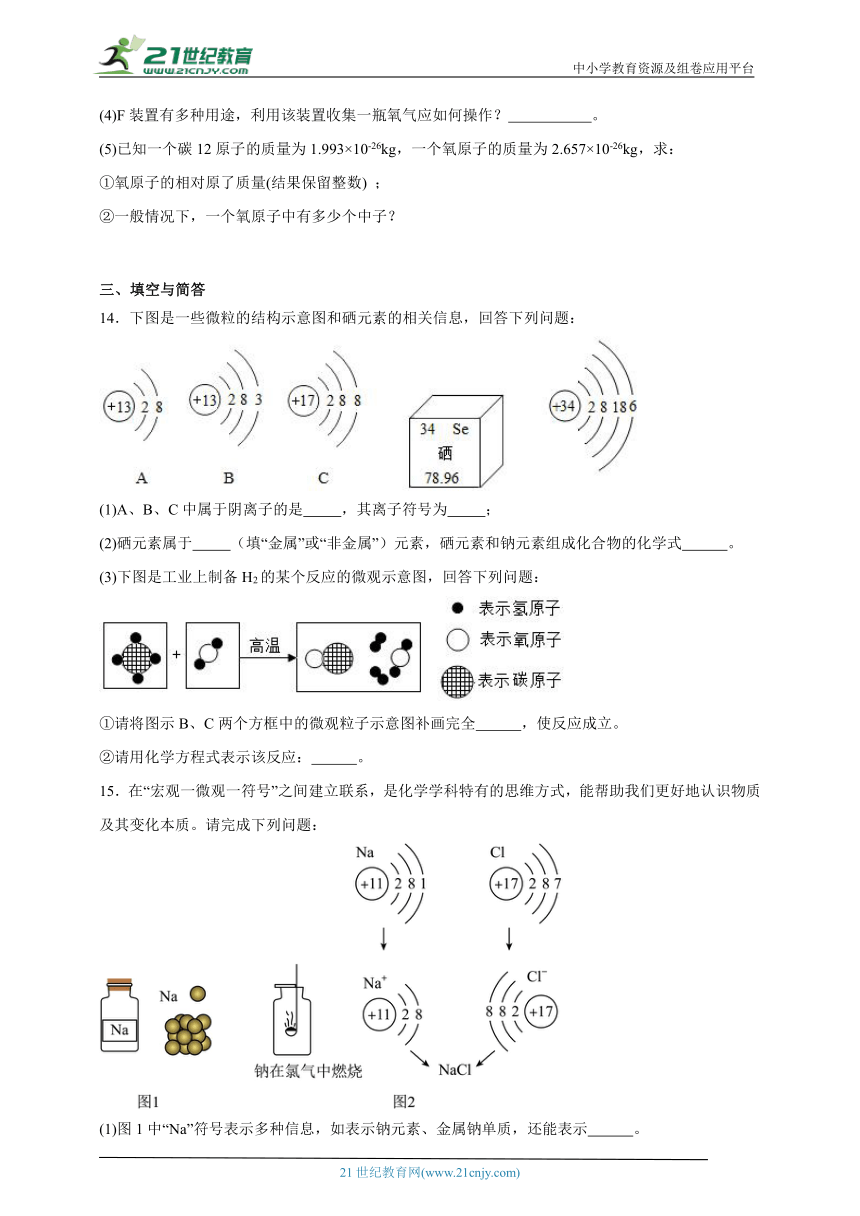

文档简介
中小学教育资源及组卷应用平台
人教版九年级上册第3单元物质构成的奥秘同步练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下图所示的粒子中,化学性质最稳定的是
A. B. C. D.
2.下列结构示意图表示阳离子的是
A. B. C. D.
3.研究人员使用加速器使第30号元素锌的原子加速,然后撞击第83号元素铋的原子,使二者原子核融合在一起而得到113号元素Nh。它有一个巨大的原子核,包含113个质子和173个中子。下列有关说法错误的是
A.第30号元素为金属元素 B.Nh的相对原子质量为286g
C.Nh的原子序数为113 D.第83号元素的原子核外有83个电子
4.关于下列几种微粒结构示意图的说法不正确的是
A.只有②是离子 B.①和③属同种元素
C.①和④化学性质相似 D.①属非金属元素
5.下列元素中属于金属元素的是
A.氢 B.碳 C.铁 D.氧
6.国际互联网上报道:目前世界上有近20亿人患有缺铁性贫血。为了全民的身体健康,我国卫生部推广使用加铁酱油。这里的“铁”指的是
A.铁单质 B.铁原子 C.铁元素 D.四氧化三铁
7.能反映“分子在不断运动”这一事实的中国古诗句是
A.绿树荫浓夏日长 B.楼台倒映入池塘
C.遥望洞庭山水翠 D.满架蔷薇一院香
8.下列事实不能说明“分子在不断运动”的是
A.水加糖变甜 B.二氧化碳气体被压缩成干冰
C.湿衣服在太阳下被晒干 D.花棚里香气扑鼻
9.下列微粒结构示意图中,表示阳离子的是
A. B. C. D.
10.下列物质由原子直接构成的是
A.二氧化碳 B.氯化钠 C.氧气 D.金
二、综合应用题
11.我们用化学学科认识事物的方式全面了解认识“空气”。
(1)从物质分类角度:新鲜的空气属于 (填“混合物”或“纯净物”)
(2)从构成物质的微粒角度用“○”表示氧原子,“●”表示氮原子
①用“”可表示的微粒是
②同温度下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,下列可表示空气微观模型的是 (填序号)
(3)从环保角度:下列做法有利于净化空气的是 (填序号)
①使用清洁能源代替煤和石油 ②多使用“共享单车”
③实施绿化工程,减少扬尘污染 ④分类回收垃圾,并露天焚烧
(4)如图为一款新型环保车,可通过 360°旋转的“大炮筒”向四周喷水,从而缓解极端恶劣天气给人带来的不适。分析这款环保车喷水的作用是
(5)实验探究角度:如图所示的实验进行空气成分的测定。
①实验前,应首先检查 确保实验成功。
②写出红磷燃烧的化学方程式 该实验中红磷应取过量的原因
③实验中,待集气瓶冷却至室温时,打开弹簧夹,观察到的现象是
④该实验中能不能用木炭代替红磷,并说明理由
12.阅读下面两条信息,回答问题。
信息一:金是一种广受欢迎的贵金属,有金黄色金属光泽,密度大,延展性好,而且金非常稳定,与大多数物质都不发生反应,常用来加工首饰。
信息二:金元素在自然界的含量非常稀少,它的化学符号是Au,原子序数是79,相对原子质量是197.00。
(1)根据信息一:找出金的物理性质和化学性质(各一条)
物理性质: ;
化学性质: 。
(2)金原子的核外电子数是 ;质子数是 ;中子数是 。
13.化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
(1)D中仪器a的名称是 。
(2)若用高锰酸钾制取并收集干燥的氧气,应选择装置的最佳组合是 (填字母,下同);实验结束后,为了鉴定收集到的气体是否是氧气,小红同学用带火星的木条伸入集气瓶内却看不到复燃现象,导致这种现象的原因是: 。(写一个)
(3)若用过氧化氢溶液来制取氧气时,发生装置应选用 (填字母),为防止气体从发生装置泄漏的必要措施是什么?
(4)F装置有多种用途,利用该装置收集一瓶氧气应如何操作? 。
(5)已知一个碳12原子的质量为1.993×10-26kg,一个氧原子的质量为2.657×10-26kg,求:
①氧原子的相对原了质量(结果保留整数) ;
②一般情况下,一个氧原子中有多少个中子?
三、填空与简答
14.下图是一些微粒的结构示意图和硒元素的相关信息,回答下列问题:
(1)A、B、C中属于阴离子的是 ,其离子符号为 ;
(2)硒元素属于 (填“金属”或“非金属”)元素,硒元素和钠元素组成化合物的化学式 。
(3)下图是工业上制备H2的某个反应的微观示意图,回答下列问题:
①请将图示B、C两个方框中的微观粒子示意图补画完全 ,使反应成立。
②请用化学方程式表示该反应: 。
15.在“宏观一微观一符号”之间建立联系,是化学学科特有的思维方式,能帮助我们更好地认识物质及其变化本质。请完成下列问题:
(1)图1中“Na”符号表示多种信息,如表示钠元素、金属钠单质,还能表示 。
(2)钠可以在氯气中燃烧生成氯化钠,反应示意图如图2所示,结合所学知识,下列说法不正确的是______(填序号)。
A.原子都是由原子核和核外电子构成的
B.原子在化学变化中可以再分成更小的粒子
C.氯化钠是由钠离子和氯离子构成的
D.在钠原子和氯原子形成氯化钠的过程中,得到电子的是氯原子
16.回答问题
(1)以下物质中属于纯净物的是 (填序号,下间),属于混合物的是 。
①冰水混合物 ②铁水 ③过氯化氢溶液 ④洁净的空气 ⑤液氮 ⑥稀有气体 ⑦二氧化碳 ⑧澄清石灰水 ⑨人能喝的水 ⑩高锰酸钾制氧气的剩余物。
(2)氢气、氧气、氮气、二氧化碳、二氧化硫、稀有气体等,按要求将相应物质的名称填写在题中的空白处。
①属于空气污染物的气体是 。
②能支持燃烧的气体是 。
③食品包装中常用作保护气的是 。
④绿色植物光合作用吸收的气体是 。
(3)写出下列元素符号或元素名称
①氦 。②钠 。③Ar 。
④钡 。⑤Cl 。⑥Ca 。
17.下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题。
(1)同一周期的元素,从左到右,各元素的原子序数依次 ,金属性逐渐减弱,非金属性逐渐增强,则第三周期中氯元素的非金属性比硫元素的非金属性 (填“强”或“弱”)。
(2)氧元素的离子与 (写元素名称)原子具有相同的核外电子数。
(3)原子序数为5和13的原子排在同一纵行,则它们在原子结构上的相似之处是 。
18.M元素组成的一种物质可用于原子反应堆的导热剂,其原子结构示意图如下。
(1)x的值是 ,M元素属于 (选填“金属”或“非金属”)元素,该元素的原子在化学反应中易 (填“得到”或“失去”)电子。
(2)M元素的化学性质与下列 (填序号)元素的化学性质相似。
19.我市有丰富的镍钼矿资源,如图是元素周期表中镍元素的有关信息示意图,请你写出从图中获得的两条信息。
(1)镍的元素符号是 。
(2)镍的相对原子质量是 。
(3)镍属于 (金属或非金属)元素。
20.下图中A、B、C、D是四种粒子的结构示意图,请根据图示信息回答下列问题:
(1)图中A、B、C、D粒子共表示 种元素。
(2)A、B、C、D中表示阳离子的离子符号为 。
(3)D中x=
21.已知下图为氢、钠、氧、硫四种元素的原子结构示意图,回答下列问题:
(1)x= ,y= ;
(2)以上属于金属元素的原子的是 (填元素符号);
(3)氧原子在化学反应中容易 (得到或失去)电子,形成的离子的符号是 ;
(4)以上四种元素中,化学性质相似的是 (填序号)。
22.如下表:原子结构是通过科学家不断地建立与修正原子结构模型,不断地实验,不断地思考研究而得到的.下表是原子结构模型的几种学说
时间 模型类型 科学家 内容
1803年 道尔顿模型 道尔顿(英国) 原子是一个坚硬的小球
1897年 汤姆生模型 汤姆生(英国) 发现电子,即“西瓜模型”正电荷是西瓜肉,电子是西瓜籽
1911年 卢瑟福模型 卢瑟福(英国) 发现原子核,原子大部分体积是空的,电子围绕带正电的原子核随意动转
1913年 分层模型 玻尔(丹麦) 电子在固定轨道上分层运动(绕着原子核)
现代 电子云模型 电子出现在原子核周围,有的区域次数多,有的区域次数少
(1)上面四种原子结构模型中道尔顿的原子结构模式是 (填序号),这种原子模型是一种 结构.
(2)1911年,卢瑟福通过实验发现原子结构,所做的实验名称是 ,实验中大多数α微粒不改变原来的运动方向,顺利通过.有一小部分α微粒发生了偏转,原因是 ;极少数α微粒被反弹了回来,原因是 .因此,卢瑟福根据实验建立了 原子模型.
(3)请用框图的形式表示原子的结构: 。
23.“宏观一微观一符号”是化学视角认识物质的方法。根据下列图示回答问题:
(1)①图中表示阳离子的是 (填序号,下同);②表示原子的是 。
(2)图中电子数相同的微粒有 。
(3)图中表示同种元素的是 和 。
(4)图中表示稀有气体的是 。
参考答案:
1.B
【详解】粒子中,化学性质最稳定的是要达到稳定的电子结构,即只有一层,最外层是2个电子,含有多个电子层,最外层有8个电子称为相对稳定结构。
故选B。
2.C
【详解】A.核电荷数=质子数=核外电子数=2+8+6=16,为原子;
B.核电荷数=质子数=核外电子数=2+8=10,为原子;
C.核电荷数=质子数=11>核外电子数=2+8=10,为阳离子;
D.核电荷数=质子数=8<核外电子数=2+8=10,为阴离子。
故选C。
3.B
【详解】A、第30号元素锌为金属元素,选项正确;B、相对原子质量没有单位,选项错误;C、Nh的原子序数为113,选项正确;D、原子序数等于质子数等于核外电子数,选项正确。故本题选B。
4.A
【详解】A、①中质子数=核外电子数,表示原子,②中质子数大于核外电子数,表示阳离子,③质子数小于核外电子数,表示阴离子,④中质子数=核外电子数,表示原子,故②和③属于离子,符合题意;
B、元素是质子数相同的一类原子的总称,①和③质子数相同,属于同种元素,不符合题意;
C、①和④最外层电子数相同,均是7,化学性质相似,不符合题意;
D、质子数=原子序数,9号元素是氟元素,由“气”字旁可知,氟元素属于非金属元素,不符合题意。
故选A。
5.C
【详解】根据中文元素名称的偏旁可以确定元素的类别。铁是“钅”旁,属于金属元素;氢、氧是“气”字头,属于气态非金属元素;碳是“石”旁,属于固态非金属元素。故选C。
6.C
【详解】人体需要的是铁元素可预防贫血,酱油中添加的是含有铁元素的物质,铁单质、铁原子、四氧化三铁都是不溶于水的固体,酱油中没有明显的固体物质,故选:C。
7.D
【详解】A、绿树荫浓夏日长,是光沿直线传播,故A 不正确;
B、楼台倒映入池塘,是光的反射,故B不正确;
C、遥望洞庭山水翠,不能说明分子在不断运动,故C不正确;
D、满架蔷薇一院香,是因为分子在不断运动,引起香味的分子四处扩散,故D正确。
故选D。
8.B
【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可。
【详解】A、水加糖变甜,是因为糖分子是在不断运动的,运动到水分子中间去了,能说明分子在不停运动的,故A正确;B、二氧化碳气体被压缩成干冰,是因为是分子间有间隔,压强增大,分子间间隔变小,不能说明分子在不停运动的,故B错误;C、湿衣服在太阳下被晒干,是因为水分子是在不断运动的,向四周扩散,运动到空气中去了,能说明分子在不停运动的,故C正确;D、花棚里香气扑鼻,是因为花香中含有的分子是在不断运动的,向四周扩散,使人们闻到花香,能说明分子在不停运动的,故D正确。故选B。
9.B
【详解】在微粒的结构示意图中,质子数=核外电子数,为原子;质子数>核外电子数,为阳离子;质子数<核外电子数,为阴离子。
A、质子数为8,电子数为10,质子数<核外电子数,为阴离子,不符合题意;
B、质子数为12,电子数为10,质子数>核外电子数,为阳离子,符合题意;
C、质子数为12,电子数为12,质子数=核外电子数,为原子,不符合题意;
D、质子数为13,电子数为13,质子数=核外电子数,为原子,不符合题意。
故选B。
10.D
【详解】试题分析:由原子构成的物质有:①金属单质、②大多数的固态非金属单质(常温)③稀有气体。D项金属于金属单质,为原子直接构成。所以应选D项。
考点:构成物质的微粒
11. 混合物 O2或氧分子 C ①②③ 降低空气中的粉尘(答案合理即可) 装置的气密性 4P+5O22P2O5 装置内空气中的氧气反应完全 烧杯中的水进入集气瓶中,且占集气瓶容积的五分之一 不能,木条燃烧生成二氧化碳气体,瓶内压强变化不明显。
【详解】(1)空气中含有氮气、氧气等多种物质属于混合物;
(2)图A错误,空气中氮气和氧气应该均匀混合;图B错误,空气中氮气和氧气应该均匀混合;图C正确,空气中的氮气和氧气均匀混合,且氧气与氮气的分子个数比为1:4;图D错误,氧气与氮气的分子个数比为1:5;
(3)从环保角度:下列做法有利于净化空气的是①使用清洁能源代替煤和石油,减少二氧化碳的排放②多使用“共享单车”出行,减少汽车尾气的排放③实施绿化工程,减少扬尘污染 ④露天焚烧垃圾会产生有毒有害气体,不利于净化空气。
(4)降低空气中的粉尘,增加空气湿度。(答案合理即可)
(5)做测定空气中氧气含量的实验前,一定要检查装置的气密性;红磷在氧气点燃反应原理是:4P+5O22P2O5;红磷应取过量是为了保证集气瓶内的氧气全部反应完全,使实验结果测量更准确;烧杯中的水进入集气瓶中,且占集气瓶容积的五分之一;实验中不能吧红磷换成木炭,木炭燃烧生成二氧化碳气体,瓶内压强变化不明显。
12. 有金黄色金属光泽,密度大,延展性好 金非常稳定,与大多数物质都不发生反应 79 79 118
【详解】(1)根据信息一,金的物理性质有:有金黄色金属光泽,密度大,延展性好;金的化学性质有:金非常稳定,与大多数物质都不发生反应;
(2)金原子的核外电子数是79;质子数是79;中子数=197-79=118。
13.(1)集气瓶
(2) BD 收集的气体不纯净(或装置漏气,没有收到氧气)
(3) A 长颈漏斗下端要插到液面以下
(4)装满水,从b端通入氧气(或倒掉瓶内液体,从c端通入氧气)
(5) 相对原子质量= 8
【解析】(1)
仪器a是集气瓶,常用于收集并储存气体。
(2)
高锰酸钾制取氧气需要加热条件,故应选择装置B作发生装置,氧气不易溶于水,密度比空气大,可用排水法和向上排空气法收集气体,若需收集干燥的氧气应采用向上排空气收集,故应选择装置D作收集装置。氧气具有助燃性,能使带火星的木条复燃,该操作中未观察到木条复燃可能是由于氧气不纯,氧气的浓度不足以使带火星的木条复燃,其原因可能是装置气密性不好,或者集气瓶内的空气未完全排净就停止了收集。
(3)
过氧化氢溶液制取氧气时不需要加热,应选择装置A作发生装置。利用该装置制取氧气时,为防止气体从发生装置泄漏,长颈漏斗的下端应伸到液面以下进行液封。
(4)
氧气不易溶于水,利用该装置收集氧气时应先将装置装满水,然后从b端通入氧气,从c端排出水,只有这样才能达到排出水收集气体的目的。氧气的密度比空气大,也可用向上排空气法收集气体,此时装置不装水,从c端通入氧气,然后从b端排出空气。
(5)
①原子的相对原子质量是以一种碳原子质量的1/12为标准,其它原子的质量与它相比较所得到的比,故氧原子的相对原子质量=。
②相对原子质量≈质子数+中子数,氧原子的相对原子质量是16,氧原子核内的质子数是8,故一般情况下,一个氧原子中的中子数=16-8=8。
14.(1) C Cl-
(2) 非金属 Na2Se
(3)
【详解】(1)原子在得到电子形成阴离子,阴离子的质子数小于核外电子数,则A、B、C中属于阴离子的是C,C是氯离子,其离子符号为:Cl-;
(2)硒元素名称带“石”字旁,属于非金属元素,其原子最外层电子数是6,在化学反应中得到2个电子,因此在化合物中显-2价,钠元素在化合物中显+1价,则形成的化合物的化学式为Na2Se;
(3)①根据质量守恒定律,化学反应前后原子的种类和数目不变,则在第二个方框还需补充一个相同的分子,在生成物方框中还需补充一个氢分子,故补充图为: ;
②根据具体的原子和微观反应示意图可以得出反应方程式为:。
15.(1)一个钠原子
(2)B
【详解】(1)Na除了表示钠元素、金属钠单质,还能表示一个钠原子。
(2)A、原子是由原子核和核外电子构成,该选项说法正确;
B、在化学变化中,原子不能再分,该选项说法不正确;
C、氯化钠是由钠离子和氯离子构成,该选项说法正确;
D、在钠原子和氯原子形成氯化钠的过程中,钠原子失去电子,氯原子得到电子,该选项说法正确。
故选B。
16.(1) ①②⑤⑦ ③④⑥⑧⑨⑩
(2) 二氧化硫 氧气 氮气 二氧化碳
(3) He Na 氩 Ba 氯 钙
【详解】(1)①冰水混合物是由水一种物质组成的,属于纯净物;
②铁水是由一种物质组成的,属于纯净物;
③过氯化氢溶液是由过氧化氢和水组成的,属于混合物;
④洁净的空气中含有氮气、氧气等多种物质,属于混合物;
⑤液氮是由一种物质组成的,属于纯净物;
⑥稀有气体中含有氦气、氖气等多种物质,属于混合物;
⑦二氧化碳是由一种物质组成的,属于纯净物;
⑧澄清石灰水是由氢氧化钙和水组成的,属于混合物;
⑨人能喝的水中含有水、可溶性物质等,属于混合物;
⑩高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,高锰酸钾制氧气的剩余物为锰酸钾和二氧化锰,属于混合物;
故①②⑤⑦属于纯净物;③④⑥⑧⑨⑩属于混合物;
(2)①二氧化硫属于空气污染物;
②氧气能支持燃烧;
③氮气的化学性质稳定,可在食品包装中用作保护气;
④绿色植物光合作用吸收的气体是二氧化碳;
(3)书写元素符号时应注意:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
①氦的元素符号表示为He;
②钠的元素符号表示为Na;
③Ar的元素名称为氩;
④钡的元素符号表示为Ba;
⑤Cl的元素名称为氯;
⑥Ca的元素名称为钙。
17. 递增(或增大) 强 氖 原子的最外层电子数相等(或原子的最外层电子数都是3)
【详解】(1)在同一周期中,从左到右,各元素的原子序数依次递增,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强,因此除稀有气体元素外,同一周期元素金属性逐渐减弱,非金属性逐渐增强,第三周期中氯元素的非金属性比硫元素的非金属性强;
(2)氧元素的离子有10个电子,和氖原子具有相同的核外电子排布;
(3)原子序数为5和13的原子排在同一纵行,它们的最外层电子数相同。
18. 11 金属 失去 A
【详解】(1)在原子中质子数等于电子数,所以x的值是2+8+1=11,所以M元素是钠元素,属于金属元素,该元素的原子最外层电子数是1,小于4,在化学反应中易失去电子。
(2)M元素原子的最外层电子数与A的最外层电子数相同,元素的化学性质相似。
19. Ni; 58.69; 金属。
【详解】(1)根据元素周期表中的一格可知,字母表示该元素的元素符号,则镍的元素符号是Ni;
(2)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为58.69;
(3)镍带“钅”字旁,属于金属元素。
20.(1)三/3
(2)Al3+
(3)8
【详解】(1)根据质子数决定元素的种类,由四种粒子的结构示意图可知,核内的质子数有三种,共表示三种元素;
(2)阳离子中,质子数>核外电子数,在A中,核内质子数是13,核外电子数是10,是带有3个单位正电荷的阳离子—铝离子,离子符号为:Al3+;
(3)D的质子数为18,表示氩元素,属于稀有气体元素,达到稳定结构,故D表示氩原子结构示意图,在原子中,核内质子数等于核外电子数,则x=18-2-8=8。
21.(1) 11 6
(2)Na
(3) 得到 O2-
(4)③和④/④和③
【详解】(1)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。原子中:质子数=核外电子数,则x=2+8+1=11;8=2+y,y=6;
(2)根据元素的简单分类方法,最外层电子数大于4,一般为非金属元素,最外层电子数小于4,一般为金属元素。根据给出的原子结构示意图中,只有氢原子和钠原子的最外层电子数不超过4个,钠元素汉字名称中带“钅”字旁,属于金属元素,氢元素名称中没有带“钅”字旁,属于非金属元素,钠元素符号为Na;
(3)氧原子的最外层电子数为6,在化学反应中易得到2个电子达到8电子的稳定结构,因此形成O2-;
(4)物质的化学性质决定于原子的最外层电子数,最外层电子数相同,具有相似的化学性质,氢和钠最外层都是1个电子,但氢是非金属元素,化学性质与金属元素的化学性质有很大的差别,属特例,而氧和硫原子的最外层电子都为6个,化学性质相似,故选③和④。
22. ④ 实心 卢瑟福实验(或α粒子散射实验) 原子核带正电,α粒子带正电,当α粒子靠近原子核时受到原子核的斥力 极少数的α粒子撞击到原子核,原子核质量远远大于α粒子 核式
【详解】(1)道尔顿的学说内容是:原子是一个坚硬的小球,所以是一个实心球体,只有④符合;这种模型是一种实心球体结构;
(2)1911年著名物理学家卢瑟福等人做了一个著名的“卢瑟福实验”(或α粒子散射实验):用一束带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,甚至有极少数的α粒子被反弹了回来.有极少数的α粒子被反弹了回来,说明遇到了质量很大的东西,即原子核质量很大,且带正电荷;大多数α粒子能穿过金箔且不改变原来的前进方向,说明原子核的体积很小,原子核外空间很大;一小部分改变了原来的方向,又因为原子核带正电,α粒子带正电,所以遇到了带正电的微粒才改变了方向。卢瑟福根据α粒子散射实验建立了原子的核式结构模型;
(3)原子由位于原子中心的原子核与核外绕原子核做圆周运动的电子组成,原子核由质子与中子组成。
23.(1) A CD
(2)ABD
(3) A C
(4)D
【详解】(1)阳离子的质子数大于电子数,如图,A中质子数是12 大于核外10个电子;属于阳离子;
原子里质子数等于电子数,如图,C中质子数等于电子数都是12 ,D中质子数等于电子数都是10,故都属于原子;
(2)如图所示,电子数相同的微粒有ABD,电子数都是10;
(3)质子数相同的原子统称为元素,因此属于同种元素的是A和C质子数都是12 ;
(4)D质子数即原子序数是10,即10号元素氖元素,属于稀有气体元素。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
人教版九年级上册第3单元物质构成的奥秘同步练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下图所示的粒子中,化学性质最稳定的是
A. B. C. D.
2.下列结构示意图表示阳离子的是
A. B. C. D.
3.研究人员使用加速器使第30号元素锌的原子加速,然后撞击第83号元素铋的原子,使二者原子核融合在一起而得到113号元素Nh。它有一个巨大的原子核,包含113个质子和173个中子。下列有关说法错误的是
A.第30号元素为金属元素 B.Nh的相对原子质量为286g
C.Nh的原子序数为113 D.第83号元素的原子核外有83个电子
4.关于下列几种微粒结构示意图的说法不正确的是
A.只有②是离子 B.①和③属同种元素
C.①和④化学性质相似 D.①属非金属元素
5.下列元素中属于金属元素的是
A.氢 B.碳 C.铁 D.氧
6.国际互联网上报道:目前世界上有近20亿人患有缺铁性贫血。为了全民的身体健康,我国卫生部推广使用加铁酱油。这里的“铁”指的是
A.铁单质 B.铁原子 C.铁元素 D.四氧化三铁
7.能反映“分子在不断运动”这一事实的中国古诗句是
A.绿树荫浓夏日长 B.楼台倒映入池塘
C.遥望洞庭山水翠 D.满架蔷薇一院香
8.下列事实不能说明“分子在不断运动”的是
A.水加糖变甜 B.二氧化碳气体被压缩成干冰
C.湿衣服在太阳下被晒干 D.花棚里香气扑鼻
9.下列微粒结构示意图中,表示阳离子的是
A. B. C. D.
10.下列物质由原子直接构成的是
A.二氧化碳 B.氯化钠 C.氧气 D.金
二、综合应用题
11.我们用化学学科认识事物的方式全面了解认识“空气”。
(1)从物质分类角度:新鲜的空气属于 (填“混合物”或“纯净物”)
(2)从构成物质的微粒角度用“○”表示氧原子,“●”表示氮原子
①用“”可表示的微粒是
②同温度下,气体的体积比等于分子数目比。若空气中其他成分忽略不计,下列可表示空气微观模型的是 (填序号)
(3)从环保角度:下列做法有利于净化空气的是 (填序号)
①使用清洁能源代替煤和石油 ②多使用“共享单车”
③实施绿化工程,减少扬尘污染 ④分类回收垃圾,并露天焚烧
(4)如图为一款新型环保车,可通过 360°旋转的“大炮筒”向四周喷水,从而缓解极端恶劣天气给人带来的不适。分析这款环保车喷水的作用是
(5)实验探究角度:如图所示的实验进行空气成分的测定。
①实验前,应首先检查 确保实验成功。
②写出红磷燃烧的化学方程式 该实验中红磷应取过量的原因
③实验中,待集气瓶冷却至室温时,打开弹簧夹,观察到的现象是
④该实验中能不能用木炭代替红磷,并说明理由
12.阅读下面两条信息,回答问题。
信息一:金是一种广受欢迎的贵金属,有金黄色金属光泽,密度大,延展性好,而且金非常稳定,与大多数物质都不发生反应,常用来加工首饰。
信息二:金元素在自然界的含量非常稀少,它的化学符号是Au,原子序数是79,相对原子质量是197.00。
(1)根据信息一:找出金的物理性质和化学性质(各一条)
物理性质: ;
化学性质: 。
(2)金原子的核外电子数是 ;质子数是 ;中子数是 。
13.化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
(1)D中仪器a的名称是 。
(2)若用高锰酸钾制取并收集干燥的氧气,应选择装置的最佳组合是 (填字母,下同);实验结束后,为了鉴定收集到的气体是否是氧气,小红同学用带火星的木条伸入集气瓶内却看不到复燃现象,导致这种现象的原因是: 。(写一个)
(3)若用过氧化氢溶液来制取氧气时,发生装置应选用 (填字母),为防止气体从发生装置泄漏的必要措施是什么?
(4)F装置有多种用途,利用该装置收集一瓶氧气应如何操作? 。
(5)已知一个碳12原子的质量为1.993×10-26kg,一个氧原子的质量为2.657×10-26kg,求:
①氧原子的相对原了质量(结果保留整数) ;
②一般情况下,一个氧原子中有多少个中子?
三、填空与简答
14.下图是一些微粒的结构示意图和硒元素的相关信息,回答下列问题:
(1)A、B、C中属于阴离子的是 ,其离子符号为 ;
(2)硒元素属于 (填“金属”或“非金属”)元素,硒元素和钠元素组成化合物的化学式 。
(3)下图是工业上制备H2的某个反应的微观示意图,回答下列问题:
①请将图示B、C两个方框中的微观粒子示意图补画完全 ,使反应成立。
②请用化学方程式表示该反应: 。
15.在“宏观一微观一符号”之间建立联系,是化学学科特有的思维方式,能帮助我们更好地认识物质及其变化本质。请完成下列问题:
(1)图1中“Na”符号表示多种信息,如表示钠元素、金属钠单质,还能表示 。
(2)钠可以在氯气中燃烧生成氯化钠,反应示意图如图2所示,结合所学知识,下列说法不正确的是______(填序号)。
A.原子都是由原子核和核外电子构成的
B.原子在化学变化中可以再分成更小的粒子
C.氯化钠是由钠离子和氯离子构成的
D.在钠原子和氯原子形成氯化钠的过程中,得到电子的是氯原子
16.回答问题
(1)以下物质中属于纯净物的是 (填序号,下间),属于混合物的是 。
①冰水混合物 ②铁水 ③过氯化氢溶液 ④洁净的空气 ⑤液氮 ⑥稀有气体 ⑦二氧化碳 ⑧澄清石灰水 ⑨人能喝的水 ⑩高锰酸钾制氧气的剩余物。
(2)氢气、氧气、氮气、二氧化碳、二氧化硫、稀有气体等,按要求将相应物质的名称填写在题中的空白处。
①属于空气污染物的气体是 。
②能支持燃烧的气体是 。
③食品包装中常用作保护气的是 。
④绿色植物光合作用吸收的气体是 。
(3)写出下列元素符号或元素名称
①氦 。②钠 。③Ar 。
④钡 。⑤Cl 。⑥Ca 。
17.下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题。
(1)同一周期的元素,从左到右,各元素的原子序数依次 ,金属性逐渐减弱,非金属性逐渐增强,则第三周期中氯元素的非金属性比硫元素的非金属性 (填“强”或“弱”)。
(2)氧元素的离子与 (写元素名称)原子具有相同的核外电子数。
(3)原子序数为5和13的原子排在同一纵行,则它们在原子结构上的相似之处是 。
18.M元素组成的一种物质可用于原子反应堆的导热剂,其原子结构示意图如下。
(1)x的值是 ,M元素属于 (选填“金属”或“非金属”)元素,该元素的原子在化学反应中易 (填“得到”或“失去”)电子。
(2)M元素的化学性质与下列 (填序号)元素的化学性质相似。
19.我市有丰富的镍钼矿资源,如图是元素周期表中镍元素的有关信息示意图,请你写出从图中获得的两条信息。
(1)镍的元素符号是 。
(2)镍的相对原子质量是 。
(3)镍属于 (金属或非金属)元素。
20.下图中A、B、C、D是四种粒子的结构示意图,请根据图示信息回答下列问题:
(1)图中A、B、C、D粒子共表示 种元素。
(2)A、B、C、D中表示阳离子的离子符号为 。
(3)D中x=
21.已知下图为氢、钠、氧、硫四种元素的原子结构示意图,回答下列问题:
(1)x= ,y= ;
(2)以上属于金属元素的原子的是 (填元素符号);
(3)氧原子在化学反应中容易 (得到或失去)电子,形成的离子的符号是 ;
(4)以上四种元素中,化学性质相似的是 (填序号)。
22.如下表:原子结构是通过科学家不断地建立与修正原子结构模型,不断地实验,不断地思考研究而得到的.下表是原子结构模型的几种学说
时间 模型类型 科学家 内容
1803年 道尔顿模型 道尔顿(英国) 原子是一个坚硬的小球
1897年 汤姆生模型 汤姆生(英国) 发现电子,即“西瓜模型”正电荷是西瓜肉,电子是西瓜籽
1911年 卢瑟福模型 卢瑟福(英国) 发现原子核,原子大部分体积是空的,电子围绕带正电的原子核随意动转
1913年 分层模型 玻尔(丹麦) 电子在固定轨道上分层运动(绕着原子核)
现代 电子云模型 电子出现在原子核周围,有的区域次数多,有的区域次数少
(1)上面四种原子结构模型中道尔顿的原子结构模式是 (填序号),这种原子模型是一种 结构.
(2)1911年,卢瑟福通过实验发现原子结构,所做的实验名称是 ,实验中大多数α微粒不改变原来的运动方向,顺利通过.有一小部分α微粒发生了偏转,原因是 ;极少数α微粒被反弹了回来,原因是 .因此,卢瑟福根据实验建立了 原子模型.
(3)请用框图的形式表示原子的结构: 。
23.“宏观一微观一符号”是化学视角认识物质的方法。根据下列图示回答问题:
(1)①图中表示阳离子的是 (填序号,下同);②表示原子的是 。
(2)图中电子数相同的微粒有 。
(3)图中表示同种元素的是 和 。
(4)图中表示稀有气体的是 。
参考答案:
1.B
【详解】粒子中,化学性质最稳定的是要达到稳定的电子结构,即只有一层,最外层是2个电子,含有多个电子层,最外层有8个电子称为相对稳定结构。
故选B。
2.C
【详解】A.核电荷数=质子数=核外电子数=2+8+6=16,为原子;
B.核电荷数=质子数=核外电子数=2+8=10,为原子;
C.核电荷数=质子数=11>核外电子数=2+8=10,为阳离子;
D.核电荷数=质子数=8<核外电子数=2+8=10,为阴离子。
故选C。
3.B
【详解】A、第30号元素锌为金属元素,选项正确;B、相对原子质量没有单位,选项错误;C、Nh的原子序数为113,选项正确;D、原子序数等于质子数等于核外电子数,选项正确。故本题选B。
4.A
【详解】A、①中质子数=核外电子数,表示原子,②中质子数大于核外电子数,表示阳离子,③质子数小于核外电子数,表示阴离子,④中质子数=核外电子数,表示原子,故②和③属于离子,符合题意;
B、元素是质子数相同的一类原子的总称,①和③质子数相同,属于同种元素,不符合题意;
C、①和④最外层电子数相同,均是7,化学性质相似,不符合题意;
D、质子数=原子序数,9号元素是氟元素,由“气”字旁可知,氟元素属于非金属元素,不符合题意。
故选A。
5.C
【详解】根据中文元素名称的偏旁可以确定元素的类别。铁是“钅”旁,属于金属元素;氢、氧是“气”字头,属于气态非金属元素;碳是“石”旁,属于固态非金属元素。故选C。
6.C
【详解】人体需要的是铁元素可预防贫血,酱油中添加的是含有铁元素的物质,铁单质、铁原子、四氧化三铁都是不溶于水的固体,酱油中没有明显的固体物质,故选:C。
7.D
【详解】A、绿树荫浓夏日长,是光沿直线传播,故A 不正确;
B、楼台倒映入池塘,是光的反射,故B不正确;
C、遥望洞庭山水翠,不能说明分子在不断运动,故C不正确;
D、满架蔷薇一院香,是因为分子在不断运动,引起香味的分子四处扩散,故D正确。
故选D。
8.B
【分析】根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,结合事实进行分析判断即可。
【详解】A、水加糖变甜,是因为糖分子是在不断运动的,运动到水分子中间去了,能说明分子在不停运动的,故A正确;B、二氧化碳气体被压缩成干冰,是因为是分子间有间隔,压强增大,分子间间隔变小,不能说明分子在不停运动的,故B错误;C、湿衣服在太阳下被晒干,是因为水分子是在不断运动的,向四周扩散,运动到空气中去了,能说明分子在不停运动的,故C正确;D、花棚里香气扑鼻,是因为花香中含有的分子是在不断运动的,向四周扩散,使人们闻到花香,能说明分子在不停运动的,故D正确。故选B。
9.B
【详解】在微粒的结构示意图中,质子数=核外电子数,为原子;质子数>核外电子数,为阳离子;质子数<核外电子数,为阴离子。
A、质子数为8,电子数为10,质子数<核外电子数,为阴离子,不符合题意;
B、质子数为12,电子数为10,质子数>核外电子数,为阳离子,符合题意;
C、质子数为12,电子数为12,质子数=核外电子数,为原子,不符合题意;
D、质子数为13,电子数为13,质子数=核外电子数,为原子,不符合题意。
故选B。
10.D
【详解】试题分析:由原子构成的物质有:①金属单质、②大多数的固态非金属单质(常温)③稀有气体。D项金属于金属单质,为原子直接构成。所以应选D项。
考点:构成物质的微粒
11. 混合物 O2或氧分子 C ①②③ 降低空气中的粉尘(答案合理即可) 装置的气密性 4P+5O22P2O5 装置内空气中的氧气反应完全 烧杯中的水进入集气瓶中,且占集气瓶容积的五分之一 不能,木条燃烧生成二氧化碳气体,瓶内压强变化不明显。
【详解】(1)空气中含有氮气、氧气等多种物质属于混合物;
(2)图A错误,空气中氮气和氧气应该均匀混合;图B错误,空气中氮气和氧气应该均匀混合;图C正确,空气中的氮气和氧气均匀混合,且氧气与氮气的分子个数比为1:4;图D错误,氧气与氮气的分子个数比为1:5;
(3)从环保角度:下列做法有利于净化空气的是①使用清洁能源代替煤和石油,减少二氧化碳的排放②多使用“共享单车”出行,减少汽车尾气的排放③实施绿化工程,减少扬尘污染 ④露天焚烧垃圾会产生有毒有害气体,不利于净化空气。
(4)降低空气中的粉尘,增加空气湿度。(答案合理即可)
(5)做测定空气中氧气含量的实验前,一定要检查装置的气密性;红磷在氧气点燃反应原理是:4P+5O22P2O5;红磷应取过量是为了保证集气瓶内的氧气全部反应完全,使实验结果测量更准确;烧杯中的水进入集气瓶中,且占集气瓶容积的五分之一;实验中不能吧红磷换成木炭,木炭燃烧生成二氧化碳气体,瓶内压强变化不明显。
12. 有金黄色金属光泽,密度大,延展性好 金非常稳定,与大多数物质都不发生反应 79 79 118
【详解】(1)根据信息一,金的物理性质有:有金黄色金属光泽,密度大,延展性好;金的化学性质有:金非常稳定,与大多数物质都不发生反应;
(2)金原子的核外电子数是79;质子数是79;中子数=197-79=118。
13.(1)集气瓶
(2) BD 收集的气体不纯净(或装置漏气,没有收到氧气)
(3) A 长颈漏斗下端要插到液面以下
(4)装满水,从b端通入氧气(或倒掉瓶内液体,从c端通入氧气)
(5) 相对原子质量= 8
【解析】(1)
仪器a是集气瓶,常用于收集并储存气体。
(2)
高锰酸钾制取氧气需要加热条件,故应选择装置B作发生装置,氧气不易溶于水,密度比空气大,可用排水法和向上排空气法收集气体,若需收集干燥的氧气应采用向上排空气收集,故应选择装置D作收集装置。氧气具有助燃性,能使带火星的木条复燃,该操作中未观察到木条复燃可能是由于氧气不纯,氧气的浓度不足以使带火星的木条复燃,其原因可能是装置气密性不好,或者集气瓶内的空气未完全排净就停止了收集。
(3)
过氧化氢溶液制取氧气时不需要加热,应选择装置A作发生装置。利用该装置制取氧气时,为防止气体从发生装置泄漏,长颈漏斗的下端应伸到液面以下进行液封。
(4)
氧气不易溶于水,利用该装置收集氧气时应先将装置装满水,然后从b端通入氧气,从c端排出水,只有这样才能达到排出水收集气体的目的。氧气的密度比空气大,也可用向上排空气法收集气体,此时装置不装水,从c端通入氧气,然后从b端排出空气。
(5)
①原子的相对原子质量是以一种碳原子质量的1/12为标准,其它原子的质量与它相比较所得到的比,故氧原子的相对原子质量=。
②相对原子质量≈质子数+中子数,氧原子的相对原子质量是16,氧原子核内的质子数是8,故一般情况下,一个氧原子中的中子数=16-8=8。
14.(1) C Cl-
(2) 非金属 Na2Se
(3)
【详解】(1)原子在得到电子形成阴离子,阴离子的质子数小于核外电子数,则A、B、C中属于阴离子的是C,C是氯离子,其离子符号为:Cl-;
(2)硒元素名称带“石”字旁,属于非金属元素,其原子最外层电子数是6,在化学反应中得到2个电子,因此在化合物中显-2价,钠元素在化合物中显+1价,则形成的化合物的化学式为Na2Se;
(3)①根据质量守恒定律,化学反应前后原子的种类和数目不变,则在第二个方框还需补充一个相同的分子,在生成物方框中还需补充一个氢分子,故补充图为: ;
②根据具体的原子和微观反应示意图可以得出反应方程式为:。
15.(1)一个钠原子
(2)B
【详解】(1)Na除了表示钠元素、金属钠单质,还能表示一个钠原子。
(2)A、原子是由原子核和核外电子构成,该选项说法正确;
B、在化学变化中,原子不能再分,该选项说法不正确;
C、氯化钠是由钠离子和氯离子构成,该选项说法正确;
D、在钠原子和氯原子形成氯化钠的过程中,钠原子失去电子,氯原子得到电子,该选项说法正确。
故选B。
16.(1) ①②⑤⑦ ③④⑥⑧⑨⑩
(2) 二氧化硫 氧气 氮气 二氧化碳
(3) He Na 氩 Ba 氯 钙
【详解】(1)①冰水混合物是由水一种物质组成的,属于纯净物;
②铁水是由一种物质组成的,属于纯净物;
③过氯化氢溶液是由过氧化氢和水组成的,属于混合物;
④洁净的空气中含有氮气、氧气等多种物质,属于混合物;
⑤液氮是由一种物质组成的,属于纯净物;
⑥稀有气体中含有氦气、氖气等多种物质,属于混合物;
⑦二氧化碳是由一种物质组成的,属于纯净物;
⑧澄清石灰水是由氢氧化钙和水组成的,属于混合物;
⑨人能喝的水中含有水、可溶性物质等,属于混合物;
⑩高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,高锰酸钾制氧气的剩余物为锰酸钾和二氧化锰,属于混合物;
故①②⑤⑦属于纯净物;③④⑥⑧⑨⑩属于混合物;
(2)①二氧化硫属于空气污染物;
②氧气能支持燃烧;
③氮气的化学性质稳定,可在食品包装中用作保护气;
④绿色植物光合作用吸收的气体是二氧化碳;
(3)书写元素符号时应注意:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
①氦的元素符号表示为He;
②钠的元素符号表示为Na;
③Ar的元素名称为氩;
④钡的元素符号表示为Ba;
⑤Cl的元素名称为氯;
⑥Ca的元素名称为钙。
17. 递增(或增大) 强 氖 原子的最外层电子数相等(或原子的最外层电子数都是3)
【详解】(1)在同一周期中,从左到右,各元素的原子序数依次递增,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强,因此除稀有气体元素外,同一周期元素金属性逐渐减弱,非金属性逐渐增强,第三周期中氯元素的非金属性比硫元素的非金属性强;
(2)氧元素的离子有10个电子,和氖原子具有相同的核外电子排布;
(3)原子序数为5和13的原子排在同一纵行,它们的最外层电子数相同。
18. 11 金属 失去 A
【详解】(1)在原子中质子数等于电子数,所以x的值是2+8+1=11,所以M元素是钠元素,属于金属元素,该元素的原子最外层电子数是1,小于4,在化学反应中易失去电子。
(2)M元素原子的最外层电子数与A的最外层电子数相同,元素的化学性质相似。
19. Ni; 58.69; 金属。
【详解】(1)根据元素周期表中的一格可知,字母表示该元素的元素符号,则镍的元素符号是Ni;
(2)根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为58.69;
(3)镍带“钅”字旁,属于金属元素。
20.(1)三/3
(2)Al3+
(3)8
【详解】(1)根据质子数决定元素的种类,由四种粒子的结构示意图可知,核内的质子数有三种,共表示三种元素;
(2)阳离子中,质子数>核外电子数,在A中,核内质子数是13,核外电子数是10,是带有3个单位正电荷的阳离子—铝离子,离子符号为:Al3+;
(3)D的质子数为18,表示氩元素,属于稀有气体元素,达到稳定结构,故D表示氩原子结构示意图,在原子中,核内质子数等于核外电子数,则x=18-2-8=8。
21.(1) 11 6
(2)Na
(3) 得到 O2-
(4)③和④/④和③
【详解】(1)原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层。原子中:质子数=核外电子数,则x=2+8+1=11;8=2+y,y=6;
(2)根据元素的简单分类方法,最外层电子数大于4,一般为非金属元素,最外层电子数小于4,一般为金属元素。根据给出的原子结构示意图中,只有氢原子和钠原子的最外层电子数不超过4个,钠元素汉字名称中带“钅”字旁,属于金属元素,氢元素名称中没有带“钅”字旁,属于非金属元素,钠元素符号为Na;
(3)氧原子的最外层电子数为6,在化学反应中易得到2个电子达到8电子的稳定结构,因此形成O2-;
(4)物质的化学性质决定于原子的最外层电子数,最外层电子数相同,具有相似的化学性质,氢和钠最外层都是1个电子,但氢是非金属元素,化学性质与金属元素的化学性质有很大的差别,属特例,而氧和硫原子的最外层电子都为6个,化学性质相似,故选③和④。
22. ④ 实心 卢瑟福实验(或α粒子散射实验) 原子核带正电,α粒子带正电,当α粒子靠近原子核时受到原子核的斥力 极少数的α粒子撞击到原子核,原子核质量远远大于α粒子 核式
【详解】(1)道尔顿的学说内容是:原子是一个坚硬的小球,所以是一个实心球体,只有④符合;这种模型是一种实心球体结构;
(2)1911年著名物理学家卢瑟福等人做了一个著名的“卢瑟福实验”(或α粒子散射实验):用一束带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,甚至有极少数的α粒子被反弹了回来.有极少数的α粒子被反弹了回来,说明遇到了质量很大的东西,即原子核质量很大,且带正电荷;大多数α粒子能穿过金箔且不改变原来的前进方向,说明原子核的体积很小,原子核外空间很大;一小部分改变了原来的方向,又因为原子核带正电,α粒子带正电,所以遇到了带正电的微粒才改变了方向。卢瑟福根据α粒子散射实验建立了原子的核式结构模型;
(3)原子由位于原子中心的原子核与核外绕原子核做圆周运动的电子组成,原子核由质子与中子组成。
23.(1) A CD
(2)ABD
(3) A C
(4)D
【详解】(1)阳离子的质子数大于电子数,如图,A中质子数是12 大于核外10个电子;属于阳离子;
原子里质子数等于电子数,如图,C中质子数等于电子数都是12 ,D中质子数等于电子数都是10,故都属于原子;
(2)如图所示,电子数相同的微粒有ABD,电子数都是10;
(3)质子数相同的原子统称为元素,因此属于同种元素的是A和C质子数都是12 ;
(4)D质子数即原子序数是10,即10号元素氖元素,属于稀有气体元素。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
