化学人教版(2019)第二册6.2.3化学反应限度及调控(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)第二册6.2.3化学反应限度及调控(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-25 16:12:46 | ||
图片预览





文档简介
(共21张PPT)
1、借助原电池装置和原理的学习,体会化学能到电能的直接转化,提高模型认知能力,学习科学探究方法。
化学反应的限度。
化学反应的限度。
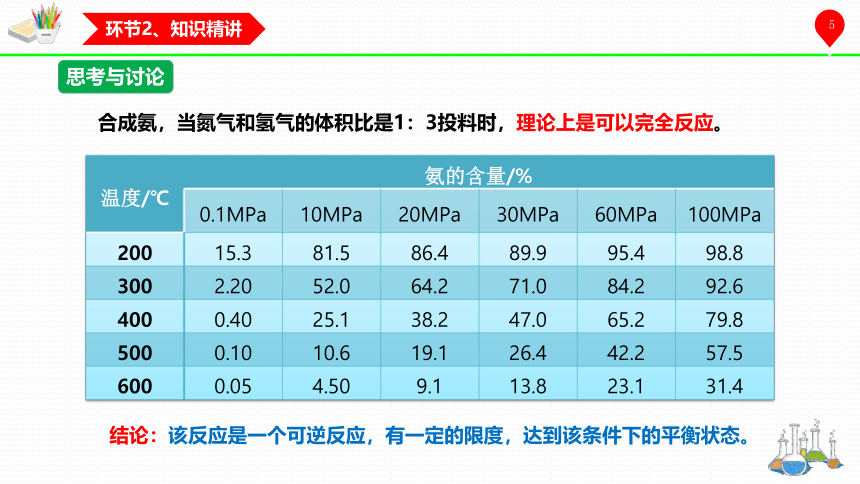
合成氨,当氮气和氢气的体积比是1:3投料时,理论上是可以完全反应。
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
思考与讨论
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
取5 mL 0.1 mol/L KI溶液,向其中滴入0.1 mol/L FeCl3溶液5~6滴,继续加入2 mL CCl4,充分振荡。取上层清液,滴入2滴KSCN溶液。
实验探究
化学方程式
CCl4层现象
上层清液现象
2Fe3+ + 2I- === 2Fe2+ + I2
紫红色
血红色
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
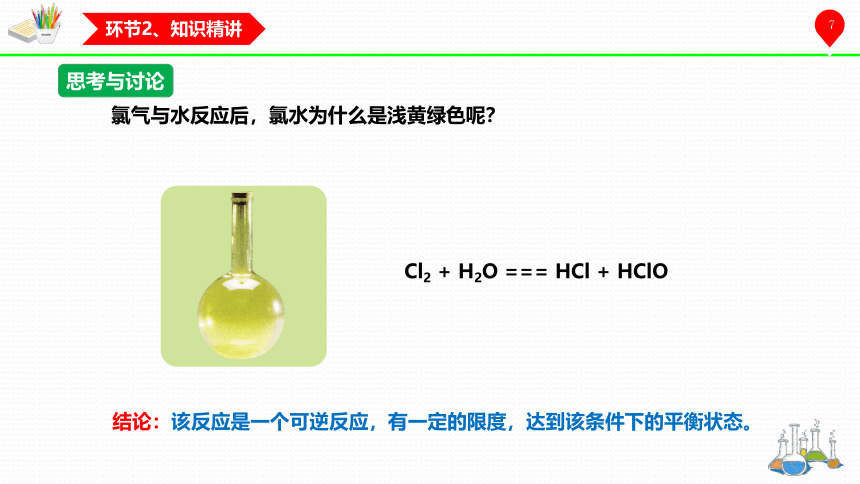
思考与讨论
氯气与水反应后,氯水为什么是浅黄绿色呢?
Cl2 + H2O === HCl + HClO
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
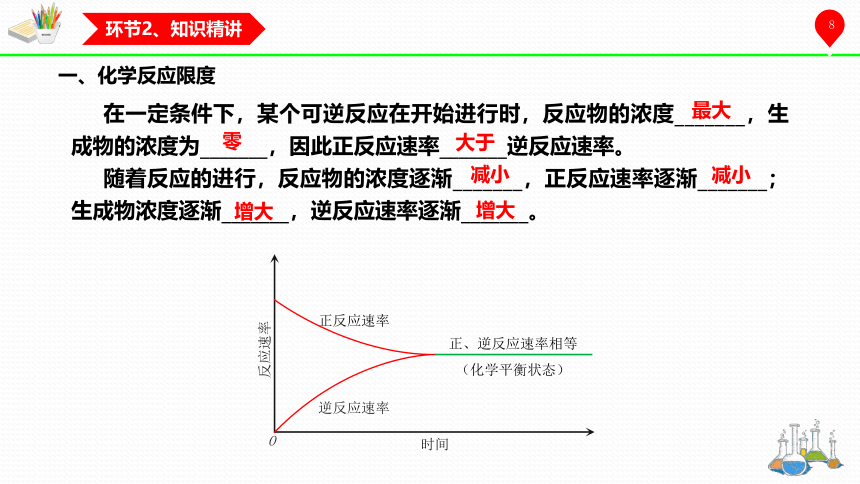
一、化学反应限度
反应速率
时间
正反应速率
逆反应速率
O
正、逆反应速率相等
(化学平衡状态)
在一定条件下,某个可逆反应在开始进行时,反应物的浓度_______,生成物的浓度为_______,因此正反应速率_______逆反应速率。
随着反应的进行,反应物的浓度逐渐_______,正反应速率逐渐_______;生成物浓度逐渐_______,逆反应速率逐渐_______。
最大
零
大于
减小
减小
增大
增大
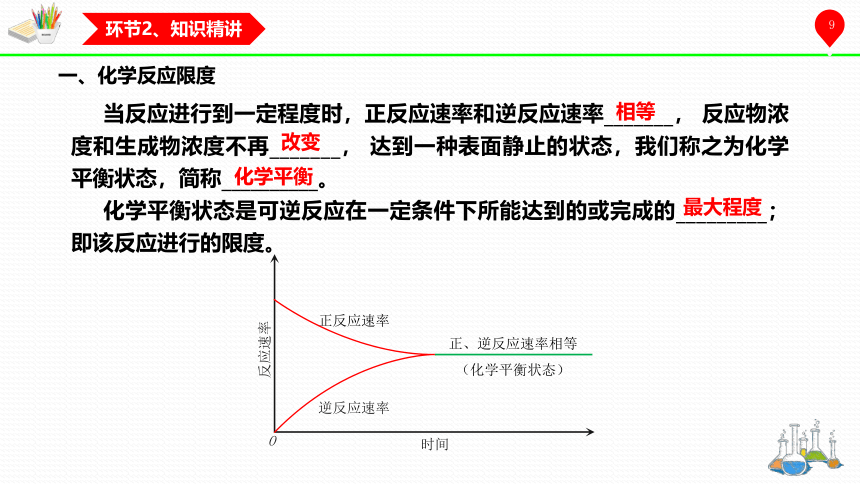
一、化学反应限度
反应速率
时间
正反应速率
逆反应速率
O
正、逆反应速率相等
(化学平衡状态)
当反应进行到一定程度时,正反应速率和逆反应速率_______, 反应物浓度和生成物浓度不再_______, 达到一种表面静止的状态,我们称之为化学平衡状态,简称__________。
化学平衡状态是可逆反应在一定条件下所能达到的或完成的_________;即该反应进行的限度。
相等
改变
化学平衡
最大程度
二、化学平衡状态的特点
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量__________
动
υ正 ____ υ逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
“表现”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
三、化学平衡状态的判断
例1、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
①③
=系数之比
υ正
υ逆
即:
一看有无正逆,二看是否等于系数之比。
解题方法:
“正、逆速率”——“相等”
标志一
a、各物质的质量、物质的量、分子数目保持不变。
b、各物质的物质的量浓度、质量分数保持不变。
c、反应物的转化率、生成物的产率保持不变。
“变量”——“不变”
①一定是变量的物理量——单一物质
标志二
三、化学平衡状态的判断
例2、 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
判断这个物理量是否为变量
解题方法:
“变量”——“不变”
标志二
三、化学平衡状态的判断
例3、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
“变量”——“不变”
标志二
三、化学平衡状态的判断
b、混合气体的M= ,要根据气体的m总、n总来确定混合气体的M是否为变量。
m总
n总
②不一定是变量的物理量——混合气体
“变量”——“不变”
标志二
三、化学平衡状态的判断
a、混合气体的n总、V总(恒T、P)、P总(恒T、V),一切只看n总是否为变量。
m总
V总
c、混合气体的ρ= ,要根据气体的m总和V总来确定混合气体的ρ是否为变量。
四、化学反应条件的控制
合成氨反应的数据分析:下表的实验数据是在不同温度、压强下,平衡混合物中氨的含量的变化情况(初始时氮气和氢气的体积比是1:3)。
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
压强越大,NH3%越大。
温度越低,NH3%越大。
化学平衡状态:
标志一:
逆、动、等、定、变
标志二:变量→不变
一定是变量的物理量
不一定是变量的物理量
化学反应的调控
化学平衡状态的判断
化学反应限度
=系数之比
υ正
υ逆
练习1、在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如图所示。下列有关说法正确的是( )
A、t1时刻,反应逆向进行
B、t2时刻,正反应速率大于逆反应速率
C、t3时刻,达到反应进行的限度
D、t4时刻,反应处于平衡状态,反应停止
B
反应速率
时间
正反应速率
逆反应速率
t
1
O
t
2
t
3
t
4
练习2、下列关于化学平衡状态的叙述错误的是( )
A、化学平衡是所有可逆反应都存在的一种状态
B、在给定条件下,达到平衡时可逆反应完成程度达到最大
C、达到平衡时,正、逆反应速率均为零
D、达到平衡时,反应物和生成物的浓度不再发生变化
C
练习3、一定条件下的密闭容器中,发生可逆反应N2(g) + 3H2(g) 2NH3(g)。下列情况不能说明该反应一定达到化学平衡的是( )
A、NH3 的质量保持不变
B、H2 的含量保持不变
C、正反应和逆反应的速率相等
D、N2、H2 和NH3 的物质的量之比为1∶3∶2
D
练习4、工业制硫酸中的一步重要反应是SO2 在400~500 ℃下的催化氧化:2SO2 + O2
A、使用催化剂是为了增大反应速率,提高生产效率
B、在上述条件下,SO2 不可能100%地转化为SO3
C、提高反应时的温度,可以实现SO2 的完全转化
D、通过调控反应条件,可以提高该反应进行的程度
催化剂
△
2SO3 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法错误的是( )
C
1、借助原电池装置和原理的学习,体会化学能到电能的直接转化,提高模型认知能力,学习科学探究方法。
化学反应的限度。
化学反应的限度。
合成氨,当氮气和氢气的体积比是1:3投料时,理论上是可以完全反应。
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
思考与讨论
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
取5 mL 0.1 mol/L KI溶液,向其中滴入0.1 mol/L FeCl3溶液5~6滴,继续加入2 mL CCl4,充分振荡。取上层清液,滴入2滴KSCN溶液。
实验探究
化学方程式
CCl4层现象
上层清液现象
2Fe3+ + 2I- === 2Fe2+ + I2
紫红色
血红色
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
思考与讨论
氯气与水反应后,氯水为什么是浅黄绿色呢?
Cl2 + H2O === HCl + HClO
结论:该反应是一个可逆反应,有一定的限度,达到该条件下的平衡状态。
一、化学反应限度
反应速率
时间
正反应速率
逆反应速率
O
正、逆反应速率相等
(化学平衡状态)
在一定条件下,某个可逆反应在开始进行时,反应物的浓度_______,生成物的浓度为_______,因此正反应速率_______逆反应速率。
随着反应的进行,反应物的浓度逐渐_______,正反应速率逐渐_______;生成物浓度逐渐_______,逆反应速率逐渐_______。
最大
零
大于
减小
减小
增大
增大
一、化学反应限度
反应速率
时间
正反应速率
逆反应速率
O
正、逆反应速率相等
(化学平衡状态)
当反应进行到一定程度时,正反应速率和逆反应速率_______, 反应物浓度和生成物浓度不再_______, 达到一种表面静止的状态,我们称之为化学平衡状态,简称__________。
化学平衡状态是可逆反应在一定条件下所能达到的或完成的_________;即该反应进行的限度。
相等
改变
化学平衡
最大程度
二、化学平衡状态的特点
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量__________
动
υ正 ____ υ逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
“表现”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
三、化学平衡状态的判断
例1、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
①③
=系数之比
υ正
υ逆
即:
一看有无正逆,二看是否等于系数之比。
解题方法:
“正、逆速率”——“相等”
标志一
a、各物质的质量、物质的量、分子数目保持不变。
b、各物质的物质的量浓度、质量分数保持不变。
c、反应物的转化率、生成物的产率保持不变。
“变量”——“不变”
①一定是变量的物理量——单一物质
标志二
三、化学平衡状态的判断
例2、 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
判断这个物理量是否为变量
解题方法:
“变量”——“不变”
标志二
三、化学平衡状态的判断
例3、恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
“变量”——“不变”
标志二
三、化学平衡状态的判断
b、混合气体的M= ,要根据气体的m总、n总来确定混合气体的M是否为变量。
m总
n总
②不一定是变量的物理量——混合气体
“变量”——“不变”
标志二
三、化学平衡状态的判断
a、混合气体的n总、V总(恒T、P)、P总(恒T、V),一切只看n总是否为变量。
m总
V总
c、混合气体的ρ= ,要根据气体的m总和V总来确定混合气体的ρ是否为变量。
四、化学反应条件的控制
合成氨反应的数据分析:下表的实验数据是在不同温度、压强下,平衡混合物中氨的含量的变化情况(初始时氮气和氢气的体积比是1:3)。
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
压强越大,NH3%越大。
温度越低,NH3%越大。
化学平衡状态:
标志一:
逆、动、等、定、变
标志二:变量→不变
一定是变量的物理量
不一定是变量的物理量
化学反应的调控
化学平衡状态的判断
化学反应限度
=系数之比
υ正
υ逆
练习1、在一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化的曲线如图所示。下列有关说法正确的是( )
A、t1时刻,反应逆向进行
B、t2时刻,正反应速率大于逆反应速率
C、t3时刻,达到反应进行的限度
D、t4时刻,反应处于平衡状态,反应停止
B
反应速率
时间
正反应速率
逆反应速率
t
1
O
t
2
t
3
t
4
练习2、下列关于化学平衡状态的叙述错误的是( )
A、化学平衡是所有可逆反应都存在的一种状态
B、在给定条件下,达到平衡时可逆反应完成程度达到最大
C、达到平衡时,正、逆反应速率均为零
D、达到平衡时,反应物和生成物的浓度不再发生变化
C
练习3、一定条件下的密闭容器中,发生可逆反应N2(g) + 3H2(g) 2NH3(g)。下列情况不能说明该反应一定达到化学平衡的是( )
A、NH3 的质量保持不变
B、H2 的含量保持不变
C、正反应和逆反应的速率相等
D、N2、H2 和NH3 的物质的量之比为1∶3∶2
D
练习4、工业制硫酸中的一步重要反应是SO2 在400~500 ℃下的催化氧化:2SO2 + O2
A、使用催化剂是为了增大反应速率,提高生产效率
B、在上述条件下,SO2 不可能100%地转化为SO3
C、提高反应时的温度,可以实现SO2 的完全转化
D、通过调控反应条件,可以提高该反应进行的程度
催化剂
△
2SO3 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法错误的是( )
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
