2024届高三化学二轮复习培优练6:“隔膜”电化学装置分析(含答案)
文档属性
| 名称 | 2024届高三化学二轮复习培优练6:“隔膜”电化学装置分析(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 568.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 09:50:27 | ||
图片预览

文档简介
培优练6 “隔膜”电化学装置分析
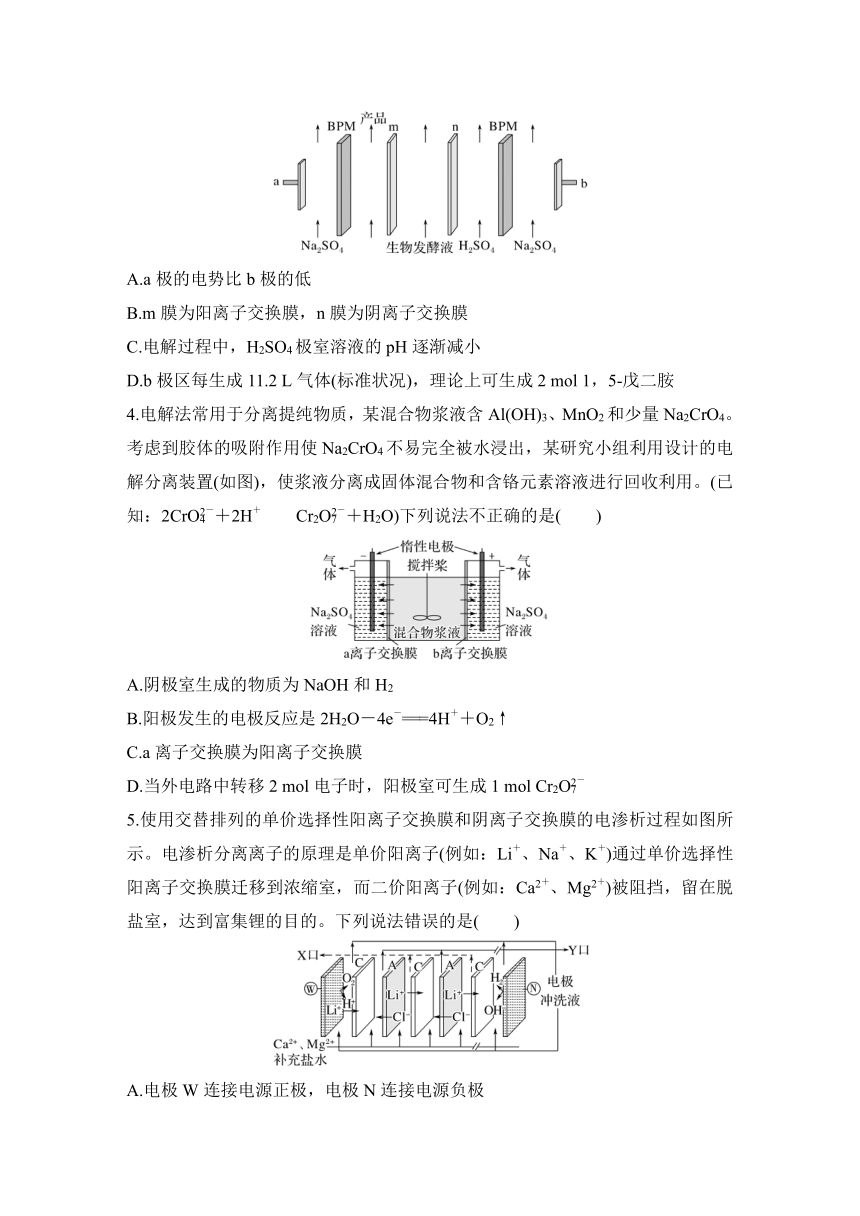
1.氯化氢回收氯气技术近年来为科学研究的热点。一种氯化氢电解回收氯气的原理如图。下列说法错误的是( )
A.石墨电极连接电源正极
B.H+ 透过交换膜从铂电极向石墨电极移动
C.阴极区域的反应为Fe3++e-===Fe2+、4Fe2++O2+4H+===4Fe3++2H2O
D.随着反应的进行,阴极区域电解质溶液pH 增大
2.某新型可充电钠离子电池放电时的工作原理如图所示,下列说法正确的是( )
A.放电时,Mo箔为电池的负极
B.充电时,电源的正极应与Mg箔连接
C.放电时,Na+通过交换膜从左室移向右室
D.充电时,阳极反应为Na2Fe[Fe(CN)6]-2e-===Fe[Fe(CN)6]+2Na+
3.1,5 戊二胺()是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5 戊二胺硫酸盐(含和SO)转换为1,5 戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( )
A.a极的电势比b极的低
B.m膜为阳离子交换膜,n膜为阴离子交换膜
C.电解过程中,H2SO4极室溶液的pH逐渐减小
D.b极区每生成11.2 L气体(标准状况),理论上可生成2 mol 1,5 戊二胺
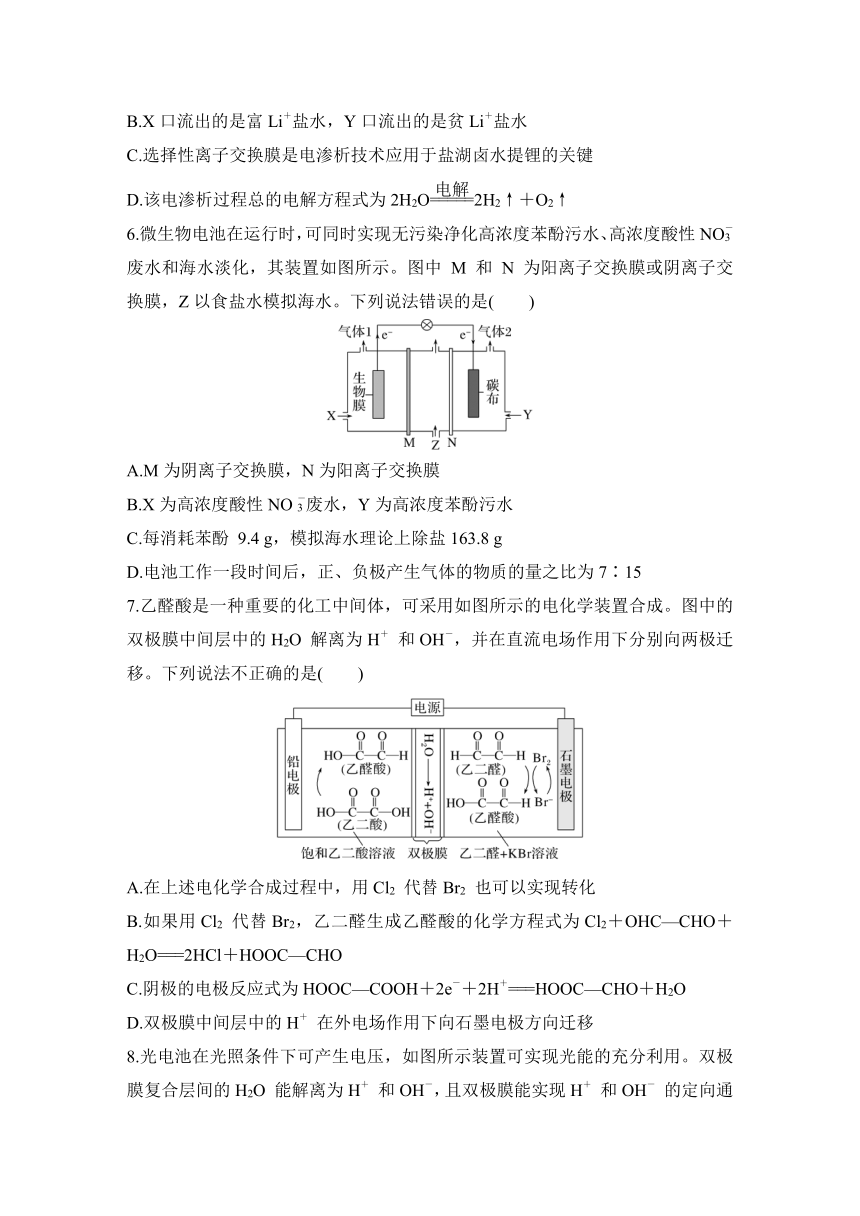
4.电解法常用于分离提纯物质,某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图),使浆液分离成固体混合物和含铬元素溶液进行回收利用。(已知:2CrO+2H+??Cr2O+H2O)下列说法不正确的是( )
A.阴极室生成的物质为NaOH和H2
B.阳极发生的电极反应是2H2O-4e-===4H++O2↑
C.a离子交换膜为阳离子交换膜
D.当外电路中转移2 mol电子时,阳极室可生成1 mol Cr2O
5.使用交替排列的单价选择性阳离子交换膜和阴离子交换膜的电渗析过程如图所示。电渗析分离离子的原理是单价阳离子(例如:Li+、Na+、K+)通过单价选择性阳离子交换膜迁移到浓缩室,而二价阳离子(例如:Ca2+、Mg2+)被阻挡,留在脱盐室,达到富集锂的目的。下列说法错误的是( )
A.电极W连接电源正极,电极N连接电源负极
B.X口流出的是富Li+盐水,Y口流出的是贫Li+盐水
C.选择性离子交换膜是电渗析技术应用于盐湖卤水提锂的关键
D.该电渗析过程总的电解方程式为2H2O2H2↑+O2↑
6.微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性NO废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是( )
A.M为阴离子交换膜,N为阳离子交换膜
B.X为高浓度酸性NO废水,Y为高浓度苯酚污水
C.每消耗苯酚 9.4 g,模拟海水理论上除盐163.8 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为7∶15
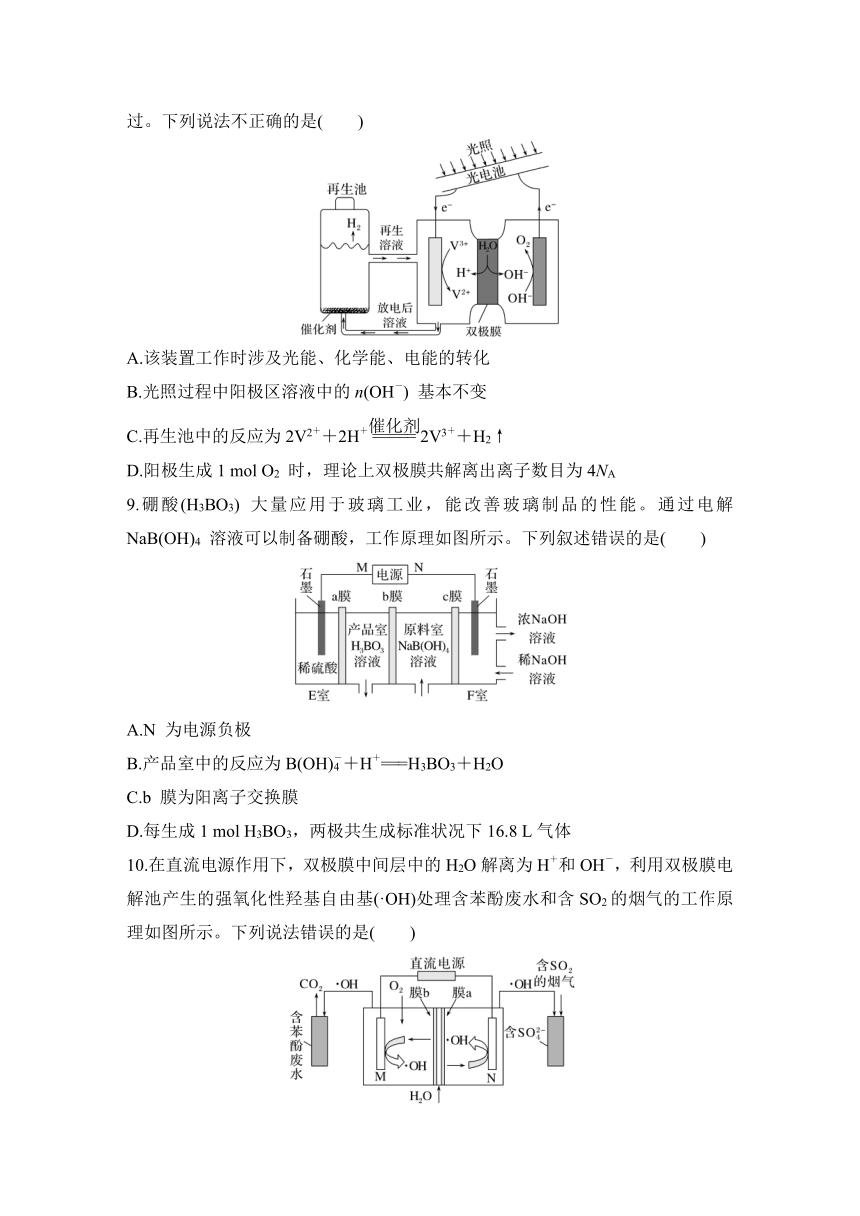
7.乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O 解离为H+ 和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.在上述电化学合成过程中,用Cl2 代替Br2 也可以实现转化
B.如果用Cl2 代替Br2,乙二醛生成乙醛酸的化学方程式为Cl2+OHC—CHO+H2O===2HCl+HOOC—CHO
C.阴极的电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O
D.双极膜中间层中的H+ 在外电场作用下向石墨电极方向迁移
8.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O 能解离为H+ 和OH-,且双极膜能实现H+ 和OH- 的定向通过。下列说法不正确的是( )
A.该装置工作时涉及光能、化学能、电能的转化
B.光照过程中阳极区溶液中的n(OH-) 基本不变
C.再生池中的反应为2V2++2H+2V3++H2↑
D.阳极生成1 mol O2 时,理论上双极膜共解离出离子数目为4NA
9.硼酸(H3BO3) 大量应用于玻璃工业,能改善玻璃制品的性能。通过电解NaB(OH)4 溶液可以制备硼酸,工作原理如图所示。下列叙述错误的是( )
A.N 为电源负极
B.产品室中的反应为B(OH)+H+===H3BO3+H2O
C.b 膜为阳离子交换膜
D.每生成1 mol H3BO3,两极共生成标准状况下16.8 L气体
10.在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生的强氧化性羟基自由基(·OH)处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是( )
A.电势:N电极>M电极
B.阴极电极反应式为O2+2e-+2H+===2·OH
C.每处理9.4 g苯酚,理论上有2.8 mol H+透过膜a
D.若·OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1∶14
11.科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为CO,实现节能减排的目标。工作原理如图所示,下列有关说法正确的是( )
A.N极为阴极
B.离子交换膜为阴离子交换膜
C.阳极的电极反应式为CO2+2e-+2H+===CO+H2O
D.理论上该装置在工作时,H3PO4 与KH2PO4 缓冲溶液的pH 保持不变
参考答案
1.A [分析题图可知,石墨电极为阴极,连接电源负极,故A错误;H+ 通过质子交换膜从阳极(铂电极)向阴极(石墨电极)移动,故B正确;石墨电极为阴极,阴极区域发生的反应为Fe3++e-===Fe2+、4Fe2++O2+4H+===4Fe3++2H2O,故C正确;阳极反应为2HCl-2e-===Cl2+2H+,电路中每转移4 mol 电子,有4 mol H+ 通过质子交换膜由阳极区域移向阴极区域,在阴极区域发生反应4Fe2++O2+4H+===4Fe3++2H2O,移向阴极区域的氢离子被消耗,又有水生成,所以随着反应的进行,阴极区域电解质溶液pH 增大,故D正确。]
2.D [根据图示,放电时,Mo箔上Fe[Fe(CN)6]转化为Na2Fe[Fe(CN)6],Fe化合价降低,发生还原反应,则Mo箔为正极,A项错误;充电时Mo箔作阳极,与电源的正极相连,B项错误;放电时Na+通过交换膜从负极(右室)移向正极(左室),C项错误;充电时阳极上Na2Fe[Fe(CN)6]失电子转化为Fe[Fe(CN)6]和Na+,D项正确。]
3.D [根据工作原理图,可知生物发酵液中通过m膜进入产品室,a极附近BPM中的OH-进入产品室,两者反应生成1,5-戊二胺,则a极为阴极,发生反应2H2O+2e-===2OH-+H2↑,阴极的电势比阳极的低,A项正确;生物发酵液中的通过m膜进入产品室,则m膜为阳离子交换膜,b极为阳极,则生物发酵液中的SO通过n膜进入H2SO4极室,则n膜为阴离子交换膜,B项正确;b极为阳极,b极附近BPM中的H+进入H2SO4极室,使溶液pH逐渐减小,C项正确;b极反应为2H2O-4e-===O2↑+4H+,则b极区每生成11.2 L气体(标准状况),转移电子的物质的量为2 mol,有1 mol 进入产品室,可生成1 mol 1,5-戊二胺,D项错误。]
4.D [电解时,阳极上水放电:2H2O-4e-===O2↑+4H+,故CrO通过阴离子交换膜向阳极移动,从而从浆液中分离出来,因存在2CrO+2H+??Cr2O+H2O,则分离后含铬元素的粒子是CrO、Cr2O;阴极上水放电:4H2O+4e-===2H2↑+4OH-,混合物浆液中的钠离子通过阳离子交换膜进入阴极,故阴极反应生成氢气和NaOH。由于生成Cr2O的反应为可逆反应,阳极室生成Cr2O小于1 mol,D错误。]
5.B [由图可知,Cl-向W电极方向移动,Li+向N电极方向移动,则W极是和电源正极相连的阳极,N极是和电源负极相连的阴极,A正确;X口流出盐水所对应的两个交换膜之间,所含的Li+通过单价选择性阳离子交换膜移向右边隔壁的两个膜之间,则X口流出的是贫Li+盐水,而Y口流出盐水所对应的两个交换膜之间,则多了左边两个膜之间渗透移动过来的Li+,则Y口流出的是富Li+盐水,B错误;通过对图分析,从盐湖卤水提锂,可利用图中的单价选择性阳离子交换膜和阴离子交换膜通过电渗析法使盐湖卤水中所含的锂离子富集起来,然后再提取锂,C正确;从W电极和N电极的产物结合电解池电极离子的放电顺序可知,W电极是OH-放电,N电极是H+放电,而OH-和H+均来自水分子的电离,则整个电渗析过程中,被电解的是水,D正确。]
6.B [由图中所示电子流向可知,生物膜为负极,发生氧化反应,则X是高浓度苯酚污水,气体1是CO2;电子流入碳布,发生还原反应,为正极,则Y是高浓度酸性NO废水,气体2是N2;海水得到淡化,则食盐水作为电解质溶液,Na+向正极移动,N是阳离子交换膜,Cl-向负极移动,M是阴离子交换膜,故A正确,B错误;负极苯酚生成CO2,有关系:~6CO2~28e-,每消耗苯酚 9.4 g,物质的量为0.1 mol,则转移电子2.8 mol,海水除盐2.8 mol NaCl,质量为163.8 g,C正确;据分析,正极产生N2,有关系:2NO~N2~10e-,负极有:~6CO2~28e-,电池工作一段时间后,转移电子数相等,则正、负极产生气体的物质的量之比为2.8∶6=7∶15,D正确。]
7.D [题给装置通电时,乙二酸被还原为乙醛酸,因此铅电极为阴极,石墨电极为阳极,阳极上Br- 失电子生成Br2,Br2 将乙二醛氧化为乙醛酸,而Cl2 与Br2 化学性质相似,故A、B正确;电解过程中阴极发生还原反应,乙二酸转化成乙醛酸,电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,故C正确;双极膜中间层的H+ 在外电场作用下移向阴极,即H+ 移向铅电极,故D错误。]
8.D [在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,故A正确;光照过程中,阳极反应消耗氢氧根离子,双极膜可将水解离为氢离子和氢氧根离子,水解离生成的氢氧根离子移向阳极,阳极区溶液中的n(OH-) 基本不变,故B正确;再生池中的反应为2V2++2H+2V3++H2↑,故C正确;阳极生成1 mol O2 时,转移4 mol 电子,消耗4 mol OH-,由于阳极区溶液中的n(OH-) 基本不变,理论上双极膜共解离出4 mol OH-和4 mol H+,即解离出的离子数目为8NA,故D错误。]
9.C [由题图可知,F 室得到浓氢氧化钠溶液,则电极反应为2H2O+2e-===2OH-+H2↑,右侧石墨为阴极,则N 为电源负极,A正确;E 室为阳极室,电极反应为2H2O-4e-===4H++O2↑,氢离子通过a 膜进入产品室;原料室中B(OH) 通过b 膜进入产品室,产品室中的反应为B(OH)+H+===H3BO3+H2O,B正确;原料室中B(OH) 通过b 膜进入产品室,b 膜为阴离子交换膜,C错误;每生成1 mol H3BO3,F 室生成H2 0.5 mol、E 室生成O2 0.25 mol,则两极共生成气体0.75 mol,标准状况下气体体积为16.8 L,D正确。]
10.C [M极上O2得电子生成羟基自由基(·OH),电极反应为O2+2e-+2H+===2·OH,则M极为阴极,连接电源的负极,膜b允许H+透过进入阴极区,M极上产生的羟基自由基将苯酚氧化成CO2;N极为阳极,其电极反应为OH--e-===·OH,则膜a允许OH-透过进入阳极区,N极上产生的羟基自由基将SO2氧化为硫酸根离子。阳极电势大于阴极,A正确;1 mol苯酚转化为CO2,失去28 mol电子,1 mol SO2转化为SO失去2 mol e-,则每处理9.4 g(0.1 mol)苯酚,理论上可处理1.4 mol SO2,反应之比为1∶4,C项错误,D项正确。]
11.D [题给装置外电路有光伏电池(将太阳能转化为电能),故题给装置为电解池,在P 极上,CO2 得电子转化为CO,故P 极为阴极,N 极为阳极,阴极的电极反应式为CO2+2H++2e-===CO+H2O,需要缓冲溶液提供H+,故离子交换膜为阳离子交换膜,阳极的电极反应式为2H2O-4e-===O2↑+4H+。由分析知,N 极为阳极,A错误;由分析知,离子交换膜为阳离子交换膜,B错误;由分析知,CO2在阴极转化为CO,C错误;根据得失电子守恒和阴、阳极电极反应知,该装置工作时,理论上缓冲溶液流入阴极的H+ 和阳极流入缓冲溶液的H+ 数目相等,故理论上缓冲溶液中c(H+) 保持不变,pH 保持不变,D正确
1.氯化氢回收氯气技术近年来为科学研究的热点。一种氯化氢电解回收氯气的原理如图。下列说法错误的是( )
A.石墨电极连接电源正极
B.H+ 透过交换膜从铂电极向石墨电极移动
C.阴极区域的反应为Fe3++e-===Fe2+、4Fe2++O2+4H+===4Fe3++2H2O
D.随着反应的进行,阴极区域电解质溶液pH 增大
2.某新型可充电钠离子电池放电时的工作原理如图所示,下列说法正确的是( )
A.放电时,Mo箔为电池的负极
B.充电时,电源的正极应与Mg箔连接
C.放电时,Na+通过交换膜从左室移向右室
D.充电时,阳极反应为Na2Fe[Fe(CN)6]-2e-===Fe[Fe(CN)6]+2Na+
3.1,5 戊二胺()是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5 戊二胺硫酸盐(含和SO)转换为1,5 戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( )
A.a极的电势比b极的低
B.m膜为阳离子交换膜,n膜为阴离子交换膜
C.电解过程中,H2SO4极室溶液的pH逐渐减小
D.b极区每生成11.2 L气体(标准状况),理论上可生成2 mol 1,5 戊二胺
4.电解法常用于分离提纯物质,某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(如图),使浆液分离成固体混合物和含铬元素溶液进行回收利用。(已知:2CrO+2H+??Cr2O+H2O)下列说法不正确的是( )
A.阴极室生成的物质为NaOH和H2
B.阳极发生的电极反应是2H2O-4e-===4H++O2↑
C.a离子交换膜为阳离子交换膜
D.当外电路中转移2 mol电子时,阳极室可生成1 mol Cr2O
5.使用交替排列的单价选择性阳离子交换膜和阴离子交换膜的电渗析过程如图所示。电渗析分离离子的原理是单价阳离子(例如:Li+、Na+、K+)通过单价选择性阳离子交换膜迁移到浓缩室,而二价阳离子(例如:Ca2+、Mg2+)被阻挡,留在脱盐室,达到富集锂的目的。下列说法错误的是( )
A.电极W连接电源正极,电极N连接电源负极
B.X口流出的是富Li+盐水,Y口流出的是贫Li+盐水
C.选择性离子交换膜是电渗析技术应用于盐湖卤水提锂的关键
D.该电渗析过程总的电解方程式为2H2O2H2↑+O2↑
6.微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性NO废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是( )
A.M为阴离子交换膜,N为阳离子交换膜
B.X为高浓度酸性NO废水,Y为高浓度苯酚污水
C.每消耗苯酚 9.4 g,模拟海水理论上除盐163.8 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为7∶15
7.乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O 解离为H+ 和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.在上述电化学合成过程中,用Cl2 代替Br2 也可以实现转化
B.如果用Cl2 代替Br2,乙二醛生成乙醛酸的化学方程式为Cl2+OHC—CHO+H2O===2HCl+HOOC—CHO
C.阴极的电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O
D.双极膜中间层中的H+ 在外电场作用下向石墨电极方向迁移
8.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O 能解离为H+ 和OH-,且双极膜能实现H+ 和OH- 的定向通过。下列说法不正确的是( )
A.该装置工作时涉及光能、化学能、电能的转化
B.光照过程中阳极区溶液中的n(OH-) 基本不变
C.再生池中的反应为2V2++2H+2V3++H2↑
D.阳极生成1 mol O2 时,理论上双极膜共解离出离子数目为4NA
9.硼酸(H3BO3) 大量应用于玻璃工业,能改善玻璃制品的性能。通过电解NaB(OH)4 溶液可以制备硼酸,工作原理如图所示。下列叙述错误的是( )
A.N 为电源负极
B.产品室中的反应为B(OH)+H+===H3BO3+H2O
C.b 膜为阳离子交换膜
D.每生成1 mol H3BO3,两极共生成标准状况下16.8 L气体
10.在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生的强氧化性羟基自由基(·OH)处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是( )
A.电势:N电极>M电极
B.阴极电极反应式为O2+2e-+2H+===2·OH
C.每处理9.4 g苯酚,理论上有2.8 mol H+透过膜a
D.若·OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1∶14
11.科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为CO,实现节能减排的目标。工作原理如图所示,下列有关说法正确的是( )
A.N极为阴极
B.离子交换膜为阴离子交换膜
C.阳极的电极反应式为CO2+2e-+2H+===CO+H2O
D.理论上该装置在工作时,H3PO4 与KH2PO4 缓冲溶液的pH 保持不变
参考答案
1.A [分析题图可知,石墨电极为阴极,连接电源负极,故A错误;H+ 通过质子交换膜从阳极(铂电极)向阴极(石墨电极)移动,故B正确;石墨电极为阴极,阴极区域发生的反应为Fe3++e-===Fe2+、4Fe2++O2+4H+===4Fe3++2H2O,故C正确;阳极反应为2HCl-2e-===Cl2+2H+,电路中每转移4 mol 电子,有4 mol H+ 通过质子交换膜由阳极区域移向阴极区域,在阴极区域发生反应4Fe2++O2+4H+===4Fe3++2H2O,移向阴极区域的氢离子被消耗,又有水生成,所以随着反应的进行,阴极区域电解质溶液pH 增大,故D正确。]
2.D [根据图示,放电时,Mo箔上Fe[Fe(CN)6]转化为Na2Fe[Fe(CN)6],Fe化合价降低,发生还原反应,则Mo箔为正极,A项错误;充电时Mo箔作阳极,与电源的正极相连,B项错误;放电时Na+通过交换膜从负极(右室)移向正极(左室),C项错误;充电时阳极上Na2Fe[Fe(CN)6]失电子转化为Fe[Fe(CN)6]和Na+,D项正确。]
3.D [根据工作原理图,可知生物发酵液中通过m膜进入产品室,a极附近BPM中的OH-进入产品室,两者反应生成1,5-戊二胺,则a极为阴极,发生反应2H2O+2e-===2OH-+H2↑,阴极的电势比阳极的低,A项正确;生物发酵液中的通过m膜进入产品室,则m膜为阳离子交换膜,b极为阳极,则生物发酵液中的SO通过n膜进入H2SO4极室,则n膜为阴离子交换膜,B项正确;b极为阳极,b极附近BPM中的H+进入H2SO4极室,使溶液pH逐渐减小,C项正确;b极反应为2H2O-4e-===O2↑+4H+,则b极区每生成11.2 L气体(标准状况),转移电子的物质的量为2 mol,有1 mol 进入产品室,可生成1 mol 1,5-戊二胺,D项错误。]
4.D [电解时,阳极上水放电:2H2O-4e-===O2↑+4H+,故CrO通过阴离子交换膜向阳极移动,从而从浆液中分离出来,因存在2CrO+2H+??Cr2O+H2O,则分离后含铬元素的粒子是CrO、Cr2O;阴极上水放电:4H2O+4e-===2H2↑+4OH-,混合物浆液中的钠离子通过阳离子交换膜进入阴极,故阴极反应生成氢气和NaOH。由于生成Cr2O的反应为可逆反应,阳极室生成Cr2O小于1 mol,D错误。]
5.B [由图可知,Cl-向W电极方向移动,Li+向N电极方向移动,则W极是和电源正极相连的阳极,N极是和电源负极相连的阴极,A正确;X口流出盐水所对应的两个交换膜之间,所含的Li+通过单价选择性阳离子交换膜移向右边隔壁的两个膜之间,则X口流出的是贫Li+盐水,而Y口流出盐水所对应的两个交换膜之间,则多了左边两个膜之间渗透移动过来的Li+,则Y口流出的是富Li+盐水,B错误;通过对图分析,从盐湖卤水提锂,可利用图中的单价选择性阳离子交换膜和阴离子交换膜通过电渗析法使盐湖卤水中所含的锂离子富集起来,然后再提取锂,C正确;从W电极和N电极的产物结合电解池电极离子的放电顺序可知,W电极是OH-放电,N电极是H+放电,而OH-和H+均来自水分子的电离,则整个电渗析过程中,被电解的是水,D正确。]
6.B [由图中所示电子流向可知,生物膜为负极,发生氧化反应,则X是高浓度苯酚污水,气体1是CO2;电子流入碳布,发生还原反应,为正极,则Y是高浓度酸性NO废水,气体2是N2;海水得到淡化,则食盐水作为电解质溶液,Na+向正极移动,N是阳离子交换膜,Cl-向负极移动,M是阴离子交换膜,故A正确,B错误;负极苯酚生成CO2,有关系:~6CO2~28e-,每消耗苯酚 9.4 g,物质的量为0.1 mol,则转移电子2.8 mol,海水除盐2.8 mol NaCl,质量为163.8 g,C正确;据分析,正极产生N2,有关系:2NO~N2~10e-,负极有:~6CO2~28e-,电池工作一段时间后,转移电子数相等,则正、负极产生气体的物质的量之比为2.8∶6=7∶15,D正确。]
7.D [题给装置通电时,乙二酸被还原为乙醛酸,因此铅电极为阴极,石墨电极为阳极,阳极上Br- 失电子生成Br2,Br2 将乙二醛氧化为乙醛酸,而Cl2 与Br2 化学性质相似,故A、B正确;电解过程中阴极发生还原反应,乙二酸转化成乙醛酸,电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,故C正确;双极膜中间层的H+ 在外电场作用下移向阴极,即H+ 移向铅电极,故D错误。]
8.D [在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,故A正确;光照过程中,阳极反应消耗氢氧根离子,双极膜可将水解离为氢离子和氢氧根离子,水解离生成的氢氧根离子移向阳极,阳极区溶液中的n(OH-) 基本不变,故B正确;再生池中的反应为2V2++2H+2V3++H2↑,故C正确;阳极生成1 mol O2 时,转移4 mol 电子,消耗4 mol OH-,由于阳极区溶液中的n(OH-) 基本不变,理论上双极膜共解离出4 mol OH-和4 mol H+,即解离出的离子数目为8NA,故D错误。]
9.C [由题图可知,F 室得到浓氢氧化钠溶液,则电极反应为2H2O+2e-===2OH-+H2↑,右侧石墨为阴极,则N 为电源负极,A正确;E 室为阳极室,电极反应为2H2O-4e-===4H++O2↑,氢离子通过a 膜进入产品室;原料室中B(OH) 通过b 膜进入产品室,产品室中的反应为B(OH)+H+===H3BO3+H2O,B正确;原料室中B(OH) 通过b 膜进入产品室,b 膜为阴离子交换膜,C错误;每生成1 mol H3BO3,F 室生成H2 0.5 mol、E 室生成O2 0.25 mol,则两极共生成气体0.75 mol,标准状况下气体体积为16.8 L,D正确。]
10.C [M极上O2得电子生成羟基自由基(·OH),电极反应为O2+2e-+2H+===2·OH,则M极为阴极,连接电源的负极,膜b允许H+透过进入阴极区,M极上产生的羟基自由基将苯酚氧化成CO2;N极为阳极,其电极反应为OH--e-===·OH,则膜a允许OH-透过进入阳极区,N极上产生的羟基自由基将SO2氧化为硫酸根离子。阳极电势大于阴极,A正确;1 mol苯酚转化为CO2,失去28 mol电子,1 mol SO2转化为SO失去2 mol e-,则每处理9.4 g(0.1 mol)苯酚,理论上可处理1.4 mol SO2,反应之比为1∶4,C项错误,D项正确。]
11.D [题给装置外电路有光伏电池(将太阳能转化为电能),故题给装置为电解池,在P 极上,CO2 得电子转化为CO,故P 极为阴极,N 极为阳极,阴极的电极反应式为CO2+2H++2e-===CO+H2O,需要缓冲溶液提供H+,故离子交换膜为阳离子交换膜,阳极的电极反应式为2H2O-4e-===O2↑+4H+。由分析知,N 极为阳极,A错误;由分析知,离子交换膜为阳离子交换膜,B错误;由分析知,CO2在阴极转化为CO,C错误;根据得失电子守恒和阴、阳极电极反应知,该装置工作时,理论上缓冲溶液流入阴极的H+ 和阳极流入缓冲溶液的H+ 数目相等,故理论上缓冲溶液中c(H+) 保持不变,pH 保持不变,D正确
同课章节目录
