专题5 药物合成的重要原料—卤代烃、胺、酰胺 测试卷 (含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 专题5 药物合成的重要原料—卤代烃、胺、酰胺 测试卷 (含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 09:51:54 | ||
图片预览




文档简介
专题5《药物合成的重要原料—卤代烃、胺、酰胺》测试卷
一、单选题
1.下列反应试剂和条件能增大有机化合物不饱和度的是
A.氢氧化钠的醇溶液,加热 B.氢氧化钠的水溶液,加热
C.稀硫酸,加热 D.银氨溶液
2.某同学设计了下列合成路线,你认为不能实现的是
A.用乙烯合成乙酸:
B.用氯苯合成环己烯:
C.用乙烯合成乙二醇:
D.用甲苯合成苯甲醇:
3.下列关于卤代烃的叙述错误的是( )
A.随着碳原子数的增多,一氯代烃的沸点逐渐升高
B.随着碳原子数的增多,一氯代烃的密度逐渐增大
C.等碳原子数的一氯代烃,支链越多,沸点越低
D.等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高
4.中国工程院院士李兰娟团队研究发现,阿比朵尔对新型冠状病毒具有有效的抑制作用,其结构简式如图所示。下列有关阿比朵尔的说法,正确的是
A.分子式为C17H23BrN2O3S
B.阿比朵尔为芳香烃
C.所有碳原子一定处于同一平面
D.分子结构中含有多个官能团,如羟基,酯基,溴原子,苯环
5.以为基本原料合成,下列合成路线最合理的是
A.
B.
C.
D.
6.下列关于有机物性质和结构的叙述正确的是
A.聚丙烯可使酸性高锰酸钾溶液褪色
B.向溴乙烷中加入硝酸银溶液,生成淡黄色沉淀
C.CH4、CCl4、CF2Cl2均为正四面体结构的分子
D.苯的邻二溴代物只有一种,说明苯分子中碳碳键的键长完全相同
7.对位芳酰胺纤维(PPTA)结构如图所示。下列说法正确的是
A.PPTA的结构简式可用表示
B.PPTA可由对苯二甲酸与对苯二胺发生加聚反应制得
C.PPTA中存在酰胺基和氢键,易溶于水
D.一定条件下,1mol对苯二甲酸最多可与5molH2发生加成反应
8.下列卤代烃中,不能发生消去反应的是
A. B.(CH3)3CCH2Cl
C. D.
9.已知钠的相对原子质量为a,阿伏加德罗常数的值为,实验测得钠的密度为。假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切,则钠原子的半径r为
A. B. C. D.
10.食品和营养专家劝大家少吃油炸食品,是因为某些高温油炸食品中含有一定量的致癌物质(丙烯酰胺)。下列关于丙烯酰胺的叙述正确的是
A.既属于酰胺类又属于烯烃
B.它能使酸性溶液和溴水褪色
C.只有4种同分异构体
D.能在碱性条件下发生水解反应,同时生成丙烯酸和氨气
11.有两种饱和一元醇的混合物18.8 g,与23g Na充分反应,生成的H2在标准状态下的体积为5.6 L,这两种醇分子中相差一个碳原子。则这两种可能醇是
A.甲醇和乙醇 B.乙醇和1 -丙醇
C.2 -丙醇和1 -丁醇 D.无法确定
12.有的说法,不正确的是
A.可以发生加聚反应
B.l mol该物质最多与5 mol氢气加成
C.含有五种官能团
D.1 mol该物质与足量的NaOH溶液反应,最多可消耗1 mol NaOH
13.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
14.中草药黄芩对肿瘤细胞的杀伤有独特作用,其有效成分汉黄芩素结构如下。由于该中药产量较小,可以通过有机化学合成来补充。下列有关汉黄芩素的叙述不正确的是
A.含有4种官能团
B.遇FeCl3溶液能发生显色反应
C.汉黄芩素不易被氧化
D.1 mol该物质最多消耗8 mol H2
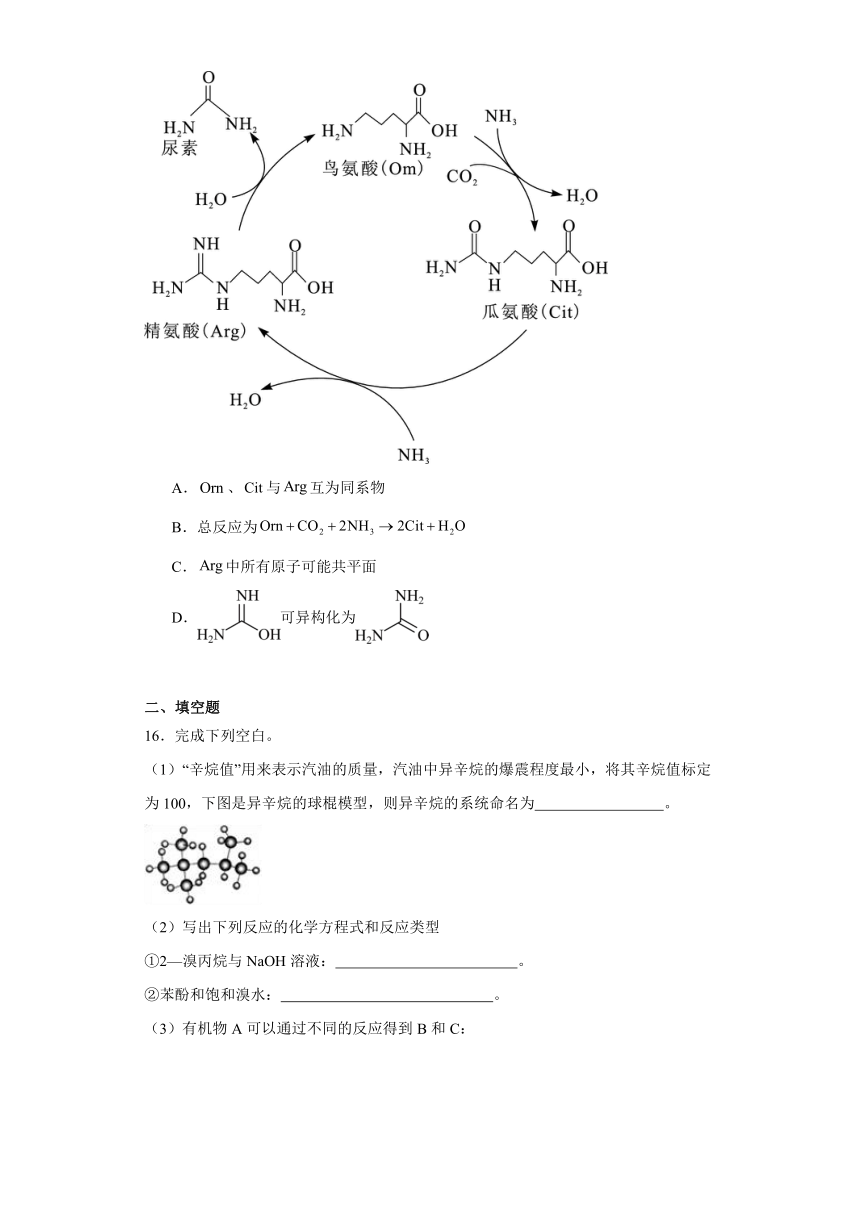
15.尿素在1773年由Rouelle从尿液中分离出来,但不明其由来。1932年Krebs等人证实在肝脏中尿素的合成与鸟氨酸(简写为)有关,并提出了如图所示的鸟氨酸循环。下列有关叙述正确的是
A.、与互为同系物
B.总反应为
C.中所有原子可能共平面
D.可异构化为
二、填空题
16.完成下列空白。
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,下图是异辛烷的球棍模型,则异辛烷的系统命名为 。
(2)写出下列反应的化学方程式和反应类型
①2—溴丙烷与NaOH溶液: 。
②苯酚和饱和溴水: 。
(3)有机物A可以通过不同的反应得到B和C:
①A的分子式为 ,C的含氧官能团名称为 。
②A制取B的有机反应类型为 。
③A制取C的化学方程式为: 。
④A发生消去反应后产物的结构简式为 。
17.写出下列各有机物的结构简式或分子式:
(1)相对分子质量为84的烃的分子式为 。
(2)某炔烃和H2充分加成生成2,5—二甲基己烷,则该炔烃的结构简式为 。
(3)0.2 mol烃A在氧气中完全燃烧后生成1.2 mol CO2和1.2 mol H2O,催化加氢后生成2,2—二甲基丁烷,则烃A的结构简式为 。
(4)某烃1 mol和2 mol HCl完全加成,生成的氯代烷最多还可以与4 mol氯气反应,则该烃的结构简式为 。
18.已知A-F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 A B C
结构简式
化合物 D E F
结构简式
(1)化合物A与足量NaOH反应的化学方程式 。
(2)1 mol化合物B在一定条件下,可以与 mol NaOH发生反应
(3)化合物C与D在一定条件下发生得到化合物Z,写出生成Z的化学方程式 。
(4)化合物D与银氨溶液反应的化学方程式 (有机物用结构简式表示)。
(5)写出符合下列条件的E的同分异构体的结构简式: 。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
三、实验题
19.溴乙烷是一种重要的有机合成中间体,沸点为,密度为。
实验室制备少量溴乙烷主要步骤如下:
步骤Ⅰ:连接如题图所示实验装置,检验装置气密性。
步骤Ⅱ:向仪器A中依次加入搅拌磁子、蒸馏水、浓、乙醇、固体,缓慢加热至无油状物馏出为止。
(1)仪器A的名称是 。
(2)向A中加入固体和浓的目的是 。
(3)反应生成的主要副产物有乙烯和乙醚,可能的原因是 。
(4)将锥形瓶置于冰水浴中的作用是 。
(5)提纯产物时需向锥形瓶中加入试剂 (填字母),充分振荡,静置后分液得粗产品,再经提纯获得纯品。
a.溶液 b.苯 c.浓硫酸
(6)请设计实验证明制取的溴乙烷纯品中含原子(实验中可选用的试剂:溶液、稀硫酸、稀硝酸、水溶液): 。
20.有机反应一般速率较小,副反应多,产物复杂。回答下面问题:
(1)有如下实验装置。
①实验室利用装置A用乙醇制乙烯,其中碎瓷片的作用是 ,反应方程式为 。
②装置B可以做乙醛的银镜反应实验,该反应的化学方程式为 。
③装置C可以制备乙酸乙酯,其中饱和碳酸钠溶液的作用是 。
④向试管a中依次加入2mL乙醇、0.5mL (填名称)、2mL乙酸和碎瓷片。本实验中既要对反应物加热,但又不能使温度过高,原因是 。
(2)1-溴丙烷中溴元素的检验:
①向试管中加入少量1-溴丙烷,再加入1mL 5% NaOH溶液,稍微加热一段时间,发生反应的化学方程式 。
②冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴2%的溶液。试剂a是 (填化学式),实验现象是 。
(3)分子式为的有机物的结构可能有 和 两种。为确定其分子结构借助现代分析仪器可对其进行的实验方法有 。
(4)①有机物A常用于食品行业,A分子的质谱图如图所示,由图可知其相对分子质量是 。
②已知9.0g A在足量中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,则A的分子式是 。
③已知1mol A能与足量溶液发生反应,生成22.4L(标准状况下)的气体,1mol A能与足量的金属Na发生反应,生成22.4L(标准状况下)的气体,A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 。
试卷第4页,共9页
参考答案:
1.A
【详解】A.某些卤代烃在氢氧化钠的醇溶液,加热的条件下发生消去反应,有机物的不饱和度增大,A正确;
B.酯类或卤代烃在氢氧化钠的水溶液,加热的条件下发生水解反应,有机物的不饱和度不变,B错误;
C.酯等物质在稀硫酸,加热的条件下发生水解反应,有机物的不饱和度不变,C错误;
D.醛基与银氨溶液反应生成羧基,有机物的不饱和度不变,D错误。
故选A。
2.B
【详解】A.乙烯与水发生加成反应生成乙醇,乙醇催化氧化生成乙醛,乙醛氧化生成乙酸,可实现转化,A项可以实现;
B.苯环可与氢气发生加成反应,氯代烃在NaOH醇溶液中可发生消去反应,反应条件不是浓硫酸加热,B项不能实现;
C.乙烯与氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中水解生成乙二醇,可实现转化,C项可以实现;
D.光照下甲基上H被Cl取代,氯代烃在NaOH水溶液中发生水解反应生成 ,可实现转化,D项可以实现;
答案选B。
3.B
【详解】A.随着碳原子数越多,一氯代烃的相对分子质量越大,从而分子间作用力越大,则沸点越高,故A正确;
B.随着碳原子数越多,一氯代烃的相对分子质量越大,则密度越小,故B错误;
C.等碳原子数的一氯代烃,支链越多,分子间距离越大,分子间作用力越小,沸点越低,故C正确;
D.等碳原子数的一卤代烃,卤素的原子序数越大,分子间作用力越大,沸点越高,故D正确。
故选B。
4.A
【详解】A.有机物的分子式为C17H23BrN2O3S,故A正确;
B.从阿比朵尔的结构简式可看出含有硫、氧、氮、溴,是烃的衍生物,故B错误;
C.单键可以旋转,从阿比朵尔的结构简式可看出,与酯基相连的乙基的两个碳原子、与硫原子相连的碳原子可能不与苯环共面,所以所有碳原子不一定处于同一平面,故C错误;
C.苯环不是官能团,故D错误;
故选A。
5.D
【详解】A.中碳碳双键和醇羟基均易被氧气氧化,最终得不到,故A错误;
B.与溴单质发生加成反应得到,碱性水解得到: , 催化氧化得到: , 再氧化得到 ,而 不能在浓硫酸作用下生成碳碳双键,故B错误;
C.与水发生加成反应得到N: 或,N经催化氧化得到 或 ,其中羰基最终不能转化成碳碳双键,故C错误;
D.与HCl发生加成反应得到N: 或,N发生催化氧化反应其中醇羟基被氧化成醛基,继续被氧化醛基转化成羧基,然后在氢氧化钠醇溶液中发生氯原子的消去反应生成碳碳双键,再经酸化得到产物,故D正确;
故选:D。
6.D
【分析】
【详解】A.聚丙烯不含碳碳双键,不能使酸性高锰酸钾溶液褪色,故错误;
B.溴乙烷和硝酸银不反应,故错误;
C.甲烷和四氯化碳都是正四面体结构,但CF2Cl2是四面体结构,故错误;
D.苯的邻二溴代物只有一种,说明苯分子中碳原子之间的键都相同,故正确。
故选D。
7.A
【详解】A.由题图可知,PPTA可由对苯二甲酸和对苯二胺发生缩聚反应生成,PPTA的结构简式正确,A正确;
B.PPTA可由对苯二甲酸和对苯二胺发生缩聚反应生成,B错误;
C.由题图可知,PPTA中存在酰胺基和氢键,不存在亲水基,难溶于水,C错误;
D.对苯二甲酸中苯环可以与氢气发生加成反应,而羧基不能与氢气加成,所以一定条件下,1mol对苯二甲酸最多可与3molH2发生加成反应,D错误;
故选A。
8.B
【详解】有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键)化合物的反应,叫做消去反应,卤代烃分子中,连有卤素原子的碳原子必须有相邻的碳原子且此相邻的碳原子上并且还必须连有氢原子时,才可发生消去反应。则选项A、C、D中有机物均可发生消去反应,(CH3)3CCH2Cl不能发生消去反应,答案选B。
9.C
【详解】设钠原子半径是x,则该晶胞的边长是。根据晶胞的结构可知,该晶胞中含有的钠原子个数是1+8,所以有,解得r=,答案选C。
10.B
【详解】A.分子中含氮氧,故不是烯烃类物质,为烃的衍生物,A错误;
B.分子中含有碳碳双键,故能使酸性溶液和溴水褪色,B正确;
C.其分子中含3个碳、1个氧、1个氮,不饱和度为2,其同分异构体至少有:,故大于4种,C错误;
D.在碱性条件下发生水解反应,同时生成丙烯酸盐,D错误;
故选B。
11.A
【详解】饱和一元醇与钠按物质的量比1:1反应,生成的H2在标准状况下的体积为5.6L,则氢气的物质的量为 =0.25mol,由 :需要金属Na的物质的量为0.5mol,参加反应的钠的质量为0.5mol×23g/mol=11.5g23g,故醇完全反应,故饱和一元醇混合物的平均摩尔质量==37.6g/mol,由于两种醇分子中相差一个碳原子,设醇中碳原子数目分别为n、n+1,则:14n+2+1637.6 12(n+1)+2(n+1)+2+16,可得n=1,故A正确;
答案选A。
12.D
【详解】A.该物质中含有碳碳双键,在一定条件下可以发生加聚反应,故A不选;
B.能与氢气发生加成反应的有苯环、C=O键和碳碳双键,其中羧基中的C=O键不能反应,则1mol X与足量的氢气反应,最多消耗5mol H2,故B不选;
C.该有机物含有碳碳双键、羰基、氯原子、醚键和羧基五种官能团,故C不选;
D.中含有羧基和氯原子,能够与NaOH反应,在碱性条件下发生中和反应和水解反应,且水解生成的酚羟基也能与NaOH反应,则常温常压,1mol X与足量的NaOH溶液反应,最多可消耗5mol NaOH,故D选;
故选:D。
13.B
【详解】C2HF3ClBr可以可知乙烷中的5个H原子分别为1个Cl、1个Br、3个F原子取代,乙烷只有一种结构,氯原子、溴原子、氟原子连在碳原子上,调节位置,有CF3CHBrCl、BrCF2CHClF、ClCF2CHBrF、HCF2CFClBr,共有4种。
故选B。
14.C
【详解】A.含有羟基、碳碳双键、醚键、羰基共4种官能团,故A正确;
B.含有酚羟基,因此遇FeCl3溶液能发生显色反应,故B正确;
C.含有酚羟基、碳碳双键,因此汉黄芩素易被氧化,故C错误;
D.该物质含有2个苯环、1个碳碳双键、1个羰基,因此1mol该物质最多消耗8 mol H2,故D正确。
综上所述,答案为C。
15.D
【详解】A.、和中所含氮原子的数目均不相同,且三者分子组成上不是相差若干个原子团,不互为同系物,选项A错误;
B.在反应中作催化剂,总反应为,选项B错误;
C.分子中含有饱和碳原子,所有原子不可能共平面,选项C错误;
D.O的电负性大于N,故键的键长小于键的,则键的键能较大,更稳定,故可异构化为更稳定的,选项D正确;
答案选D。
16. 2,2,4-三甲基戊烷 CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr;取代(水解)反应 ;取代反应 C9H10O3 羧基、醛基 取代反应(或酯化反应) 或
【详解】分析:(1)根据异辛烷的结构简式命名;
(2)①卤代烃在氢氧化钠的水溶液中发生水解反应;
②苯酚和浓溴水发生取代反应;
(3)①根据A的键线式书写分子式,根据结构简式判断官能团;
②根据A与B分子中官能团的变化判断反应类型;
③根据羟基发生催化氧化生成醛基书写;
④根据羟基发生消去反应生成碳碳双键判断。
详解:(1)根据异辛烷的球棍模型可知主链含有5个碳原子,3个甲基作支链,则异辛烷的系统命名为2,2,4-三甲基戊烷。
(2)①2-溴丙烷与NaOH溶液发生水解反应生成2-丙醇和溴化钠,方程式为CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr;
②苯酚和饱和溴水发生取代反应生成三溴苯酚和溴化氢,方程式为;
(3)①根据A的结构简式可知A的分子式为C9H10O3,C的含氧官能团名称为羧基、醛基;
②A制取B的反应中羧基与羟基发生酯化反应生成酯基,反应类型为取代反应。
③A制取C是羟基的催化氧化,反应的化学方程式为。
④A分子中含有羟基,发生消去反应后产物的结构简式为。
17. C6H12 (CH3)2CH—C≡C—CH(CH3)2 (CH3)3CCH=CH2 CH≡CH
【详解】试题分析:(1)利用余商法计算该烃的C、H原子数。
(2)(1)饱和烃与炔烃的碳的骨架完全相同,倒推可得,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键。
(3)根据烃燃烧通式计算分子式,根据催化加氢后生成2,2—二甲基丁烷判断碳骨架。
(4)某烃1 mol和2 mol HCl完全加成,说明含有2个双键或1个叁键,生成的氯代烷最多还可以与4 mol氯气反应,说明氯代烷中有4个H原子,1 mol和2 mol HCl完全加成产物中有4个H原子,所以原物质分子中只有2个H原子
解析:(1)某烃相对分子质量为84,利用商余法,分子中最大碳原子数目为: 商为6,含H原子为 ,即该烃分子含有6个C原子、12个H原子,
所以该烃的分子式为C6H12;
(2)该饱和烃的结构简式为(CH3)2CH—CH2-CH2—CH(CH3)2 炔烃的碳的骨架完全相同,倒推可得,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键,所以该炔烃的结构简式为(CH3)2CH—C≡C—CH(CH3)2 。
(3)根据烃燃烧通式计算分子式,
X=6,y=12,
该烃分子式为C6H12;
根据催化加氢后生成2,2—二甲基丁烷,说明该烃碳骨架与2,2—二甲基丁烷相同,所以该烃的结构简式为(CH3)3CCH=CH2。
(4)某烃1 mol和2 mol HCl完全加成,说明含有2个双键或1个叁键,生成的氯代烷最多还可以与4 mol氯气反应,说明氯代烷中有4个H原子,1 mol和2 mol HCl完全加成产物中有4个H原子,所以原物质分子中只有2个H原子,所以则该烃的结构简式为CH≡CH。
点睛:烯烃催化加氢后生成某烷烃,烯烃与烷烃碳骨架完全相同,饱和烃相邻碳原子上必须均含有氢原子时才可出现碳碳双键。
18.(1) +NaOH→ +
(2)3
(3) + +H2O
(4) +2Ag(NH3)2OH +2Ag↓+3NH3+H2O
(5)
【详解】(1)化合物A是苯甲酸异丙酯,分子结构简式是 ,分子结构中含有酯基,在碱性条件下水解产生苯甲酸钠 和2-丙醇 ,该反应的化学方程式为: +NaOH→ + ;
(2)酚羟基和酯基都可以与NaOH发生反应。根据化合物B结构简式可知其中含有2个酚羟基和一个酯基,故1 mol化合物B在一定条件下,可以与3 mol NaOH发生反应;
(3)化合物C分子中含有羧基,化合物D分子中含有醇羟基,二者在浓硫酸存在条件下加热,发生酯化反应产生酯和水,该反应的化学方程式为: + +H2O;
(4)化合物D分子中含有醛基,具有还原性,可以被银氨溶液氧化,醛基被氧化为羧基,银氨溶液被还原为Ag单质,同时反应产生NH3、H2O,该反应的化学方程式为: +2Ag(NH3)2OH +2Ag↓+3NH3+H2O;
(5)E的同分异构体同时符合条件:A.苯环上只有一个取代基;B.能发生水解反应,说明含有酯基;C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀,说明含有醛基,则该物质是甲酸形成的酯,该物质的结构简式为 。
19.(1)蒸馏烧瓶
(2)获得氢溴酸
(3)温度控制不当
(4)减少溴乙烷的挥发
(5)a
(6)取少量产物于试管中,向其中加入水溶液,加热,充分反应后再加入稀硝酸至溶液呈酸性,滴加溶液,若产生淡黄色沉淀,则证明该产物为溴乙烷
【分析】装置A中浓、乙醇、固体在加热条件下反应生成溴乙烷,溴乙烷沸点为,冷凝收集溴乙烷。要检验溴乙烷中的溴原子,先加氢氧化钠水解出溴离子,再加硝酸中和氢氧化钠,最后加硝酸银。
【详解】(1)根据装置图,仪器A的名称是蒸馏烧瓶;
(2)乙醇和浓的氢溴酸反应生成溴乙烷和水,向A中加入固体和浓的目的是获得氢溴酸;
(3)乙醇和浓硫酸在170℃时发生消去反应生成乙烯,乙醇和浓硫酸在140℃时发生取代反应生成乙醚,所以反应生成的乙烯和乙醚的原因是温度控制不当;
(4)溴乙烷的沸点为,将锥形瓶置于冰水浴中的作用是减少溴乙烷的挥发;
(5)溴乙烷中可能含有HBr等酸性物质,提纯产物时需向锥形瓶中加入溶液,充分振荡,静置后分液得粗产品,再经提纯获得纯品,选a。
(6)溴乙烷不能电离,取少量产物于试管中,向其中加入水溶液,加热,发生水解反应,再加入稀硝酸至溶液呈酸性,滴加溶液,若产生淡黄色沉淀,则证明溴乙烷中含原子。
20.(1) 防止暴沸 溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度 浓硫酸 防止副反应发生
(2) 出现浅黄色沉淀
(3)红外光谱法
(4) 90
【详解】(1)①实验室利用乙醇制乙烯过程中,碎瓷片的作用是防止暴沸;该反应的方程式为;
②乙醛和银氨溶液水浴中加热发生银镜反应,化学反应方程式为;
③制备乙酸乙酯过程中,饱和碳酸钠溶液的作用是溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度;
④向试管a中依次加入2mL乙醇、0.5mL浓硫酸(作催化剂和吸水剂)、2mL乙酸和碎瓷片。实验中过程中,对反应物加热的温度不能过高,以防止副反应发生。
(2)①1-溴丙烷在NaOH水溶液中加热发生水解生成丙醇,反应的化学方程式为;
②试剂a应为HNO3,其作用是将溶液酸化,以免干扰溴离子的检验;往试管中滴入溶液,反应会生成浅黄色沉淀。
(3)通过红外光谱法可获得分子中所含有的化学键或官能团的信息,从而确定分子的结构。
(4)①质谱图中,最右边的质荷比表示该有机物的相对分子质量,由此可知该有机物的相对分子质量是90;
②9.0g C在足量氧气中充分燃烧生成5.4g水和13.2g二氧化碳,则C分子中碳原子的物质的量n(C)=n(CO2)==0.3mol、氢原子的物质的量n(H)=2 n(H2O)=×2=0.6mol,氧原子的物质的量n(O)==0.3mol,C的分子中C、H、O的原子个数比为0.3mol:0.6mol:0.3mol =1:2:1,最简式为CH2O,由质谱图可知,C的相对分子质量为90,设C的分子式为(CH2O)n,则n==3,所以C的分子式为C3H6O3;
③由题给信息,结合A的分子式可知,A分子中含有1个羧基和1个羟基。A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,说明分子中含有1个甲基,由此可推知A的结构简式是
一、单选题
1.下列反应试剂和条件能增大有机化合物不饱和度的是
A.氢氧化钠的醇溶液,加热 B.氢氧化钠的水溶液,加热
C.稀硫酸,加热 D.银氨溶液
2.某同学设计了下列合成路线,你认为不能实现的是
A.用乙烯合成乙酸:
B.用氯苯合成环己烯:
C.用乙烯合成乙二醇:
D.用甲苯合成苯甲醇:
3.下列关于卤代烃的叙述错误的是( )
A.随着碳原子数的增多,一氯代烃的沸点逐渐升高
B.随着碳原子数的增多,一氯代烃的密度逐渐增大
C.等碳原子数的一氯代烃,支链越多,沸点越低
D.等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高
4.中国工程院院士李兰娟团队研究发现,阿比朵尔对新型冠状病毒具有有效的抑制作用,其结构简式如图所示。下列有关阿比朵尔的说法,正确的是
A.分子式为C17H23BrN2O3S
B.阿比朵尔为芳香烃
C.所有碳原子一定处于同一平面
D.分子结构中含有多个官能团,如羟基,酯基,溴原子,苯环
5.以为基本原料合成,下列合成路线最合理的是
A.
B.
C.
D.
6.下列关于有机物性质和结构的叙述正确的是
A.聚丙烯可使酸性高锰酸钾溶液褪色
B.向溴乙烷中加入硝酸银溶液,生成淡黄色沉淀
C.CH4、CCl4、CF2Cl2均为正四面体结构的分子
D.苯的邻二溴代物只有一种,说明苯分子中碳碳键的键长完全相同
7.对位芳酰胺纤维(PPTA)结构如图所示。下列说法正确的是
A.PPTA的结构简式可用表示
B.PPTA可由对苯二甲酸与对苯二胺发生加聚反应制得
C.PPTA中存在酰胺基和氢键,易溶于水
D.一定条件下,1mol对苯二甲酸最多可与5molH2发生加成反应
8.下列卤代烃中,不能发生消去反应的是
A. B.(CH3)3CCH2Cl
C. D.
9.已知钠的相对原子质量为a,阿伏加德罗常数的值为,实验测得钠的密度为。假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切,则钠原子的半径r为
A. B. C. D.
10.食品和营养专家劝大家少吃油炸食品,是因为某些高温油炸食品中含有一定量的致癌物质(丙烯酰胺)。下列关于丙烯酰胺的叙述正确的是
A.既属于酰胺类又属于烯烃
B.它能使酸性溶液和溴水褪色
C.只有4种同分异构体
D.能在碱性条件下发生水解反应,同时生成丙烯酸和氨气
11.有两种饱和一元醇的混合物18.8 g,与23g Na充分反应,生成的H2在标准状态下的体积为5.6 L,这两种醇分子中相差一个碳原子。则这两种可能醇是
A.甲醇和乙醇 B.乙醇和1 -丙醇
C.2 -丙醇和1 -丁醇 D.无法确定
12.有的说法,不正确的是
A.可以发生加聚反应
B.l mol该物质最多与5 mol氢气加成
C.含有五种官能团
D.1 mol该物质与足量的NaOH溶液反应,最多可消耗1 mol NaOH
13.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
14.中草药黄芩对肿瘤细胞的杀伤有独特作用,其有效成分汉黄芩素结构如下。由于该中药产量较小,可以通过有机化学合成来补充。下列有关汉黄芩素的叙述不正确的是
A.含有4种官能团
B.遇FeCl3溶液能发生显色反应
C.汉黄芩素不易被氧化
D.1 mol该物质最多消耗8 mol H2
15.尿素在1773年由Rouelle从尿液中分离出来,但不明其由来。1932年Krebs等人证实在肝脏中尿素的合成与鸟氨酸(简写为)有关,并提出了如图所示的鸟氨酸循环。下列有关叙述正确的是
A.、与互为同系物
B.总反应为
C.中所有原子可能共平面
D.可异构化为
二、填空题
16.完成下列空白。
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,下图是异辛烷的球棍模型,则异辛烷的系统命名为 。
(2)写出下列反应的化学方程式和反应类型
①2—溴丙烷与NaOH溶液: 。
②苯酚和饱和溴水: 。
(3)有机物A可以通过不同的反应得到B和C:
①A的分子式为 ,C的含氧官能团名称为 。
②A制取B的有机反应类型为 。
③A制取C的化学方程式为: 。
④A发生消去反应后产物的结构简式为 。
17.写出下列各有机物的结构简式或分子式:
(1)相对分子质量为84的烃的分子式为 。
(2)某炔烃和H2充分加成生成2,5—二甲基己烷,则该炔烃的结构简式为 。
(3)0.2 mol烃A在氧气中完全燃烧后生成1.2 mol CO2和1.2 mol H2O,催化加氢后生成2,2—二甲基丁烷,则烃A的结构简式为 。
(4)某烃1 mol和2 mol HCl完全加成,生成的氯代烷最多还可以与4 mol氯气反应,则该烃的结构简式为 。
18.已知A-F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 A B C
结构简式
化合物 D E F
结构简式
(1)化合物A与足量NaOH反应的化学方程式 。
(2)1 mol化合物B在一定条件下,可以与 mol NaOH发生反应
(3)化合物C与D在一定条件下发生得到化合物Z,写出生成Z的化学方程式 。
(4)化合物D与银氨溶液反应的化学方程式 (有机物用结构简式表示)。
(5)写出符合下列条件的E的同分异构体的结构简式: 。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
三、实验题
19.溴乙烷是一种重要的有机合成中间体,沸点为,密度为。
实验室制备少量溴乙烷主要步骤如下:
步骤Ⅰ:连接如题图所示实验装置,检验装置气密性。
步骤Ⅱ:向仪器A中依次加入搅拌磁子、蒸馏水、浓、乙醇、固体,缓慢加热至无油状物馏出为止。
(1)仪器A的名称是 。
(2)向A中加入固体和浓的目的是 。
(3)反应生成的主要副产物有乙烯和乙醚,可能的原因是 。
(4)将锥形瓶置于冰水浴中的作用是 。
(5)提纯产物时需向锥形瓶中加入试剂 (填字母),充分振荡,静置后分液得粗产品,再经提纯获得纯品。
a.溶液 b.苯 c.浓硫酸
(6)请设计实验证明制取的溴乙烷纯品中含原子(实验中可选用的试剂:溶液、稀硫酸、稀硝酸、水溶液): 。
20.有机反应一般速率较小,副反应多,产物复杂。回答下面问题:
(1)有如下实验装置。
①实验室利用装置A用乙醇制乙烯,其中碎瓷片的作用是 ,反应方程式为 。
②装置B可以做乙醛的银镜反应实验,该反应的化学方程式为 。
③装置C可以制备乙酸乙酯,其中饱和碳酸钠溶液的作用是 。
④向试管a中依次加入2mL乙醇、0.5mL (填名称)、2mL乙酸和碎瓷片。本实验中既要对反应物加热,但又不能使温度过高,原因是 。
(2)1-溴丙烷中溴元素的检验:
①向试管中加入少量1-溴丙烷,再加入1mL 5% NaOH溶液,稍微加热一段时间,发生反应的化学方程式 。
②冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴2%的溶液。试剂a是 (填化学式),实验现象是 。
(3)分子式为的有机物的结构可能有 和 两种。为确定其分子结构借助现代分析仪器可对其进行的实验方法有 。
(4)①有机物A常用于食品行业,A分子的质谱图如图所示,由图可知其相对分子质量是 。
②已知9.0g A在足量中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,则A的分子式是 。
③已知1mol A能与足量溶液发生反应,生成22.4L(标准状况下)的气体,1mol A能与足量的金属Na发生反应,生成22.4L(标准状况下)的气体,A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 。
试卷第4页,共9页
参考答案:
1.A
【详解】A.某些卤代烃在氢氧化钠的醇溶液,加热的条件下发生消去反应,有机物的不饱和度增大,A正确;
B.酯类或卤代烃在氢氧化钠的水溶液,加热的条件下发生水解反应,有机物的不饱和度不变,B错误;
C.酯等物质在稀硫酸,加热的条件下发生水解反应,有机物的不饱和度不变,C错误;
D.醛基与银氨溶液反应生成羧基,有机物的不饱和度不变,D错误。
故选A。
2.B
【详解】A.乙烯与水发生加成反应生成乙醇,乙醇催化氧化生成乙醛,乙醛氧化生成乙酸,可实现转化,A项可以实现;
B.苯环可与氢气发生加成反应,氯代烃在NaOH醇溶液中可发生消去反应,反应条件不是浓硫酸加热,B项不能实现;
C.乙烯与氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中水解生成乙二醇,可实现转化,C项可以实现;
D.光照下甲基上H被Cl取代,氯代烃在NaOH水溶液中发生水解反应生成 ,可实现转化,D项可以实现;
答案选B。
3.B
【详解】A.随着碳原子数越多,一氯代烃的相对分子质量越大,从而分子间作用力越大,则沸点越高,故A正确;
B.随着碳原子数越多,一氯代烃的相对分子质量越大,则密度越小,故B错误;
C.等碳原子数的一氯代烃,支链越多,分子间距离越大,分子间作用力越小,沸点越低,故C正确;
D.等碳原子数的一卤代烃,卤素的原子序数越大,分子间作用力越大,沸点越高,故D正确。
故选B。
4.A
【详解】A.有机物的分子式为C17H23BrN2O3S,故A正确;
B.从阿比朵尔的结构简式可看出含有硫、氧、氮、溴,是烃的衍生物,故B错误;
C.单键可以旋转,从阿比朵尔的结构简式可看出,与酯基相连的乙基的两个碳原子、与硫原子相连的碳原子可能不与苯环共面,所以所有碳原子不一定处于同一平面,故C错误;
C.苯环不是官能团,故D错误;
故选A。
5.D
【详解】A.中碳碳双键和醇羟基均易被氧气氧化,最终得不到,故A错误;
B.与溴单质发生加成反应得到,碱性水解得到: , 催化氧化得到: , 再氧化得到 ,而 不能在浓硫酸作用下生成碳碳双键,故B错误;
C.与水发生加成反应得到N: 或,N经催化氧化得到 或 ,其中羰基最终不能转化成碳碳双键,故C错误;
D.与HCl发生加成反应得到N: 或,N发生催化氧化反应其中醇羟基被氧化成醛基,继续被氧化醛基转化成羧基,然后在氢氧化钠醇溶液中发生氯原子的消去反应生成碳碳双键,再经酸化得到产物,故D正确;
故选:D。
6.D
【分析】
【详解】A.聚丙烯不含碳碳双键,不能使酸性高锰酸钾溶液褪色,故错误;
B.溴乙烷和硝酸银不反应,故错误;
C.甲烷和四氯化碳都是正四面体结构,但CF2Cl2是四面体结构,故错误;
D.苯的邻二溴代物只有一种,说明苯分子中碳原子之间的键都相同,故正确。
故选D。
7.A
【详解】A.由题图可知,PPTA可由对苯二甲酸和对苯二胺发生缩聚反应生成,PPTA的结构简式正确,A正确;
B.PPTA可由对苯二甲酸和对苯二胺发生缩聚反应生成,B错误;
C.由题图可知,PPTA中存在酰胺基和氢键,不存在亲水基,难溶于水,C错误;
D.对苯二甲酸中苯环可以与氢气发生加成反应,而羧基不能与氢气加成,所以一定条件下,1mol对苯二甲酸最多可与3molH2发生加成反应,D错误;
故选A。
8.B
【详解】有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键)化合物的反应,叫做消去反应,卤代烃分子中,连有卤素原子的碳原子必须有相邻的碳原子且此相邻的碳原子上并且还必须连有氢原子时,才可发生消去反应。则选项A、C、D中有机物均可发生消去反应,(CH3)3CCH2Cl不能发生消去反应,答案选B。
9.C
【详解】设钠原子半径是x,则该晶胞的边长是。根据晶胞的结构可知,该晶胞中含有的钠原子个数是1+8,所以有,解得r=,答案选C。
10.B
【详解】A.分子中含氮氧,故不是烯烃类物质,为烃的衍生物,A错误;
B.分子中含有碳碳双键,故能使酸性溶液和溴水褪色,B正确;
C.其分子中含3个碳、1个氧、1个氮,不饱和度为2,其同分异构体至少有:,故大于4种,C错误;
D.在碱性条件下发生水解反应,同时生成丙烯酸盐,D错误;
故选B。
11.A
【详解】饱和一元醇与钠按物质的量比1:1反应,生成的H2在标准状况下的体积为5.6L,则氢气的物质的量为 =0.25mol,由 :需要金属Na的物质的量为0.5mol,参加反应的钠的质量为0.5mol×23g/mol=11.5g23g,故醇完全反应,故饱和一元醇混合物的平均摩尔质量==37.6g/mol,由于两种醇分子中相差一个碳原子,设醇中碳原子数目分别为n、n+1,则:14n+2+1637.6 12(n+1)+2(n+1)+2+16,可得n=1,故A正确;
答案选A。
12.D
【详解】A.该物质中含有碳碳双键,在一定条件下可以发生加聚反应,故A不选;
B.能与氢气发生加成反应的有苯环、C=O键和碳碳双键,其中羧基中的C=O键不能反应,则1mol X与足量的氢气反应,最多消耗5mol H2,故B不选;
C.该有机物含有碳碳双键、羰基、氯原子、醚键和羧基五种官能团,故C不选;
D.中含有羧基和氯原子,能够与NaOH反应,在碱性条件下发生中和反应和水解反应,且水解生成的酚羟基也能与NaOH反应,则常温常压,1mol X与足量的NaOH溶液反应,最多可消耗5mol NaOH,故D选;
故选:D。
13.B
【详解】C2HF3ClBr可以可知乙烷中的5个H原子分别为1个Cl、1个Br、3个F原子取代,乙烷只有一种结构,氯原子、溴原子、氟原子连在碳原子上,调节位置,有CF3CHBrCl、BrCF2CHClF、ClCF2CHBrF、HCF2CFClBr,共有4种。
故选B。
14.C
【详解】A.含有羟基、碳碳双键、醚键、羰基共4种官能团,故A正确;
B.含有酚羟基,因此遇FeCl3溶液能发生显色反应,故B正确;
C.含有酚羟基、碳碳双键,因此汉黄芩素易被氧化,故C错误;
D.该物质含有2个苯环、1个碳碳双键、1个羰基,因此1mol该物质最多消耗8 mol H2,故D正确。
综上所述,答案为C。
15.D
【详解】A.、和中所含氮原子的数目均不相同,且三者分子组成上不是相差若干个原子团,不互为同系物,选项A错误;
B.在反应中作催化剂,总反应为,选项B错误;
C.分子中含有饱和碳原子,所有原子不可能共平面,选项C错误;
D.O的电负性大于N,故键的键长小于键的,则键的键能较大,更稳定,故可异构化为更稳定的,选项D正确;
答案选D。
16. 2,2,4-三甲基戊烷 CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr;取代(水解)反应 ;取代反应 C9H10O3 羧基、醛基 取代反应(或酯化反应) 或
【详解】分析:(1)根据异辛烷的结构简式命名;
(2)①卤代烃在氢氧化钠的水溶液中发生水解反应;
②苯酚和浓溴水发生取代反应;
(3)①根据A的键线式书写分子式,根据结构简式判断官能团;
②根据A与B分子中官能团的变化判断反应类型;
③根据羟基发生催化氧化生成醛基书写;
④根据羟基发生消去反应生成碳碳双键判断。
详解:(1)根据异辛烷的球棍模型可知主链含有5个碳原子,3个甲基作支链,则异辛烷的系统命名为2,2,4-三甲基戊烷。
(2)①2-溴丙烷与NaOH溶液发生水解反应生成2-丙醇和溴化钠,方程式为CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr;
②苯酚和饱和溴水发生取代反应生成三溴苯酚和溴化氢,方程式为;
(3)①根据A的结构简式可知A的分子式为C9H10O3,C的含氧官能团名称为羧基、醛基;
②A制取B的反应中羧基与羟基发生酯化反应生成酯基,反应类型为取代反应。
③A制取C是羟基的催化氧化,反应的化学方程式为。
④A分子中含有羟基,发生消去反应后产物的结构简式为。
17. C6H12 (CH3)2CH—C≡C—CH(CH3)2 (CH3)3CCH=CH2 CH≡CH
【详解】试题分析:(1)利用余商法计算该烃的C、H原子数。
(2)(1)饱和烃与炔烃的碳的骨架完全相同,倒推可得,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键。
(3)根据烃燃烧通式计算分子式,根据催化加氢后生成2,2—二甲基丁烷判断碳骨架。
(4)某烃1 mol和2 mol HCl完全加成,说明含有2个双键或1个叁键,生成的氯代烷最多还可以与4 mol氯气反应,说明氯代烷中有4个H原子,1 mol和2 mol HCl完全加成产物中有4个H原子,所以原物质分子中只有2个H原子
解析:(1)某烃相对分子质量为84,利用商余法,分子中最大碳原子数目为: 商为6,含H原子为 ,即该烃分子含有6个C原子、12个H原子,
所以该烃的分子式为C6H12;
(2)该饱和烃的结构简式为(CH3)2CH—CH2-CH2—CH(CH3)2 炔烃的碳的骨架完全相同,倒推可得,饱和烃相邻碳原子上必须均含有两个或两个以上的氢原子时才可出现碳碳叁键,所以该炔烃的结构简式为(CH3)2CH—C≡C—CH(CH3)2 。
(3)根据烃燃烧通式计算分子式,
X=6,y=12,
该烃分子式为C6H12;
根据催化加氢后生成2,2—二甲基丁烷,说明该烃碳骨架与2,2—二甲基丁烷相同,所以该烃的结构简式为(CH3)3CCH=CH2。
(4)某烃1 mol和2 mol HCl完全加成,说明含有2个双键或1个叁键,生成的氯代烷最多还可以与4 mol氯气反应,说明氯代烷中有4个H原子,1 mol和2 mol HCl完全加成产物中有4个H原子,所以原物质分子中只有2个H原子,所以则该烃的结构简式为CH≡CH。
点睛:烯烃催化加氢后生成某烷烃,烯烃与烷烃碳骨架完全相同,饱和烃相邻碳原子上必须均含有氢原子时才可出现碳碳双键。
18.(1) +NaOH→ +
(2)3
(3) + +H2O
(4) +2Ag(NH3)2OH +2Ag↓+3NH3+H2O
(5)
【详解】(1)化合物A是苯甲酸异丙酯,分子结构简式是 ,分子结构中含有酯基,在碱性条件下水解产生苯甲酸钠 和2-丙醇 ,该反应的化学方程式为: +NaOH→ + ;
(2)酚羟基和酯基都可以与NaOH发生反应。根据化合物B结构简式可知其中含有2个酚羟基和一个酯基,故1 mol化合物B在一定条件下,可以与3 mol NaOH发生反应;
(3)化合物C分子中含有羧基,化合物D分子中含有醇羟基,二者在浓硫酸存在条件下加热,发生酯化反应产生酯和水,该反应的化学方程式为: + +H2O;
(4)化合物D分子中含有醛基,具有还原性,可以被银氨溶液氧化,醛基被氧化为羧基,银氨溶液被还原为Ag单质,同时反应产生NH3、H2O,该反应的化学方程式为: +2Ag(NH3)2OH +2Ag↓+3NH3+H2O;
(5)E的同分异构体同时符合条件:A.苯环上只有一个取代基;B.能发生水解反应,说明含有酯基;C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀,说明含有醛基,则该物质是甲酸形成的酯,该物质的结构简式为 。
19.(1)蒸馏烧瓶
(2)获得氢溴酸
(3)温度控制不当
(4)减少溴乙烷的挥发
(5)a
(6)取少量产物于试管中,向其中加入水溶液,加热,充分反应后再加入稀硝酸至溶液呈酸性,滴加溶液,若产生淡黄色沉淀,则证明该产物为溴乙烷
【分析】装置A中浓、乙醇、固体在加热条件下反应生成溴乙烷,溴乙烷沸点为,冷凝收集溴乙烷。要检验溴乙烷中的溴原子,先加氢氧化钠水解出溴离子,再加硝酸中和氢氧化钠,最后加硝酸银。
【详解】(1)根据装置图,仪器A的名称是蒸馏烧瓶;
(2)乙醇和浓的氢溴酸反应生成溴乙烷和水,向A中加入固体和浓的目的是获得氢溴酸;
(3)乙醇和浓硫酸在170℃时发生消去反应生成乙烯,乙醇和浓硫酸在140℃时发生取代反应生成乙醚,所以反应生成的乙烯和乙醚的原因是温度控制不当;
(4)溴乙烷的沸点为,将锥形瓶置于冰水浴中的作用是减少溴乙烷的挥发;
(5)溴乙烷中可能含有HBr等酸性物质,提纯产物时需向锥形瓶中加入溶液,充分振荡,静置后分液得粗产品,再经提纯获得纯品,选a。
(6)溴乙烷不能电离,取少量产物于试管中,向其中加入水溶液,加热,发生水解反应,再加入稀硝酸至溶液呈酸性,滴加溶液,若产生淡黄色沉淀,则证明溴乙烷中含原子。
20.(1) 防止暴沸 溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度 浓硫酸 防止副反应发生
(2) 出现浅黄色沉淀
(3)红外光谱法
(4) 90
【详解】(1)①实验室利用乙醇制乙烯过程中,碎瓷片的作用是防止暴沸;该反应的方程式为;
②乙醛和银氨溶液水浴中加热发生银镜反应,化学反应方程式为;
③制备乙酸乙酯过程中,饱和碳酸钠溶液的作用是溶解乙醇,反应乙酸,降低乙酸乙酯的溶解度;
④向试管a中依次加入2mL乙醇、0.5mL浓硫酸(作催化剂和吸水剂)、2mL乙酸和碎瓷片。实验中过程中,对反应物加热的温度不能过高,以防止副反应发生。
(2)①1-溴丙烷在NaOH水溶液中加热发生水解生成丙醇,反应的化学方程式为;
②试剂a应为HNO3,其作用是将溶液酸化,以免干扰溴离子的检验;往试管中滴入溶液,反应会生成浅黄色沉淀。
(3)通过红外光谱法可获得分子中所含有的化学键或官能团的信息,从而确定分子的结构。
(4)①质谱图中,最右边的质荷比表示该有机物的相对分子质量,由此可知该有机物的相对分子质量是90;
②9.0g C在足量氧气中充分燃烧生成5.4g水和13.2g二氧化碳,则C分子中碳原子的物质的量n(C)=n(CO2)==0.3mol、氢原子的物质的量n(H)=2 n(H2O)=×2=0.6mol,氧原子的物质的量n(O)==0.3mol,C的分子中C、H、O的原子个数比为0.3mol:0.6mol:0.3mol =1:2:1,最简式为CH2O,由质谱图可知,C的相对分子质量为90,设C的分子式为(CH2O)n,则n==3,所以C的分子式为C3H6O3;
③由题给信息,结合A的分子式可知,A分子中含有1个羧基和1个羟基。A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,说明分子中含有1个甲基,由此可推知A的结构简式是
