化学人教版(2019)第二册6.1.1化学反应与热能(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)第二册6.1.1化学反应与热能(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 231.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 11:29:37 | ||
图片预览









文档简介
1、通过实验和已有知识、经验感受化学反应中的能量变化,知道常见的吸热反应和放热反应,树立物质变化中伴随能量变化的观念。
2、能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
化学反应中能量变化的本质。
化学反应中能量变化的本质。
燃烧是一个化学变化,它们中的能量是如何变化的呢?其他化学反应,有热量变化吗?
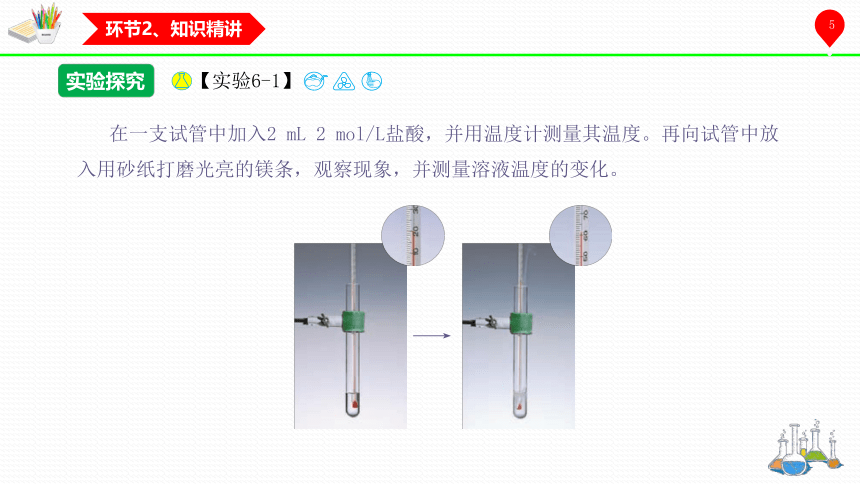
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验探究
【实验6-1】
实验探究
【实验6-1】
{7DF18680-E054-41AD-8BC1-D1AEF772440D}现象
结论
反应方程式
镁与盐酸反应,放出大量气泡
反应是放热反应
Mg + 2HCl === MgCl2 + H2↑
温度计水银柱上升
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验探究
【实验6-1】
将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
实验探究
【实验6-2】
实验探究
【实验6-2】
将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
实验探究
【实验6-2】
{7DF18680-E054-41AD-8BC1-D1AEF772440D}现象
结论
反应方程式
有刺激性气味气体产生;混合物呈糊状;木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
Ba(OH)2· 8H2O + 2NH4Cl
===BaCl2 +2NH3 +10H2O↑
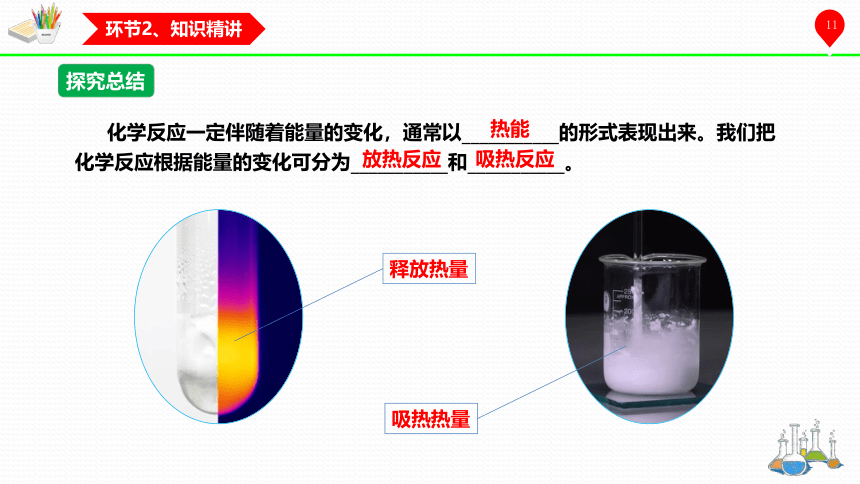
探究总结
化学反应一定伴随着能量的变化,通常以___________的形式表现出来。我们把化学反应根据能量的变化可分为___________和___________。
热能
放热反应
吸热反应
释放热量
吸热热量
根据日常生活和已学化学反应,你还知道哪些放热反应,哪些吸热反应?
钠投入水中
钢铁冶炼
炸药爆炸
思考与讨论
所有的燃烧
一、化学反应与热能
1、常见的放热反应
① 燃烧
② 酸碱中和反应
③ 大多数化合反应
④ 金属与酸(或水)反应放出氢气的反应
⑤ 物质的缓慢氧化
一、化学反应与热能
2、常见的吸热反应
① 大多数分解反应
② Ba(OH)2· 8H2O + 2NH4Cl===BaCl2 +2NH3 +10H2O↑
⑤ 盐酸与碳酸氢钠的反应
③ C(灼热)+CO2 === 2CO
高温
④ C+H2O(g) === CO+H2
高温
△
NH4Cl===NH3 + HCl
思考与讨论
1、需要加热才能进行的反应一定是吸热反应吗?
2、放热过程不一定是放热反应,吸热过程不一定是吸热反应。
2Al + Fe2O3 === 2Fe + Al2O3
高温
浓硫酸的稀释,NaOH固体的溶解等是放热过程。
升华、蒸发、电离等是吸热过程。
3、放热反应不一定容易发生,如合成氨的反应;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应。
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
二、化学反应中能量变化的分析
二、化学反应中能量变化的分析
氧化汞
HgO
O
Hg
Hg
Hg
O
O
汞
Hg
氧气
O2
O
Hg
+
氧化汞分解反应示意图
化学反应在宏观上生成了新物质,其微观实质是反应物分子破裂为原子,原子重新结合成生成物分子。
二、化学反应中能量变化的分析
氯气
Cl2
Cl
O
Cl
氢气
H2
H
H
Cl
O
Cl
H
H
氯化氢
HCl
氯气和氢气反应示意图
+
+
我们又学习了化学键,认识了原子(离子)之间以化学键结合成分子(物质)。化学反应的实质是旧的化学键断裂、新的化学键形成的过程。
请判断上述反应是吸热反应还是放热反应?
1 mol H2
共价键断裂
吸收436 kJ能量
2 mol H
1 mol Cl2
共价键断裂
吸收243 kJ能量
2 mol Cl
共价键形成
释放862 kJ能量
2 mol HCl
吸收的总能量:679 kJ
释放的总能量:862 kJ
<
放热反应
H2(g) + Cl2(g) = 2HCl(g)
放出
183
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中, 了 kJ的能量。
思考与讨论
1、从化学键的观点来分析能量的变化(微观)
二、化学反应中能量变化的分析
旧化学键
断裂
吸收能量
放出能量
新化学键
形成
由上分析,化学反应在物质变化的过程中一定伴随着能量的变化。
一个化学反应是放出热量还是吸收热量取决于什么?
吸热反应
吸收的多,放出的少
吸收的少,放出的多
放热反应
生成物的总能量高
反应物的总能量低
2、从化学能的观点来分析能量的变化(宏观)
二、化学反应中能量变化的分析
反应物的总能量高
生成物的总能量低
化学反应
释放能量
化学反应
吸收能量
各种物质都具有_______,物质的组成、结构与状态不同,所具有的能量不同。
能量
二、化学反应中能量变化的分析
吸热反应
放热反应
断键吸收总能量 > 成键放出总能量
断键吸收总能量 < 成键放出总能量
微观
宏观
反应物的总能量 > 生成物的总能量
反应物的总能量< 生成物的总能量
吸收的多,放出的少
吸收的少,放出的多
能量由高到低
能量由低到高
吸热反应
放热反应
二、化学反应中能量变化的分析
能
量
反应进程
反应物
生成物
E吸
E放
能
量
反应进程
生成物
反应物
E放
E吸
放热反应
吸热反应
化学反应的过程可以看成是能量的“贮存”或“释放”的过程。
原始社会人均耗能
8×103 kJ/d
农业社会人均耗能
5×104 kJ/d
现代社会人均耗能
1×106 kJ/d
社会发展和能源的利用
人类对能源的利用
2015年我国能源消费总量和构成
煤炭
石油
节能不是简单地减少能源的使用,更重要的是充分有效的利用能源。
燃料利用过程中,节能的主要环节是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清洁积灰等方法;另一个环节是能量利用阶段,可通过使用节能灯、改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用。
目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
常见的放热反应
和吸热反应
微观
放热反应:吸收的少、放出的多
宏观
吸热反应:吸收的多、放出的少
放热反应:反应物高、生成物低
吸热反应:反应物低、生成物高
化学反应一定
伴随着能量变化
化学反应与热能
练习2、已知拆开1 mol H2中的化学键要吸收436 kJ的能量,拆开1 mol O2中的化学键要吸收498 kJ的能量,形成气态水中1 mol H—O键要放出465 kJ的能量。若反应2H2+O2 === 2H2O(g)中生成2 molH2 O(g) 需 (填“放出”或“吸收”)能量 kJ。
490
放出
练习1、化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一。化学反应的另一基本特征是 ,通常表现为 的释放或吸收。
练习3、下列说法错误的是( )。
A、化学反应必然伴随发生能量变化
B、化学反应中的能量变化与反应物的质量无关
C、能量变化必然伴随发生化学反应
D、化学反应中的能量变化主要是由化学键变化引起的
练习4、一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )。
A、金刚石比石墨稳定
B、等质量的金刚石和石墨完全燃烧释放的热量相同
C、金刚石转化为石墨是吸热反应
D、1 mol C(金刚石)比1 mol C(石墨)的总能量高
2、能从反应物与生成物所具有的能量、化学键的断裂与形成两个角度理解化学反应中能量变化的主要原因,提升证据推理能力。
化学反应中能量变化的本质。
化学反应中能量变化的本质。
燃烧是一个化学变化,它们中的能量是如何变化的呢?其他化学反应,有热量变化吗?
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验探究
【实验6-1】
实验探究
【实验6-1】
{7DF18680-E054-41AD-8BC1-D1AEF772440D}现象
结论
反应方程式
镁与盐酸反应,放出大量气泡
反应是放热反应
Mg + 2HCl === MgCl2 + H2↑
温度计水银柱上升
在一支试管中加入2 mL 2 mol/L盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条,观察现象,并测量溶液温度的变化。
实验探究
【实验6-1】
将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
实验探究
【实验6-2】
实验探究
【实验6-2】
将20 g Ba(OH)2·8H2O晶体研细后与10 g NH4Cl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的木片上。用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸杯壁下部,试着用手拿起烧杯。观察现象。
实验探究
【实验6-2】
{7DF18680-E054-41AD-8BC1-D1AEF772440D}现象
结论
反应方程式
有刺激性气味气体产生;混合物呈糊状;木片与烧杯底部粘在一起;用手触摸杯壁下部发凉。
Ba(OH)2·8H2O与NH4Cl反应吸收热量
Ba(OH)2· 8H2O + 2NH4Cl
===BaCl2 +2NH3 +10H2O↑
探究总结
化学反应一定伴随着能量的变化,通常以___________的形式表现出来。我们把化学反应根据能量的变化可分为___________和___________。
热能
放热反应
吸热反应
释放热量
吸热热量
根据日常生活和已学化学反应,你还知道哪些放热反应,哪些吸热反应?
钠投入水中
钢铁冶炼
炸药爆炸
思考与讨论
所有的燃烧
一、化学反应与热能
1、常见的放热反应
① 燃烧
② 酸碱中和反应
③ 大多数化合反应
④ 金属与酸(或水)反应放出氢气的反应
⑤ 物质的缓慢氧化
一、化学反应与热能
2、常见的吸热反应
① 大多数分解反应
② Ba(OH)2· 8H2O + 2NH4Cl===BaCl2 +2NH3 +10H2O↑
⑤ 盐酸与碳酸氢钠的反应
③ C(灼热)+CO2 === 2CO
高温
④ C+H2O(g) === CO+H2
高温
△
NH4Cl===NH3 + HCl
思考与讨论
1、需要加热才能进行的反应一定是吸热反应吗?
2、放热过程不一定是放热反应,吸热过程不一定是吸热反应。
2Al + Fe2O3 === 2Fe + Al2O3
高温
浓硫酸的稀释,NaOH固体的溶解等是放热过程。
升华、蒸发、电离等是吸热过程。
3、放热反应不一定容易发生,如合成氨的反应;吸热反应不一定难发生,如Ba(OH)2·8H2O晶体与NH4Cl晶体的反应。
化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
二、化学反应中能量变化的分析
二、化学反应中能量变化的分析
氧化汞
HgO
O
Hg
Hg
Hg
O
O
汞
Hg
氧气
O2
O
Hg
+
氧化汞分解反应示意图
化学反应在宏观上生成了新物质,其微观实质是反应物分子破裂为原子,原子重新结合成生成物分子。
二、化学反应中能量变化的分析
氯气
Cl2
Cl
O
Cl
氢气
H2
H
H
Cl
O
Cl
H
H
氯化氢
HCl
氯气和氢气反应示意图
+
+
我们又学习了化学键,认识了原子(离子)之间以化学键结合成分子(物质)。化学反应的实质是旧的化学键断裂、新的化学键形成的过程。
请判断上述反应是吸热反应还是放热反应?
1 mol H2
共价键断裂
吸收436 kJ能量
2 mol H
1 mol Cl2
共价键断裂
吸收243 kJ能量
2 mol Cl
共价键形成
释放862 kJ能量
2 mol HCl
吸收的总能量:679 kJ
释放的总能量:862 kJ
<
放热反应
H2(g) + Cl2(g) = 2HCl(g)
放出
183
1 mol H2与1 mol Cl2反应生成2 mol HCl分子的过程中, 了 kJ的能量。
思考与讨论
1、从化学键的观点来分析能量的变化(微观)
二、化学反应中能量变化的分析
旧化学键
断裂
吸收能量
放出能量
新化学键
形成
由上分析,化学反应在物质变化的过程中一定伴随着能量的变化。
一个化学反应是放出热量还是吸收热量取决于什么?
吸热反应
吸收的多,放出的少
吸收的少,放出的多
放热反应
生成物的总能量高
反应物的总能量低
2、从化学能的观点来分析能量的变化(宏观)
二、化学反应中能量变化的分析
反应物的总能量高
生成物的总能量低
化学反应
释放能量
化学反应
吸收能量
各种物质都具有_______,物质的组成、结构与状态不同,所具有的能量不同。
能量
二、化学反应中能量变化的分析
吸热反应
放热反应
断键吸收总能量 > 成键放出总能量
断键吸收总能量 < 成键放出总能量
微观
宏观
反应物的总能量 > 生成物的总能量
反应物的总能量< 生成物的总能量
吸收的多,放出的少
吸收的少,放出的多
能量由高到低
能量由低到高
吸热反应
放热反应
二、化学反应中能量变化的分析
能
量
反应进程
反应物
生成物
E吸
E放
能
量
反应进程
生成物
反应物
E放
E吸
放热反应
吸热反应
化学反应的过程可以看成是能量的“贮存”或“释放”的过程。
原始社会人均耗能
8×103 kJ/d
农业社会人均耗能
5×104 kJ/d
现代社会人均耗能
1×106 kJ/d
社会发展和能源的利用
人类对能源的利用
2015年我国能源消费总量和构成
煤炭
石油
节能不是简单地减少能源的使用,更重要的是充分有效的利用能源。
燃料利用过程中,节能的主要环节是燃料燃烧阶段,可通过改进锅炉的炉型和燃料空气比、清洁积灰等方法;另一个环节是能量利用阶段,可通过使用节能灯、改进电动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用。
目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
常见的放热反应
和吸热反应
微观
放热反应:吸收的少、放出的多
宏观
吸热反应:吸收的多、放出的少
放热反应:反应物高、生成物低
吸热反应:反应物低、生成物高
化学反应一定
伴随着能量变化
化学反应与热能
练习2、已知拆开1 mol H2中的化学键要吸收436 kJ的能量,拆开1 mol O2中的化学键要吸收498 kJ的能量,形成气态水中1 mol H—O键要放出465 kJ的能量。若反应2H2+O2 === 2H2O(g)中生成2 molH2 O(g) 需 (填“放出”或“吸收”)能量 kJ。
490
放出
练习1、化学反应的本质是有新物质生成,物质的变化是化学反应的基本特征之一。化学反应的另一基本特征是 ,通常表现为 的释放或吸收。
练习3、下列说法错误的是( )。
A、化学反应必然伴随发生能量变化
B、化学反应中的能量变化与反应物的质量无关
C、能量变化必然伴随发生化学反应
D、化学反应中的能量变化主要是由化学键变化引起的
练习4、一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )。
A、金刚石比石墨稳定
B、等质量的金刚石和石墨完全燃烧释放的热量相同
C、金刚石转化为石墨是吸热反应
D、1 mol C(金刚石)比1 mol C(石墨)的总能量高
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
