化学人教版九上课后提分练:3.2 原子结构(含解析)
文档属性
| 名称 | 化学人教版九上课后提分练:3.2 原子结构(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 251.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 10:33:42 | ||
图片预览




文档简介
原子结构
一、选择题
1.与元素的化学性质关系最密切的是 ( )
A.元素的相对原子质量
B.元素的核电荷数
C.原子的核外电子数
D.原子的最外层电子数
2.一般原子的原子核是:
A.由电子和质子构成 B.由电子和中子构成
C.由质子和中子构成 D.由电子、质子和中子构成
3.某元素R的原子序数为m,能够形成核外有x个电子的Rn+,则下列关系式一定正确的是:
A.m=n B.m=n+x C.m=n-x D.m=x-n
4.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
5.如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
6.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是
A. B..
C. D.
7.下列对微粒的描述中,不正确的是()
A.易失电子 B.易形成阴离子
C.阳离子 D.化学性质稳定
8.下列关于原子的叙述正确的是( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子不能直接构成物质.
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤
9.下列各组物质中,按顺序分别是由分子、原子、离子构成的一组是( )
A.水、铁、乙醇
B.干冰、氮气、氯化钠
C.氢气、汞、硫酸铜
D.氮气、甲烷、硝酸钾
10.人们对微观世界的认识是一个不断发展的过程。关于原子结构的说法有:
①在球体内充斥正电荷,电子镶嵌其中
②原子是可分的
③原子核外的电子是分层排布的
④原子中有带负电的电子
⑤原子核外的电子能量相同
⑥原子核很小,但集中了原子的大部分质量
其中正确的观点是
A.①②③④⑤⑥
B.②③④⑥
C.①③④⑤
D.②③④⑤⑥
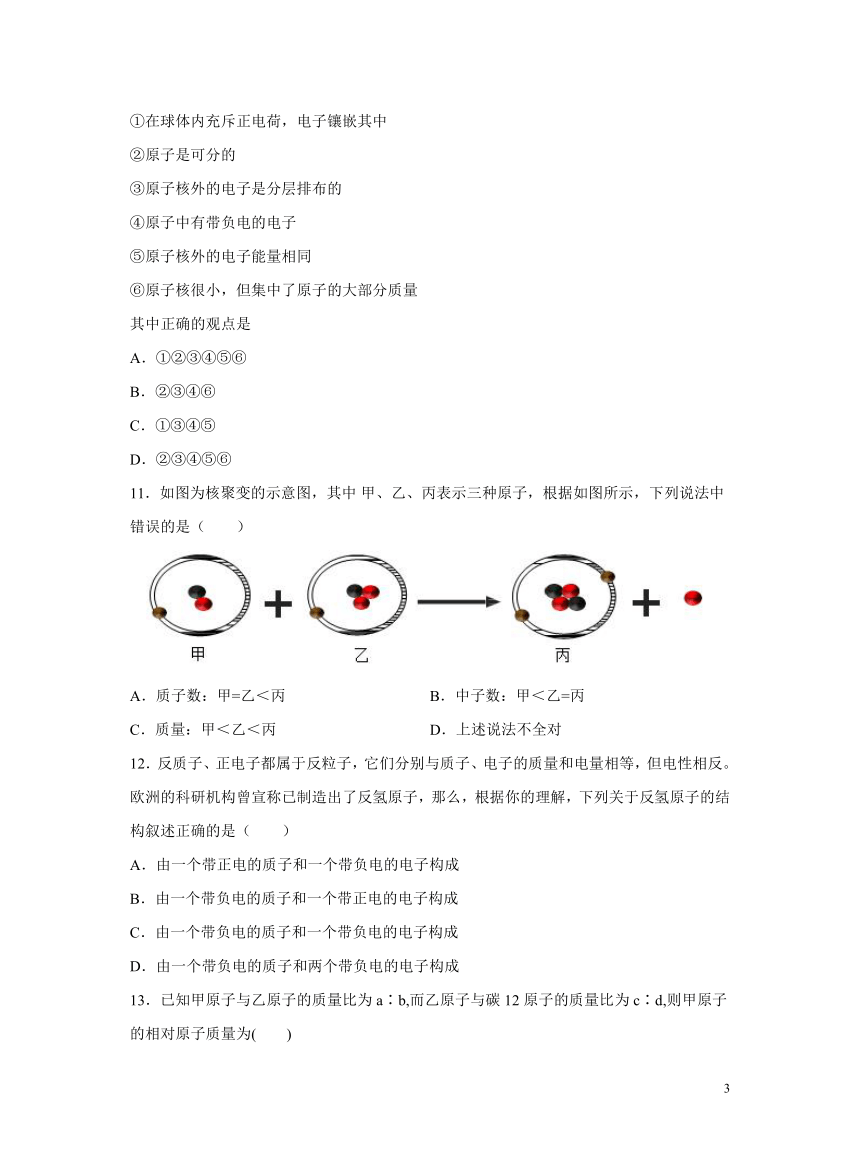
11.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
12.反质子、正电子都属于反粒子,它们分别与质子、电子的质量和电量相等,但电性相反。欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是( )
A.由一个带正电的质子和一个带负电的电子构成
B.由一个带负电的质子和一个带正电的电子构成
C.由一个带负电的质子和一个带负电的电子构成
D.由一个带负电的质子和两个带负电的电子构成
13.已知甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲原子的相对原子质量为( )
A. B. C. D.
14.已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )
A.16m/(m-n) B.16n/(m-n) C.16n/(n-m) D.32n/(m-n)
15.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为
A.12 B.16
C.5 D.10
二、填空题
16.在以下粒子中找出符合下列条件的粒子,将序号填在横线上:
①分子 ②原子 ③离子 ④阳离子 ⑤阴离子 ⑥原子核 ⑦质子 ⑧中子 ⑨电子
(1)质量最小的粒子:________;
(2)带正电荷的粒子:________;
(3)带负电荷的粒子:________;
(4)不显电性的粒子:________;
(5)决定原子质量的粒子:___________;
(6)与氢原子相对原子质量接近的:_________________;
(7)同一原子中数目相等的粒子:__________________;
(8)能直接构成纯净物的粒子:__________________;
(9)化学变化中最小的粒子:____________________。
17.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由分子构成的物质是 _____ ,由离子构成的物质是 _____ 。
(2)是某粒子的结构示意图,该粒子在化学反应中容易 _____ 电子形成 _____ 。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 _____ (填字母)。
a ①② b ②③ c ③④ d ④⑤
18.某粒子(原子或离子)的结构示意图为: ,请回答下列问题:
(1)若n=8,且该粒子带两个单位负电荷则该粒子的符号为__________;
(2)若m-n<10,则该粒子是一个____________(选填“原子”、“阳离子”或“阴离子”);
(3)若m=19,n=___________,则该粒子的符号为____________。
19.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
20.下面是几种粒子的结构示意图:
(1)B粒子所表示的元素符号为_____;
(2)表示原子的粒子有_____(填序号,下同);
(3)表示阴离子的有_____;
(4)表示阳离子的有_____;
(5)在化学反应中易失去电子的粒子是_____,写出其离子符号_____;
(6)在化学反应中易得到电子的粒子是_____,写出其离子符号_____。
答案解析
一、选择题
1.与元素的化学性质关系最密切的是 ( )
A.元素的相对原子质量
B.元素的核电荷数
C.原子的核外电子数
D.原子的最外层电子数
【答案】D
【详解】元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决定元素化学性质的是最外层电子数;故选D。
2.一般原子的原子核是:
A.由电子和质子构成 B.由电子和中子构成
C.由质子和中子构成 D.由电子、质子和中子构成
【答案】C
【详解】原子核一般是由质子与中子构成的,电子存在于原子核的周围,故选C。
3.某元素R的原子序数为m,能够形成核外有x个电子的Rn+,则下列关系式一定正确的是:
A.m=n B.m=n+x C.m=n-x D.m=x-n
【答案】B
【详解】某元素R的原子序数为m,原子中原子序数=核电荷数=质子数=核外电子数,则该原子的原子核外电子数为m;能够形成核外有x个电子的Rn+离子,Rn+是R原子失去n个电子得到的,m= x+ n,故选B。
4.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
【答案】A
【详解】Na失去1个电子形成Na+,②核外电子数、③电子层结构均发生了改变;核内质子数没有发生改变,则①核电荷数相同;由于原子的质量主要集中在原子核上,故失去一个电子对质量影响很小,质量几乎相等,即④相对原子质量几乎相等,二者质子数都为11,且Na+核外为8电子稳定结构,较钠原子稳定。故①④⑤⑥说法正确。故选:A。
5.如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
【答案】A
【详解】氧气是由氧分子构成的;氧分子是由氧原子构成的;原子分为原子核和核外电子,原子核分为质子和中子;所以a、b、c相对应的是原子、原子核、核外电子;故选A。
6.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是
A. B..
C. D.
【答案】A
【详解】A、质子数为2的He为稀有气体元素,化学性质稳定;氩的原子最外层为8个电子,化学性质稳定,化学性质相似; B、两种粒子最外层电子数分别为7、1,最外层电子数不相同,化学性质不相似;
C、虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同,质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;化学性质不同;D、两种粒子最外层电子数分别为8、6,最外层电子数不相同,化学性质不相似。
故选:A。
7.下列对微粒的描述中,不正确的是()
A.易失电子 B.易形成阴离子
C.阳离子 D.化学性质稳定
【答案】C
【详解】A.最外层电子数为1,在化学变化中易失去电子,故选项A正确;B.最外层电子数为6,在化学变化中易得到电子形成阴离子,故选项B正确;C.核内质子数小于核外电子数,不是阳离子,是阴离子,故选项C错误;D.最外层电子数为8,化学性质稳定,故选项D正确。故选C。
8.下列关于原子的叙述正确的是( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子不能直接构成物质.
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤
【答案】A
【详解】①原子中不一定含有中子,比如氢原子不含有中子,错误; ②原子在不停地运动,正确;③原子是化学变化中的最小粒子,正确; ④原子由原子核和核外电子构成,正确; ⑤原子能直接构成物质,如铜是由铜原子直接构成的,错误。故选A。
9.下列各组物质中,按顺序分别是由分子、原子、离子构成的一组是( )
A.水、铁、乙醇
B.干冰、氮气、氯化钠
C.氢气、汞、硫酸铜
D.氮气、甲烷、硝酸钾
【答案】C
【详解】A、水是由氢、氧元素组成的化合物,是由水分子构成的; 铁属于金属单质,是由铁原子直接构成的;乙醇是由乙醇分子构成的,不符合题意;B、干冰是固态二氧化碳,是由二氧化碳分子构成的;氮气属于气态非金属单质,是由氮分子构成的,氯化钠是由钠离子和氯离子构成的,不符合题意;C、氢气属于气态单质,是由氢分子构成的;汞属于金属单质,是由汞原子直接构成的;硫酸铜是由铜离子和硫酸根离子构成的,符合题意; D、氮气属于气态单质,是由氮分子构成的;甲烷是由甲烷分子构成的,硝酸钾是由钾离子和硝酸根离子构成的,不符合题意。故选C。
10.人们对微观世界的认识是一个不断发展的过程。关于原子结构的说法有:
①在球体内充斥正电荷,电子镶嵌其中
②原子是可分的
③原子核外的电子是分层排布的
④原子中有带负电的电子
⑤原子核外的电子能量相同
⑥原子核很小,但集中了原子的大部分质量
其中正确的观点是
A.①②③④⑤⑥
B.②③④⑥
C.①③④⑤
D.②③④⑤⑥
【答案】B
【详解】①在球体内充斥正电荷,电子并不是镶嵌其中,因为质子带正电荷,电子在原子核外高速运动,说法错误;②原子是可分的,分为原子核和核外电子,说法正确;③原子核外的电子是分层排布的,说法正确;④原子中有带负电的电子,说法正确;⑤原子核外的电子是分层排布的,能量不相同,说法错误;
⑥原子核很小,但集中了原子的大部分质量,质子、中子均在核内,核外电子质量可忽略不计,说法正确;
故②③④⑥正确;故选:B。
11.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
【答案】D
【详解】A、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲和乙中质子数都是1,丙中质子数是2,故A正确;B、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲的中子数是1,乙和丙的中子数是2,故B正确;C、决定原子质量大小的微粒是中子和质子,甲中含有一个质子和一个中子,乙中含有一个质子和2个中子,丙中含有2个质子和2个中子,所以质量:甲<乙<丙,故C正确;D、由于ABC都正确,所以D错误,故D错误。故选:D。
12.反质子、正电子都属于反粒子,它们分别与质子、电子的质量和电量相等,但电性相反。欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是( )
A.由一个带正电的质子和一个带负电的电子构成
B.由一个带负电的质子和一个带正电的电子构成
C.由一个带负电的质子和一个带负电的电子构成
D.由一个带负电的质子和两个带负电的电子构成
【答案】B
【详解】氢原子由一个带正电的质子和一个带负电的电子构成,则反氢原子由一个带负电的质子和—个带正电的电子构成,故选B。
13.已知甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲原子的相对原子质量为( )
A. B. C. D.
【答案】A
【详解】碳12原子的相对原子质量为12,由乙原子与碳12原子的质量比为c:d,可知乙原子的相对原子质量为,又知甲原子与乙原子的质量比为a:b,则甲原子的相对原子质量为 。故选A。
14.已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )
A.16m/(m-n) B.16n/(m-n) C.16n/(n-m) D.32n/(m-n)
【答案】B
【详解】1个硫原子的质量为n-2(m-n) kg,若以一个氧原子质量的1/16作为相对原子质量的标准,硫的相对原子质量为则SO2的相对分子质量为+16×2,故选B。
15.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为
A.12 B.16
C.5 D.10
【答案】B
【详解】由左图,碳12原子的与1个氢原子的质量相等,氢原子的相对原子质量为1,则1个碳12原子的相对原子质量为12;右图中,左盘上有1个碳12原子和个碳12原子,个碳12原子的相对原子质量为,则左盘上碳原子的相对原子质量为12+4=16;故A原子的相对原子质量约为16;故选B。
二、填空题
16.在以下粒子中找出符合下列条件的粒子,将序号填在横线上:
①分子 ②原子 ③离子 ④阳离子 ⑤阴离子 ⑥原子核 ⑦质子 ⑧中子 ⑨电子
(1)质量最小的粒子:________;
(2)带正电荷的粒子:________;
(3)带负电荷的粒子:________;
(4)不显电性的粒子:________;
(5)决定原子质量的粒子:___________;
(6)与氢原子相对原子质量接近的:_________________;
(7)同一原子中数目相等的粒子:__________________;
(8)能直接构成纯净物的粒子:__________________;
(9)化学变化中最小的粒子:____________________。
【答案】(1)⑨ (2)④⑥⑦ (3)⑤⑨ (4)①②⑧ (5)⑦⑧ (6)⑦⑧ (7)⑦⑨
(8)①②③ (9)②
【详解】(1)质量最小的粒子是电子,故填:⑨;
(2)带正电的粒子是阳离子、原子核、质子,故填:④⑥⑦;
(3)带负电荷的粒子是阴离子、电子,故填:⑤⑨;
(4)不显电性的粒子是分子、原子、中子,故填:①②⑧;
(5)原子的质量主要集中在原子核,而原子核又是由质子和中子构成的,因此决定原子质量的粒子是质子和中子,故填:⑦⑧;
(6)一个氢原子的质量约为1.67×10-27kg,一个质子的质量约为1.6726×10-27kg,一个中子的质量约为1.6749×10-27kg,与氢原子质量接近的是质子、中子,故填:⑦⑧;
(7)同一原子中,质子数=电子数,故填:⑦⑨;
(8)分子、原子、离子都能直接构成纯净物,故填:①②③;
(9)原子是化学变化中的最小粒子,故填:②。
17.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由分子构成的物质是 _____ ,由离子构成的物质是 _____ 。
(2)是某粒子的结构示意图,该粒子在化学反应中容易 _____ 电子形成 _____ 。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 _____ (填字母)。
a ①② b ②③ c ③④ d ④⑤
【答案】(1)干冰 氯化钠
(2) 失去 Na+
(3) d
【详解】(1)氯化钠由离子构成,金刚石由原子构成,干冰由分子构成,该三种物质中,由分子构成的物质是干冰 ,由离子构成的物质是氯化钠 ;
(2)最外层是1个电子的原子,易失去电子,故该粒子在化学反应中容易失去电子,核内有11个质子的原子是钠原子,所得粒子是钠离子,其符号是Na+;
(3)由反应的微观示意图可知,碳原子、氧原子在化学反应前后没变,故选d。
18.某粒子(原子或离子)的结构示意图为: ,请回答下列问题:
(1)若n=8,且该粒子带两个单位负电荷则该粒子的符号为__________;
(2)若m-n<10,则该粒子是一个____________(选填“原子”、“阳离子”或“阴离子”);
(3)若m=19,n=___________,则该粒子的符号为____________。
【答案】(1)S2- (2)阴离子 (3)8 K+
【详解】(1)若n=8,且该粒子带两个单位负电荷,则m=2+8+8-2=16,为硫元素,则该粒子的符号为S2-;
(2)若m-n<10,即m<10+n,质子数<核外电子数,为阴离子;
(3)若m=19,该元素为钾元素,根据原子核外电子排布规律,钾原子的第三层的电子数为8,该粒子失去了一个电子为钾离子符号为K+。
19.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
【答案】(1)原子 阳离子
(2)12
(3)17 8
【详解】(1)当x=10+y时,核电荷数=核外电子数,该粒子表示原子;当x>10+y时,核电荷数>核外电子数,说明该粒子失去了电子,所以表示阳离子;
(2)若该结构示意图表示的粒子是R原子,则x=10+y,当y=2时,x=12。
(3)若该结构示意图表示的粒子是R-离子,说明R原子得到一个电子形成稳定结构,所以y=8,R-离子的核外电子数是18,又因为R原子得到一个电子形成R-离子,则x=17。
20.下面是几种粒子的结构示意图:
(1)B粒子所表示的元素符号为_____;
(2)表示原子的粒子有_____(填序号,下同);
(3)表示阴离子的有_____;
(4)表示阳离子的有_____;
(5)在化学反应中易失去电子的粒子是_____,写出其离子符号_____;
(6)在化学反应中易得到电子的粒子是_____,写出其离子符号_____。
【答案】(1)O (2)BD (3)AE (4)C (5)D Mg2+ (6)B O2-
【详解】(1)质子数决定元素的种类,由粒子的结构示意图可知B为氧元素,元素符号为O;
(2)B、D中的质子数等于电子数是原子。表示原子的粒子有BD;
(3)A、E的质子数小于电子数是阴离子. 表示阴离子的有AE;
(4)在C中,质子数是11,电子数是10,是阳离子. 表示阳离子的有C;
(5)在化学反应中最外层电子数小于4的易失去电子,故在化学反应中易失去电子的粒子是D,易失去最外层的2个电子形成镁离子。在化学反应中易失去电子的粒子是D,其离子符号为Mg2+;
(6)在化学反应中最外层电子数大于4的易得到电子,故在化学反应中易得到电子的粒子是B,易得到2个电子形成氧离子。在化学反应中易得到电子的粒子是B,其离子符号为:O2-。
1
一、选择题
1.与元素的化学性质关系最密切的是 ( )
A.元素的相对原子质量
B.元素的核电荷数
C.原子的核外电子数
D.原子的最外层电子数
2.一般原子的原子核是:
A.由电子和质子构成 B.由电子和中子构成
C.由质子和中子构成 D.由电子、质子和中子构成
3.某元素R的原子序数为m,能够形成核外有x个电子的Rn+,则下列关系式一定正确的是:
A.m=n B.m=n+x C.m=n-x D.m=x-n
4.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
5.如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
6.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是
A. B..
C. D.
7.下列对微粒的描述中,不正确的是()
A.易失电子 B.易形成阴离子
C.阳离子 D.化学性质稳定
8.下列关于原子的叙述正确的是( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子不能直接构成物质.
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤
9.下列各组物质中,按顺序分别是由分子、原子、离子构成的一组是( )
A.水、铁、乙醇
B.干冰、氮气、氯化钠
C.氢气、汞、硫酸铜
D.氮气、甲烷、硝酸钾
10.人们对微观世界的认识是一个不断发展的过程。关于原子结构的说法有:
①在球体内充斥正电荷,电子镶嵌其中
②原子是可分的
③原子核外的电子是分层排布的
④原子中有带负电的电子
⑤原子核外的电子能量相同
⑥原子核很小,但集中了原子的大部分质量
其中正确的观点是
A.①②③④⑤⑥
B.②③④⑥
C.①③④⑤
D.②③④⑤⑥
11.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
12.反质子、正电子都属于反粒子,它们分别与质子、电子的质量和电量相等,但电性相反。欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是( )
A.由一个带正电的质子和一个带负电的电子构成
B.由一个带负电的质子和一个带正电的电子构成
C.由一个带负电的质子和一个带负电的电子构成
D.由一个带负电的质子和两个带负电的电子构成
13.已知甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲原子的相对原子质量为( )
A. B. C. D.
14.已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )
A.16m/(m-n) B.16n/(m-n) C.16n/(n-m) D.32n/(m-n)
15.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为
A.12 B.16
C.5 D.10
二、填空题
16.在以下粒子中找出符合下列条件的粒子,将序号填在横线上:
①分子 ②原子 ③离子 ④阳离子 ⑤阴离子 ⑥原子核 ⑦质子 ⑧中子 ⑨电子
(1)质量最小的粒子:________;
(2)带正电荷的粒子:________;
(3)带负电荷的粒子:________;
(4)不显电性的粒子:________;
(5)决定原子质量的粒子:___________;
(6)与氢原子相对原子质量接近的:_________________;
(7)同一原子中数目相等的粒子:__________________;
(8)能直接构成纯净物的粒子:__________________;
(9)化学变化中最小的粒子:____________________。
17.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由分子构成的物质是 _____ ,由离子构成的物质是 _____ 。
(2)是某粒子的结构示意图,该粒子在化学反应中容易 _____ 电子形成 _____ 。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 _____ (填字母)。
a ①② b ②③ c ③④ d ④⑤
18.某粒子(原子或离子)的结构示意图为: ,请回答下列问题:
(1)若n=8,且该粒子带两个单位负电荷则该粒子的符号为__________;
(2)若m-n<10,则该粒子是一个____________(选填“原子”、“阳离子”或“阴离子”);
(3)若m=19,n=___________,则该粒子的符号为____________。
19.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
20.下面是几种粒子的结构示意图:
(1)B粒子所表示的元素符号为_____;
(2)表示原子的粒子有_____(填序号,下同);
(3)表示阴离子的有_____;
(4)表示阳离子的有_____;
(5)在化学反应中易失去电子的粒子是_____,写出其离子符号_____;
(6)在化学反应中易得到电子的粒子是_____,写出其离子符号_____。
答案解析
一、选择题
1.与元素的化学性质关系最密切的是 ( )
A.元素的相对原子质量
B.元素的核电荷数
C.原子的核外电子数
D.原子的最外层电子数
【答案】D
【详解】元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决定元素化学性质的是最外层电子数;故选D。
2.一般原子的原子核是:
A.由电子和质子构成 B.由电子和中子构成
C.由质子和中子构成 D.由电子、质子和中子构成
【答案】C
【详解】原子核一般是由质子与中子构成的,电子存在于原子核的周围,故选C。
3.某元素R的原子序数为m,能够形成核外有x个电子的Rn+,则下列关系式一定正确的是:
A.m=n B.m=n+x C.m=n-x D.m=x-n
【答案】B
【详解】某元素R的原子序数为m,原子中原子序数=核电荷数=质子数=核外电子数,则该原子的原子核外电子数为m;能够形成核外有x个电子的Rn+离子,Rn+是R原子失去n个电子得到的,m= x+ n,故选B。
4.下列关于Na、Na+两种粒子的判断:①核电荷数相同;②核外电子数相等;③电子层结构完全相同;④质量几乎相等;⑤质子数相等;⑥Na+比Na稳定。其中正确的是( )
A.①④⑤⑥ B.①③⑤⑥ C.①④⑤ D.②③④
【答案】A
【详解】Na失去1个电子形成Na+,②核外电子数、③电子层结构均发生了改变;核内质子数没有发生改变,则①核电荷数相同;由于原子的质量主要集中在原子核上,故失去一个电子对质量影响很小,质量几乎相等,即④相对原子质量几乎相等,二者质子数都为11,且Na+核外为8电子稳定结构,较钠原子稳定。故①④⑤⑥说法正确。故选:A。
5.如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
【答案】A
【详解】氧气是由氧分子构成的;氧分子是由氧原子构成的;原子分为原子核和核外电子,原子核分为质子和中子;所以a、b、c相对应的是原子、原子核、核外电子;故选A。
6.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是
A. B..
C. D.
【答案】A
【详解】A、质子数为2的He为稀有气体元素,化学性质稳定;氩的原子最外层为8个电子,化学性质稳定,化学性质相似; B、两种粒子最外层电子数分别为7、1,最外层电子数不相同,化学性质不相似;
C、虽然两种元素的原子的最外层电子数相同,但它们的化学性质却完全不同,质子数为2的He为稀有气体元素,化学性质稳定;而质子数为12的原子最外层电子数为2,不稳定,易失最外层的2个电子形成稳定结构;化学性质不同;D、两种粒子最外层电子数分别为8、6,最外层电子数不相同,化学性质不相似。
故选:A。
7.下列对微粒的描述中,不正确的是()
A.易失电子 B.易形成阴离子
C.阳离子 D.化学性质稳定
【答案】C
【详解】A.最外层电子数为1,在化学变化中易失去电子,故选项A正确;B.最外层电子数为6,在化学变化中易得到电子形成阴离子,故选项B正确;C.核内质子数小于核外电子数,不是阳离子,是阴离子,故选项C错误;D.最外层电子数为8,化学性质稳定,故选项D正确。故选C。
8.下列关于原子的叙述正确的是( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子不能直接构成物质.
A.②③④ B.①②④ C.①③⑤ D.①②③④⑤
【答案】A
【详解】①原子中不一定含有中子,比如氢原子不含有中子,错误; ②原子在不停地运动,正确;③原子是化学变化中的最小粒子,正确; ④原子由原子核和核外电子构成,正确; ⑤原子能直接构成物质,如铜是由铜原子直接构成的,错误。故选A。
9.下列各组物质中,按顺序分别是由分子、原子、离子构成的一组是( )
A.水、铁、乙醇
B.干冰、氮气、氯化钠
C.氢气、汞、硫酸铜
D.氮气、甲烷、硝酸钾
【答案】C
【详解】A、水是由氢、氧元素组成的化合物,是由水分子构成的; 铁属于金属单质,是由铁原子直接构成的;乙醇是由乙醇分子构成的,不符合题意;B、干冰是固态二氧化碳,是由二氧化碳分子构成的;氮气属于气态非金属单质,是由氮分子构成的,氯化钠是由钠离子和氯离子构成的,不符合题意;C、氢气属于气态单质,是由氢分子构成的;汞属于金属单质,是由汞原子直接构成的;硫酸铜是由铜离子和硫酸根离子构成的,符合题意; D、氮气属于气态单质,是由氮分子构成的;甲烷是由甲烷分子构成的,硝酸钾是由钾离子和硝酸根离子构成的,不符合题意。故选C。
10.人们对微观世界的认识是一个不断发展的过程。关于原子结构的说法有:
①在球体内充斥正电荷,电子镶嵌其中
②原子是可分的
③原子核外的电子是分层排布的
④原子中有带负电的电子
⑤原子核外的电子能量相同
⑥原子核很小,但集中了原子的大部分质量
其中正确的观点是
A.①②③④⑤⑥
B.②③④⑥
C.①③④⑤
D.②③④⑤⑥
【答案】B
【详解】①在球体内充斥正电荷,电子并不是镶嵌其中,因为质子带正电荷,电子在原子核外高速运动,说法错误;②原子是可分的,分为原子核和核外电子,说法正确;③原子核外的电子是分层排布的,说法正确;④原子中有带负电的电子,说法正确;⑤原子核外的电子是分层排布的,能量不相同,说法错误;
⑥原子核很小,但集中了原子的大部分质量,质子、中子均在核内,核外电子质量可忽略不计,说法正确;
故②③④⑥正确;故选:B。
11.如图为核聚变的示意图,其中 甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是( )
A.质子数:甲=乙<丙 B.中子数:甲<乙=丙
C.质量:甲<乙<丙 D.上述说法不全对
【答案】D
【详解】A、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲和乙中质子数都是1,丙中质子数是2,故A正确;B、核内质子数等于核外电子数,由图乙可知黑球是质子,红球是中子,甲的中子数是1,乙和丙的中子数是2,故B正确;C、决定原子质量大小的微粒是中子和质子,甲中含有一个质子和一个中子,乙中含有一个质子和2个中子,丙中含有2个质子和2个中子,所以质量:甲<乙<丙,故C正确;D、由于ABC都正确,所以D错误,故D错误。故选:D。
12.反质子、正电子都属于反粒子,它们分别与质子、电子的质量和电量相等,但电性相反。欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是( )
A.由一个带正电的质子和一个带负电的电子构成
B.由一个带负电的质子和一个带正电的电子构成
C.由一个带负电的质子和一个带负电的电子构成
D.由一个带负电的质子和两个带负电的电子构成
【答案】B
【详解】氢原子由一个带正电的质子和一个带负电的电子构成,则反氢原子由一个带负电的质子和—个带正电的电子构成,故选B。
13.已知甲原子与乙原子的质量比为a∶b,而乙原子与碳12原子的质量比为c∶d,则甲原子的相对原子质量为( )
A. B. C. D.
【答案】A
【详解】碳12原子的相对原子质量为12,由乙原子与碳12原子的质量比为c:d,可知乙原子的相对原子质量为,又知甲原子与乙原子的质量比为a:b,则甲原子的相对原子质量为 。故选A。
14.已知一个SO2分子的质量为n kg,一个SO3分子的质量为m kg(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )
A.16m/(m-n) B.16n/(m-n) C.16n/(n-m) D.32n/(m-n)
【答案】B
【详解】1个硫原子的质量为n-2(m-n) kg,若以一个氧原子质量的1/16作为相对原子质量的标准,硫的相对原子质量为则SO2的相对分子质量为+16×2,故选B。
15.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为
A.12 B.16
C.5 D.10
【答案】B
【详解】由左图,碳12原子的与1个氢原子的质量相等,氢原子的相对原子质量为1,则1个碳12原子的相对原子质量为12;右图中,左盘上有1个碳12原子和个碳12原子,个碳12原子的相对原子质量为,则左盘上碳原子的相对原子质量为12+4=16;故A原子的相对原子质量约为16;故选B。
二、填空题
16.在以下粒子中找出符合下列条件的粒子,将序号填在横线上:
①分子 ②原子 ③离子 ④阳离子 ⑤阴离子 ⑥原子核 ⑦质子 ⑧中子 ⑨电子
(1)质量最小的粒子:________;
(2)带正电荷的粒子:________;
(3)带负电荷的粒子:________;
(4)不显电性的粒子:________;
(5)决定原子质量的粒子:___________;
(6)与氢原子相对原子质量接近的:_________________;
(7)同一原子中数目相等的粒子:__________________;
(8)能直接构成纯净物的粒子:__________________;
(9)化学变化中最小的粒子:____________________。
【答案】(1)⑨ (2)④⑥⑦ (3)⑤⑨ (4)①②⑧ (5)⑦⑧ (6)⑦⑧ (7)⑦⑨
(8)①②③ (9)②
【详解】(1)质量最小的粒子是电子,故填:⑨;
(2)带正电的粒子是阳离子、原子核、质子,故填:④⑥⑦;
(3)带负电荷的粒子是阴离子、电子,故填:⑤⑨;
(4)不显电性的粒子是分子、原子、中子,故填:①②⑧;
(5)原子的质量主要集中在原子核,而原子核又是由质子和中子构成的,因此决定原子质量的粒子是质子和中子,故填:⑦⑧;
(6)一个氢原子的质量约为1.67×10-27kg,一个质子的质量约为1.6726×10-27kg,一个中子的质量约为1.6749×10-27kg,与氢原子质量接近的是质子、中子,故填:⑦⑧;
(7)同一原子中,质子数=电子数,故填:⑦⑨;
(8)分子、原子、离子都能直接构成纯净物,故填:①②③;
(9)原子是化学变化中的最小粒子,故填:②。
17.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由分子构成的物质是 _____ ,由离子构成的物质是 _____ 。
(2)是某粒子的结构示意图,该粒子在化学反应中容易 _____ 电子形成 _____ 。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是 _____ (填字母)。
a ①② b ②③ c ③④ d ④⑤
【答案】(1)干冰 氯化钠
(2) 失去 Na+
(3) d
【详解】(1)氯化钠由离子构成,金刚石由原子构成,干冰由分子构成,该三种物质中,由分子构成的物质是干冰 ,由离子构成的物质是氯化钠 ;
(2)最外层是1个电子的原子,易失去电子,故该粒子在化学反应中容易失去电子,核内有11个质子的原子是钠原子,所得粒子是钠离子,其符号是Na+;
(3)由反应的微观示意图可知,碳原子、氧原子在化学反应前后没变,故选d。
18.某粒子(原子或离子)的结构示意图为: ,请回答下列问题:
(1)若n=8,且该粒子带两个单位负电荷则该粒子的符号为__________;
(2)若m-n<10,则该粒子是一个____________(选填“原子”、“阳离子”或“阴离子”);
(3)若m=19,n=___________,则该粒子的符号为____________。
【答案】(1)S2- (2)阴离子 (3)8 K+
【详解】(1)若n=8,且该粒子带两个单位负电荷,则m=2+8+8-2=16,为硫元素,则该粒子的符号为S2-;
(2)若m-n<10,即m<10+n,质子数<核外电子数,为阴离子;
(3)若m=19,该元素为钾元素,根据原子核外电子排布规律,钾原子的第三层的电子数为8,该粒子失去了一个电子为钾离子符号为K+。
19.某粒子R的结构示意图为 。
(1)当x=10+y时,该粒子为 _________ (填“原子”或“阳离子”或“阴离子”,下同),当x>10+y时,该粒子为 _________ 。
(2)若该结构示意图表示的粒子是R原子,当y=2时,x= _________ 。
(3)若该结构示意图表示的粒子是R-,则x= _________ ,y= _________ 。
【答案】(1)原子 阳离子
(2)12
(3)17 8
【详解】(1)当x=10+y时,核电荷数=核外电子数,该粒子表示原子;当x>10+y时,核电荷数>核外电子数,说明该粒子失去了电子,所以表示阳离子;
(2)若该结构示意图表示的粒子是R原子,则x=10+y,当y=2时,x=12。
(3)若该结构示意图表示的粒子是R-离子,说明R原子得到一个电子形成稳定结构,所以y=8,R-离子的核外电子数是18,又因为R原子得到一个电子形成R-离子,则x=17。
20.下面是几种粒子的结构示意图:
(1)B粒子所表示的元素符号为_____;
(2)表示原子的粒子有_____(填序号,下同);
(3)表示阴离子的有_____;
(4)表示阳离子的有_____;
(5)在化学反应中易失去电子的粒子是_____,写出其离子符号_____;
(6)在化学反应中易得到电子的粒子是_____,写出其离子符号_____。
【答案】(1)O (2)BD (3)AE (4)C (5)D Mg2+ (6)B O2-
【详解】(1)质子数决定元素的种类,由粒子的结构示意图可知B为氧元素,元素符号为O;
(2)B、D中的质子数等于电子数是原子。表示原子的粒子有BD;
(3)A、E的质子数小于电子数是阴离子. 表示阴离子的有AE;
(4)在C中,质子数是11,电子数是10,是阳离子. 表示阳离子的有C;
(5)在化学反应中最外层电子数小于4的易失去电子,故在化学反应中易失去电子的粒子是D,易失去最外层的2个电子形成镁离子。在化学反应中易失去电子的粒子是D,其离子符号为Mg2+;
(6)在化学反应中最外层电子数大于4的易得到电子,故在化学反应中易得到电子的粒子是B,易得到2个电子形成氧离子。在化学反应中易得到电子的粒子是B,其离子符号为:O2-。
1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
