专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题2《化学反应速率与化学平衡》单元检测题(含解析)2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1 | 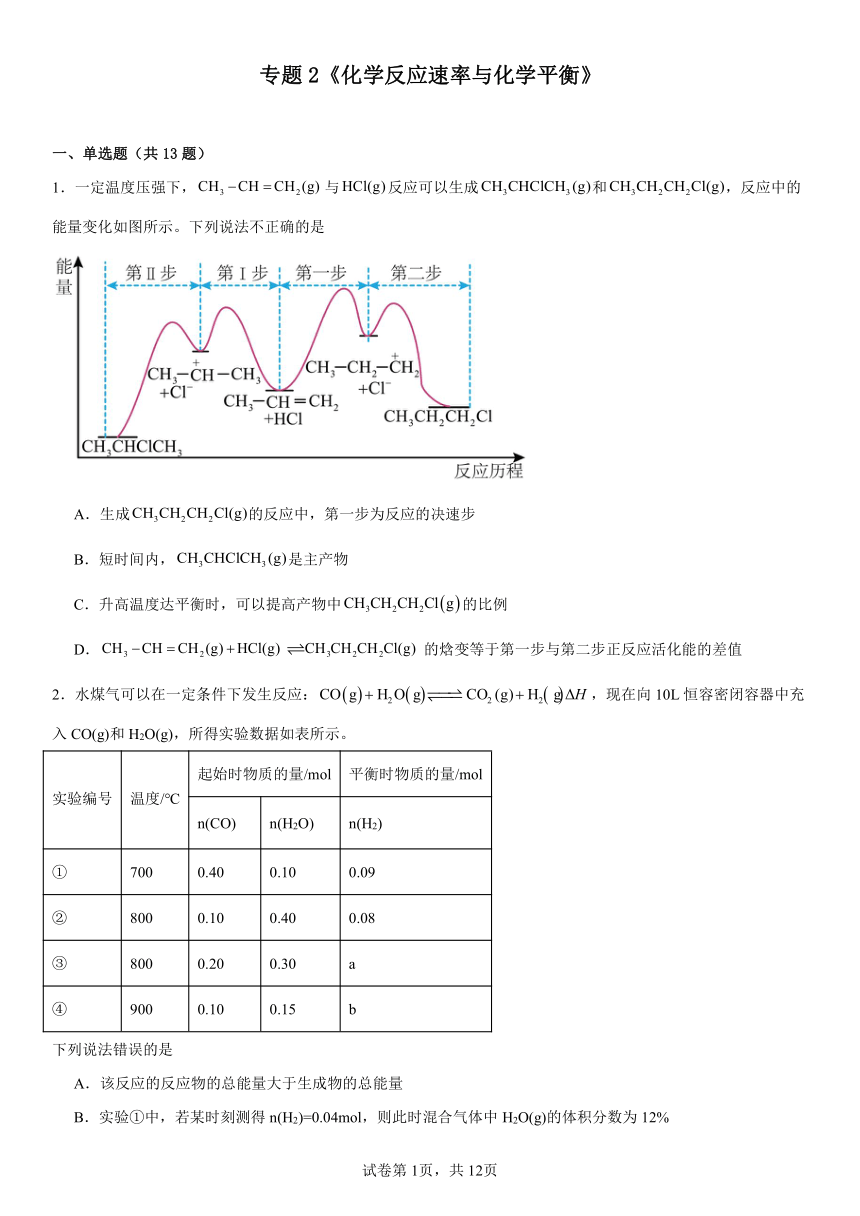 | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 15:34:23 | ||
图片预览


文档简介
专题2《化学反应速率与化学平衡》
一、单选题(共13题)
1.一定温度压强下,与反应可以生成和,反应中的能量变化如图所示。下列说法不正确的是
A.生成的反应中,第一步为反应的决速步
B.短时间内,是主产物
C.升高温度达平衡时,可以提高产物中的比例
D.的焓变等于第一步与第二步正反应活化能的差值
2.水煤气可以在一定条件下发生反应:,现在向10L恒容密闭容器中充入CO(g)和H2O(g),所得实验数据如表所示。
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(CO) n(H2O) n(H2)
① 700 0.40 0.10 0.09
② 800 0.10 0.40 0.08
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法错误的是
A.该反应的反应物的总能量大于生成物的总能量
B.实验①中,若某时刻测得n(H2)=0.04mol,则此时混合气体中H2O(g)的体积分数为12%
C.实验①和③中,反应均达到平衡时,平衡常数之比
D.实验④中,反应达到平衡时,CO的转化率为60%
3.在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示200 ℃和100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.图Ⅱ可知反应xA(g)+yB(g) zC(g)的 ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
4.恒温恒压下,在起始容积为的密闭容器中发生反应:
0 0
5
10
反应过程中的部分数据如上表。下列说法正确的是
A.容器内气体密度不变,标志着反应已达到平衡状态
B.内,用C表示的平均反应速率为
C.时,A的物质的量浓度为
D.反应达到平衡后充入少量氦气不参与反应,正反应速率减小,逆反应速率增大
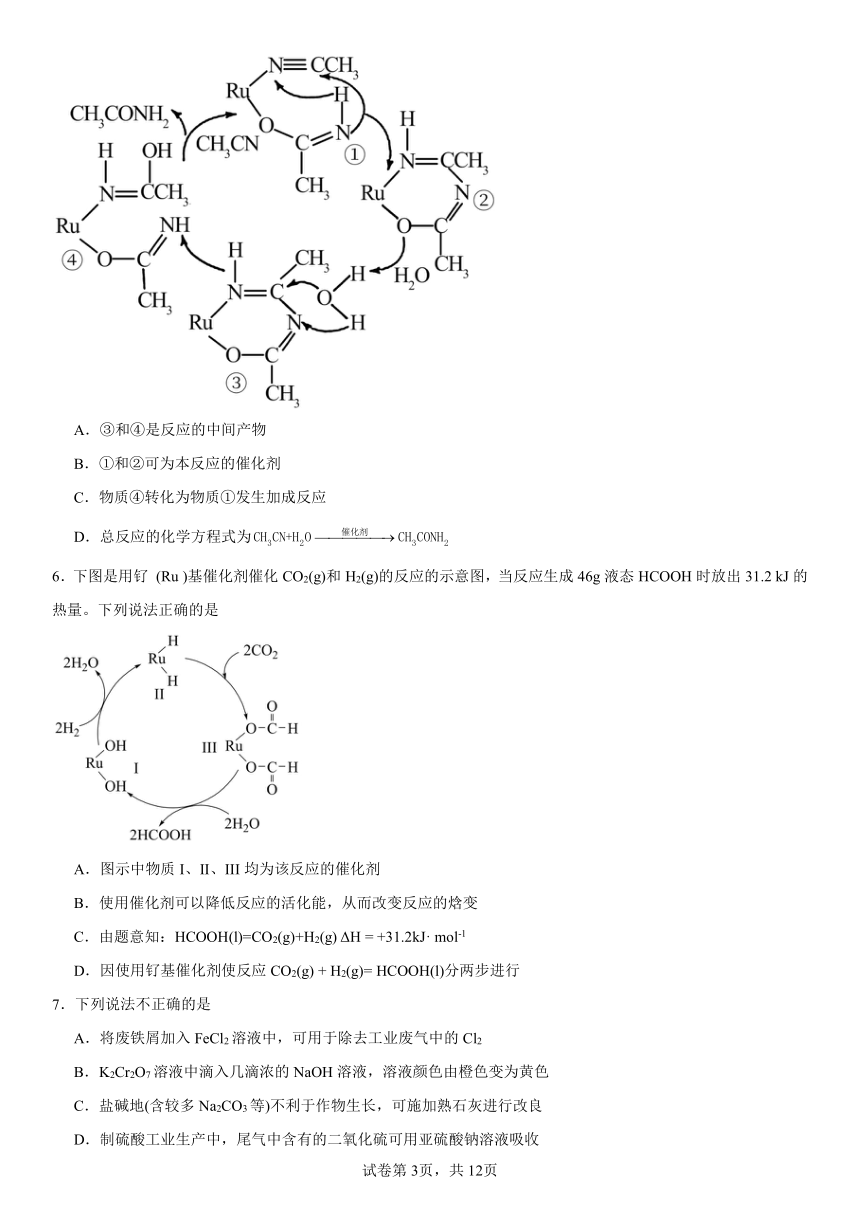
5.某文献报道,乙腈的某种催化水化反应机理如图所示。下列有关该反应机理的说法不正确的是
A.③和④是反应的中间产物
B.①和②可为本反应的催化剂
C.物质④转化为物质①发生加成反应
D.总反应的化学方程式为
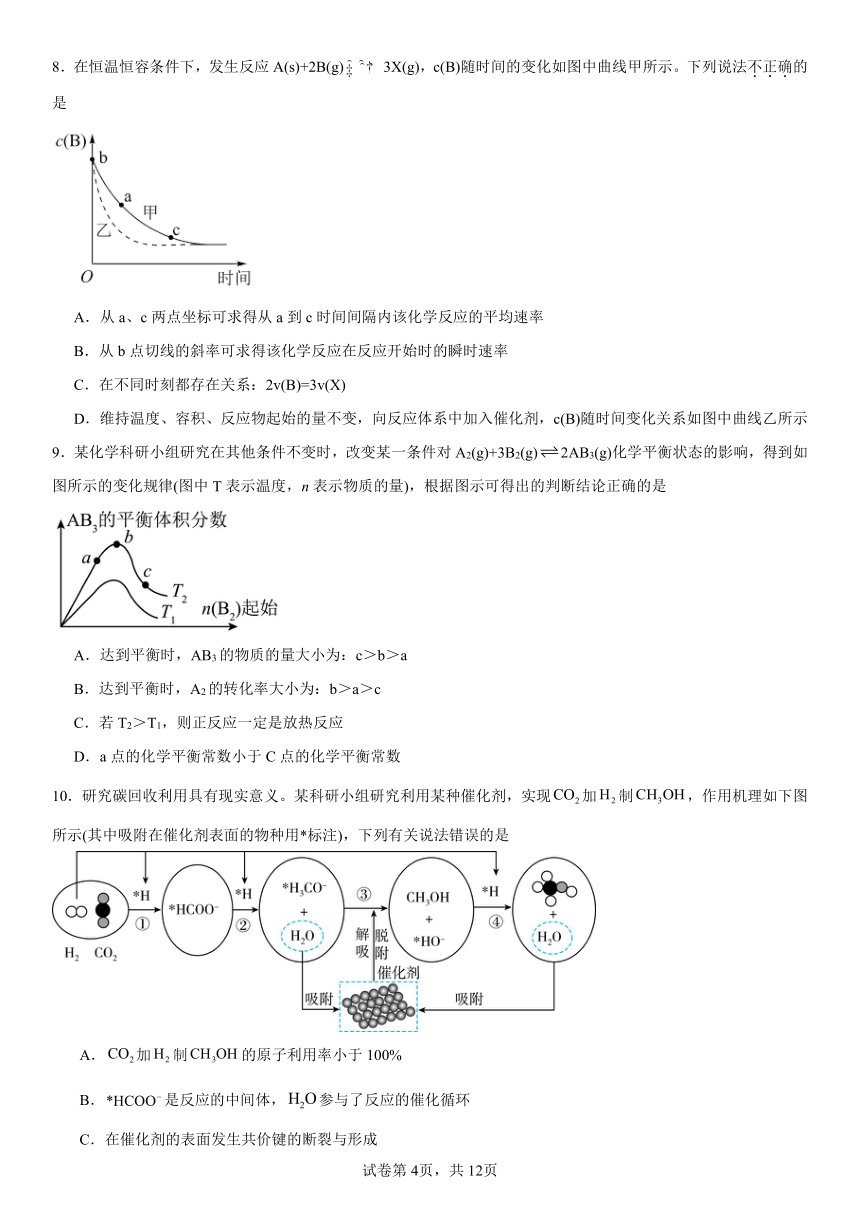
6.下图是用钌 (Ru )基催化剂催化CO2(g)和H2(g)的反应的示意图,当反应生成46g液态HCOOH时放出31.2 kJ的热量。下列说法正确的是
A.图示中物质I、II、III均为该反应的催化剂
B.使用催化剂可以降低反应的活化能,从而改变反应的焓变
C.由题意知:HCOOH(l)=CO2(g)+H2(g) ΔH = +31.2kJ· mol-1
D.因使用钌基催化剂使反应CO2(g) + H2(g)= HCOOH(l)分两步进行
7.下列说法不正确的是
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.K2Cr2O7溶液中滴入几滴浓的NaOH溶液,溶液颜色由橙色变为黄色
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.制硫酸工业生产中,尾气中含有的二氧化硫可用亚硫酸钠溶液吸收
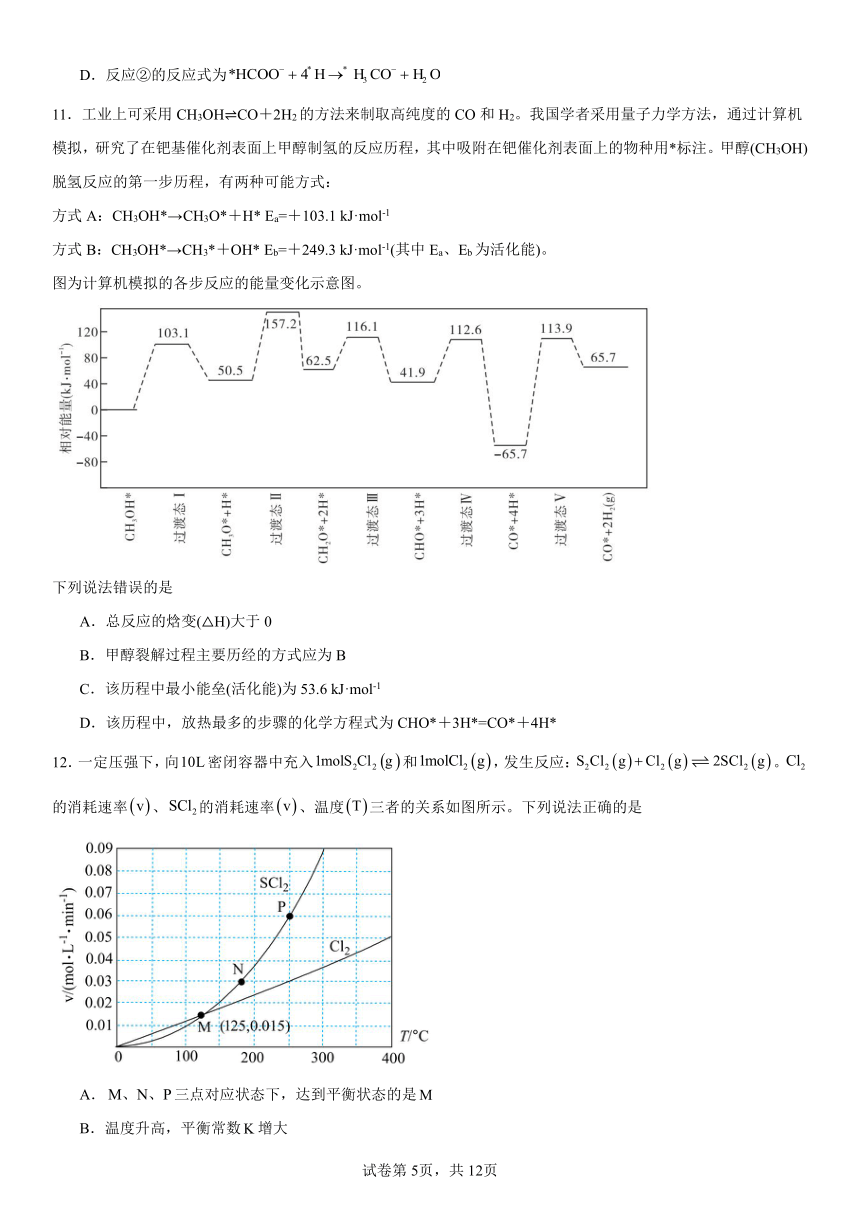
8.在恒温恒容条件下,发生反应A(s)+2B(g)3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示
9.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
A.达到平衡时,AB3的物质的量大小为:c>b>a
B.达到平衡时,A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.a点的化学平衡常数小于C点的化学平衡常数
10.研究碳回收利用具有现实意义。某科研小组研究利用某种催化剂,实现加制,作用机理如下图所示(其中吸附在催化剂表面的物种用*标注),下列有关说法错误的是
A.加制的原子利用率小于100%
B.是反应的中间体,参与了反应的催化循环
C.在催化剂的表面发生共价键的断裂与形成
D.反应②的反应式为
11.工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。
下列说法错误的是
A.总反应的焓变(△H)大于0
B.甲醇裂解过程主要历经的方式应为B
C.该历程中最小能垒(活化能)为53.6 kJ·mol-1
D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H*
12.一定压强下,向密闭容器中充入和,发生反应:。的消耗速率、的消耗速率、温度三者的关系如图所示。下列说法正确的是
A.三点对应状态下,达到平衡状态的是
B.温度升高,平衡常数增大
C.保持其他条件不变,若投料改为通入,平衡时的体积分数增大
D.时,平衡时的消耗速率大于
13.合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
②2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH2= 72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。
则下列说法正确的是
A.E1表示2CH4(g)+O2(g) =2CO(g)+4H2(g)的活化能
B.E2表示CH4(g)+H2O(g)CO(g)+3H2(g)的活化能
C.该图示为反应①的反应过程与能量变化示意图,该反应为吸热反应
D.一般情况下,加入催化剂,既能降低E1,也能降低E2,也能降低ΔH
二、填空题(共8题)
14.(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO2CO2+N2。反应能够自发进行,则反应的ΔH 0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g)FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K K1 K2
973 1.47 2.38
1 173 2.15 1.67
根据表中数据,计算反应CO2(g)+H2(g)CO(g)+H2O(g)的K。
①平衡常数的表达式K1= ;
②温度为973K时:K= ;(结果保留小数点后2位)
③反应CO2(g)+H2(g)CO(g)+H2O(g)是 (填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应 (填“已经”或“没有”)达到平衡,原因是 ;此时刻v正 (填“>”或“<”)v逆。
15.工业烟气中的对环境和人体健康有极大的危害,若能合理的利用吸收,可以减少污染。请完成下列问题:
(1)催化还原氮氧化物是目前应用广泛的烟气脱硝技术,发生的化学反应为: ,向容积为的恒容密闭容器中充入和的混合气体充分反应。不同投料比时,的平衡转化率与温度的关系如图中曲线所示[投料比]。
① 0(填“>”“<”或“=”);
②x填 (填“>”“<”或“=”);
③投料比为时,Q点 (填“>”“<”或“=”)P点;
④在时,反应的平衡常数计算式为 。
(2)科学家正在研究利用催化技术将和和转变成和,其反应为: ,反应的逆反应速率与时间的关系如图所示:
由图可知,反应在、、时都达到了平衡,而、时都改变了一种条件,试判断改变的条件是(请列举一种可能):时 ;时 ;若时降压,时达到平衡,时增大反应物的浓度,在图中画出时逆反应速率与时间的关系线 。
16.化学反应速率和平衡原理作为化学学科的核心内容,其相关理论和实践对化学学科的发展有着重要的意义。
Ⅰ.某学习小组选用溶液和溶液,探究、对分解的影响。
记录数据如下:
实验序号 添加试剂及用量 完全分解所需时间/min
1 溶液
2 溶液
(1)实验结果显示,可得出的结论是: (填化学式)更有利于分解。
(2)甲同学查阅资料得知:能加速分解,对分解无影响。为排除干扰,该同学进行实验:向两份溶液中分别加入a mL浓度均为 的 (填化学式)溶液和 (填化学式)溶液。内,发现均几乎不分解。甲同学认为:在无存在的情况下,、对催化分解无影响。
(3)乙同学又提出猜想:、对催化分解会产生影响。于是进行下表实验。限选试剂及其标号如下:
A.溶液 B.少量KCl固体
C.溶液 D.少量固体
实验序号 添加试剂 完全分解所需时间/min
3 需同时加入溶液和 (填标号)
4 需同时加入溶液和 (填标号)
(4)根据实验1~4中测得的完全分解所需时间,小组同学认为 (填“增强”或“减弱”,下同)的催化效果, 的催化效果。
Ⅱ.为了探究反应条件对反应的影响,某活动小组设计了三个实验,实验曲线如图所示。
编号 温度 压强
Ⅰ 530℃ 3MPa
Ⅱ X 5MPa Y
Ⅲ 630℃ 5MPa
(5)请依据实验曲线图补充完整表格中的实验条件:X= ,Y= 。
(6)对比实验Ⅱ和实验Ⅲ可知、升高温度,CO的转化率 (填“增大”“减小”或“不变”), (填“>”或“<”)0,理由是 。
(7)编号Ⅰ实验中,反应达到平衡时,的转化率为50%,则530℃时该反应的平衡常数 (以分压表示,分压=总压×物质的量分数)。
17.(1)某反应在体积为的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
①该反应的化学方程式为
②反应开始至2min时,B的平均反应速率为
③平衡时A的转化率为
(2)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 A B C D E F
4mol·L-1H2SO4溶液/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
①请完成此实验设计:其中V1= V6=
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
18.在10L 容器中,加入2mol SO2(g)和2mol NO2(g),保持温度恒定,发生反应:SO2(g)+ NO2(g) SO3(g)+ NO(g),当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则
(1)若在该容器中再继续加入1 mol SO2(g),则化学平衡将向 方向移动(选填“正反应”、“逆反应”、“不”),NO2(g)的转化率将 (填“增大”、“减小”或“不变”),达到新的平衡状态时,容器中的SO2(g)的浓度是 。
(2)在其他条件不变的情况下,扩大容器的体积,平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
19.乙烯、环氧乙烷是重要的化工原料,用途广泛。
实验测得 2CH2=CH2(g)+O2(g) 2 (g) △H﹤0中,v逆=k逆·c2(),v正=k正c2(CH2=CH2)·c(O2)(为速率常数,只与温度有关)。
(1)反应达到平衡后,仅降低温度,下列说法正确的是_______(填字母)。
A.均增大,且增大的倍数更多 B.均减小,且减小的倍数更少
C.增大、减小,平衡正向移动 D.均减小,且减小的倍数更少
(2)若在的密闭容器中充入和,在一定温度下只发生上述反应,经过反应达到平衡,体系的压强变为原来的0.875倍,则内 , 。
20.在密闭容器中发生反应CO2(g) + H2(g) CO(g) + H2O(g),其平衡常数(K)和温度(T)的关系如下表所示。
T/ ℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的平衡常数表达式K= ;由上表可知该反应为 反应(填“吸热”或“放热”)。
(2)830℃时,向容器中充入2mol CO2、8mol H2,保持温度不变,反应达到平衡后,其平衡常数 1.0(填“大于”“小于”或“等于”),此时CO2的物质的量为 。
(3)下列有利于提高平衡时CO2转化率的措施有 (填字母)。
a.使用催化剂 b.升温 c.增大 CO2和 H2的投料比
(4)若1200℃时,在某时刻反应混合物中CO2、H2、CO、 H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时反应的平衡移动方向为 (填“正反应方向”“逆反应方向”或“不移动”)。
(5)实验发现,其它条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H2的体积分数增大,实验结果如图所示。
(已知:1微米 = 10-6米,1纳米= 10-9米)。
投入纳米CaO比微米CaO时,H2的体积分数更高的原因是 。
21.我国2020年颁布的能源法中,首次将氢能纳入能源定义。在工业市场中,甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,被广泛应用于氢气的工业生产。甲烷水蒸气重整反应体系中主要存在的反应方程式有:
反应1:
反应2:
反应3:
(1) 。
(2)反应1在 下自发进行(填“高温”,“低温”或“任意温度”)。
(3)一定温度下,向某容积为1L的恒容容器中充入和,发生上述反应,tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①tmin内CH4的消耗速率为 。(用含m,n,t的代数式表示,下同)。反应1的平衡常数Kc= 。
②保持容器体积和投料量不变,分别在和下进行上述反应,测得容器中CO和CH4的含量随温度的变化如下图所示。
5MPa时,表示CO和CH4平衡组成随温度变化关系的曲线分别是 和 。X点平衡组成含量高于Y点的原因是 。
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用、作电解质,则工作时负极上电极反应式为 ;当有发生定向移动时,电路中转移的电子数目为 (用表示阿伏加德罗常数的值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.生成的反应中,第一步反应活化能高,是决速步,故A正确;
B.短时间内,生成的反应活化能低,反应速率快,因此是主产物,故B正确;
C.,升高温度有利于平衡正向移动,可以提高产物中的比例,故C正确;
D.的焓变等于第一步与第二步反应的的代数和,故D错误;
故选D。
2.D
【详解】A.实验①可知:达到平衡时,CO、H2O、CO2、H2物质的量分别为0.31、0.01、0.09、0.09,根据平衡常数的表达式,求出;同理,实验②可知:达到平衡时,CO、H2O、CO2、H2物质的量分别为0.02、0.32、0.08、0.08,,对比实验①和实验②,升高温度,K减小,平衡逆向移动根据勒夏特列原理,该反应为放热反应,即反应物的总能量大于生成物的总能量,故A说法正确;
B.某时刻测得氢气物质的量为0.04mol,此时二氧化碳物质的量也为0.04mol,该时刻CO物质的量为0.36mol,水蒸气物质的量为0.06mol,该时刻H2O(g)的体积分数等于物质的量分数,故B说法正确;
C.实验②和③中,温度相同,则平衡常数相同,根据A项中已求平衡常数可得实验①和③中,反应均达到平衡时,则平衡常数之比为,故C说法正确;
D.实验②和③,温度相同,平衡常数相同,实验③达到平衡时,n(CO)=(0.2-a)mol,n(H2O)=(0.3-a)mol,n(CO2)=n(H2)=amol,则,所以a=0.12,CO的转化率为60%,若④的温度也为800℃,恒容体系中,气体体积不变的反应,平衡时CO的转化率应为60%,但④的实际温度为900℃,相比800℃,平衡逆向移动,则CO转化率应小于60%,故D说法错误;
但为D。
3.A
【分析】根据图I可知,5分钟内,A物质反应了0.4mol,B物质反应了0.2mol,C物质生成了0.2mol,所以该反应的化学方程式是2A(g)+B(g) C(g);根据图II可知,当起始时A、B的物质的量的比值相同时,200C时,C物质平衡时的体积分数大于100C时,所以该反应为吸热反应。
【详解】A.200 ℃时,反应从开始到平衡的平均速率v(B)= ,A项正确;
B.根据分析可知,该反应为吸热反应,B项错误;
C.恒容容器,向体系中充入He,平衡不移动,C项错误;
D.向容器中再充入2 mol A和1 mol B,新平衡等效于原平衡正移,所以A的体积分数小于0.5,D项错误;
故答案为A。
4.B
【分析】发生反应5min时
发生反应10min时
【详解】A.反应A(g)+2B(g)= 3C(g)中,反应物和产物都是气体,气体总质量不变,又因为容器体积不变,反应过程中气体密度一直不变,容器内气体密度不变时,不能说明反应已达到平衡状态,A错误;
B.5~10min内,用C表示的平均反应速率为=0.012mol·L-1·min-1,B正确;
C.由分析可知,5min时,A的物质的量浓度为 =0.16mol·L-1,C错误;
D.反应达到平衡后充入少量氦气(不参与反应) ,反应物和生成物浓度都不变,速率不变,D错误;
故选B。
5.C
【分析】由图知,①→ ②,②+H2O→③,③→④,④+CH3CN→①+CH3CONH2,则总反应为:,据此回答;
【详解】A.据分析, ③和④是反应的中间产物,A正确;
B.据分析, ①和②参与了反应又重新生成、可为本反应的催化剂,B正确;
C. 物质④转化为物质①的反应为:④+CH3CN→①+CH3CONH2,不属于加成反应,C不正确;
D. 据分析,总反应的化学方程式为,D正确;
答案选C。
6.C
【详解】A.图为催化CO2 (g)和H2(g)的反应生成液态HCOOH,物质I在合成甲酸的过程中物质的量没有改变,只是改变了反应机理,所以物质I为该反应的催化剂,而II、 III均为该反应的中间产物,故A错误;
B.使用催化剂可以降低反应的活化能,反应的焓变不变,故B错误;
C.反应生成46g液态HCOOH,其物质的量为,生成1molHCOOH放出31.2kJ的热量,则HCOOH(l)=CO2(g)+H2(g) ΔH = +31.2kJ· mol-1,故C正确;
D.由图可知,因使用钌基催化剂使反应CO2(g) + H2(g)= HCOOH(l)分三步进行,故D错误;
故选C。
7.C
【详解】A.Cl2具有强氧化性,能氧化Fe2+生成Fe3+,同时Fe可将Fe3+还原生成亚铁离子,所以将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2,故A正确;
B.加NaOH溶液使反应Cr2O(橙色)+H2O2H++2CrO(黄色)正向移动,溶液由橙色变为黄色,故B正确;
C.盐碱地(含较多Na2CO3等)不利于作物生长,如施加熟石灰进行改良,会生成CaCO3和 NaOH,加重土壤的碱性和板结,该应用不合理,故C错误;
D.制硫酸工业生产中,尾气中含有的二氧化硫能与亚硫酸钠和水反应生成亚硫酸氢钠,故D正确;
故答案选C。
8.C
【详解】A.图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,选项A正确;
B.b点处的切线的斜率是此时刻物质浓度除以此时刻时间,为反应物B的瞬时速率,选项B正确;
C.化学反应速率之比等于化学方程式计量数之比分析,3v(B)=2v(X),选项C不正确;
D.维持温度、容积不变,向反应体系中加入催化剂,平衡不移动,反应速率增大,达到新的平衡状态,平衡状态与原来的平衡状态相同,选项D正确;
答案选C。
9.A
【详解】A.根据图象可知,在温度相同时,a、b、c各点中B2的起始物质的量依次增大,化学反应正向进行,所以平衡时AB3物质的量依次增大,故达到平衡时,AB3的物质的量大小为:c>b>a,A正确;
B.根据图象可知,a、b、c各点中B2的起始物质的量依次增大,对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为:c>b>a,B错误;
C.若T2>T1,由图象可知温度升高生成物的物质的量增大,说明升高温度平衡向正反应分析移动,则正反应为吸热反应,C错误;
D.a、c两点B2起始物质的量不相同,但反应温度相同,而化学平衡常数只与温度有关,温度相同,则化学平衡常数相同,D错误;
故合理选项是A。
10.C
【详解】A.由图可知加生成和水,故原子利用率小于100%,A正确;
B.由图可知,催化剂的作用是吸附和解吸反应过程中生成的水,说明参与了反应的催化循环,是反应过程中存在的物质,反应开始和结束都没有该物质,是中间体,B正确;
C.由图可知,催化剂的作用是吸附和解吸反应过程中生成的水,没有发生共价键的断裂与形成,C错误;
D.由图可知反应②的反应式为,D正确;
故选C。
11.B
【详解】A.根据图示,反应物总能量小于生成物总能量,总反应的焓变(△H)大于0,故A正确;
B.方式A的活化能小于方式B,甲醇裂解过程主要历经的方式应为A,故B错误;
C.根据图示,该历程中各步反应活化能最小的为116.1-62.5=53.6 kJ·mol-1,故C正确;
D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H* △H=41.9-(-65.7)=+107.6 kJ·mol-1,故D正确;
选B。
12.D
【详解】A. 时,点的消耗速率和的消耗速率均为,说明反应未达平衡状态,A错误;
B.由图可知点的消耗速率是的消耗速率的2倍,可知此时正反应速率等于逆反应速率,反应达到平衡状态,点后,温度升高,的消耗速率增大的程度大于的消耗速率增大的程度的2倍,可知逆反应速率增大的程度大于正反应速率增大的程度,平衡逆向移动,则逆反应吸热,正反应放热,升高温度,减小,B错误;
C.该反应前后气体分子数相等,充入,相当于充入、,即相当于增大压强,增大压强,该反应平衡不移动,故的体积分数不变,错误;
D.时,点未达平衡状态,且正反应速率大于逆反应速率,反应正向进行,的消耗速率小于的生成速率,当达到该温度下的平衡状态时,的消耗速率等于的生成速率,的消耗速率应大于,D正确。
故选D。
13.C
【分析】已知反应①是吸热反应,反应②是放热反应,而图象所表达的是吸热反应即反应①。
【详解】A.E1表示CH4(g)+H2O(g)CO(g)+3H2(g)的活化能,故A错误;
B.E2表示CO(g)+3H2(g)CH4(g)+H2O(g)的活化能,因此B错误;
C.该图所示为反应①的反应过程与能量变化示意图,该反应为吸热反应,故C正确;
D.加入催化剂,正逆反应的活化能都降低了,即E1、E2都降低,但二者的差值不变,ΔH不变,故D错误;
故选C。
14. < 0.62 吸热 没有 此时Qc==≈0.0123<0.32=K >
【分析】
【详解】(1)2NO+2CO 2CO2+N2反应的△S<0,反应自发进行△H-T△S<0,则反应焓变一定小于0,△H<0,反应是放热反应,故答案为<;
(3)①Fe(s)+CO2(g) FeO(s)+CO(g)I、Fe(s)+H2O(g) FeO(s)+H2(g)II,
将方程式I II得CO2(g)+H2(g) CO(g)+H2O(g),则化学平衡常数K={c(CO)×c(H2O)}÷{c(CO2).c(H2)}={ c(CO)÷c(CO2)}×{c(H2)c(H2O)}=K1÷K2,温度为973K时K=1.47÷2.38=0.62,
故答案为 ;0.62;
③升高温度,化学平衡常数增大,说明平衡向正反应方向移动,则正反应是吸热反应,故答案为吸热。
(3)某时刻经测定CO的转化率为10%,则
CO(g)+H2O(g)CO2(g)+H2(g),
起始(mol/L):1 1 0 0
转化(mol/L):0.1 0.1 0.1 0.1
某时刻(mol/L):0.9 0.9 0.1 0.1
Qc=0.1×0.1÷(0.9×0.9)=0.012<0.32,
则没有达到平衡状态,反应向正反应方向移动,v正>v逆,
故答案为没有;Qc.
15.(1) < > < 或
(2) 升高温度或充入生成物气体 改进催化剂
【分析】(1)①由图可知,升高温度NO2转化率减小平衡逆向移动;
②投料比越大NO2的物质的量越大,NO2的转化率反而越小;
③投料比为3:4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大;
④400K时,NO2的转化率为50%,列出三段式
,所以平衡常数;据此计算;
(2)由图可知,反应在t2时v逆突然增大,在趋于平衡的过程中逆反应速率逐渐减小,反应逆向移动重新建立平衡,该反应前后气体物质的化学计量数之和不等,t8时逆反应速率急剧增大且与正反应速率相等,故只能是催化剂的影响。
【详解】(1)①由图可知,升高温度NO2转化率减小平衡逆向移动,所以正反应放热,则ΔH<0;
故答案为<;
②则从图中可以看出,同一个温度下,x对应的NO2的转化率均小于3:4对应的NO2的转化率,因投料比越大NO2的物质的量越大,NO2的转化率反而越小,故x>3:4,
故答案为>;
③投料比为3:4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,则可知此时逆反应速率比平衡时逆反应速率小,以氨气表示反应速率得出,Q点v逆(NH3)<P点v逆(NH3);
故答案为<;
④时,的转化率为50%,计算出各组分的物质的量浓度,代入平衡常数表达式,得;
故答案为或;
(2)由图可知,反应在t2时v逆突然增大,在趋于平衡的过程中逆反应速率逐渐减小,反应逆向移动重新建立平衡,改变的条件是升高温度或充入生成物气体;该反应前后气体物质的化学计量数之和不等,t8时逆反应速率急剧增大且与正反应速率相等,故只能是催化剂的影响;t4时降压,v逆急剧减小,平衡左移,然后在t5时平衡,t6时增大反应物的浓度,v逆不变,因而t4~t6时逆反应速率与时间的关系线为,
故答案为高温度或充入生成物气体;催化剂;。
【点睛】本题考查化学平衡的计算、化学平衡的影响因素和平衡图象分析判断,为高频考点,侧重学生的分析、计算和推理等综合运用能力的考查,明确外界因素对化学平衡的影响、把握图象信息分析是解题的关键,注意平衡常数的表达式和三段式格式在平衡计算中的应用。
16.(1)
(2) 2b KCl
(3) B D
(4) 增强 减弱
(5) 530℃
(6) 减小 < 升高温度,CO的转化率减小,平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,因此
(7)0.2
【分析】Ⅰ.实验探究、对分解的影响,通过控制变量法,选用、的铜盐溶液,通过比较完全分解所需时间来判断催化效果。
Ⅱ.探究反应条件对反应的影响,通过控制变量法,实验Ⅰ和实验Ⅱ相比,压强不同,探究压强对反应的影响,实验Ⅱ和实验Ⅲ相比,温度不同,探究温度对反应的影响。
【详解】(1),即加入溶液后分解速率更快,更有利于分解,故答案为:;
(2)带2个单位正电荷,带1个单位正电荷,所以应向两份溶液中分别加入a mL浓度均为2b mol/L的、溶液,故答案为:2b;KCl;;
(3)该实验的目的是探究、对催化分解的影响,所以只需改变阴离子的量,所以实验3中应加入溶液和少量KCl固体,即选B;实验4中应加入溶液和固体,即选D,以此来改变阴离子的量,观察对分解的是否产生影响,故答案为:B;D;
(4),说明加入更多的后分解加快,即增强的催化效果;而,说明加入更多的后分解减慢,即减弱的催化效果,故答案为:增强;减弱;
(5)实验要控制变量,实验Ⅰ和实验Ⅱ相比,压强不同,Ⅰ和Ⅱ其他条件应相同,故,,故答案为:530℃;;
(6)对比实验Ⅱ和实验Ⅲ可知,升高温度,升高,故升高温度向逆反应方向移动,CO的转化率减小;升高温度,CO的转化率减小,平衡向逆反应方向移动,逆反应方向为吸热,正反应为放热反应,故,故答案为:减小;<;升高温度,CO的转化率减小,平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,因此;
(7)编号Ⅰ实验中,反应达平衡时,的转化率为50%,则参加反应的为,列三段式:
该反应气体分子数不变,故平衡总压=开始总压=3MPa,530℃时该反应的平衡常数,故答案为:0.2。
17. 2A+B2C 0.1mol/(L min) 40% 30 10 当加入一定量CuSO4后,生成的单质Cu沉积在Zn表面,降低了Zn与H2SO4溶液的接触面积
【详解】(1)①由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C,故答案为:2A+B2C;
②由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为=0.1mol/(L min),故答案为:0.1mol/(L min);
③平衡时A的转化率为=40%,故答案为:40%;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml,故答案为:30;10;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,故答案为:当加入一定量CuSO4后,生成的单质Cu沉积在Zn表面,降低了Zn与H2SO4溶液的接触面积。
18. 正反应 增大 0.18mol/L 不
【详解】(1)SO2为反应物,加入SO2平衡向正反应方向移动;NO2的转化率增大。
原平衡SO2的转化率为50%,列三段式有:
该反应前后气体系数之和相等,可以用物质的量代替浓度计算平衡常数,所以该温度下反应的平衡常数K=1,设新平衡SO2的浓度为a,列三段式有:
则有=1,解得a=0.18mol/L;
(2)该反应前后气体系数之和相等,在其他条件不变的情况下,扩大容器的体积,虽然压强减小,但平衡不发生移动。
19.(1)B
(2) 0.75
【详解】(1)降低温度,正逆反应速率均减小,该反应为放热反应,降温化学平衡正向移动,逆反应速率下降幅度大于正反应速率,则k正降幅小于k逆
A.k正、k逆均减小,A错误;
B.k正、k逆均减小,且k正减小的倍数更少,B正确;
C.k正、k逆均减小,化学平衡正向移动,C错误;
D.k正、k逆均减小,且k正减小的倍数更少,D错误;
故答案选B。
(2)2CH2=CH2(g)+O2(g) 2 (g),设反应消耗CH2=CH22xmol,则消耗O2xmol,生成2xmol,反应后气体总物质的量为(1-2x+1-x+2x)mol=(2-x)mol,则,x=0.25mol,0-10min内v(O2)=。。
20.(1) 吸热
(2) 等于 0.4mol
(3)b
(4)逆反应方向
(5)相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快;在相同时间内消耗CO2的量更多,导致c(CO2)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高
【详解】(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的平衡常数表达式K=;由上表可知随之温度升高平衡常数逐渐增大,说明升高温度平衡正向进行,所以该反应为吸热反应。
(2)830℃时,向容器中充入2mol CO2、8mol H2,保持温度不变,反应达到平衡后,由于平衡常数只与温度有关系,则其平衡常数等于1.0。设平衡时消耗二氧化碳的物质的量是xmol,则剩余二氧化碳是2mol-xmol、氢气是8mol-xmol、一氧化碳和水蒸气均是xmol,由于反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则,解得x=1.6,所以此时CO2的物质的量为0.4mol。
(3)a.使用催化剂不能影响平衡,CO2转化率不变;
b.正反应吸热,升温平衡正向进行,CO2转化率增大;
c.增大CO2和H2的投料比有利于增大氢气的转化率,CO2转化率降低;
答案选b;
(4)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时浓度熵为>2.6,所以反应的平衡移动方向为逆反应方向。
(5)由于相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快;在相同时间内消耗CO2的量更多,导致c(CO2)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高。
21. +165 高温 d a 升高温度反应一向正反应方向移动,反应三向逆反应方向移动,但反应一的影响程度更大,所以一氧化碳含量增多 4NA
【详解】(1)由盖斯定律可知
故答案为;
(2)反应1: ,,所以该反应在高温条件下自发进行,故答案为高温;
(3)①根据反应方程式可知,所以甲烷的消耗速率为
,故答案为;
依据原子守恒,由于为,为,则剩余,水剩余,
氢原子为,即氢气为,
容积为的恒容容器,所以反应1的平衡常数,故答案为;也可以根据三段式解题。
②保持容器体积和投料量不变,分别在和下进行上述反应,反应1为吸热,反应2为吸热,反应3为放热反应,所以升高温度甲烷的含量降低,一氧化碳的含量增多,在同温条件下,增大压强反应1和2均向逆反应方向移动,所以甲烷含量增大,所以时,表示平衡组成随温度变化关系的曲线为线,平衡组成随温度变化关系的曲线为线:压强相同条件下,升高温度反应1向正反应方向移动,反应3向逆反应方向移动,但反应一的影响程度更大,所以一氧化碳含量增多,故答案为升高温度反应1向正反应方向移动,反应3向逆反应方向移动,但反应1的影响程度更大,所以一氧化碳含量增多:
(4)在负极上失电子,参与电极反应失电子转化为,熔融盐燃料电池用、作电解质。则工作时负极上电极反应式为,当有发生定向移动时,内电路有电荷移动,外电路中转移的电子数目为。
答案第1页,共2页
答案第1页,共2页
一、单选题(共13题)
1.一定温度压强下,与反应可以生成和,反应中的能量变化如图所示。下列说法不正确的是
A.生成的反应中,第一步为反应的决速步
B.短时间内,是主产物
C.升高温度达平衡时,可以提高产物中的比例
D.的焓变等于第一步与第二步正反应活化能的差值
2.水煤气可以在一定条件下发生反应:,现在向10L恒容密闭容器中充入CO(g)和H2O(g),所得实验数据如表所示。
实验编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
n(CO) n(H2O) n(H2)
① 700 0.40 0.10 0.09
② 800 0.10 0.40 0.08
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法错误的是
A.该反应的反应物的总能量大于生成物的总能量
B.实验①中,若某时刻测得n(H2)=0.04mol,则此时混合气体中H2O(g)的体积分数为12%
C.实验①和③中,反应均达到平衡时,平衡常数之比
D.实验④中,反应达到平衡时,CO的转化率为60%
3.在容积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示200 ℃和100 ℃下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.图Ⅱ可知反应xA(g)+yB(g) zC(g)的 ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数大于0.5
4.恒温恒压下,在起始容积为的密闭容器中发生反应:
0 0
5
10
反应过程中的部分数据如上表。下列说法正确的是
A.容器内气体密度不变,标志着反应已达到平衡状态
B.内,用C表示的平均反应速率为
C.时,A的物质的量浓度为
D.反应达到平衡后充入少量氦气不参与反应,正反应速率减小,逆反应速率增大
5.某文献报道,乙腈的某种催化水化反应机理如图所示。下列有关该反应机理的说法不正确的是
A.③和④是反应的中间产物
B.①和②可为本反应的催化剂
C.物质④转化为物质①发生加成反应
D.总反应的化学方程式为
6.下图是用钌 (Ru )基催化剂催化CO2(g)和H2(g)的反应的示意图,当反应生成46g液态HCOOH时放出31.2 kJ的热量。下列说法正确的是
A.图示中物质I、II、III均为该反应的催化剂
B.使用催化剂可以降低反应的活化能,从而改变反应的焓变
C.由题意知:HCOOH(l)=CO2(g)+H2(g) ΔH = +31.2kJ· mol-1
D.因使用钌基催化剂使反应CO2(g) + H2(g)= HCOOH(l)分两步进行
7.下列说法不正确的是
A.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
B.K2Cr2O7溶液中滴入几滴浓的NaOH溶液,溶液颜色由橙色变为黄色
C.盐碱地(含较多Na2CO3等)不利于作物生长,可施加熟石灰进行改良
D.制硫酸工业生产中,尾气中含有的二氧化硫可用亚硫酸钠溶液吸收
8.在恒温恒容条件下,发生反应A(s)+2B(g)3X(g),c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是
A.从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
D.维持温度、容积、反应物起始的量不变,向反应体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示
9.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示可得出的判断结论正确的是
A.达到平衡时,AB3的物质的量大小为:c>b>a
B.达到平衡时,A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.a点的化学平衡常数小于C点的化学平衡常数
10.研究碳回收利用具有现实意义。某科研小组研究利用某种催化剂,实现加制,作用机理如下图所示(其中吸附在催化剂表面的物种用*标注),下列有关说法错误的是
A.加制的原子利用率小于100%
B.是反应的中间体,参与了反应的催化循环
C.在催化剂的表面发生共价键的断裂与形成
D.反应②的反应式为
11.工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH3*+OH* Eb=+249.3 kJ·mol-1(其中Ea、Eb为活化能)。
图为计算机模拟的各步反应的能量变化示意图。
下列说法错误的是
A.总反应的焓变(△H)大于0
B.甲醇裂解过程主要历经的方式应为B
C.该历程中最小能垒(活化能)为53.6 kJ·mol-1
D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H*
12.一定压强下,向密闭容器中充入和,发生反应:。的消耗速率、的消耗速率、温度三者的关系如图所示。下列说法正确的是
A.三点对应状态下,达到平衡状态的是
B.温度升高,平衡常数增大
C.保持其他条件不变,若投料改为通入,平衡时的体积分数增大
D.时,平衡时的消耗速率大于
13.合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
②2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH2= 72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。
则下列说法正确的是
A.E1表示2CH4(g)+O2(g) =2CO(g)+4H2(g)的活化能
B.E2表示CH4(g)+H2O(g)CO(g)+3H2(g)的活化能
C.该图示为反应①的反应过程与能量变化示意图,该反应为吸热反应
D.一般情况下,加入催化剂,既能降低E1,也能降低E2,也能降低ΔH
二、填空题(共8题)
14.(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO2CO2+N2。反应能够自发进行,则反应的ΔH 0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g)FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K K1 K2
973 1.47 2.38
1 173 2.15 1.67
根据表中数据,计算反应CO2(g)+H2(g)CO(g)+H2O(g)的K。
①平衡常数的表达式K1= ;
②温度为973K时:K= ;(结果保留小数点后2位)
③反应CO2(g)+H2(g)CO(g)+H2O(g)是 (填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应 (填“已经”或“没有”)达到平衡,原因是 ;此时刻v正 (填“>”或“<”)v逆。
15.工业烟气中的对环境和人体健康有极大的危害,若能合理的利用吸收,可以减少污染。请完成下列问题:
(1)催化还原氮氧化物是目前应用广泛的烟气脱硝技术,发生的化学反应为: ,向容积为的恒容密闭容器中充入和的混合气体充分反应。不同投料比时,的平衡转化率与温度的关系如图中曲线所示[投料比]。
① 0(填“>”“<”或“=”);
②x填 (填“>”“<”或“=”);
③投料比为时,Q点 (填“>”“<”或“=”)P点;
④在时,反应的平衡常数计算式为 。
(2)科学家正在研究利用催化技术将和和转变成和,其反应为: ,反应的逆反应速率与时间的关系如图所示:
由图可知,反应在、、时都达到了平衡,而、时都改变了一种条件,试判断改变的条件是(请列举一种可能):时 ;时 ;若时降压,时达到平衡,时增大反应物的浓度,在图中画出时逆反应速率与时间的关系线 。
16.化学反应速率和平衡原理作为化学学科的核心内容,其相关理论和实践对化学学科的发展有着重要的意义。
Ⅰ.某学习小组选用溶液和溶液,探究、对分解的影响。
记录数据如下:
实验序号 添加试剂及用量 完全分解所需时间/min
1 溶液
2 溶液
(1)实验结果显示,可得出的结论是: (填化学式)更有利于分解。
(2)甲同学查阅资料得知:能加速分解,对分解无影响。为排除干扰,该同学进行实验:向两份溶液中分别加入a mL浓度均为 的 (填化学式)溶液和 (填化学式)溶液。内,发现均几乎不分解。甲同学认为:在无存在的情况下,、对催化分解无影响。
(3)乙同学又提出猜想:、对催化分解会产生影响。于是进行下表实验。限选试剂及其标号如下:
A.溶液 B.少量KCl固体
C.溶液 D.少量固体
实验序号 添加试剂 完全分解所需时间/min
3 需同时加入溶液和 (填标号)
4 需同时加入溶液和 (填标号)
(4)根据实验1~4中测得的完全分解所需时间,小组同学认为 (填“增强”或“减弱”,下同)的催化效果, 的催化效果。
Ⅱ.为了探究反应条件对反应的影响,某活动小组设计了三个实验,实验曲线如图所示。
编号 温度 压强
Ⅰ 530℃ 3MPa
Ⅱ X 5MPa Y
Ⅲ 630℃ 5MPa
(5)请依据实验曲线图补充完整表格中的实验条件:X= ,Y= 。
(6)对比实验Ⅱ和实验Ⅲ可知、升高温度,CO的转化率 (填“增大”“减小”或“不变”), (填“>”或“<”)0,理由是 。
(7)编号Ⅰ实验中,反应达到平衡时,的转化率为50%,则530℃时该反应的平衡常数 (以分压表示,分压=总压×物质的量分数)。
17.(1)某反应在体积为的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
①该反应的化学方程式为
②反应开始至2min时,B的平均反应速率为
③平衡时A的转化率为
(2)为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 A B C D E F
4mol·L-1H2SO4溶液/mL 30 V1 V2 V3 V4 V5
饱和CuSO4溶液/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
①请完成此实验设计:其中V1= V6=
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
18.在10L 容器中,加入2mol SO2(g)和2mol NO2(g),保持温度恒定,发生反应:SO2(g)+ NO2(g) SO3(g)+ NO(g),当达到平衡状态时,测得容器中SO2(g)的转化率为50%,则
(1)若在该容器中再继续加入1 mol SO2(g),则化学平衡将向 方向移动(选填“正反应”、“逆反应”、“不”),NO2(g)的转化率将 (填“增大”、“减小”或“不变”),达到新的平衡状态时,容器中的SO2(g)的浓度是 。
(2)在其他条件不变的情况下,扩大容器的体积,平衡 移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
19.乙烯、环氧乙烷是重要的化工原料,用途广泛。
实验测得 2CH2=CH2(g)+O2(g) 2 (g) △H﹤0中,v逆=k逆·c2(),v正=k正c2(CH2=CH2)·c(O2)(为速率常数,只与温度有关)。
(1)反应达到平衡后,仅降低温度,下列说法正确的是_______(填字母)。
A.均增大,且增大的倍数更多 B.均减小,且减小的倍数更少
C.增大、减小,平衡正向移动 D.均减小,且减小的倍数更少
(2)若在的密闭容器中充入和,在一定温度下只发生上述反应,经过反应达到平衡,体系的压强变为原来的0.875倍,则内 , 。
20.在密闭容器中发生反应CO2(g) + H2(g) CO(g) + H2O(g),其平衡常数(K)和温度(T)的关系如下表所示。
T/ ℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的平衡常数表达式K= ;由上表可知该反应为 反应(填“吸热”或“放热”)。
(2)830℃时,向容器中充入2mol CO2、8mol H2,保持温度不变,反应达到平衡后,其平衡常数 1.0(填“大于”“小于”或“等于”),此时CO2的物质的量为 。
(3)下列有利于提高平衡时CO2转化率的措施有 (填字母)。
a.使用催化剂 b.升温 c.增大 CO2和 H2的投料比
(4)若1200℃时,在某时刻反应混合物中CO2、H2、CO、 H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时反应的平衡移动方向为 (填“正反应方向”“逆反应方向”或“不移动”)。
(5)实验发现,其它条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H2的体积分数增大,实验结果如图所示。
(已知:1微米 = 10-6米,1纳米= 10-9米)。
投入纳米CaO比微米CaO时,H2的体积分数更高的原因是 。
21.我国2020年颁布的能源法中,首次将氢能纳入能源定义。在工业市场中,甲烷水蒸气重整制氢是目前工业制氢最为成熟的方法,被广泛应用于氢气的工业生产。甲烷水蒸气重整反应体系中主要存在的反应方程式有:
反应1:
反应2:
反应3:
(1) 。
(2)反应1在 下自发进行(填“高温”,“低温”或“任意温度”)。
(3)一定温度下,向某容积为1L的恒容容器中充入和,发生上述反应,tmin后反应达到平衡。达到平衡时,容器中CO为mmol,CO2为nmol。
①tmin内CH4的消耗速率为 。(用含m,n,t的代数式表示,下同)。反应1的平衡常数Kc= 。
②保持容器体积和投料量不变,分别在和下进行上述反应,测得容器中CO和CH4的含量随温度的变化如下图所示。
5MPa时,表示CO和CH4平衡组成随温度变化关系的曲线分别是 和 。X点平衡组成含量高于Y点的原因是 。
(4)熔融盐燃料电池具有较高的能量转化效率,某CO熔融盐燃料电池用、作电解质,则工作时负极上电极反应式为 ;当有发生定向移动时,电路中转移的电子数目为 (用表示阿伏加德罗常数的值)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.生成的反应中,第一步反应活化能高,是决速步,故A正确;
B.短时间内,生成的反应活化能低,反应速率快,因此是主产物,故B正确;
C.,升高温度有利于平衡正向移动,可以提高产物中的比例,故C正确;
D.的焓变等于第一步与第二步反应的的代数和,故D错误;
故选D。
2.D
【详解】A.实验①可知:达到平衡时,CO、H2O、CO2、H2物质的量分别为0.31、0.01、0.09、0.09,根据平衡常数的表达式,求出;同理,实验②可知:达到平衡时,CO、H2O、CO2、H2物质的量分别为0.02、0.32、0.08、0.08,,对比实验①和实验②,升高温度,K减小,平衡逆向移动根据勒夏特列原理,该反应为放热反应,即反应物的总能量大于生成物的总能量,故A说法正确;
B.某时刻测得氢气物质的量为0.04mol,此时二氧化碳物质的量也为0.04mol,该时刻CO物质的量为0.36mol,水蒸气物质的量为0.06mol,该时刻H2O(g)的体积分数等于物质的量分数,故B说法正确;
C.实验②和③中,温度相同,则平衡常数相同,根据A项中已求平衡常数可得实验①和③中,反应均达到平衡时,则平衡常数之比为,故C说法正确;
D.实验②和③,温度相同,平衡常数相同,实验③达到平衡时,n(CO)=(0.2-a)mol,n(H2O)=(0.3-a)mol,n(CO2)=n(H2)=amol,则,所以a=0.12,CO的转化率为60%,若④的温度也为800℃,恒容体系中,气体体积不变的反应,平衡时CO的转化率应为60%,但④的实际温度为900℃,相比800℃,平衡逆向移动,则CO转化率应小于60%,故D说法错误;
但为D。
3.A
【分析】根据图I可知,5分钟内,A物质反应了0.4mol,B物质反应了0.2mol,C物质生成了0.2mol,所以该反应的化学方程式是2A(g)+B(g) C(g);根据图II可知,当起始时A、B的物质的量的比值相同时,200C时,C物质平衡时的体积分数大于100C时,所以该反应为吸热反应。
【详解】A.200 ℃时,反应从开始到平衡的平均速率v(B)= ,A项正确;
B.根据分析可知,该反应为吸热反应,B项错误;
C.恒容容器,向体系中充入He,平衡不移动,C项错误;
D.向容器中再充入2 mol A和1 mol B,新平衡等效于原平衡正移,所以A的体积分数小于0.5,D项错误;
故答案为A。
4.B
【分析】发生反应5min时
发生反应10min时
【详解】A.反应A(g)+2B(g)= 3C(g)中,反应物和产物都是气体,气体总质量不变,又因为容器体积不变,反应过程中气体密度一直不变,容器内气体密度不变时,不能说明反应已达到平衡状态,A错误;
B.5~10min内,用C表示的平均反应速率为=0.012mol·L-1·min-1,B正确;
C.由分析可知,5min时,A的物质的量浓度为 =0.16mol·L-1,C错误;
D.反应达到平衡后充入少量氦气(不参与反应) ,反应物和生成物浓度都不变,速率不变,D错误;
故选B。
5.C
【分析】由图知,①→ ②,②+H2O→③,③→④,④+CH3CN→①+CH3CONH2,则总反应为:,据此回答;
【详解】A.据分析, ③和④是反应的中间产物,A正确;
B.据分析, ①和②参与了反应又重新生成、可为本反应的催化剂,B正确;
C. 物质④转化为物质①的反应为:④+CH3CN→①+CH3CONH2,不属于加成反应,C不正确;
D. 据分析,总反应的化学方程式为,D正确;
答案选C。
6.C
【详解】A.图为催化CO2 (g)和H2(g)的反应生成液态HCOOH,物质I在合成甲酸的过程中物质的量没有改变,只是改变了反应机理,所以物质I为该反应的催化剂,而II、 III均为该反应的中间产物,故A错误;
B.使用催化剂可以降低反应的活化能,反应的焓变不变,故B错误;
C.反应生成46g液态HCOOH,其物质的量为,生成1molHCOOH放出31.2kJ的热量,则HCOOH(l)=CO2(g)+H2(g) ΔH = +31.2kJ· mol-1,故C正确;
D.由图可知,因使用钌基催化剂使反应CO2(g) + H2(g)= HCOOH(l)分三步进行,故D错误;
故选C。
7.C
【详解】A.Cl2具有强氧化性,能氧化Fe2+生成Fe3+,同时Fe可将Fe3+还原生成亚铁离子,所以将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2,故A正确;
B.加NaOH溶液使反应Cr2O(橙色)+H2O2H++2CrO(黄色)正向移动,溶液由橙色变为黄色,故B正确;
C.盐碱地(含较多Na2CO3等)不利于作物生长,如施加熟石灰进行改良,会生成CaCO3和 NaOH,加重土壤的碱性和板结,该应用不合理,故C错误;
D.制硫酸工业生产中,尾气中含有的二氧化硫能与亚硫酸钠和水反应生成亚硫酸氢钠,故D正确;
故答案选C。
8.C
【详解】A.图象中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,选项A正确;
B.b点处的切线的斜率是此时刻物质浓度除以此时刻时间,为反应物B的瞬时速率,选项B正确;
C.化学反应速率之比等于化学方程式计量数之比分析,3v(B)=2v(X),选项C不正确;
D.维持温度、容积不变,向反应体系中加入催化剂,平衡不移动,反应速率增大,达到新的平衡状态,平衡状态与原来的平衡状态相同,选项D正确;
答案选C。
9.A
【详解】A.根据图象可知,在温度相同时,a、b、c各点中B2的起始物质的量依次增大,化学反应正向进行,所以平衡时AB3物质的量依次增大,故达到平衡时,AB3的物质的量大小为:c>b>a,A正确;
B.根据图象可知,a、b、c各点中B2的起始物质的量依次增大,对于可逆反应来说,增大一种反应物的物质的量或浓度,有利于平衡向正反应方向移动,则另一种反应物的转化率增大,则达到平衡时A2的转化率大小为:c>b>a,B错误;
C.若T2>T1,由图象可知温度升高生成物的物质的量增大,说明升高温度平衡向正反应分析移动,则正反应为吸热反应,C错误;
D.a、c两点B2起始物质的量不相同,但反应温度相同,而化学平衡常数只与温度有关,温度相同,则化学平衡常数相同,D错误;
故合理选项是A。
10.C
【详解】A.由图可知加生成和水,故原子利用率小于100%,A正确;
B.由图可知,催化剂的作用是吸附和解吸反应过程中生成的水,说明参与了反应的催化循环,是反应过程中存在的物质,反应开始和结束都没有该物质,是中间体,B正确;
C.由图可知,催化剂的作用是吸附和解吸反应过程中生成的水,没有发生共价键的断裂与形成,C错误;
D.由图可知反应②的反应式为,D正确;
故选C。
11.B
【详解】A.根据图示,反应物总能量小于生成物总能量,总反应的焓变(△H)大于0,故A正确;
B.方式A的活化能小于方式B,甲醇裂解过程主要历经的方式应为A,故B错误;
C.根据图示,该历程中各步反应活化能最小的为116.1-62.5=53.6 kJ·mol-1,故C正确;
D.该历程中,放热最多的步骤的化学方程式为CHO*+3H*=CO*+4H* △H=41.9-(-65.7)=+107.6 kJ·mol-1,故D正确;
选B。
12.D
【详解】A. 时,点的消耗速率和的消耗速率均为,说明反应未达平衡状态,A错误;
B.由图可知点的消耗速率是的消耗速率的2倍,可知此时正反应速率等于逆反应速率,反应达到平衡状态,点后,温度升高,的消耗速率增大的程度大于的消耗速率增大的程度的2倍,可知逆反应速率增大的程度大于正反应速率增大的程度,平衡逆向移动,则逆反应吸热,正反应放热,升高温度,减小,B错误;
C.该反应前后气体分子数相等,充入,相当于充入、,即相当于增大压强,增大压强,该反应平衡不移动,故的体积分数不变,错误;
D.时,点未达平衡状态,且正反应速率大于逆反应速率,反应正向进行,的消耗速率小于的生成速率,当达到该温度下的平衡状态时,的消耗速率等于的生成速率,的消耗速率应大于,D正确。
故选D。
13.C
【分析】已知反应①是吸热反应,反应②是放热反应,而图象所表达的是吸热反应即反应①。
【详解】A.E1表示CH4(g)+H2O(g)CO(g)+3H2(g)的活化能,故A错误;
B.E2表示CO(g)+3H2(g)CH4(g)+H2O(g)的活化能,因此B错误;
C.该图所示为反应①的反应过程与能量变化示意图,该反应为吸热反应,故C正确;
D.加入催化剂,正逆反应的活化能都降低了,即E1、E2都降低,但二者的差值不变,ΔH不变,故D错误;
故选C。
14. < 0.62 吸热 没有 此时Qc==≈0.0123<0.32=K >
【分析】
【详解】(1)2NO+2CO 2CO2+N2反应的△S<0,反应自发进行△H-T△S<0,则反应焓变一定小于0,△H<0,反应是放热反应,故答案为<;
(3)①Fe(s)+CO2(g) FeO(s)+CO(g)I、Fe(s)+H2O(g) FeO(s)+H2(g)II,
将方程式I II得CO2(g)+H2(g) CO(g)+H2O(g),则化学平衡常数K={c(CO)×c(H2O)}÷{c(CO2).c(H2)}={ c(CO)÷c(CO2)}×{c(H2)c(H2O)}=K1÷K2,温度为973K时K=1.47÷2.38=0.62,
故答案为 ;0.62;
③升高温度,化学平衡常数增大,说明平衡向正反应方向移动,则正反应是吸热反应,故答案为吸热。
(3)某时刻经测定CO的转化率为10%,则
CO(g)+H2O(g)CO2(g)+H2(g),
起始(mol/L):1 1 0 0
转化(mol/L):0.1 0.1 0.1 0.1
某时刻(mol/L):0.9 0.9 0.1 0.1
Qc=0.1×0.1÷(0.9×0.9)=0.012<0.32,
则没有达到平衡状态,反应向正反应方向移动,v正>v逆,
故答案为没有;Qc
15.(1) < > < 或
(2) 升高温度或充入生成物气体 改进催化剂
【分析】(1)①由图可知,升高温度NO2转化率减小平衡逆向移动;
②投料比越大NO2的物质的量越大,NO2的转化率反而越小;
③投料比为3:4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大;
④400K时,NO2的转化率为50%,列出三段式
,所以平衡常数;据此计算;
(2)由图可知,反应在t2时v逆突然增大,在趋于平衡的过程中逆反应速率逐渐减小,反应逆向移动重新建立平衡,该反应前后气体物质的化学计量数之和不等,t8时逆反应速率急剧增大且与正反应速率相等,故只能是催化剂的影响。
【详解】(1)①由图可知,升高温度NO2转化率减小平衡逆向移动,所以正反应放热,则ΔH<0;
故答案为<;
②则从图中可以看出,同一个温度下,x对应的NO2的转化率均小于3:4对应的NO2的转化率,因投料比越大NO2的物质的量越大,NO2的转化率反而越小,故x>3:4,
故答案为>;
③投料比为3:4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,则可知此时逆反应速率比平衡时逆反应速率小,以氨气表示反应速率得出,Q点v逆(NH3)<P点v逆(NH3);
故答案为<;
④时,的转化率为50%,计算出各组分的物质的量浓度,代入平衡常数表达式,得;
故答案为或;
(2)由图可知,反应在t2时v逆突然增大,在趋于平衡的过程中逆反应速率逐渐减小,反应逆向移动重新建立平衡,改变的条件是升高温度或充入生成物气体;该反应前后气体物质的化学计量数之和不等,t8时逆反应速率急剧增大且与正反应速率相等,故只能是催化剂的影响;t4时降压,v逆急剧减小,平衡左移,然后在t5时平衡,t6时增大反应物的浓度,v逆不变,因而t4~t6时逆反应速率与时间的关系线为,
故答案为高温度或充入生成物气体;催化剂;。
【点睛】本题考查化学平衡的计算、化学平衡的影响因素和平衡图象分析判断,为高频考点,侧重学生的分析、计算和推理等综合运用能力的考查,明确外界因素对化学平衡的影响、把握图象信息分析是解题的关键,注意平衡常数的表达式和三段式格式在平衡计算中的应用。
16.(1)
(2) 2b KCl
(3) B D
(4) 增强 减弱
(5) 530℃
(6) 减小 < 升高温度,CO的转化率减小,平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,因此
(7)0.2
【分析】Ⅰ.实验探究、对分解的影响,通过控制变量法,选用、的铜盐溶液,通过比较完全分解所需时间来判断催化效果。
Ⅱ.探究反应条件对反应的影响,通过控制变量法,实验Ⅰ和实验Ⅱ相比,压强不同,探究压强对反应的影响,实验Ⅱ和实验Ⅲ相比,温度不同,探究温度对反应的影响。
【详解】(1),即加入溶液后分解速率更快,更有利于分解,故答案为:;
(2)带2个单位正电荷,带1个单位正电荷,所以应向两份溶液中分别加入a mL浓度均为2b mol/L的、溶液,故答案为:2b;KCl;;
(3)该实验的目的是探究、对催化分解的影响,所以只需改变阴离子的量,所以实验3中应加入溶液和少量KCl固体,即选B;实验4中应加入溶液和固体,即选D,以此来改变阴离子的量,观察对分解的是否产生影响,故答案为:B;D;
(4),说明加入更多的后分解加快,即增强的催化效果;而,说明加入更多的后分解减慢,即减弱的催化效果,故答案为:增强;减弱;
(5)实验要控制变量,实验Ⅰ和实验Ⅱ相比,压强不同,Ⅰ和Ⅱ其他条件应相同,故,,故答案为:530℃;;
(6)对比实验Ⅱ和实验Ⅲ可知,升高温度,升高,故升高温度向逆反应方向移动,CO的转化率减小;升高温度,CO的转化率减小,平衡向逆反应方向移动,逆反应方向为吸热,正反应为放热反应,故,故答案为:减小;<;升高温度,CO的转化率减小,平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,因此;
(7)编号Ⅰ实验中,反应达平衡时,的转化率为50%,则参加反应的为,列三段式:
该反应气体分子数不变,故平衡总压=开始总压=3MPa,530℃时该反应的平衡常数,故答案为:0.2。
17. 2A+B2C 0.1mol/(L min) 40% 30 10 当加入一定量CuSO4后,生成的单质Cu沉积在Zn表面,降低了Zn与H2SO4溶液的接触面积
【详解】(1)①由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,所以C为生成物,当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B2C,故答案为:2A+B2C;
②由图象可以看出,反应开始至2分钟时,△n(B)=1mol,B的平均反应速率为=0.1mol/(L min),故答案为:0.1mol/(L min);
③平衡时A的转化率为=40%,故答案为:40%;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml,故答案为:30;10;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,故答案为:当加入一定量CuSO4后,生成的单质Cu沉积在Zn表面,降低了Zn与H2SO4溶液的接触面积。
18. 正反应 增大 0.18mol/L 不
【详解】(1)SO2为反应物,加入SO2平衡向正反应方向移动;NO2的转化率增大。
原平衡SO2的转化率为50%,列三段式有:
该反应前后气体系数之和相等,可以用物质的量代替浓度计算平衡常数,所以该温度下反应的平衡常数K=1,设新平衡SO2的浓度为a,列三段式有:
则有=1,解得a=0.18mol/L;
(2)该反应前后气体系数之和相等,在其他条件不变的情况下,扩大容器的体积,虽然压强减小,但平衡不发生移动。
19.(1)B
(2) 0.75
【详解】(1)降低温度,正逆反应速率均减小,该反应为放热反应,降温化学平衡正向移动,逆反应速率下降幅度大于正反应速率,则k正降幅小于k逆
A.k正、k逆均减小,A错误;
B.k正、k逆均减小,且k正减小的倍数更少,B正确;
C.k正、k逆均减小,化学平衡正向移动,C错误;
D.k正、k逆均减小,且k正减小的倍数更少,D错误;
故答案选B。
(2)2CH2=CH2(g)+O2(g) 2 (g),设反应消耗CH2=CH22xmol,则消耗O2xmol,生成2xmol,反应后气体总物质的量为(1-2x+1-x+2x)mol=(2-x)mol,则,x=0.25mol,0-10min内v(O2)=。。
20.(1) 吸热
(2) 等于 0.4mol
(3)b
(4)逆反应方向
(5)相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快;在相同时间内消耗CO2的量更多,导致c(CO2)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高
【详解】(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的平衡常数表达式K=;由上表可知随之温度升高平衡常数逐渐增大,说明升高温度平衡正向进行,所以该反应为吸热反应。
(2)830℃时,向容器中充入2mol CO2、8mol H2,保持温度不变,反应达到平衡后,由于平衡常数只与温度有关系,则其平衡常数等于1.0。设平衡时消耗二氧化碳的物质的量是xmol,则剩余二氧化碳是2mol-xmol、氢气是8mol-xmol、一氧化碳和水蒸气均是xmol,由于反应前后体积不变,可以用物质的量代替浓度计算平衡常数,则,解得x=1.6,所以此时CO2的物质的量为0.4mol。
(3)a.使用催化剂不能影响平衡,CO2转化率不变;
b.正反应吸热,升温平衡正向进行,CO2转化率增大;
c.增大CO2和H2的投料比有利于增大氢气的转化率,CO2转化率降低;
答案选b;
(4)若1200℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2mol/L、2mol/L、4mol/L、4mol/L,则此时浓度熵为>2.6,所以反应的平衡移动方向为逆反应方向。
(5)由于相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快;在相同时间内消耗CO2的量更多,导致c(CO2)降低更大,使平衡逆向移动的程度更大,所以投入纳米CaO,氢气的体积分数更高。
21. +165 高温 d a 升高温度反应一向正反应方向移动,反应三向逆反应方向移动,但反应一的影响程度更大,所以一氧化碳含量增多 4NA
【详解】(1)由盖斯定律可知
故答案为;
(2)反应1: ,,所以该反应在高温条件下自发进行,故答案为高温;
(3)①根据反应方程式可知,所以甲烷的消耗速率为
,故答案为;
依据原子守恒,由于为,为,则剩余,水剩余,
氢原子为,即氢气为,
容积为的恒容容器,所以反应1的平衡常数,故答案为;也可以根据三段式解题。
②保持容器体积和投料量不变,分别在和下进行上述反应,反应1为吸热,反应2为吸热,反应3为放热反应,所以升高温度甲烷的含量降低,一氧化碳的含量增多,在同温条件下,增大压强反应1和2均向逆反应方向移动,所以甲烷含量增大,所以时,表示平衡组成随温度变化关系的曲线为线,平衡组成随温度变化关系的曲线为线:压强相同条件下,升高温度反应1向正反应方向移动,反应3向逆反应方向移动,但反应一的影响程度更大,所以一氧化碳含量增多,故答案为升高温度反应1向正反应方向移动,反应3向逆反应方向移动,但反应1的影响程度更大,所以一氧化碳含量增多:
(4)在负极上失电子,参与电极反应失电子转化为,熔融盐燃料电池用、作电解质。则工作时负极上电极反应式为,当有发生定向移动时,内电路有电荷移动,外电路中转移的电子数目为。
答案第1页,共2页
答案第1页,共2页
