第三章铁金属材料 单元测试题(含解析)2023--2024学年高一化学人教版必修1
文档属性
| 名称 | 第三章铁金属材料 单元测试题(含解析)2023--2024学年高一化学人教版必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 648.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 21:10:55 | ||
图片预览



文档简介
第三章 铁 金属材料 单元测试题
一、单选题
1.下列物质中,在一定条件下能与铁反应,且铁元素化合价全部变为+3价的是
A.S B.H2O C.稀硫酸 D.氯气
2.下列反应的离子方程式正确的是
A.氯气尾气处理的原理:
B.少量通入溶液中:
C.向红色溶液中加入过量铁粉至溶液红色褪去:
D.向含氯化铁的氯化镁溶液中加入氧化镁除杂质:
3.设NA为阿伏伽德罗常数的值,下列说法正确的有几个
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,22.4L氢气和22.4L氩气所含的分子数相等,且均为NA
③0.2mol/L的NaCl溶液中,Na+数为0.2NA
④32gO2和O3混合气体中含有原子数为2NA
⑤标准状况下,22.4L水所水分子的数目为NA
⑥标准状况下,4.48LCl2通入水中,反应转移的电子数为0.2NA
⑦1L0.1mol L-1的乙酸溶液中含H+的数量为0.1NA
⑧1molFe溶于过量硝酸,转移电子数为2NA
A.2 B.3 C.4 D.5
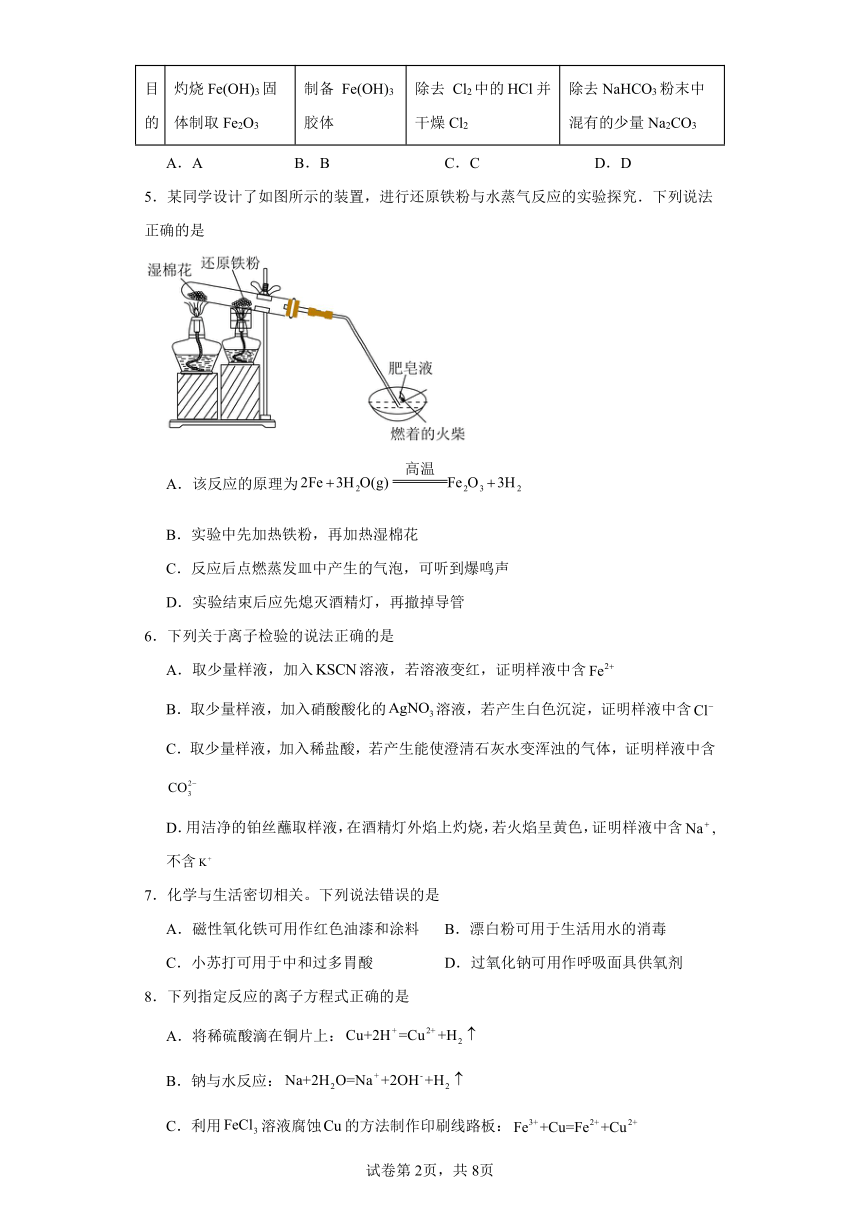
4.应用下列装置能达到实验目的的是
选项 A B C D
装置
目的 灼烧Fe(OH)3固体制取Fe2O3 制备 Fe(OH)3胶体 除去 Cl2中的HCl并干燥Cl2 除去NaHCO3粉末中混有的少量Na2CO3
A.A B.B C.C D.D
5.某同学设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验探究.下列说法正确的是
A.该反应的原理为
B.实验中先加热铁粉,再加热湿棉花
C.反应后点燃蒸发皿中产生的气泡,可听到爆鸣声
D.实验结束后应先熄灭酒精灯,再撤掉导管
6.下列关于离子检验的说法正确的是
A.取少量样液,加入溶液,若溶液变红,证明样液中含
B.取少量样液,加入硝酸酸化的溶液,若产生白色沉淀,证明样液中含
C.取少量样液,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,证明样液中含
D.用洁净的铂丝蘸取样液,在酒精灯外焰上灼烧,若火焰呈黄色,证明样液中含,不含
7.化学与生活密切相关。下列说法错误的是
A.磁性氧化铁可用作红色油漆和涂料 B.漂白粉可用于生活用水的消毒
C.小苏打可用于中和过多胃酸 D.过氧化钠可用作呼吸面具供氧剂
8.下列指定反应的离子方程式正确的是
A.将稀硫酸滴在铜片上:
B.钠与水反应:
C.利用溶液腐蚀的方法制作印刷线路板:
D.用醋酸除去水垢:
9.下列途径,不能得到氯化铁的是
A.金属单质与非金属单质反应 B.碱性氧化物与酸反应
C.酸与碱发生中和反应 D.金属与酸反应
10.氢化钠(NaH)可在野外作生氢剂,其中氢显-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应
B.该反应是复分解反应
C.NaH中氢元素被氧化
D.在标准状况下,生成11.2LH2,则转移电子的物质的量为1mol
11.下列反应的离子方程式,不正确的是
A.氢氧化铁悬浊液溶于氢碘酸溶液中:
B.向溶液中加入过量NaOH溶液并加热:
C.少量的通入NaClO溶液中:
D.过氧化钠与水反应:
12.金属元素易形成多种合金。下列说法错误的是
A.甘肃出土的春秋早期秦国的铜柄铁剑中,铁元素有化合态和游离态两种存在形式
B.人们日常生活中的铝制品是由金属铝制造的
C.由镍、铁、碳和钴组成的镍钴合金可制造喷气式飞机的发动机叶片
D.Ti-Fe合金和La-Ni合金都是优良的储氢合金
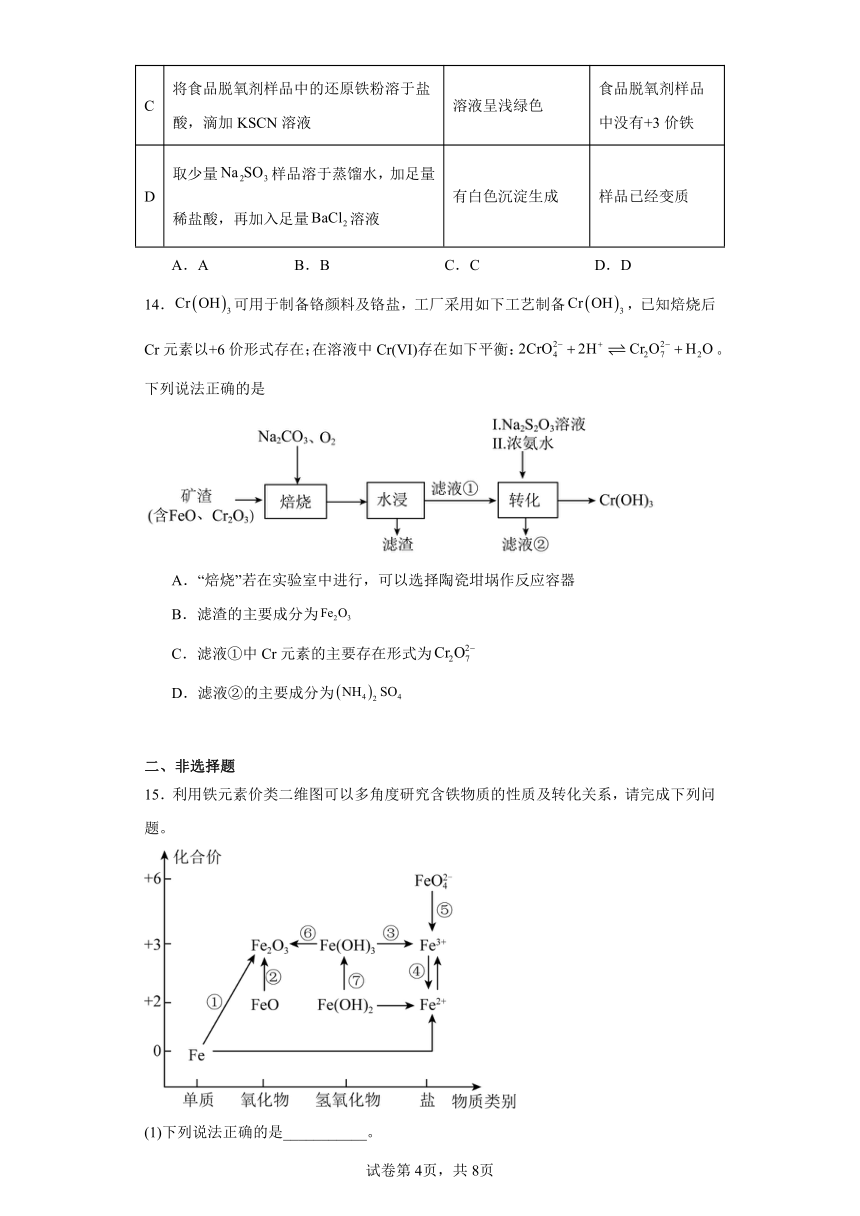
13.下列实验方案、现象和结论都正确的是
实验方案 现象 结论
A 往溶液中加入Zn片 短时间内无明显现象 的氧化能力比弱
B 取两份新制氯水,分别滴加溶液和淀粉KI溶液 前者有白色沉淀,后者溶液变蓝色 氯气与水的反应存在限度
C 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液 溶液呈浅绿色 食品脱氧剂样品中没有+3价铁
D 取少量样品溶于蒸馏水,加足量稀盐酸,再加入足量溶液 有白色沉淀生成 样品已经变质
A.A B.B C.C D.D
14.可用于制备铬颜料及铬盐,工厂采用如下工艺制备,已知焙烧后Cr元素以+6价形式存在;在溶液中Cr(Ⅵ)存在如下平衡:。下列说法正确的是
A.“焙烧”若在实验室中进行,可以选择陶瓷坩埚作反应容器
B.滤渣的主要成分为
C.滤液①中Cr元素的主要存在形式为
D.滤液②的主要成分为
二、非选择题
15.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。
(1)下列说法正确的是___________。
A.是碱性氧化物
B.铁与高温水蒸气的反应可实现上述转化①
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②
D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果
(2)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象: 。
(3)常用作杀菌消毒剂,生产的反应原理是:(未配平),则该反应中氧化剂与还原剂的物质的量之比为 。
(4)从制造印刷电路板的废液中回收铜,并重新获得溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得溶液,准备采用下列步骤:
请写出上述流程中加入①和④的有关物质的化学式:① ,④ 。请写出通入⑥反应的离子方程式 。
16.化学研究源于实验与理论的结合,得益于科学的推断与探究。
(1)一个体重的健康人含铁,这铁在人体中以和的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
①服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收,以下为常见铁元素的几种微粒,其中既有氧化性又有还原性的是 。
A. B. C.
②工业盐的主要成分是,曾多次发生过因误食而中毒的事件,其原因是将人体内的转化为而失去了与结合的能力,这说明具有 性。
③工业盐中毒后,可服用维生素C来缓解中毒症状,这说明维生素C具有 性。
(2)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:,该脱氧反应中还原剂是 。
(3)某化学兴趣小组用食品脱氧剂(铁粉、活性炭、氯化钠)进行如图两个实验。
实验Ⅰ:
请回答:
①溶液丙中一定含有的金属阳离子是 (写离子符号)。
②检验溶液丙中的方案是 。
③实验Ⅱ:将乙烘干后进行如图实验,物质之间的转化关系如图(部分产物路法)
写出反应②的离子方程式 ,若反应消耗金属A,转移电子的数目为 。
17.含氯物质用途广泛,可用于特定场合的消毒。回答下列问题:
(1)下列关于氯气的说法错误的是___________。
A.室温下,氯气能溶于水 B.可采用碱石灰干燥氯气
C.可通过排饱和食盐水法收集少量氯气 D.室温下,可通过加压使氯气液化而储存于钢瓶中
(2)实验室可利用和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。
①仪器a的名称为 。
②在记录量气管读数时,应注意将装置冷却至室温,再 (填具体操作),视线与量气管内凹液面相切,水平读数。
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到气体367.5mL(已知此时气体摩尔体积为24.5L/mol)。由此可知:不与反应的盐酸临界浓度约为 mol/L(保留3位有效数字)。
(3)消毒效率可用单位质量消毒剂的得电子数来表示。NaClO和作消毒剂时还原产物均为。NaClO的消毒效率是氯气的 倍(保留2位小数)。
(4)久置后的84消毒液会变质,用化学方程式解释原因: ; 。(已知酸性:)
(5)针对不同物品的消毒,84消毒液需要稀释到不同的浓度。取1mL含次氯酸钠的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为 。
(6)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
18.物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、Cl2,这些物质按照以下方法进行分类后如图所示,其中A组为单质,B组为化合物,请按照要求回答问题。
(1)该分类方法为 ,
(2)B组物质中属于非电解质的为 ,其中能作制冷剂的物质的电子式为 。
(3)C组物质中有的能与水剧烈反应,该反应中氧化剂和还原剂物质的量之比为 。
(4)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用: 。
(5)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式: 。
(6)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为 ;
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.S氧化性弱,与Fe反应生成FeS,A不符合题意;
B.Fe与水蒸气反应生成Fe3O4,其中铁元素既有+2价,又有+3价,B不符合题意;
C.Fe与稀硫酸反应生成FeSO4,C不符合题意;
D.Fe与氯气反应生成FeCl3,D符合题意;
故答案选D。
2.D
【详解】A.氯气与NaOH溶液反应,生成NaCl、NaClO和H2O:,A不正确;
B.少量通入溶液中,生成盐酸和硫酸钠,盐酸再与过量的Na2SO3反应,生成NaCl、NaHSO3,B不正确;
C.不能拆开,在其溶液中加入过量铁粉至溶液褪色,生成Fe2+、SCN-:,C不正确;
D.向含氯化铁的氯化镁溶液中加入氧化镁,MgO与Fe3+水解生成的H+反应,生成Mg2+等,从而促进Fe3+水解:,D正确;
故选D。
3.A
【详解】①标准状况下,11.2L以任意比例混合的氮气和氧气所含原子物质的量为,则原子数为NA,①正确;
②未给定标准状况,无法计算,②错误,
③溶液体积未知,无法计算,③错误;
④32gO2和O3混合气体含有原子物质的量为,则32gO2和O3混合气体含有原子数为2NA,④正确;
⑤标况下,水为液态,无法用气体摩尔体积计算,⑤错误;
⑥标准状况下,4.48LCl2通入水中,只有少量Cl2与水反应,无法计算反应转移的电子数,⑥错误;
⑦乙酸部分电离,1L0.1mol L-1的乙酸溶液中含H+的数量小于0.1NA,⑦错误;
⑧1molFe溶于过量硝酸,生成铁离子,转移电子数为3NA,⑧错误;
①④正确,故选A。
4.C
【详解】A.灼烧Fe(OH)3固体制取Fe2O3应该用坩埚,故A错误;
B.制备 Fe(OH)3胶体应该向沸水中滴加饱和氯化铁溶液,故B错误;
C.饱和食盐水可以除去 Cl2中的HCl,浓盐酸干燥Cl2,故C正确;
D.加热NaHCO3分解,除去Na2CO3粉末中混有的少量NaHCO3,可以用加热分解,故D错误;
故答案为C。
5.C
【详解】A.反应的化学方程式为:,故A错误;
B.实验中应该先加热湿棉花,产生水蒸气,再加热铁粉,故B错误;
C.加热时试管内铁粉红热,点燃肥皂泡,因混有空气可听到爆鸣声,故C正确;
D.实验结束后为防止倒吸应该先撤导管后熄灭酒精灯,故D错误。
故选C。
6.B
【详解】A.Fe3+遇KSCN变为红色,故A错误;
B.向某溶液中加入硝酸酸化的硝酸银溶液有白色沉淀出现,白色沉淀为AgCl,则原溶液含,故B正确;
C.向某无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,产生的无色气体可能为二氧化碳或二氧化硫,则溶液中可能含有、、、等,故C错误;
D.观察钾的焰色试验应该透过蓝色钴玻璃,故D错误;
答案选B。
7.A
【详解】A.磁性氧化铁是黑色晶体,不能用作红色油漆和涂料,故A错误;
B.漂白粉具有强氧化性,能杀菌消毒,可用于生活用水的消毒,故B正确;
C.小苏打是碳酸氢钠,碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳、水,可用于中和过多胃酸,故C正确;
D.过氧化钠和二氧化碳反应生成碳酸钠和氧气,过氧化钠可用作呼吸面具供氧剂,故D正确;
选A。
8.D
【详解】A.铜单质与稀硫酸不发生反应,故A错误;
B.钠与水反应的离子方程式为:,故B错误;
C.方程式电荷不守恒,应为,故C错误;
D.醋酸为弱电解质,碳酸钙为难溶物,反应方程式为:,故D正确;
故答案为:D。
9.D
【详解】A. 金属单质与非金属单质反应:铁丝在氯气中燃烧生成氯化铁,故A不选;
B. 碱性氧化物与酸反应:三氧化二铁与盐酸反应生成氯化铁和水,故B不选;
C. 酸与碱发生中和反应:氢氧化铁与与盐酸反应生成氯化铁和水,故C不选;
D. 金属与酸反应:铁与盐酸反生成氯化亚铁和氢气,不能得到氯化铁,故D选;
故选D。
10.C
【详解】A.该反应不是置换反应,A项错误;
B.该反应不是复分解反应,B项错误;
C.NaH中氢显-1价,在反应中升高到0价,被氧化,C项正确;
D.在反应中生成1mol氢气,转移1mol电子,在标准状况下,生成11.2LH2,其物质的量为0.5mol,则转移电子的物质的量为0.5mol,D项错误;
故选C。
11.D
【详解】A.三价铁离子具有强的氧化性,能够氧化碘离子;氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A正确;
B.向NH4HCO3溶液中加入过量NaOH溶液并加热生成碳酸钠、氨气和水,离子方程式为,故B正确;
C.二氧化硫少量,氢离子与次氯酸根离子结合生成次氯酸;少量SO2通入NaClO溶液中,离子方程式为:,故C正确;
D.过氧化钠与水反应生成氢氧化钠和氧气。过氧化钠与足量水反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故D错误;
故选:D。
12.B
【详解】A.铁剑中部分铁生锈生成氧化铁,故铁剑中铁元素有化合态和游离态两种存在形式,A正确;
B.纯铝很软,人们日常生活中的铝制品是由金属铝合金制造的,B错误;
C.由镍、铁、碳和钴组成的镍钴合金耐高温、硬度大,可制造喷气式飞机的发动机叶片,故C正确;
D.Ti-Fe合金和La-Ni合金具有良好的储氢性能,都是优良的储氢合金,故D正确;
故选B。
13.D
【详解】A.往FeCl2溶液中加入Zn片,离子反应方程式为:Fe2++Zn=Fe+Zn2+,FeCl2溶液呈浅绿色、ZnCl2溶液呈无色,所以溶液由浅绿色变为无色,Fe2为氧化剂、Zn2+为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,Fe2+的氧化能力比Zn2+强,故A错误;
B.Cl2和HClO均能氧化KI生成碘单质,溶液变蓝色,故无法证明上述反应存在限度,故B错误;
C.将食品脱氧剂样品中的还原铁粉溶于盐酸,Fe3+能被Fe还原为Fe2+,滴加KSCN溶液,溶液不变红色,故C错误;
D.盐酸可排除亚硫酸根离子的干扰,再加氯化钡若生成白色沉淀为硫酸钡,则样品已经变质,故D正确;
故选:D。
14.B
【分析】矿渣主要成分为FeO、Cr2O3,加入纯碱、空气焙烧,已知焙烧后Cr元素以+6价形式存在,发生反应:2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2、4FeO+O22Fe2O3,水浸之后除去生成的氧化铁,滤液中加入Na2S2O3与Na2CrO4发生氧化还原反应生成Cr(OH)3,以此解答该题。
【详解】A.陶瓷坩埚成分为SiO2,高温下能与碳酸钠反应,因此“焙烧”不可以选择陶瓷坩埚作反应容器,故A错误;
B.矿渣主要成分为FeO、Cr2O3,加入纯碱、空气焙烧,4FeO+O22Fe2O3,水浸之后除去生成的氧化铁,滤渣的主要成分为Fe2O3,故B正确;
C.已知焙烧后Cr元素以+6价形式存在,发生反应:2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2,即滤液①中Cr元素的主要存在形式为,故C错误;
D.Na2S2O3与Na2CrO4发生氧化还原反应生成Cr(OH)3,硫元素化合价升高,被氧化为硫酸根,加入浓氨水调节pH,滤液②的主要成分为Na2SO4,故D错误;
故选:B。
15.(1)AD
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)3:2
(4) Fe HCl 2Fe2++Cl2=2Fe3++2Cl-
【分析】制造印刷电路板的废液中含有FeCl3、FeCl2、CuCl2,加过量的铁粉,把FeCl3还原为FeCl2,铁置换出CuCl2中的Cu,过滤,滤液②为FeCl2,滤渣③含有Fe、Cu,滤渣③加过量的盐酸溶解铁,过滤出Cu,滤液⑤为FeCl2,FeCl2溶液中通入氯气生成溶液。
【详解】(1)A.能与盐酸反应生成氯化铁和水,是碱性氧化物,故A正确;
B.铁与高温水蒸气的反应生成Fe3O4,故B错误;
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化为Fe3O4,故C错误;
D.维生素C具有还原性,能防止Fe2+被氧化,硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果,故D正确;
选AD。
(2)制备氢氧化亚铁时,Fe(OH)2被氧气氧化为红褐色Fe(OH)3,由白色絮状沉淀最终转化为红褐色沉淀,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)(未配平),Fe元素化合价由+3升高为+6,Fe(NO3)3是还原剂,氯元素化合价由+1降低为-1,KClO是氧化剂,根据得失电子守恒,则该反应中氧化剂与还原剂的物质的量之比为3:2。
(4)加过量的铁粉,把FeCl3还原为FeCl2,铁置换出CuCl2中的Cu,所以①是Fe;滤渣③含有Fe、Cu,滤渣③加过量的盐酸溶解铁,④是HCl。通入⑥是FeCl2溶液中通入氯气生成,反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-。
16.(1) B 氧化 还原
(2)
(3) 、 取少许丙溶液于试管中,向试管中加入过量的溶液,振荡静置,向上层清液中滴加溶液,观察到有白色沉淀产生,溶液丙中含有
【详解】(1)①铁原子中铁元素为最低价态0价,只有还原性,铁离子中铁元素为最高价态+3价,只有氧化性,亚铁离子中铁元素为中间价态为+2价,既有氧化性又有还原性,故选B;
②由亚硝酸钠能将人体内的亚铁离子氧化为铁离子,说明反应中氮元素的化合价降低被还原,亚硝酸钠是反应的氧化剂,表现氧化性,故答案为:氧化;
③工业盐中毒后,可服用维生素C来缓解中毒症状说明维生素C具有还原性,能将铁离子还原为亚铁离子,反应中维生素C表现还原性,故答案为:还原;
(2)由方程式可知,反应中铁元素的化合价升高被氧化,氢氧化亚铁是反应的还原剂,故答案为:;
(3)实验Ⅰ:由题给流程可知,脱氧剂中加入过量稀硫酸,铁粉与稀硫酸反应生成硫酸亚铁和氢气,过滤得到活性炭固体和含有硫酸亚铁和氯化钠的溶液;
①由分析可知,溶液丙为硫酸亚铁和氯化钠混合溶液,溶液中含有的金属阳离子是钠离子和亚铁离子,故答案为:、;
②由分析可知,溶液丙为硫酸亚铁和氯化钠混合溶液,溶液中含有的硫酸根离子会干扰氯离子检验,检验溶液中氯离子时,应先加入过量的硝酸钡溶液,将溶液中的硫酸根离子转化为硫酸钡沉淀,排出硫酸根离子对氯离子检验的干扰,具体操作为取少许丙溶液于试管中,向试管中加入过量的硝酸钡溶液,振荡静置,向上层清液中滴加硝酸银溶液,观察到有白色沉淀产生,溶液丙中含有氯离子,故答案为:取少许丙溶液于试管中,向试管中加入过量的溶液,振荡静置,向上层清液中滴加溶液,观察到有白色沉淀产生,溶液丙中含有;
③由题给流程可知,反应①为活性炭与氧化铁高温条件下反应生成铁;有色溶液C与氢氧化钠溶液反应生成蓝色沉淀说明溶液C为含有铜离子的溶液、蓝色沉淀为氢氧化铜,则反应③为溶液中铜离子与氢氧根离子反应生成氢氧化铜沉淀;反应②为铁与溶液中铜离子发生置换反应生成铜和硫酸亚铁,反应的离子方程式为,反应中消耗1mol铁时,反应转移2mol电子,则反应消耗16.8g时,转移电子的数目为×2×NAmol—1=0.6NA,答案为:;0.6NA。
17.(1)B
(2) 锥形瓶 调节水准管高度,使其液面与量气管中液面相平 3.00
(3)0.95
(4)
(5)0.002
(6)203
【详解】(1)A. 室温下,氯气能溶于水,故A正确;
B. 氯气能与碱性物质反应,不能用碱石灰干燥氯气,故B错误;
C. 氯气难溶于饱和食盐水,可通过排饱和食盐水法收集少量氯气,故C正确;
D. 室温下,氯气和铁不反应,可通过加压使氯气液化而储存于钢瓶中,故D正确;
选B。
(2)①根据装置图,仪器a的名称为锥形瓶。
②在记录量气管读数时,应注意将装置冷却至室温;再调节水准管高度,使其液面与量气管中液面相平,保证量气管内气体的压强等于外界大气压;视线与量气管内凹液面相切,水平读数。
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到氢气体积367.5mL(已知此时气体摩尔体积为24.5L/mol),氢气的物质的量为 ,不与反应的盐酸的物质的量为0.03mol,剩余盐酸的浓度为 ,由此可知不与反应的盐酸临界浓度约为3.00mol/L。
(3)1gNaClO作消毒剂时得电子的物质的量为,1gCl2作消毒剂时得电子的物质的量为, NaClO的消毒效率是氯气的0.95倍。
(4)酸性:,次氯酸钠和二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸分解为盐酸和氧气,反应方程式为、;
(5)含次氯酸钠的84消毒液物质的量浓度为,取1mL含次氯酸钠的84消毒液,加水稀释至100mL,根据稀释前后次氯酸钠的物质的量不变,则稀释后的溶液中次氯酸钠的物质的量浓度为。
(6)设生产1000kg该溶液需消耗氯气的质量为xkg。则反应消耗的氢氧化钠的质量为[(1000-x)×30%-1000×1%]kg=(290-0.3x)kg;
则
x=203kg。
18.(1)树状分类法
(2) SO2、NH3
(3)1:1
(4)焊接钢轨
(5)5SO2+2+2H2O=5+2Mn2++4H+
(6)Na2CO3
【分析】在物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、Cl2中,Na2O2、NaHCO3、SO2、NH3组成元素含有两种或两种以上,属于化合物;而Al、Fe、Na、Cl2的组成元素只有一种,属于单质。在Al、Fe、Na、Cl2中,Na、Cl2能够与水反应,其中Na与冷水剧烈反应。在Na2O2、NaHCO3、SO2、NH3中,Na2O2、NaHCO3是离子化合物,在熔融状态下能够导电;SO2、NH3由分子构成,在熔融状态下不能导电,在A组物质Fe、Na、Cl2,Al中,Cl2能够与Fe、Na、Al三种金属反应,在每一个反应中,Cl2得到电子表现氧化性,其中可以证明其具有强氧化性的是Cl2在与变价金属Fe反应时,使金属变为高价态形成FeCl3,该反应的化学反应方程式为:2Fe+3Cl22FeCl3;B组物质包括Na2O2、NaHCO3、SO2、NH3,其中Na2O2、NaHCO3都是离子化合物,在熔融状态下能够导电,属于E组电解质;而SO2、NH3都是由分子构成,在熔融状态下不能发生电离而导电,在水溶液中也不能因自身发生电离而导电,因此SO2、NH3都属于非电解质,属于F组物质。然后根据问题分析解答。
【详解】(1)把多种物质按照某一个标准进行分类,依次类推,这种分类方法分类的物质就像大树一样,这种分类方法叫做树状分类法;
(2)B组中SO2、NH3属于非电解质,其中NH3可以作制冷剂。在NH3中,N原子与3个H原子形成3个共价键,使分子中各个原子都达到最外层2个或8个电子的稳定结构,其电子式为:;
(3)C组物质中Na与冷水会发生剧烈反应,化学方程式为:2Na+2H2O=2NaOH+H2↑,在该反应中Na为还原剂,H2O为氧化性,则该反应中氧化剂和还原剂物质的量之比为1:1;
(4)根据上述分析可知A组物质包括Fe、Na、Cl2,Al,其中Cl2、Na能与冷水反应,属于C组物质, Fe、Al属于D组物质,Al能够与Fe的化合物如Fe2O3在高温下发生铝热反应制取Fe,反应方程式为:2Al+Fe2O3Al2O3+2Fe,该反应的用途如可用于焊接钢轨;
(5)F组中的酸性氧化物是SO2,该物质具有强的还原性,能够被酸性KMnO4溶液氧化为H2SO4,而使溶液紫色褪色,该反应的离子方程式为:5SO2+2+2H2O=5+2Mn2++4H+;
(6)根据上述分析可知:E组物质为Na2O2、NaHCO3,在密闭容器中加热上述混合物发生反应,若混合物中金属原子与氧原子的物质的量之比为1:2,假设Na2O2、NaHCO3的物质的量分别是a、b,则,解得b=2a,即n(NaHCO3)=2n(Na2O2)。若Na2O2为1 mol,则NaHCO3为2 mol,NaHCO3受热发生分解反应:2NaHCO3Na2CO3+CO2↑+H2O,2 mol NaHCO3分解产生1 mol Na2CO3、1 mol CO2、1 mol H2O,然后发生反应:2Na2O2+2CO2=2Na2CO3+O2,1 mol CO2恰好反应消耗1 mol Na2O2,Na2O2反应完全,不再发生反应:2Na2O2+2H2O=4NaOH+O2↑,故反应完全后剩余固体是Na2CO3;
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质中,在一定条件下能与铁反应,且铁元素化合价全部变为+3价的是
A.S B.H2O C.稀硫酸 D.氯气
2.下列反应的离子方程式正确的是
A.氯气尾气处理的原理:
B.少量通入溶液中:
C.向红色溶液中加入过量铁粉至溶液红色褪去:
D.向含氯化铁的氯化镁溶液中加入氧化镁除杂质:
3.设NA为阿伏伽德罗常数的值,下列说法正确的有几个
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,22.4L氢气和22.4L氩气所含的分子数相等,且均为NA
③0.2mol/L的NaCl溶液中,Na+数为0.2NA
④32gO2和O3混合气体中含有原子数为2NA
⑤标准状况下,22.4L水所水分子的数目为NA
⑥标准状况下,4.48LCl2通入水中,反应转移的电子数为0.2NA
⑦1L0.1mol L-1的乙酸溶液中含H+的数量为0.1NA
⑧1molFe溶于过量硝酸,转移电子数为2NA
A.2 B.3 C.4 D.5
4.应用下列装置能达到实验目的的是
选项 A B C D
装置
目的 灼烧Fe(OH)3固体制取Fe2O3 制备 Fe(OH)3胶体 除去 Cl2中的HCl并干燥Cl2 除去NaHCO3粉末中混有的少量Na2CO3
A.A B.B C.C D.D
5.某同学设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验探究.下列说法正确的是
A.该反应的原理为
B.实验中先加热铁粉,再加热湿棉花
C.反应后点燃蒸发皿中产生的气泡,可听到爆鸣声
D.实验结束后应先熄灭酒精灯,再撤掉导管
6.下列关于离子检验的说法正确的是
A.取少量样液,加入溶液,若溶液变红,证明样液中含
B.取少量样液,加入硝酸酸化的溶液,若产生白色沉淀,证明样液中含
C.取少量样液,加入稀盐酸,若产生能使澄清石灰水变浑浊的气体,证明样液中含
D.用洁净的铂丝蘸取样液,在酒精灯外焰上灼烧,若火焰呈黄色,证明样液中含,不含
7.化学与生活密切相关。下列说法错误的是
A.磁性氧化铁可用作红色油漆和涂料 B.漂白粉可用于生活用水的消毒
C.小苏打可用于中和过多胃酸 D.过氧化钠可用作呼吸面具供氧剂
8.下列指定反应的离子方程式正确的是
A.将稀硫酸滴在铜片上:
B.钠与水反应:
C.利用溶液腐蚀的方法制作印刷线路板:
D.用醋酸除去水垢:
9.下列途径,不能得到氯化铁的是
A.金属单质与非金属单质反应 B.碱性氧化物与酸反应
C.酸与碱发生中和反应 D.金属与酸反应
10.氢化钠(NaH)可在野外作生氢剂,其中氢显-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应
B.该反应是复分解反应
C.NaH中氢元素被氧化
D.在标准状况下,生成11.2LH2,则转移电子的物质的量为1mol
11.下列反应的离子方程式,不正确的是
A.氢氧化铁悬浊液溶于氢碘酸溶液中:
B.向溶液中加入过量NaOH溶液并加热:
C.少量的通入NaClO溶液中:
D.过氧化钠与水反应:
12.金属元素易形成多种合金。下列说法错误的是
A.甘肃出土的春秋早期秦国的铜柄铁剑中,铁元素有化合态和游离态两种存在形式
B.人们日常生活中的铝制品是由金属铝制造的
C.由镍、铁、碳和钴组成的镍钴合金可制造喷气式飞机的发动机叶片
D.Ti-Fe合金和La-Ni合金都是优良的储氢合金
13.下列实验方案、现象和结论都正确的是
实验方案 现象 结论
A 往溶液中加入Zn片 短时间内无明显现象 的氧化能力比弱
B 取两份新制氯水,分别滴加溶液和淀粉KI溶液 前者有白色沉淀,后者溶液变蓝色 氯气与水的反应存在限度
C 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液 溶液呈浅绿色 食品脱氧剂样品中没有+3价铁
D 取少量样品溶于蒸馏水,加足量稀盐酸,再加入足量溶液 有白色沉淀生成 样品已经变质
A.A B.B C.C D.D
14.可用于制备铬颜料及铬盐,工厂采用如下工艺制备,已知焙烧后Cr元素以+6价形式存在;在溶液中Cr(Ⅵ)存在如下平衡:。下列说法正确的是
A.“焙烧”若在实验室中进行,可以选择陶瓷坩埚作反应容器
B.滤渣的主要成分为
C.滤液①中Cr元素的主要存在形式为
D.滤液②的主要成分为
二、非选择题
15.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。
(1)下列说法正确的是___________。
A.是碱性氧化物
B.铁与高温水蒸气的反应可实现上述转化①
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②
D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果
(2)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象: 。
(3)常用作杀菌消毒剂,生产的反应原理是:(未配平),则该反应中氧化剂与还原剂的物质的量之比为 。
(4)从制造印刷电路板的废液中回收铜,并重新获得溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得溶液,准备采用下列步骤:
请写出上述流程中加入①和④的有关物质的化学式:① ,④ 。请写出通入⑥反应的离子方程式 。
16.化学研究源于实验与理论的结合,得益于科学的推断与探究。
(1)一个体重的健康人含铁,这铁在人体中以和的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。
①服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收,以下为常见铁元素的几种微粒,其中既有氧化性又有还原性的是 。
A. B. C.
②工业盐的主要成分是,曾多次发生过因误食而中毒的事件,其原因是将人体内的转化为而失去了与结合的能力,这说明具有 性。
③工业盐中毒后,可服用维生素C来缓解中毒症状,这说明维生素C具有 性。
(2)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。脱氧中的一步主要反应为:,该脱氧反应中还原剂是 。
(3)某化学兴趣小组用食品脱氧剂(铁粉、活性炭、氯化钠)进行如图两个实验。
实验Ⅰ:
请回答:
①溶液丙中一定含有的金属阳离子是 (写离子符号)。
②检验溶液丙中的方案是 。
③实验Ⅱ:将乙烘干后进行如图实验,物质之间的转化关系如图(部分产物路法)
写出反应②的离子方程式 ,若反应消耗金属A,转移电子的数目为 。
17.含氯物质用途广泛,可用于特定场合的消毒。回答下列问题:
(1)下列关于氯气的说法错误的是___________。
A.室温下,氯气能溶于水 B.可采用碱石灰干燥氯气
C.可通过排饱和食盐水法收集少量氯气 D.室温下,可通过加压使氯气液化而储存于钢瓶中
(2)实验室可利用和浓盐酸制备氯气。为测定反应残余液中盐酸的浓度,小组同学提出方案:与足量Zn反应,测量生成的体积,计算残余液中盐酸的浓度。装置如图所示(量气管和水准管之间用橡胶管连接,夹持仪器略)。
①仪器a的名称为 。
②在记录量气管读数时,应注意将装置冷却至室温,再 (填具体操作),视线与量气管内凹液面相切,水平读数。
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到气体367.5mL(已知此时气体摩尔体积为24.5L/mol)。由此可知:不与反应的盐酸临界浓度约为 mol/L(保留3位有效数字)。
(3)消毒效率可用单位质量消毒剂的得电子数来表示。NaClO和作消毒剂时还原产物均为。NaClO的消毒效率是氯气的 倍(保留2位小数)。
(4)久置后的84消毒液会变质,用化学方程式解释原因: ; 。(已知酸性:)
(5)针对不同物品的消毒,84消毒液需要稀释到不同的浓度。取1mL含次氯酸钠的84消毒液,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为 。
(6)工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为 kg(保留整数)。
18.物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、Cl2,这些物质按照以下方法进行分类后如图所示,其中A组为单质,B组为化合物,请按照要求回答问题。
(1)该分类方法为 ,
(2)B组物质中属于非电解质的为 ,其中能作制冷剂的物质的电子式为 。
(3)C组物质中有的能与水剧烈反应,该反应中氧化剂和还原剂物质的量之比为 。
(4)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用: 。
(5)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式: 。
(6)在密闭容器中,将E组中的混合物加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为 ;
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.S氧化性弱,与Fe反应生成FeS,A不符合题意;
B.Fe与水蒸气反应生成Fe3O4,其中铁元素既有+2价,又有+3价,B不符合题意;
C.Fe与稀硫酸反应生成FeSO4,C不符合题意;
D.Fe与氯气反应生成FeCl3,D符合题意;
故答案选D。
2.D
【详解】A.氯气与NaOH溶液反应,生成NaCl、NaClO和H2O:,A不正确;
B.少量通入溶液中,生成盐酸和硫酸钠,盐酸再与过量的Na2SO3反应,生成NaCl、NaHSO3,B不正确;
C.不能拆开,在其溶液中加入过量铁粉至溶液褪色,生成Fe2+、SCN-:,C不正确;
D.向含氯化铁的氯化镁溶液中加入氧化镁,MgO与Fe3+水解生成的H+反应,生成Mg2+等,从而促进Fe3+水解:,D正确;
故选D。
3.A
【详解】①标准状况下,11.2L以任意比例混合的氮气和氧气所含原子物质的量为,则原子数为NA,①正确;
②未给定标准状况,无法计算,②错误,
③溶液体积未知,无法计算,③错误;
④32gO2和O3混合气体含有原子物质的量为,则32gO2和O3混合气体含有原子数为2NA,④正确;
⑤标况下,水为液态,无法用气体摩尔体积计算,⑤错误;
⑥标准状况下,4.48LCl2通入水中,只有少量Cl2与水反应,无法计算反应转移的电子数,⑥错误;
⑦乙酸部分电离,1L0.1mol L-1的乙酸溶液中含H+的数量小于0.1NA,⑦错误;
⑧1molFe溶于过量硝酸,生成铁离子,转移电子数为3NA,⑧错误;
①④正确,故选A。
4.C
【详解】A.灼烧Fe(OH)3固体制取Fe2O3应该用坩埚,故A错误;
B.制备 Fe(OH)3胶体应该向沸水中滴加饱和氯化铁溶液,故B错误;
C.饱和食盐水可以除去 Cl2中的HCl,浓盐酸干燥Cl2,故C正确;
D.加热NaHCO3分解,除去Na2CO3粉末中混有的少量NaHCO3,可以用加热分解,故D错误;
故答案为C。
5.C
【详解】A.反应的化学方程式为:,故A错误;
B.实验中应该先加热湿棉花,产生水蒸气,再加热铁粉,故B错误;
C.加热时试管内铁粉红热,点燃肥皂泡,因混有空气可听到爆鸣声,故C正确;
D.实验结束后为防止倒吸应该先撤导管后熄灭酒精灯,故D错误。
故选C。
6.B
【详解】A.Fe3+遇KSCN变为红色,故A错误;
B.向某溶液中加入硝酸酸化的硝酸银溶液有白色沉淀出现,白色沉淀为AgCl,则原溶液含,故B正确;
C.向某无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,产生的无色气体可能为二氧化碳或二氧化硫,则溶液中可能含有、、、等,故C错误;
D.观察钾的焰色试验应该透过蓝色钴玻璃,故D错误;
答案选B。
7.A
【详解】A.磁性氧化铁是黑色晶体,不能用作红色油漆和涂料,故A错误;
B.漂白粉具有强氧化性,能杀菌消毒,可用于生活用水的消毒,故B正确;
C.小苏打是碳酸氢钠,碳酸氢钠能与盐酸反应生成氯化钠、二氧化碳、水,可用于中和过多胃酸,故C正确;
D.过氧化钠和二氧化碳反应生成碳酸钠和氧气,过氧化钠可用作呼吸面具供氧剂,故D正确;
选A。
8.D
【详解】A.铜单质与稀硫酸不发生反应,故A错误;
B.钠与水反应的离子方程式为:,故B错误;
C.方程式电荷不守恒,应为,故C错误;
D.醋酸为弱电解质,碳酸钙为难溶物,反应方程式为:,故D正确;
故答案为:D。
9.D
【详解】A. 金属单质与非金属单质反应:铁丝在氯气中燃烧生成氯化铁,故A不选;
B. 碱性氧化物与酸反应:三氧化二铁与盐酸反应生成氯化铁和水,故B不选;
C. 酸与碱发生中和反应:氢氧化铁与与盐酸反应生成氯化铁和水,故C不选;
D. 金属与酸反应:铁与盐酸反生成氯化亚铁和氢气,不能得到氯化铁,故D选;
故选D。
10.C
【详解】A.该反应不是置换反应,A项错误;
B.该反应不是复分解反应,B项错误;
C.NaH中氢显-1价,在反应中升高到0价,被氧化,C项正确;
D.在反应中生成1mol氢气,转移1mol电子,在标准状况下,生成11.2LH2,其物质的量为0.5mol,则转移电子的物质的量为0.5mol,D项错误;
故选C。
11.D
【详解】A.三价铁离子具有强的氧化性,能够氧化碘离子;氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A正确;
B.向NH4HCO3溶液中加入过量NaOH溶液并加热生成碳酸钠、氨气和水,离子方程式为,故B正确;
C.二氧化硫少量,氢离子与次氯酸根离子结合生成次氯酸;少量SO2通入NaClO溶液中,离子方程式为:,故C正确;
D.过氧化钠与水反应生成氢氧化钠和氧气。过氧化钠与足量水反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故D错误;
故选:D。
12.B
【详解】A.铁剑中部分铁生锈生成氧化铁,故铁剑中铁元素有化合态和游离态两种存在形式,A正确;
B.纯铝很软,人们日常生活中的铝制品是由金属铝合金制造的,B错误;
C.由镍、铁、碳和钴组成的镍钴合金耐高温、硬度大,可制造喷气式飞机的发动机叶片,故C正确;
D.Ti-Fe合金和La-Ni合金具有良好的储氢性能,都是优良的储氢合金,故D正确;
故选B。
13.D
【详解】A.往FeCl2溶液中加入Zn片,离子反应方程式为:Fe2++Zn=Fe+Zn2+,FeCl2溶液呈浅绿色、ZnCl2溶液呈无色,所以溶液由浅绿色变为无色,Fe2为氧化剂、Zn2+为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,Fe2+的氧化能力比Zn2+强,故A错误;
B.Cl2和HClO均能氧化KI生成碘单质,溶液变蓝色,故无法证明上述反应存在限度,故B错误;
C.将食品脱氧剂样品中的还原铁粉溶于盐酸,Fe3+能被Fe还原为Fe2+,滴加KSCN溶液,溶液不变红色,故C错误;
D.盐酸可排除亚硫酸根离子的干扰,再加氯化钡若生成白色沉淀为硫酸钡,则样品已经变质,故D正确;
故选:D。
14.B
【分析】矿渣主要成分为FeO、Cr2O3,加入纯碱、空气焙烧,已知焙烧后Cr元素以+6价形式存在,发生反应:2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2、4FeO+O22Fe2O3,水浸之后除去生成的氧化铁,滤液中加入Na2S2O3与Na2CrO4发生氧化还原反应生成Cr(OH)3,以此解答该题。
【详解】A.陶瓷坩埚成分为SiO2,高温下能与碳酸钠反应,因此“焙烧”不可以选择陶瓷坩埚作反应容器,故A错误;
B.矿渣主要成分为FeO、Cr2O3,加入纯碱、空气焙烧,4FeO+O22Fe2O3,水浸之后除去生成的氧化铁,滤渣的主要成分为Fe2O3,故B正确;
C.已知焙烧后Cr元素以+6价形式存在,发生反应:2Cr2O3+4Na2CO3+3O2 4Na2CrO4+4CO2,即滤液①中Cr元素的主要存在形式为,故C错误;
D.Na2S2O3与Na2CrO4发生氧化还原反应生成Cr(OH)3,硫元素化合价升高,被氧化为硫酸根,加入浓氨水调节pH,滤液②的主要成分为Na2SO4,故D错误;
故选:B。
15.(1)AD
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)3:2
(4) Fe HCl 2Fe2++Cl2=2Fe3++2Cl-
【分析】制造印刷电路板的废液中含有FeCl3、FeCl2、CuCl2,加过量的铁粉,把FeCl3还原为FeCl2,铁置换出CuCl2中的Cu,过滤,滤液②为FeCl2,滤渣③含有Fe、Cu,滤渣③加过量的盐酸溶解铁,过滤出Cu,滤液⑤为FeCl2,FeCl2溶液中通入氯气生成溶液。
【详解】(1)A.能与盐酸反应生成氯化铁和水,是碱性氧化物,故A正确;
B.铁与高温水蒸气的反应生成Fe3O4,故B错误;
C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化为Fe3O4,故C错误;
D.维生素C具有还原性,能防止Fe2+被氧化,硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果,故D正确;
选AD。
(2)制备氢氧化亚铁时,Fe(OH)2被氧气氧化为红褐色Fe(OH)3,由白色絮状沉淀最终转化为红褐色沉淀,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)(未配平),Fe元素化合价由+3升高为+6,Fe(NO3)3是还原剂,氯元素化合价由+1降低为-1,KClO是氧化剂,根据得失电子守恒,则该反应中氧化剂与还原剂的物质的量之比为3:2。
(4)加过量的铁粉,把FeCl3还原为FeCl2,铁置换出CuCl2中的Cu,所以①是Fe;滤渣③含有Fe、Cu,滤渣③加过量的盐酸溶解铁,④是HCl。通入⑥是FeCl2溶液中通入氯气生成,反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-。
16.(1) B 氧化 还原
(2)
(3) 、 取少许丙溶液于试管中,向试管中加入过量的溶液,振荡静置,向上层清液中滴加溶液,观察到有白色沉淀产生,溶液丙中含有
【详解】(1)①铁原子中铁元素为最低价态0价,只有还原性,铁离子中铁元素为最高价态+3价,只有氧化性,亚铁离子中铁元素为中间价态为+2价,既有氧化性又有还原性,故选B;
②由亚硝酸钠能将人体内的亚铁离子氧化为铁离子,说明反应中氮元素的化合价降低被还原,亚硝酸钠是反应的氧化剂,表现氧化性,故答案为:氧化;
③工业盐中毒后,可服用维生素C来缓解中毒症状说明维生素C具有还原性,能将铁离子还原为亚铁离子,反应中维生素C表现还原性,故答案为:还原;
(2)由方程式可知,反应中铁元素的化合价升高被氧化,氢氧化亚铁是反应的还原剂,故答案为:;
(3)实验Ⅰ:由题给流程可知,脱氧剂中加入过量稀硫酸,铁粉与稀硫酸反应生成硫酸亚铁和氢气,过滤得到活性炭固体和含有硫酸亚铁和氯化钠的溶液;
①由分析可知,溶液丙为硫酸亚铁和氯化钠混合溶液,溶液中含有的金属阳离子是钠离子和亚铁离子,故答案为:、;
②由分析可知,溶液丙为硫酸亚铁和氯化钠混合溶液,溶液中含有的硫酸根离子会干扰氯离子检验,检验溶液中氯离子时,应先加入过量的硝酸钡溶液,将溶液中的硫酸根离子转化为硫酸钡沉淀,排出硫酸根离子对氯离子检验的干扰,具体操作为取少许丙溶液于试管中,向试管中加入过量的硝酸钡溶液,振荡静置,向上层清液中滴加硝酸银溶液,观察到有白色沉淀产生,溶液丙中含有氯离子,故答案为:取少许丙溶液于试管中,向试管中加入过量的溶液,振荡静置,向上层清液中滴加溶液,观察到有白色沉淀产生,溶液丙中含有;
③由题给流程可知,反应①为活性炭与氧化铁高温条件下反应生成铁;有色溶液C与氢氧化钠溶液反应生成蓝色沉淀说明溶液C为含有铜离子的溶液、蓝色沉淀为氢氧化铜,则反应③为溶液中铜离子与氢氧根离子反应生成氢氧化铜沉淀;反应②为铁与溶液中铜离子发生置换反应生成铜和硫酸亚铁,反应的离子方程式为,反应中消耗1mol铁时,反应转移2mol电子,则反应消耗16.8g时,转移电子的数目为×2×NAmol—1=0.6NA,答案为:;0.6NA。
17.(1)B
(2) 锥形瓶 调节水准管高度,使其液面与量气管中液面相平 3.00
(3)0.95
(4)
(5)0.002
(6)203
【详解】(1)A. 室温下,氯气能溶于水,故A正确;
B. 氯气能与碱性物质反应,不能用碱石灰干燥氯气,故B错误;
C. 氯气难溶于饱和食盐水,可通过排饱和食盐水法收集少量氯气,故C正确;
D. 室温下,氯气和铁不反应,可通过加压使氯气液化而储存于钢瓶中,故D正确;
选B。
(2)①根据装置图,仪器a的名称为锥形瓶。
②在记录量气管读数时,应注意将装置冷却至室温;再调节水准管高度,使其液面与量气管中液面相平,保证量气管内气体的压强等于外界大气压;视线与量气管内凹液面相切,水平读数。
③取残余液10.0mL与足量的锌粒反应,最终量气管内收集到氢气体积367.5mL(已知此时气体摩尔体积为24.5L/mol),氢气的物质的量为 ,不与反应的盐酸的物质的量为0.03mol,剩余盐酸的浓度为 ,由此可知不与反应的盐酸临界浓度约为3.00mol/L。
(3)1gNaClO作消毒剂时得电子的物质的量为,1gCl2作消毒剂时得电子的物质的量为, NaClO的消毒效率是氯气的0.95倍。
(4)酸性:,次氯酸钠和二氧化碳反应生成碳酸氢钠和次氯酸,次氯酸分解为盐酸和氧气,反应方程式为、;
(5)含次氯酸钠的84消毒液物质的量浓度为,取1mL含次氯酸钠的84消毒液,加水稀释至100mL,根据稀释前后次氯酸钠的物质的量不变,则稀释后的溶液中次氯酸钠的物质的量浓度为。
(6)设生产1000kg该溶液需消耗氯气的质量为xkg。则反应消耗的氢氧化钠的质量为[(1000-x)×30%-1000×1%]kg=(290-0.3x)kg;
则
x=203kg。
18.(1)树状分类法
(2) SO2、NH3
(3)1:1
(4)焊接钢轨
(5)5SO2+2+2H2O=5+2Mn2++4H+
(6)Na2CO3
【分析】在物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、Cl2中,Na2O2、NaHCO3、SO2、NH3组成元素含有两种或两种以上,属于化合物;而Al、Fe、Na、Cl2的组成元素只有一种,属于单质。在Al、Fe、Na、Cl2中,Na、Cl2能够与水反应,其中Na与冷水剧烈反应。在Na2O2、NaHCO3、SO2、NH3中,Na2O2、NaHCO3是离子化合物,在熔融状态下能够导电;SO2、NH3由分子构成,在熔融状态下不能导电,在A组物质Fe、Na、Cl2,Al中,Cl2能够与Fe、Na、Al三种金属反应,在每一个反应中,Cl2得到电子表现氧化性,其中可以证明其具有强氧化性的是Cl2在与变价金属Fe反应时,使金属变为高价态形成FeCl3,该反应的化学反应方程式为:2Fe+3Cl22FeCl3;B组物质包括Na2O2、NaHCO3、SO2、NH3,其中Na2O2、NaHCO3都是离子化合物,在熔融状态下能够导电,属于E组电解质;而SO2、NH3都是由分子构成,在熔融状态下不能发生电离而导电,在水溶液中也不能因自身发生电离而导电,因此SO2、NH3都属于非电解质,属于F组物质。然后根据问题分析解答。
【详解】(1)把多种物质按照某一个标准进行分类,依次类推,这种分类方法分类的物质就像大树一样,这种分类方法叫做树状分类法;
(2)B组中SO2、NH3属于非电解质,其中NH3可以作制冷剂。在NH3中,N原子与3个H原子形成3个共价键,使分子中各个原子都达到最外层2个或8个电子的稳定结构,其电子式为:;
(3)C组物质中Na与冷水会发生剧烈反应,化学方程式为:2Na+2H2O=2NaOH+H2↑,在该反应中Na为还原剂,H2O为氧化性,则该反应中氧化剂和还原剂物质的量之比为1:1;
(4)根据上述分析可知A组物质包括Fe、Na、Cl2,Al,其中Cl2、Na能与冷水反应,属于C组物质, Fe、Al属于D组物质,Al能够与Fe的化合物如Fe2O3在高温下发生铝热反应制取Fe,反应方程式为:2Al+Fe2O3Al2O3+2Fe,该反应的用途如可用于焊接钢轨;
(5)F组中的酸性氧化物是SO2,该物质具有强的还原性,能够被酸性KMnO4溶液氧化为H2SO4,而使溶液紫色褪色,该反应的离子方程式为:5SO2+2+2H2O=5+2Mn2++4H+;
(6)根据上述分析可知:E组物质为Na2O2、NaHCO3,在密闭容器中加热上述混合物发生反应,若混合物中金属原子与氧原子的物质的量之比为1:2,假设Na2O2、NaHCO3的物质的量分别是a、b,则,解得b=2a,即n(NaHCO3)=2n(Na2O2)。若Na2O2为1 mol,则NaHCO3为2 mol,NaHCO3受热发生分解反应:2NaHCO3Na2CO3+CO2↑+H2O,2 mol NaHCO3分解产生1 mol Na2CO3、1 mol CO2、1 mol H2O,然后发生反应:2Na2O2+2CO2=2Na2CO3+O2,1 mol CO2恰好反应消耗1 mol Na2O2,Na2O2反应完全,不再发生反应:2Na2O2+2H2O=4NaOH+O2↑,故反应完全后剩余固体是Na2CO3;
答案第1页,共2页
答案第1页,共2页
