河北省保定市1+3联考2023-2024学年高一上学期12月联考化学试题(含答案)
文档属性
| 名称 | 河北省保定市1+3联考2023-2024学年高一上学期12月联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 653.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-26 21:44:54 | ||
图片预览



文档简介
保定市1+3联考2023-2024学年高一上学期12月联考
化学试题
(时间:75分钟,满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—12 O—16 Mg—24 S—32 Fe—56
一、单项选择题:本题包含14小题,每小题3分,共42分。每小题给出的4个选项中只有一项是符合题目要求的。
1.下列与化学有关的文献或诗文,理解错误的是( )
A.《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是屠呦呦
B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指分液
C.《浪淘沙》中记载:“日照澄洲江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来。”雾是气溶胶,分散质粒子直径范围是1-100nm
D.《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。“熬之则成胆矾”是浓缩结晶过程
2.下列叙述或化学用语正确的是( )
A.和互为同位素 B.的电子式:
C.HClO的结构式: D.甲烷分子的空间填充模型为
3.化学与生产、生活、科技及环境等密切相关。下列说法正确的是( )
A.抗击新冠疫情时,84消毒液、二氧化氯泡腾片可作为环境消毒剂
B.侯氏制碱法应在饱和食盐水中先通入二氧化碳再通入氨气
C.工业上常用电解熔融氯化钠和熔融氧化镁的方法制备金属钠和镁
D.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
4.设阿伏加德罗常数的数值为,下列说法正确的是( )
A.常温下,5.6g铁片投入足量的浓硫酸中,铁失去的电子数为
B.常温下,0.1mol/L氨水中浓度为0.1mol/L
C.100g质量分数为46%的乙醇溶液中,含键的数目为
D.标准状况下,铝和氢氧化钠溶液反应生成转移的电子数为
5.在指定的溶液中,下列各组离子一定能大量共存的是( )
A.无色透明溶液中:、、、
B.强酸性溶液:、、、
C.加入紫色石蕊显蓝色的溶液中:、、、
D.与Al反应产生的溶液中:、、、
6.实验室制取下列气体,所选的反应试剂、制备装置与收集方法合理的是( )
选项 气体 反应试剂 制备装置 收集方法
A 石灰石、稀硫酸 b e
B 、浓盐酸 b d
C 浓盐酸、 b d
D a e
A.A B.B C.C D.D
7.下列反应的离子方程式书写错误的是( )
A.过氧化钠与水反应:
B.加碘盐与药物碘化钾片尽量不要同时服用:
C.向氯化镁溶液中加入澄清石灰水沉镁:
D.将等物质的量浓度的和溶液以体积比1:2混合:
8.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.漂白粉
9.纸电池像纸一样轻薄柔软,在制作方法和应用范围上与传统电池相比均有很大突破。如图为某种纸电池的结构示意图。电解液为氯化钠溶液,总反应为:,下列有关纸电池说法错误的是( )
A.a、b电极不一定都使用金属材料
B.电流从a电极流向b电极
C.该电池正极反应式为:
D.当2.4gMg发生反应时,流经溶液的电子数为
10.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述正确的是( )
A.两步反应均为放热反应 B.A与C的能量差为
C.A→B的反应一定需要加热 D.三种物质中C最稳定
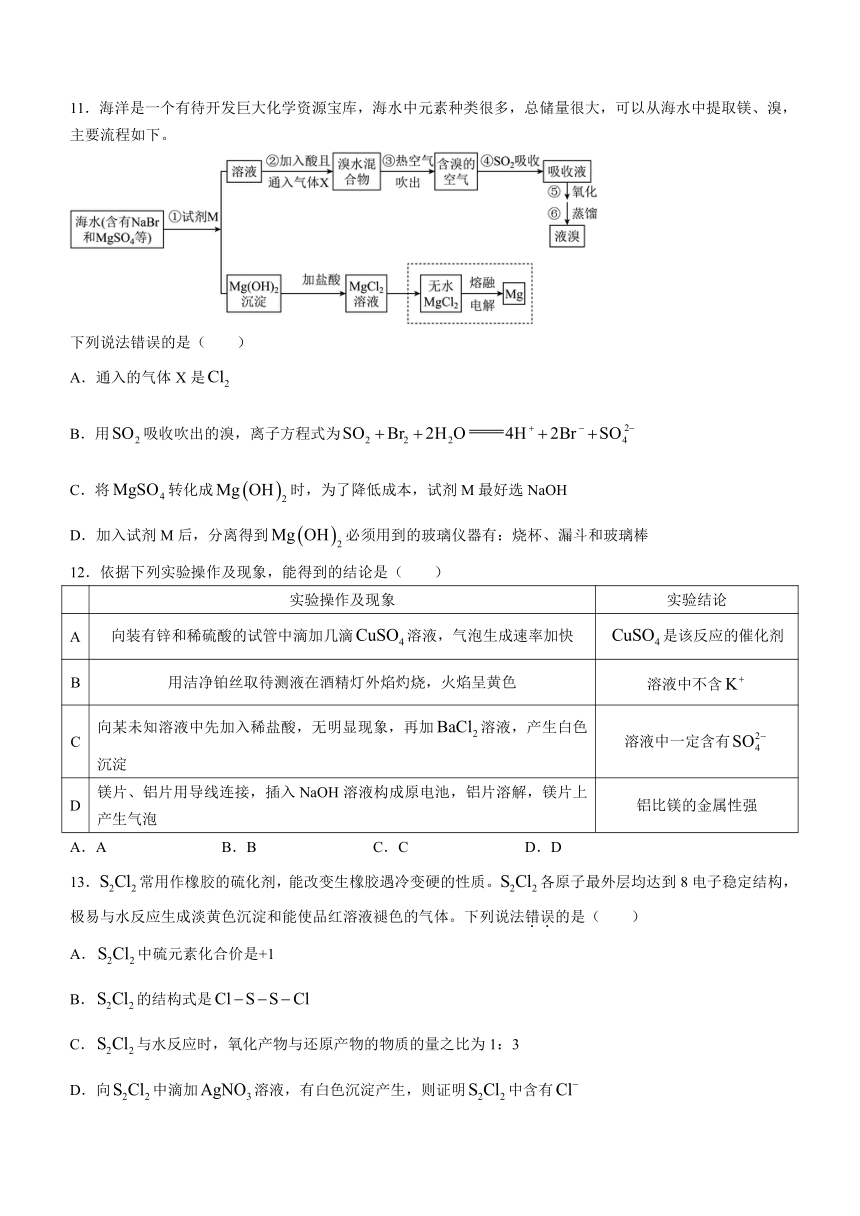
11.海洋是一个有待开发巨大化学资源宝库,海水中元素种类很多,总储量很大,可以从海水中提取镁、溴,主要流程如下。
下列说法错误的是( )
A.通入的气体X是
B.用吸收吹出的溴,离子方程式为
C.将转化成时,为了降低成本,试剂M最好选NaOH
D.加入试剂M后,分离得到必须用到的玻璃仪器有:烧杯、漏斗和玻璃棒
12.依据下列实验操作及现象,能得到的结论是( )
实验操作及现象 实验结论
A 向装有锌和稀硫酸的试管中滴加几滴溶液,气泡生成速率加快 是该反应的催化剂
B 用洁净铂丝取待测液在酒精灯外焰灼烧,火焰呈黄色 溶液中不含
C 向某未知溶液中先加入稀盐酸,无明显现象,再加溶液,产生白色沉淀 溶液中一定含有
D 镁片、铝片用导线连接,插入NaOH溶液构成原电池,铝片溶解,镁片上产生气泡 铝比镁的金属性强
A.A B.B C.C D.D
13.常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法错误的是( )
A.中硫元素化合价是+1
B.的结构式是
C.与水反应时,氧化产物与还原产物的物质的量之比为1:3
D.向中滴加溶液,有白色沉淀产生,则证明中含有
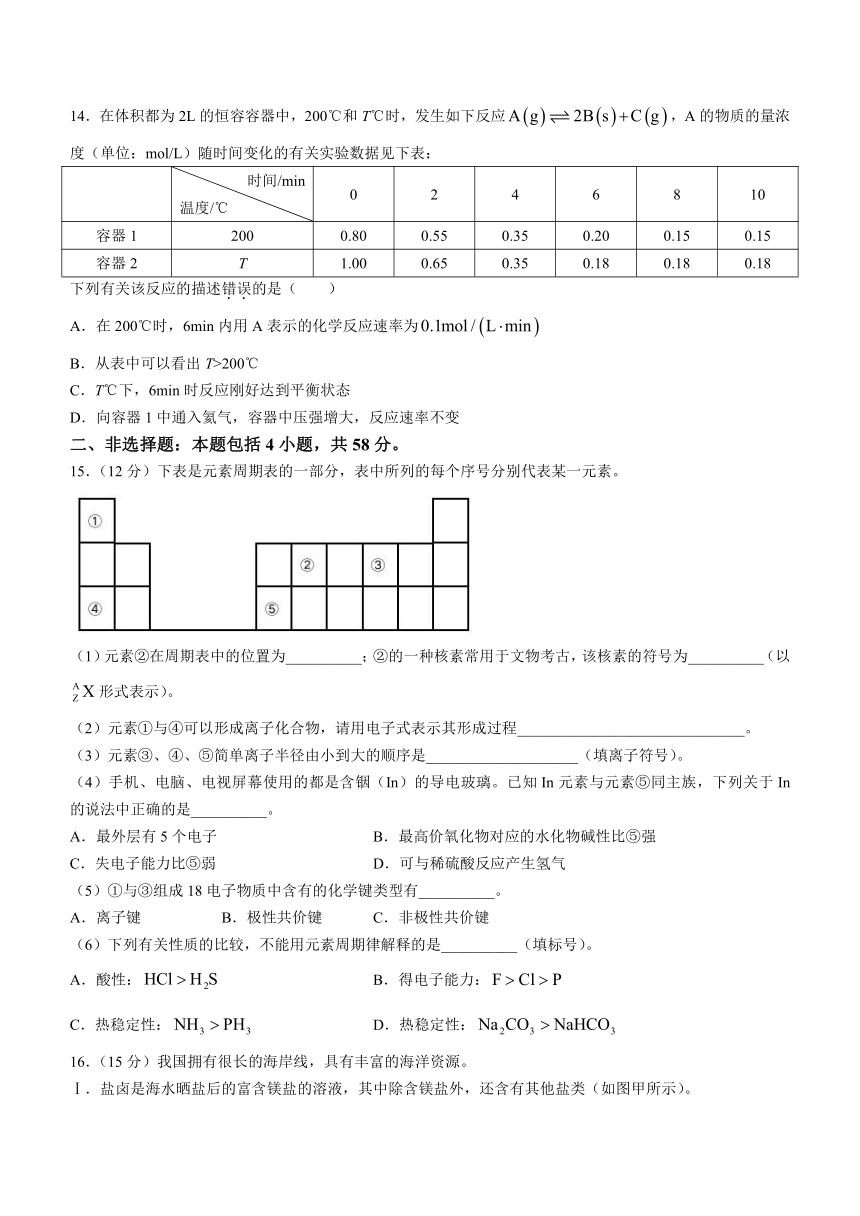
14.在体积都为2L的恒容容器中,200℃和T℃时,发生如下反应,A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
时间/min 温度/℃ 0 2 4 6 8 10
容器1 200 0.80 0.55 0.35 0.20 0.15 0.15
容器2 T 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述错误的是( )
A.在200℃时,6min内用A表示的化学反应速率为
B.从表中可以看出T>200℃
C.T℃下,6min时反应刚好达到平衡状态
D.向容器1中通入氦气,容器中压强增大,反应速率不变
二、非选择题:本题包括4小题,共58分。
15.(12分)下表是元素周期表的一部分,表中所列的每个序号分别代表某一元素。
(1)元素②在周期表中的位置为__________;②的一种核素常用于文物考古,该核素的符号为__________(以形式表示)。
(2)元素①与④可以形成离子化合物,请用电子式表示其形成过程______________________________。
(3)元素③、④、⑤简单离子半径由小到大的顺序是____________________(填离子符号)。
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是__________。
A.最外层有5个电子 B.最高价氧化物对应的水化物碱性比⑤强
C.失电子能力比⑤弱 D.可与稀硫酸反应产生氢气
(5)①与③组成18电子物质中含有的化学键类型有__________。
A.离子键 B.极性共价键 C.非极性共价键
(6)下列有关性质的比较,不能用元素周期律解释的是__________(填标号)。
A.酸性: B.得电子能力:
C.热稳定性: D.热稳定性:
16.(15分)我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
甲 乙
(1)根据图甲所示,写出盐卤中含量最多的盐为__________。(填化学式)
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到以上,根据溶解度曲线,首先析出的晶体应是__________。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
粗盐的提纯应选择图__________(填字母,下同)装置,若实验中为了除去粗盐中的、、等杂质离子加入试剂的顺序可以是__________。
A.NaOH、、、HCl B.NaOH、、、HCl
C.、、NaOH、HCl D.、NaOH、、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。
(4)实验步骤①会用到下列仪器中的__________(填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中的存在,______________________________。
(6)“提取碘”存在以下两种方案。
①方案乙中“操作X”的名称是__________。
②该流程可循环利用的物质是__________。
③采用方案乙得到纯碘的产率较低,原因是______________________________。
17.(15分)硫酸是十分重要的化工原料。工业上用接触法制备硫酸的流程如图:
请回答下列问题:
(1)“焙烧”前,黄铁矿要粉碎过筛,其目的是______________________________。
(2)黄铁矿主要成的电子式为__________;焙烧时发生反应的化学方程式为______________________________。
(3)用98.3%的浓硫酸吸收的目的是______________________________。
(4)工业制硫酸的尾气中含有一定量,处理尾气的一种方法的流程如下所示:
尾气(含)产品
①“产品”的化学式为__________。
②能否将第一步中的浓苛性钠溶液换成同温度下饱和溶液直接制得产品,其原因是______________________________。
(5)为测定尾气中的含量,工作人员将尾气样品经过管道通入密闭容器中的100mL0.2mol/L的酸性高锰酸钾溶液,已知在反应中被还原成。
①写出密闭容器中反应的离子方程式______________________________。
②若管中尾气流量为VL/min,经过tmin溶液恰好褪色,假定尾气中的可被充分吸收,则该尾气中的含量为__________g/L。
18.(16分)现代社会中,人类的一切活动都离不开能量。氢能是一种极具发展潜力的清洁能源。
Ⅰ.已知热化学方程式: (太阳光分解水制氢气)
(1)反应中主要能量转化形式为__________能转化为__________能。
(2)若在反应中使用催化剂,__________。(选填“增大”“减小”或“不变”)
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:。一定温度下,向体积为1L的恒容密闭容器中充入和,反应过程中测得的浓度与反应时间的关系如下表所示:
时间/s 0 1 2 3 4 5
0.0 5.0 9.0 12.0 14.0 15.0
(3)101KPa时,气体完全燃烧生成液态水和气体,放出890.3KJ的热量,反应的热化学方程式为________________________________________。
(4)①0~4s时间段内用表示该反应速率__________,反应到5s时,的转化率为__________。
②下列能判断该反应已经达到化学平衡状态的是__________。(填字母)
A.的浓度不再变化
B.生成的同时生成
C.容器内气体的密度不再发生变化
(5)燃料电池如图2、图3所示,放电时,氧化产物依次为、。
图2 图3
①图2中Pt极为__________(填“正”或“负”)极。
②若消耗等物质量的,则图2、图3装置中通过外电路的电子数之比为__________。
保定市1+3联考2023-2024学年高一上学期12月联考
化学试题参考答案
一、单项选择题:本题包含14小题,每小题3分,共42分。每小题给出的4个选项中只有一项是符合题目要求的。
1.B 2.D 3.A 4.D
5.C 6.C 7.C 8.D
9.D 10.D 11.C 12.C
13.D 14.C
二、非选择题:本题包括4小题,共58分。
15.(12分)
【答案】(1)第2周期ⅣA族(1分);(1分)
(2)(2分)
(3)、、(2分)
(4)BD(2分)
(5)BC(2分)
(6)AD(2分)
16.(15分)
【答案】(1)NaCl(1分)(2)(2分)
(3)①C(1分)②BD(2分)
(4)acd(2分)
(5)通过焰色试验,透过蓝色钴玻璃观察到紫色火焰,证明含K (2分)
(6)①蒸馏(1分)②(2分)③碘易升华,加热造成碘损失(2分)
17.(15分)
【答案】(1)增大固体与气体的接触面积,提高反应速率(2分)
(2)(2分);(2分)
(3)防止形成酸雾(2分)
(4)①(1分)②不能,氢氧化钙溶解度小,导致吸收不完全(2分)
(5)①(2分)②(2分)
18.(16分)
【答案】(1)太阳(1分);化学(1分)
(2)不变(2分)(3) (2分)
(4)①(2分);0.15%(2分)②A(2分)
(5)①正(2分)②1:1(2分)
化学试题
(时间:75分钟,满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、班级和考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H—1 C—12 O—16 Mg—24 S—32 Fe—56
一、单项选择题:本题包含14小题,每小题3分,共42分。每小题给出的4个选项中只有一项是符合题目要求的。
1.下列与化学有关的文献或诗文,理解错误的是( )
A.《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是屠呦呦
B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指分液
C.《浪淘沙》中记载:“日照澄洲江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来。”雾是气溶胶,分散质粒子直径范围是1-100nm
D.《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。“熬之则成胆矾”是浓缩结晶过程
2.下列叙述或化学用语正确的是( )
A.和互为同位素 B.的电子式:
C.HClO的结构式: D.甲烷分子的空间填充模型为
3.化学与生产、生活、科技及环境等密切相关。下列说法正确的是( )
A.抗击新冠疫情时,84消毒液、二氧化氯泡腾片可作为环境消毒剂
B.侯氏制碱法应在饱和食盐水中先通入二氧化碳再通入氨气
C.工业上常用电解熔融氯化钠和熔融氧化镁的方法制备金属钠和镁
D.食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
4.设阿伏加德罗常数的数值为,下列说法正确的是( )
A.常温下,5.6g铁片投入足量的浓硫酸中,铁失去的电子数为
B.常温下,0.1mol/L氨水中浓度为0.1mol/L
C.100g质量分数为46%的乙醇溶液中,含键的数目为
D.标准状况下,铝和氢氧化钠溶液反应生成转移的电子数为
5.在指定的溶液中,下列各组离子一定能大量共存的是( )
A.无色透明溶液中:、、、
B.强酸性溶液:、、、
C.加入紫色石蕊显蓝色的溶液中:、、、
D.与Al反应产生的溶液中:、、、
6.实验室制取下列气体,所选的反应试剂、制备装置与收集方法合理的是( )
选项 气体 反应试剂 制备装置 收集方法
A 石灰石、稀硫酸 b e
B 、浓盐酸 b d
C 浓盐酸、 b d
D a e
A.A B.B C.C D.D
7.下列反应的离子方程式书写错误的是( )
A.过氧化钠与水反应:
B.加碘盐与药物碘化钾片尽量不要同时服用:
C.向氯化镁溶液中加入澄清石灰水沉镁:
D.将等物质的量浓度的和溶液以体积比1:2混合:
8.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
B.
C.
D.漂白粉
9.纸电池像纸一样轻薄柔软,在制作方法和应用范围上与传统电池相比均有很大突破。如图为某种纸电池的结构示意图。电解液为氯化钠溶液,总反应为:,下列有关纸电池说法错误的是( )
A.a、b电极不一定都使用金属材料
B.电流从a电极流向b电极
C.该电池正极反应式为:
D.当2.4gMg发生反应时,流经溶液的电子数为
10.某反应由两步反应A→B→C完成,它的反应能量变化曲线如图所示。下列叙述正确的是( )
A.两步反应均为放热反应 B.A与C的能量差为
C.A→B的反应一定需要加热 D.三种物质中C最稳定
11.海洋是一个有待开发巨大化学资源宝库,海水中元素种类很多,总储量很大,可以从海水中提取镁、溴,主要流程如下。
下列说法错误的是( )
A.通入的气体X是
B.用吸收吹出的溴,离子方程式为
C.将转化成时,为了降低成本,试剂M最好选NaOH
D.加入试剂M后,分离得到必须用到的玻璃仪器有:烧杯、漏斗和玻璃棒
12.依据下列实验操作及现象,能得到的结论是( )
实验操作及现象 实验结论
A 向装有锌和稀硫酸的试管中滴加几滴溶液,气泡生成速率加快 是该反应的催化剂
B 用洁净铂丝取待测液在酒精灯外焰灼烧,火焰呈黄色 溶液中不含
C 向某未知溶液中先加入稀盐酸,无明显现象,再加溶液,产生白色沉淀 溶液中一定含有
D 镁片、铝片用导线连接,插入NaOH溶液构成原电池,铝片溶解,镁片上产生气泡 铝比镁的金属性强
A.A B.B C.C D.D
13.常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。各原子最外层均达到8电子稳定结构,极易与水反应生成淡黄色沉淀和能使品红溶液褪色的气体。下列说法错误的是( )
A.中硫元素化合价是+1
B.的结构式是
C.与水反应时,氧化产物与还原产物的物质的量之比为1:3
D.向中滴加溶液,有白色沉淀产生,则证明中含有
14.在体积都为2L的恒容容器中,200℃和T℃时,发生如下反应,A的物质的量浓度(单位:mol/L)随时间变化的有关实验数据见下表:
时间/min 温度/℃ 0 2 4 6 8 10
容器1 200 0.80 0.55 0.35 0.20 0.15 0.15
容器2 T 1.00 0.65 0.35 0.18 0.18 0.18
下列有关该反应的描述错误的是( )
A.在200℃时,6min内用A表示的化学反应速率为
B.从表中可以看出T>200℃
C.T℃下,6min时反应刚好达到平衡状态
D.向容器1中通入氦气,容器中压强增大,反应速率不变
二、非选择题:本题包括4小题,共58分。
15.(12分)下表是元素周期表的一部分,表中所列的每个序号分别代表某一元素。
(1)元素②在周期表中的位置为__________;②的一种核素常用于文物考古,该核素的符号为__________(以形式表示)。
(2)元素①与④可以形成离子化合物,请用电子式表示其形成过程______________________________。
(3)元素③、④、⑤简单离子半径由小到大的顺序是____________________(填离子符号)。
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是__________。
A.最外层有5个电子 B.最高价氧化物对应的水化物碱性比⑤强
C.失电子能力比⑤弱 D.可与稀硫酸反应产生氢气
(5)①与③组成18电子物质中含有的化学键类型有__________。
A.离子键 B.极性共价键 C.非极性共价键
(6)下列有关性质的比较,不能用元素周期律解释的是__________(填标号)。
A.酸性: B.得电子能力:
C.热稳定性: D.热稳定性:
16.(15分)我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
甲 乙
(1)根据图甲所示,写出盐卤中含量最多的盐为__________。(填化学式)
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到以上,根据溶解度曲线,首先析出的晶体应是__________。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
粗盐的提纯应选择图__________(填字母,下同)装置,若实验中为了除去粗盐中的、、等杂质离子加入试剂的顺序可以是__________。
A.NaOH、、、HCl B.NaOH、、、HCl
C.、、NaOH、HCl D.、NaOH、、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。
(4)实验步骤①会用到下列仪器中的__________(填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中的存在,______________________________。
(6)“提取碘”存在以下两种方案。
①方案乙中“操作X”的名称是__________。
②该流程可循环利用的物质是__________。
③采用方案乙得到纯碘的产率较低,原因是______________________________。
17.(15分)硫酸是十分重要的化工原料。工业上用接触法制备硫酸的流程如图:
请回答下列问题:
(1)“焙烧”前,黄铁矿要粉碎过筛,其目的是______________________________。
(2)黄铁矿主要成的电子式为__________;焙烧时发生反应的化学方程式为______________________________。
(3)用98.3%的浓硫酸吸收的目的是______________________________。
(4)工业制硫酸的尾气中含有一定量,处理尾气的一种方法的流程如下所示:
尾气(含)产品
①“产品”的化学式为__________。
②能否将第一步中的浓苛性钠溶液换成同温度下饱和溶液直接制得产品,其原因是______________________________。
(5)为测定尾气中的含量,工作人员将尾气样品经过管道通入密闭容器中的100mL0.2mol/L的酸性高锰酸钾溶液,已知在反应中被还原成。
①写出密闭容器中反应的离子方程式______________________________。
②若管中尾气流量为VL/min,经过tmin溶液恰好褪色,假定尾气中的可被充分吸收,则该尾气中的含量为__________g/L。
18.(16分)现代社会中,人类的一切活动都离不开能量。氢能是一种极具发展潜力的清洁能源。
Ⅰ.已知热化学方程式: (太阳光分解水制氢气)
(1)反应中主要能量转化形式为__________能转化为__________能。
(2)若在反应中使用催化剂,__________。(选填“增大”“减小”或“不变”)
Ⅱ.甲烷、水蒸气催化重整是制备高纯氢的方法之一,反应为:。一定温度下,向体积为1L的恒容密闭容器中充入和,反应过程中测得的浓度与反应时间的关系如下表所示:
时间/s 0 1 2 3 4 5
0.0 5.0 9.0 12.0 14.0 15.0
(3)101KPa时,气体完全燃烧生成液态水和气体,放出890.3KJ的热量,反应的热化学方程式为________________________________________。
(4)①0~4s时间段内用表示该反应速率__________,反应到5s时,的转化率为__________。
②下列能判断该反应已经达到化学平衡状态的是__________。(填字母)
A.的浓度不再变化
B.生成的同时生成
C.容器内气体的密度不再发生变化
(5)燃料电池如图2、图3所示,放电时,氧化产物依次为、。
图2 图3
①图2中Pt极为__________(填“正”或“负”)极。
②若消耗等物质量的,则图2、图3装置中通过外电路的电子数之比为__________。
保定市1+3联考2023-2024学年高一上学期12月联考
化学试题参考答案
一、单项选择题:本题包含14小题,每小题3分,共42分。每小题给出的4个选项中只有一项是符合题目要求的。
1.B 2.D 3.A 4.D
5.C 6.C 7.C 8.D
9.D 10.D 11.C 12.C
13.D 14.C
二、非选择题:本题包括4小题,共58分。
15.(12分)
【答案】(1)第2周期ⅣA族(1分);(1分)
(2)(2分)
(3)、、(2分)
(4)BD(2分)
(5)BC(2分)
(6)AD(2分)
16.(15分)
【答案】(1)NaCl(1分)(2)(2分)
(3)①C(1分)②BD(2分)
(4)acd(2分)
(5)通过焰色试验,透过蓝色钴玻璃观察到紫色火焰,证明含K (2分)
(6)①蒸馏(1分)②(2分)③碘易升华,加热造成碘损失(2分)
17.(15分)
【答案】(1)增大固体与气体的接触面积,提高反应速率(2分)
(2)(2分);(2分)
(3)防止形成酸雾(2分)
(4)①(1分)②不能,氢氧化钙溶解度小,导致吸收不完全(2分)
(5)①(2分)②(2分)
18.(16分)
【答案】(1)太阳(1分);化学(1分)
(2)不变(2分)(3) (2分)
(4)①(2分);0.15%(2分)②A(2分)
(5)①正(2分)②1:1(2分)
同课章节目录
