第四章化学反应与电能(单元同步测试题)(含解析)——2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章化学反应与电能(单元同步测试题)(含解析)——2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 972.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 09:35:08 | ||
图片预览


文档简介
第四章 化学反应与电能 单元同步测试题
一、单选题
1.锂离子电池充、放电电池总反应:LixC6+Li1-xCoO2LiCoO2+C6,该电池充、放电的工作示意图如图。下列有关说法不正确的是
A.该电池具有较高的比能量
B.负极的反应式:LixC6-xe-=xLi++C6
C.放电时,Li+从石墨晶体中脱嵌移向正极
D.充电时,若转移1 mol e-,石墨电极将增重7x g
2.电解食盐水间接氧化法去除工业废水中氨氮的原理如图所示,通过电解氨氮溶液(含有少量的NaCl),将转化为(无逸出),下列说法正确的是
A.M为负极 B.N极附近pH值不变化
C. D.电解后上升
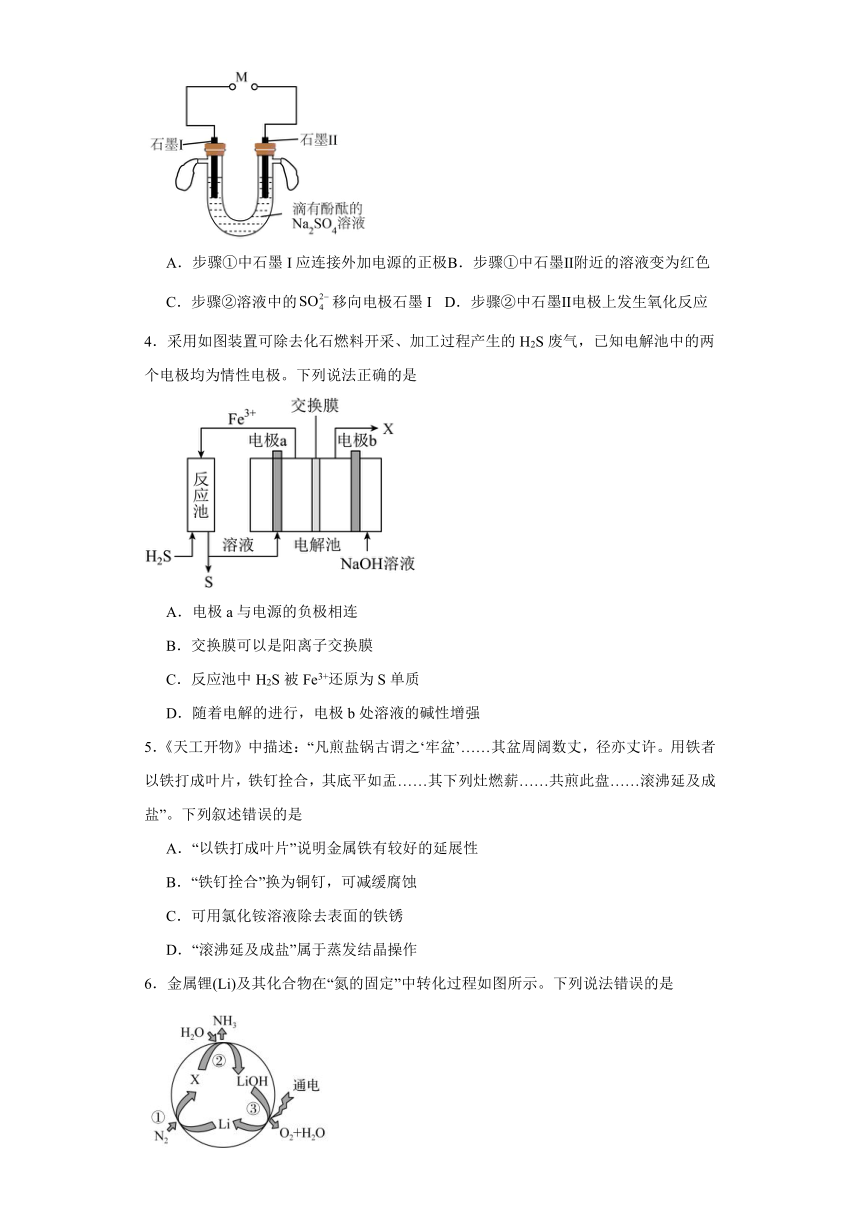
3.某兴趣小组设计并制作了一个简单的燃料电池,步骤如下:①按照如图装置组装仪器,U形管中注入滴有酚酞、1mol/L的溶液,在M处连接一个外加电源。一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍。②2分钟后,将连接在M处的外加电源换作一个音乐盒,立即听到优美的音乐声响起,表明该小组的燃料电池制作成功。下列对该操作过程的叙述错误的是
A.步骤①中石墨I应连接外加电源的正极 B.步骤①中石墨Ⅱ附近的溶液变为红色
C.步骤②溶液中的移向电极石墨I D.步骤②中石墨Ⅱ电极上发生氧化反应
4.采用如图装置可除去化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为情性电极。下列说法正确的是
A.电极a与电源的负极相连
B.交换膜可以是阳离子交换膜
C.反应池中H2S被Fe3+还原为S单质
D.随着电解的进行,电极b处溶液的碱性增强
5.《天工开物》中描述:“凡煎盐锅古谓之‘牢盆’……其盆周阔数丈,径亦丈许。用铁者以铁打成叶片,铁钉拴合,其底平如盂……其下列灶燃薪……共煎此盘……滚沸延及成盐”。下列叙述错误的是
A.“以铁打成叶片”说明金属铁有较好的延展性
B.“铁钉拴合”换为铜钉,可减缓腐蚀
C.可用氯化铵溶液除去表面的铁锈
D.“滚沸延及成盐”属于蒸发结晶操作
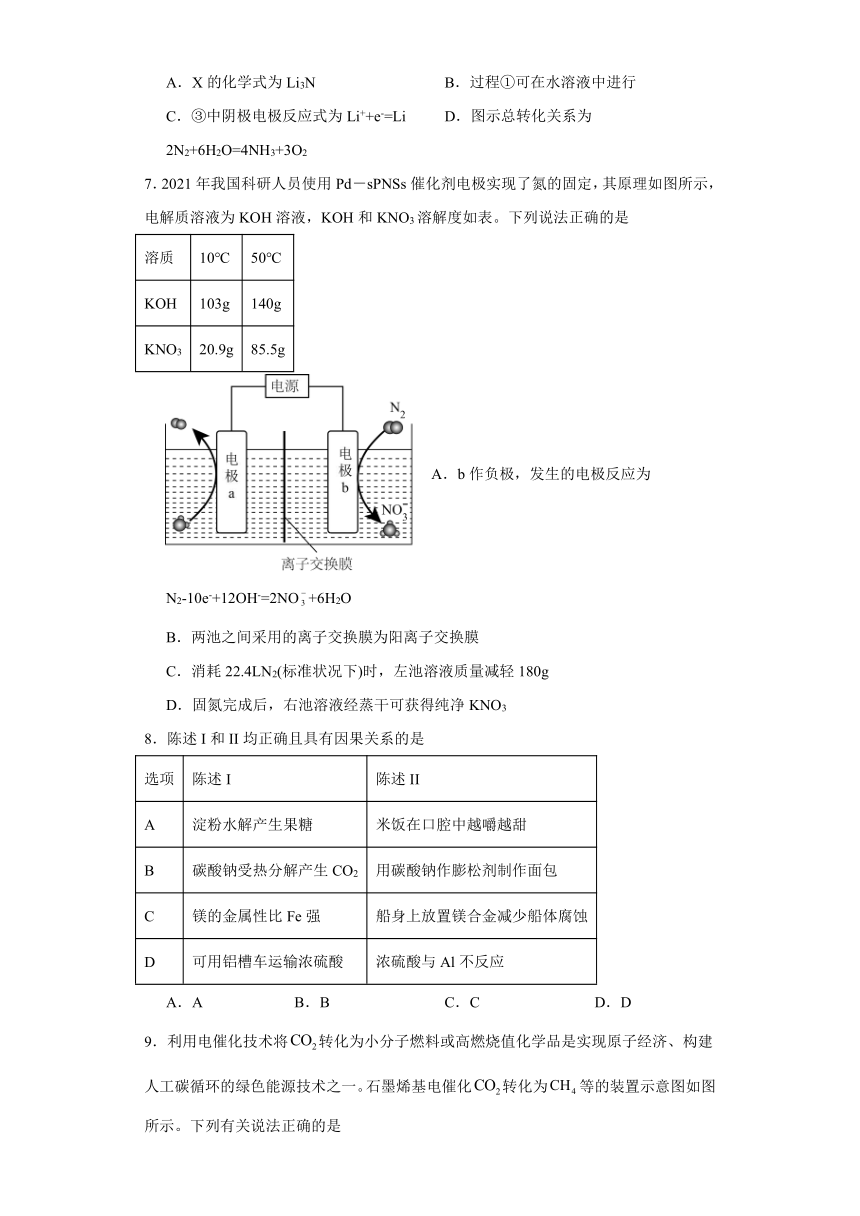
6.金属锂(Li)及其化合物在“氮的固定”中转化过程如图所示。下列说法错误的是
A.X的化学式为Li3N B.过程①可在水溶液中进行
C.③中阴极电极反应式为Li++e-=Li D.图示总转化关系为2N2+6H2O=4NH3+3O2
7.2021年我国科研人员使用Pd-sPNSs催化剂电极实现了氮的固定,其原理如图所示,电解质溶液为KOH溶液,KOH和KNO3溶解度如表。下列说法正确的是
溶质 10℃ 50℃
KOH 103g 140g
KNO3 20.9g 85.5g
A.b作负极,发生的电极反应为N2-10e-+12OH-=2NO+6H2O
B.两池之间采用的离子交换膜为阳离子交换膜
C.消耗22.4LN2(标准状况下)时,左池溶液质量减轻180g
D.固氮完成后,右池溶液经蒸干可获得纯净KNO3
8.陈述I和II均正确且具有因果关系的是
选项 陈述I 陈述II
A 淀粉水解产生果糖 米饭在口腔中越嚼越甜
B 碳酸钠受热分解产生CO2 用碳酸钠作膨松剂制作面包
C 镁的金属性比Fe强 船身上放置镁合金减少船体腐蚀
D 可用铝槽车运输浓硫酸 浓硫酸与Al不反应
A.A B.B C.C D.D
9.利用电催化技术将转化为小分子燃料或高燃烧值化学品是实现原子经济、构建人工碳循环的绿色能源技术之一。石墨烯基电催化转化为等的装置示意图如图所示。下列有关说法正确的是
A.在石墨烯基b电极发生氧化反应
B.电催化过程溶液中的由Ⅱ室向I室迁移
C.消耗1mol转移8mol电子
D.a电极的电极反应式为
10.锂﹣空气电池是一种可充放电池,电池反应为2Li+O2=Li2O2(已知Li2O2是固体),某锂—空气电池的构造原理图如下,下列说法正确的是
A.电解液可选用强电解质的水溶液
B.放电时正极的电极反应式为O2+2Li++2e—=Li2O2
C.每当有1.4gLi参与放电,电路中转移电子0.1mol
D.示意图中,电子流向从含催化剂的多孔电极→锂
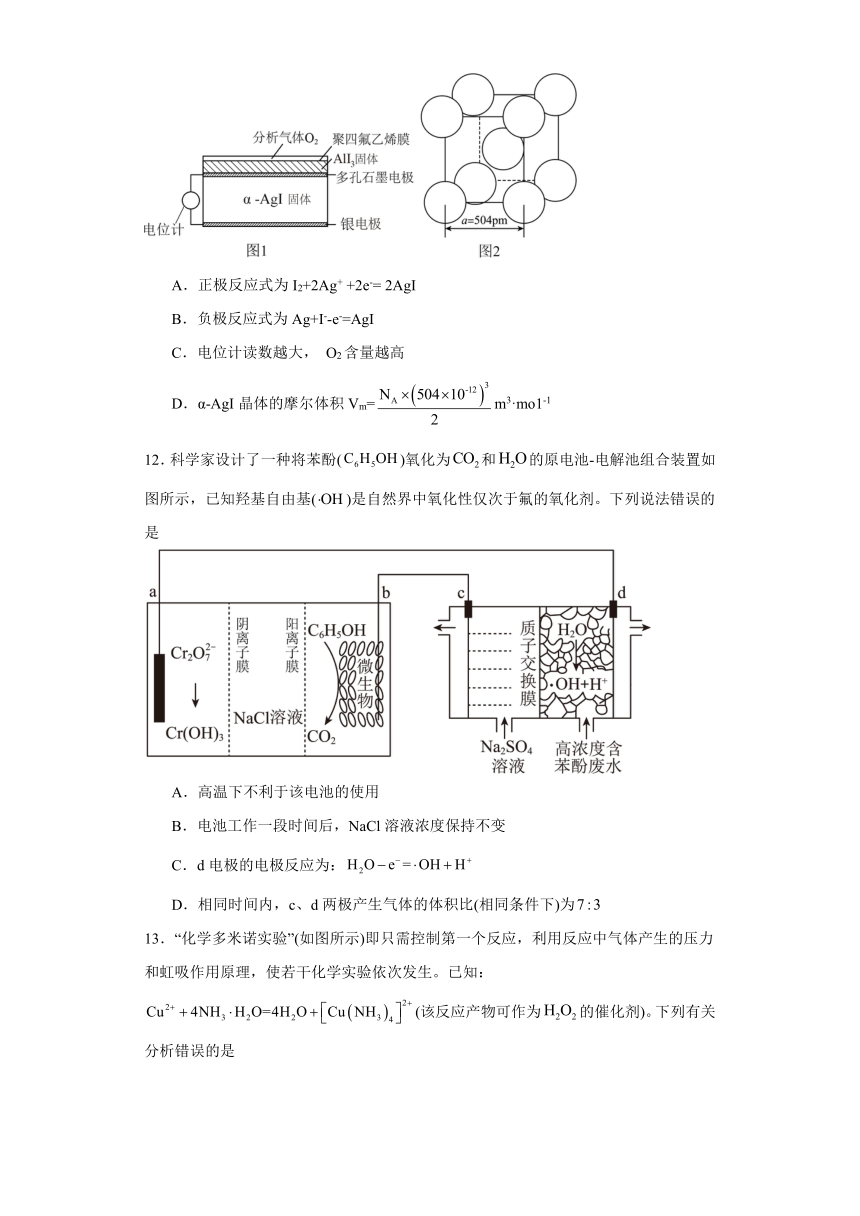
11.氧气传感器40XV主要用于工业安全方面测量环境中氧气气体浓度,量程符合0~ 30%范围内使用。一种测定O2含量的气体传感器如图1所示。传感器工作时,仅Ag+能在 α -AgI晶体里迁移,O2透过聚四氟乙烯进入传感器,AgI 的物质的量增加。α-AgI晶体中I-离子作体心立方堆积(如图2所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。下列有关说法不正确的是
A.正极反应式为I2+2Ag+ +2e-= 2AgI
B.负极反应式为Ag+I--e-=AgI
C.电位计读数越大, O2含量越高
D.α-AgI晶体的摩尔体积Vm=m3·mo1-1
12.科学家设计了一种将苯酚()氧化为和的原电池-电解池组合装置如图所示,已知羟基自由基()是自然界中氧化性仅次于氟的氧化剂。下列说法错误的是
A.高温下不利于该电池的使用
B.电池工作一段时间后,NaCl溶液浓度保持不变
C.d电极的电极反应为:
D.相同时间内,c、d两极产生气体的体积比(相同条件下)为
13.“化学多米诺实验”(如图所示)即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。已知:(该反应产物可作为的催化剂)。下列有关分析错误的是
A.该实验成功的重要条件是整套装置气密性良好
B.H中出现浅黄色浑浊,证明O非金属性强于S
C.中存在极性共价键和配位键,N原子的杂化类型为杂化
D.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率
二、多选题
14.锌—空气电池(原理如图所示)适宜用作城市电动车的动力源,该电池放电时Zn转化为ZnO,该电池工作时下列说法正确的是
A.该电池正极的电极反应为
B.该原电池中,电子由石墨电极经电解质溶液流入锌电极
C.该电池放电时向锌电极移动
D.该原电池工作一段时间后,电解质溶液的pH值变大
三、非选择题
15.钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答下列问题:
(1)钢铁的电化学腐蚀原理:在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
①分别写出图1中铁电极和石墨电极的电极反应式: , 。
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示位置做出修改,并用箭头标出导线中电子流动方向 。
③写出修改后石墨电极的电极反应式: 。
(2)工业上常用盐酸除去铁锈。现将一生锈的铁片放入盐酸中,溶液中可能发生反应的化学方程式有 。
(3)在实际生产中,可在铁制品的表面镀铜防止铁被腐蚀。装置如图2所示:
①A电极对应的金属是 (填元素名称),B电极的电极反应式为 。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。
16.电化学在生活、生产、科学技术等各个领域的发展中扮演着越来越重要的角色。燃料电池的工作示意图如图,乙池中的电解质溶液为物质的量浓度均为的的混合溶液,一段时间后,观察到乙池中铁片溶解。
(1)乙池中的能量转化形式为 。
(2)气体Y为 ,闭合开关K,电极a上发生的电极反应为 ,溶液中的移动方向为 (填“移向电极a”或“移向电极b”)。
(3)乙池中铁电极发生的电极反应为 ,一段时间后,向铁电极附近滴入几滴铁氰化钾溶液,可观察到 。
(4)电池工作一段时间后,乙池中石墨电极上产生(标准状况)气体,则甲池中消耗的质量为 g,石墨电极增重 g。
17.我国在应对气候变化的工作中取得显著成效,承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,北京冬奥会更是首个实现“碳中和”的世界级体育盛会。因此,如何高效利用成为重要的研究课题。
Ⅰ.光合作用
(1)植物光合作用中能量的转化形式为 ;已知植物通过光合作用每吸收需要吸收的能量约为470 kJ,若某植物通过光合作用大约吸收了能量,则吸收的为 g。
(2)“人工树叶”电化学装置如图1所示(以稀硫酸为电解质溶液),该装置能将和|转化为糖类(用表示)和。
①Y为 (填“阴极”或“阳极”),该极上发生的电极反应为 。
②室温下,该装置工作一段时间后,电解质溶液的pH (填“升高”、“降低”或“不变”)。
Ⅱ.电化学方法可将有效地转化为,电化学装置如图2所示
(3)在 (填“阳极”或“阴极”)室产生;电解时,的移动方向为由 (填“左室”或“右室”,下同)向 移动。
18.氨的转化与去除:微生物燃料电池(MFC)是一种现代化氨氮去除技术,如图为MFC碳氮联合同时去除的氮转化系统原理示意图。
(1)A极的电极反应式为 ,A、B两极生成CO2和N2的物质的量之比为 。
(2)用化学用语简述去除的原理: 。
参考答案:
1.D
【详解】A.锂离子电池单位质量输出的电能比较大,故该电池具有较高的比能量,A正确;
B.根据总反应分析,该电池的负极反应式为LixC6-xe-=xLi++C6,B正确;
C.放电时阳离子向正极移动,C正确;
D.充电时,若转移1mol电子,则石墨电极增重1mol金属锂,即增重7克,D错误;
故选D。
2.C
【分析】该装置为电解池装置,在M电极上氯离子失去电子生成氯气(无 Cl2逸出),然后氯气将氨氧化为氮气,氯气又被还原为氯离子,在这过程中氯离子做了催化剂,M电极为阳极,阳极区的总反应为;N电极为阴极,电极反应为2H2O+2e-=H2↑+2OH-。
【详解】A.由分析可知,M电极为阳极,A错误;
B.由分析可知,N电极为阴极,电极反应为2H2O+2e-=H2↑+2OH-,故该电极附近pH增大,B错误;
C.M电极为阳极,阳极区的总反应为,阴极的电极反应为2H2O+2e-=H2↑+2OH-,根据电路中电子转移守恒可知,生成的氢气更多,C正确;
D.由分析可知,在阳极上氯离子失去电子生成氯气,然后氯气又被氨还原为氯离子,电解后氯离子浓度不可能上升,D错误;
故选C。
3.C
【分析】电解1mol/L的溶液溶液,实际为电解水,总反应为2H2O2H2↑+O2↑,一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍,石墨Ⅱ附近产生气体为氢气,石墨I附近产生氧气,石墨Ⅱ附近氢氧根离子浓度增大,溶液变红,则电解时,石墨Ⅱ为阴极,石墨I为阳极,实验②构成燃料电池,氢气所在石墨Ⅱ电极为负极,氧气所在石墨I电极为正极,据此解答。
【详解】A.根据分析,步骤①为电解装置,石墨I为阳极,应连接外加电源的正极,A正确;
B.步骤①中石墨Ⅱ附近氢离子放电,氢氧根离子浓度增大,溶液变为红色,B正确;
C.步骤②为原电池装置,石墨Ⅱ为负极,石墨I为正极,阴离子移向负极,溶液中的移向电极石墨Ⅱ,C错误;
D.步骤②为原电池装置,石墨Ⅱ电极上氢气失去电子,发生氧化反应,D正确;
故选C。
4.D
【分析】电极a有生成,则a为电解池阳极,b为电解池阴极;在反应池中与硫化氢发生氧化还原反应,还原产物可再进入电解池中放电。a为电解池阳极,发生氧化反应,电极反应为
【详解】A.由分析可知,电极a为电解池阳极,与电源的正极相连,A错误;
B.若交换膜为阳离子交换膜,会向阴极移动,与氢氧根离子生成红褐色沉淀,B错误;
C.反应池中与硫化氢发生氧化还原反应,,被氧化为S单质,C错误;
D.阴极上,水电离的氢离子放电生成氢气,氢氧根离子移向阳极,考虑水放电在不断减少,则NaOH溶液的浓度变大,碱性增强,D正确;
故选:D。
5.B
【详解】A.以“铁打成叶片”是把铁块打成铁片,说明铁具有良好的延展性,选项A正确;
B.若使用铜钉,铁、铜和水溶液构成原电池,铁比铜活泼,作负极,会加速铁生锈,选项B错误;
C.氯化铵水解呈酸性,可用于除铁锈,选项C正确;
D.“滚沸延及成盐”为水分蒸发,使盐结晶析出,属于蒸发结晶操作,选项D正确;
答案选B。
6.B
【详解】A.根据图中信息,锂和氮气反应生成,A项正确;
B.Li能与水反应,不能在水溶液中进行,B项错误;
C.③中是电解LiOH,阴极发生还原反应,其电极反应式为,C项正确;
D.根据图中信息可得,氮气与水反应生成氨气和氧气,D项正确;
故选B。
7.C
【分析】该装置有外加电源,属于电解装置,电极b上N2→NO,N元素失去电子,化合价升高,根据电解原理,电极b为阳极,电极a为阴极,据此分析;
【详解】A.根据上述分析,电极b为阳极,电解质溶液为KOH溶液,其电极反应式为N2-10e-+12OH-=2NO+6H2O,故A错误;
B.根据装置图,电极a应是H2O得电子转化成氢气,其电极反应式为2H2O+2e-=H2↑+2OH-,阳极消耗OH-,阴极产生OH-,OH-通过离子交换膜移向阳极,离子交换膜为阴离子交换膜,故B错误;
C.电极b的反应式为N2-10e-+12OH-=2NO+6H2O,消耗标况下22.4L氮气,电路转移电子物质的量为10mol,电极a电极反应式为2H2O+2e-=H2↑+2OH-,产生氢气物质的量为5mol,同时有10molOH-移向右侧,左池溶液质量减轻(5mol×2g/mol+10mol×17g/mol)=180g,故C正确;
D.固氮完成后,根据溶解度表,应采用蒸发浓缩,降温结晶的方法,也可能KOH过量,硝酸钾中混有KOH,故D错误;
答案为C。
8.C
【详解】A.淀粉水解只能生成葡萄糖,故A错误;
B.碳酸钠受热不分解,故B错误;
C.镁的金属性比Fe强,船身上放置镁合金可形成原电池,镁铝合金作负极,船体作正极,从而可减少船体腐蚀,故C正确;
D.可用铝槽车运输浓硫酸,是因为常温下铝与浓硫酸发生钝化,阻止反应继续进行,故D错误;
故选:C。
9.D
【分析】该装置有外接电源则为电解池,左侧电极上为阳极,电极反应式为2H2O-4e-=4H++ O2↑,右侧电极为阴极,电极反应式为等多种反应,以此解题。
【详解】A.由分析可知,在石墨烯基b电极发生还原反应,A错误;
B.由分析可知,I室为阳极室,在电解池中阳离子向阴极室移动,即向Ⅱ室移动,B错误;
C.Ⅱ室中CO2转化为CO、CH4、C2H4等,不是只生成CH4,则每消耗气体,转移电子不等于8mol,C错误;
D.由分析可知,a电极的电极反应式为,D正确;
故选D。
10.B
【分析】由图可知,放电时,锂电极是原电池的负极,锂失去电子发生氧化反应生成锂离子,电极反应式为Li—e—=Li+,含催化剂的多孔电极为正极,锂离子作用下空气中的氧气在正极得到电子发生还原反应生成过氧化锂,电极反应式为O2+2Li++2e—=Li2O2。
【详解】A.锂是活泼金属,能与水反应,所以锂—空气电池的电解液不能选用强电解质的水溶液,故A错误;
B.由分析可知,放电时,含催化剂的多孔电极为正极,锂离子作用下空气中的氧气在正极得到电子发生还原反应生成过氧化锂,电极反应式为O2+2Li++2e—=Li2O2,故B正确;
C.由分析可知,放电时,锂电极是原电池的负极,锂失去电子发生氧化反应生成锂离子,电极反应式为Li—e—=Li+,则每当有1.4g锂参与放电,电路中转移电子的物质的量为×1=0.2mol,故C错误;
D.由分析可知,放电时,锂电极是原电池的负极,含催化剂的多孔电极为正极,则电子流向从锂→含催化剂的多孔电极,故D错误;
故选B。
11.B
【详解】A.传感器工作时,仅Ag+能在 α -AgI晶体里迁移,O2透过聚四氟乙烯进入传感器,AgI 的物质的量增加,根据原电池原理,AlI3减少,发生反应4AlI3 +3O2 = 6I2 + 2Al2O3,正极反应式为I2+2Ag+ +2e-= 2AgI,故A正确;
B.负极反应式为Ag-e-=Ag+,故B错误;
C.根据反应原理发生反应4AlI3 +3O2 = 6I2 + 2Al2O3,O2浓度越大,产生的I2越多,则穿过电位计的电子越多,故C正确;
D.根据公式,,所以, α-AgI晶体中I-离子作体心立方堆积,2,(50410-12)3m3,故D正确;
所以本题选B.
【点睛】本题考查电化学的相关知识,需结合得失电子的关系判断原电池的正负极及电极反应式的书写
12.B
【分析】该装置是原电池和电解池组合装置,左边是微生物燃料电池,右边是电解池,在原电池中苯酚被氧化为二氧化碳,发生氧化反应是原电池的负极,重铬酸根离子被还原为Cr(OH)3,作正极,与b相连接的c是阴极发生还原反应,生成氢气,与a连接的d极为阳极,发生氧化反应,把废水中苯酚氧化成二氧化碳除去。
【详解】A.由于用微生物做催化剂,不能在高温下进行,高温不利于该电池的使用,故A正确;
B.电池工作一段时间后,a侧产生的氢氧根离子和b侧产生的H+迁移到中间室生成水,导致NaCl浓度降低,故B错误;
C.d为阳极,水失去电子发生氧化反应生成羟基自由和氢离子,故C正确;
D.c为阴极发生还原反应生成氢气,d极为阳极羟基自由基把苯酚氧化为二氧化碳,根据电子守恒,28mol电子转移会产生14mol氢气和6molCO2,C6H5OH~28e-~6CO2~14H2,c、d两极产生气体的体积比(相同条件下)为,故D正确;
答案选B。
【点睛】根据电子守恒来计算两极产生的气体的物质的量。
13.D
【分析】由装置及原理可知,实验中生成气体,应防止装置漏气,B中生成氢气,A和B之间导管a可平衡气压,C中导管短进长出,氢气将C中溶液排入D中,B与D两容器中比较,D中形成原电池后可以加快反应速率,生成的氢气将E中硫酸铜排入F中发生Cu2++4NH3 H2O═4H2O+[Cu(NH3)4]2+,然后进入G中,作H2O2的催化剂可加快反应进行,气流过快时H中过氧化氢与硫化氢反应生成S,I中NaOH溶液吸收尾气,以此解答该题。
【详解】A.进行实验前必须进行的操作检验装置的气密性,一旦漏气实验失败,故A正确;
B.氧气和硫化氢反应生成硫,H中出现浅黄色浑浊,可证明O非金属性强于S,故B正确;
C.中存在N-H极性共价键和配位键,NH3中N原子价层电子对数为3+ =4,N原子的杂化类型为杂化,故C正确;
D.装置B与D中比较,D中形成原电池后可以加快反应速率,则若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率小于D中速率,故D错误;
故选D。
14.AC
【分析】该原电池为Zn-石墨-KOH原电池,放电时Zn发生氧化反应生成氧化锌,失去电子作负极,空气中的氧气得到电子发生还原反应,石墨为正极。
【详解】A.该电池放电时,正极反应为O2+4e-+H2O=4OH-,选项A正确;
B.电池工作时,电子从Zn电极经过导线流向石墨电极,不经过溶液,选项B错误;
C.根据原电池中阴离子定向移动到负极,因此该电池放电时OH-向Zn电极移动,选项C正确;
D.该电池的总反应原理为,可知反应前后电解质溶液的pH不变,选项D错误;
答案选AC。
15.(1) Fe-2e-=Fe2+ O2+4e-+2H2O=4OH- 2Cl--2e-=Cl2↑
(2)Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2
(3) 铜 Cu2++2e-=Cu 0.08 镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,铁被保护
【详解】(1)①图1为原电池,Fe作负极,电极反应式为Fe-2e-=Fe2+,石墨作正极,电极反应式为O2+4e-+2H2O=4OH-,故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;
②利用外加电流的阴极保护法,在虚线框内添加外接电源,使铁作阴极,电子流动方向与电流方向相反如图所示,故答案为:;
③修改后石墨为阳极,氯离子放电:2Cl- -2e-=Cl2↑,故答案为:2Cl- -2e-=Cl2↑;
(2)铁锈成分为Fe2O3,可与盐酸反应Fe2O3+6HCl=2FeCl3+3H2O,FeCl3与Fe反应2FeCl3+Fe=3FeCl2,铁与盐酸反应Fe+2HCl=FeCl2+H2↑,故答案为:Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2;
(3)①铁制品表面镀铜,则铁作阴极,铜作阳极,A电极是阳极,应为铜,B电极上Cu2+得电子被还原为Cu,电极反应为:Cu2++2e-=Cu,故答案为:铜;Cu2++2e-=Cu;
②二者质量差为5.12g,说明阳极上有2.56g铜被氧化,阴极上生成2.56g铜,转移电子的物质的量为×2=0.08mol,故答案为:0.08;
③镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,故导致铁被保护,镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,故答案为:镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,铁被保护。
16.(1)电能转化为化学能
(2) 氧气或 移向电极a
(3) 有蓝色沉淀生成
(4) 4 6.4
【分析】一段时间后,观察到乙池中铁片溶解,则铁片为阳极,石墨电极为阴极,甲池中电极a为负极,电极b为正极。
【详解】(1)乙池为电解池,则其中的能量转化形式为电能转化为化学能。
(2)电极b为正极,气体Y在正极发生还原反应,则Y为氧气,闭合开关K,电极a为负极,甲烷在负极发生氧化反应,电极反应为,原电池中阴离子向负极移动,则溶液中的移动方向为移向电极a。
(3)乙池中铁电极为阳极,铁发生氧化反应,电极反应为Fe 2e =Fe2+;Fe2+与铁氰化钾溶液反应可生成蓝色沉淀,则一段时间后,向铁电极附近滴入几滴铁氰化钾溶液,可观察到有蓝色沉淀生成。
(4)乙池中石墨电极为阴极,发生的电极反应依次为、,当产生(标准状况)气体时,阴极依次生成、,电路中转移电子的总物质的量为,电极上电子数守恒,根据可知,甲池中消耗的质量为,石墨电极增重。
17.(1) 太阳能转化为化学能 176
(2) 阳极 降低
(3) 阴极 左室 右室
【详解】(1)光合作用是将太阳能转化为化学能;已知植物通过光合作用每吸收需要吸收的能量约为470 kJ,若某植物通过光合作用大约吸收了能量,则吸收的的物质的量为 ,CO2的质量为。
(2)①Y电极水失电子发生氧化反应生成氧气,Y为阳极,该极上发生的电极反应为。
②总反应为,反应消耗水,该装置工作一段时间后,电解质溶液的浓度增大,pH降低。
(3)CO2生成,碳元素化合价降低发生还原反应,所以在阴极室产生;右侧为阴极室、左侧为阳极室,电解时,的移动方向为由左室向右室移动。
18.(1) CH3COO--8e-+2H2O=2CO2↑+7H+ 5∶2
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O
【详解】(1)B极电极反应式为2N+12H++10e-=N2↑+6H2O,A极电极反应式为CH3COO--8e-+2H2O=2CO2↑+7H+,A、B两极生成CO2和N2的物质的量之比为5∶2。故答案为:CH3COO--8e-+2H2O=2CO2↑+7H+;5∶2;
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O,最终实现转化为无污染的氮气,故答案为:在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O;
一、单选题
1.锂离子电池充、放电电池总反应:LixC6+Li1-xCoO2LiCoO2+C6,该电池充、放电的工作示意图如图。下列有关说法不正确的是
A.该电池具有较高的比能量
B.负极的反应式:LixC6-xe-=xLi++C6
C.放电时,Li+从石墨晶体中脱嵌移向正极
D.充电时,若转移1 mol e-,石墨电极将增重7x g
2.电解食盐水间接氧化法去除工业废水中氨氮的原理如图所示,通过电解氨氮溶液(含有少量的NaCl),将转化为(无逸出),下列说法正确的是
A.M为负极 B.N极附近pH值不变化
C. D.电解后上升
3.某兴趣小组设计并制作了一个简单的燃料电池,步骤如下:①按照如图装置组装仪器,U形管中注入滴有酚酞、1mol/L的溶液,在M处连接一个外加电源。一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍。②2分钟后,将连接在M处的外加电源换作一个音乐盒,立即听到优美的音乐声响起,表明该小组的燃料电池制作成功。下列对该操作过程的叙述错误的是
A.步骤①中石墨I应连接外加电源的正极 B.步骤①中石墨Ⅱ附近的溶液变为红色
C.步骤②溶液中的移向电极石墨I D.步骤②中石墨Ⅱ电极上发生氧化反应
4.采用如图装置可除去化石燃料开采、加工过程产生的H2S废气,已知电解池中的两个电极均为情性电极。下列说法正确的是
A.电极a与电源的负极相连
B.交换膜可以是阳离子交换膜
C.反应池中H2S被Fe3+还原为S单质
D.随着电解的进行,电极b处溶液的碱性增强
5.《天工开物》中描述:“凡煎盐锅古谓之‘牢盆’……其盆周阔数丈,径亦丈许。用铁者以铁打成叶片,铁钉拴合,其底平如盂……其下列灶燃薪……共煎此盘……滚沸延及成盐”。下列叙述错误的是
A.“以铁打成叶片”说明金属铁有较好的延展性
B.“铁钉拴合”换为铜钉,可减缓腐蚀
C.可用氯化铵溶液除去表面的铁锈
D.“滚沸延及成盐”属于蒸发结晶操作
6.金属锂(Li)及其化合物在“氮的固定”中转化过程如图所示。下列说法错误的是
A.X的化学式为Li3N B.过程①可在水溶液中进行
C.③中阴极电极反应式为Li++e-=Li D.图示总转化关系为2N2+6H2O=4NH3+3O2
7.2021年我国科研人员使用Pd-sPNSs催化剂电极实现了氮的固定,其原理如图所示,电解质溶液为KOH溶液,KOH和KNO3溶解度如表。下列说法正确的是
溶质 10℃ 50℃
KOH 103g 140g
KNO3 20.9g 85.5g
A.b作负极,发生的电极反应为N2-10e-+12OH-=2NO+6H2O
B.两池之间采用的离子交换膜为阳离子交换膜
C.消耗22.4LN2(标准状况下)时,左池溶液质量减轻180g
D.固氮完成后,右池溶液经蒸干可获得纯净KNO3
8.陈述I和II均正确且具有因果关系的是
选项 陈述I 陈述II
A 淀粉水解产生果糖 米饭在口腔中越嚼越甜
B 碳酸钠受热分解产生CO2 用碳酸钠作膨松剂制作面包
C 镁的金属性比Fe强 船身上放置镁合金减少船体腐蚀
D 可用铝槽车运输浓硫酸 浓硫酸与Al不反应
A.A B.B C.C D.D
9.利用电催化技术将转化为小分子燃料或高燃烧值化学品是实现原子经济、构建人工碳循环的绿色能源技术之一。石墨烯基电催化转化为等的装置示意图如图所示。下列有关说法正确的是
A.在石墨烯基b电极发生氧化反应
B.电催化过程溶液中的由Ⅱ室向I室迁移
C.消耗1mol转移8mol电子
D.a电极的电极反应式为
10.锂﹣空气电池是一种可充放电池,电池反应为2Li+O2=Li2O2(已知Li2O2是固体),某锂—空气电池的构造原理图如下,下列说法正确的是
A.电解液可选用强电解质的水溶液
B.放电时正极的电极反应式为O2+2Li++2e—=Li2O2
C.每当有1.4gLi参与放电,电路中转移电子0.1mol
D.示意图中,电子流向从含催化剂的多孔电极→锂
11.氧气传感器40XV主要用于工业安全方面测量环境中氧气气体浓度,量程符合0~ 30%范围内使用。一种测定O2含量的气体传感器如图1所示。传感器工作时,仅Ag+能在 α -AgI晶体里迁移,O2透过聚四氟乙烯进入传感器,AgI 的物质的量增加。α-AgI晶体中I-离子作体心立方堆积(如图2所示),Ag+主要分布在由I-构成的四面体、八面体等空隙中。下列有关说法不正确的是
A.正极反应式为I2+2Ag+ +2e-= 2AgI
B.负极反应式为Ag+I--e-=AgI
C.电位计读数越大, O2含量越高
D.α-AgI晶体的摩尔体积Vm=m3·mo1-1
12.科学家设计了一种将苯酚()氧化为和的原电池-电解池组合装置如图所示,已知羟基自由基()是自然界中氧化性仅次于氟的氧化剂。下列说法错误的是
A.高温下不利于该电池的使用
B.电池工作一段时间后,NaCl溶液浓度保持不变
C.d电极的电极反应为:
D.相同时间内,c、d两极产生气体的体积比(相同条件下)为
13.“化学多米诺实验”(如图所示)即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。已知:(该反应产物可作为的催化剂)。下列有关分析错误的是
A.该实验成功的重要条件是整套装置气密性良好
B.H中出现浅黄色浑浊,证明O非金属性强于S
C.中存在极性共价键和配位键,N原子的杂化类型为杂化
D.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率
二、多选题
14.锌—空气电池(原理如图所示)适宜用作城市电动车的动力源,该电池放电时Zn转化为ZnO,该电池工作时下列说法正确的是
A.该电池正极的电极反应为
B.该原电池中,电子由石墨电极经电解质溶液流入锌电极
C.该电池放电时向锌电极移动
D.该原电池工作一段时间后,电解质溶液的pH值变大
三、非选择题
15.钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答下列问题:
(1)钢铁的电化学腐蚀原理:在酸性环境中发生析氢腐蚀,在中性或碱性环境中发生吸氧腐蚀。
①分别写出图1中铁电极和石墨电极的电极反应式: , 。
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在图1虚线框内所示位置做出修改,并用箭头标出导线中电子流动方向 。
③写出修改后石墨电极的电极反应式: 。
(2)工业上常用盐酸除去铁锈。现将一生锈的铁片放入盐酸中,溶液中可能发生反应的化学方程式有 。
(3)在实际生产中,可在铁制品的表面镀铜防止铁被腐蚀。装置如图2所示:
①A电极对应的金属是 (填元素名称),B电极的电极反应式为 。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。
16.电化学在生活、生产、科学技术等各个领域的发展中扮演着越来越重要的角色。燃料电池的工作示意图如图,乙池中的电解质溶液为物质的量浓度均为的的混合溶液,一段时间后,观察到乙池中铁片溶解。
(1)乙池中的能量转化形式为 。
(2)气体Y为 ,闭合开关K,电极a上发生的电极反应为 ,溶液中的移动方向为 (填“移向电极a”或“移向电极b”)。
(3)乙池中铁电极发生的电极反应为 ,一段时间后,向铁电极附近滴入几滴铁氰化钾溶液,可观察到 。
(4)电池工作一段时间后,乙池中石墨电极上产生(标准状况)气体,则甲池中消耗的质量为 g,石墨电极增重 g。
17.我国在应对气候变化的工作中取得显著成效,承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,北京冬奥会更是首个实现“碳中和”的世界级体育盛会。因此,如何高效利用成为重要的研究课题。
Ⅰ.光合作用
(1)植物光合作用中能量的转化形式为 ;已知植物通过光合作用每吸收需要吸收的能量约为470 kJ,若某植物通过光合作用大约吸收了能量,则吸收的为 g。
(2)“人工树叶”电化学装置如图1所示(以稀硫酸为电解质溶液),该装置能将和|转化为糖类(用表示)和。
①Y为 (填“阴极”或“阳极”),该极上发生的电极反应为 。
②室温下,该装置工作一段时间后,电解质溶液的pH (填“升高”、“降低”或“不变”)。
Ⅱ.电化学方法可将有效地转化为,电化学装置如图2所示
(3)在 (填“阳极”或“阴极”)室产生;电解时,的移动方向为由 (填“左室”或“右室”,下同)向 移动。
18.氨的转化与去除:微生物燃料电池(MFC)是一种现代化氨氮去除技术,如图为MFC碳氮联合同时去除的氮转化系统原理示意图。
(1)A极的电极反应式为 ,A、B两极生成CO2和N2的物质的量之比为 。
(2)用化学用语简述去除的原理: 。
参考答案:
1.D
【详解】A.锂离子电池单位质量输出的电能比较大,故该电池具有较高的比能量,A正确;
B.根据总反应分析,该电池的负极反应式为LixC6-xe-=xLi++C6,B正确;
C.放电时阳离子向正极移动,C正确;
D.充电时,若转移1mol电子,则石墨电极增重1mol金属锂,即增重7克,D错误;
故选D。
2.C
【分析】该装置为电解池装置,在M电极上氯离子失去电子生成氯气(无 Cl2逸出),然后氯气将氨氧化为氮气,氯气又被还原为氯离子,在这过程中氯离子做了催化剂,M电极为阳极,阳极区的总反应为;N电极为阴极,电极反应为2H2O+2e-=H2↑+2OH-。
【详解】A.由分析可知,M电极为阳极,A错误;
B.由分析可知,N电极为阴极,电极反应为2H2O+2e-=H2↑+2OH-,故该电极附近pH增大,B错误;
C.M电极为阳极,阳极区的总反应为,阴极的电极反应为2H2O+2e-=H2↑+2OH-,根据电路中电子转移守恒可知,生成的氢气更多,C正确;
D.由分析可知,在阳极上氯离子失去电子生成氯气,然后氯气又被氨还原为氯离子,电解后氯离子浓度不可能上升,D错误;
故选C。
3.C
【分析】电解1mol/L的溶液溶液,实际为电解水,总反应为2H2O2H2↑+O2↑,一段时间后石墨Ⅱ附近气球的体积是石墨I附近气球体积的2倍,石墨Ⅱ附近产生气体为氢气,石墨I附近产生氧气,石墨Ⅱ附近氢氧根离子浓度增大,溶液变红,则电解时,石墨Ⅱ为阴极,石墨I为阳极,实验②构成燃料电池,氢气所在石墨Ⅱ电极为负极,氧气所在石墨I电极为正极,据此解答。
【详解】A.根据分析,步骤①为电解装置,石墨I为阳极,应连接外加电源的正极,A正确;
B.步骤①中石墨Ⅱ附近氢离子放电,氢氧根离子浓度增大,溶液变为红色,B正确;
C.步骤②为原电池装置,石墨Ⅱ为负极,石墨I为正极,阴离子移向负极,溶液中的移向电极石墨Ⅱ,C错误;
D.步骤②为原电池装置,石墨Ⅱ电极上氢气失去电子,发生氧化反应,D正确;
故选C。
4.D
【分析】电极a有生成,则a为电解池阳极,b为电解池阴极;在反应池中与硫化氢发生氧化还原反应,还原产物可再进入电解池中放电。a为电解池阳极,发生氧化反应,电极反应为
【详解】A.由分析可知,电极a为电解池阳极,与电源的正极相连,A错误;
B.若交换膜为阳离子交换膜,会向阴极移动,与氢氧根离子生成红褐色沉淀,B错误;
C.反应池中与硫化氢发生氧化还原反应,,被氧化为S单质,C错误;
D.阴极上,水电离的氢离子放电生成氢气,氢氧根离子移向阳极,考虑水放电在不断减少,则NaOH溶液的浓度变大,碱性增强,D正确;
故选:D。
5.B
【详解】A.以“铁打成叶片”是把铁块打成铁片,说明铁具有良好的延展性,选项A正确;
B.若使用铜钉,铁、铜和水溶液构成原电池,铁比铜活泼,作负极,会加速铁生锈,选项B错误;
C.氯化铵水解呈酸性,可用于除铁锈,选项C正确;
D.“滚沸延及成盐”为水分蒸发,使盐结晶析出,属于蒸发结晶操作,选项D正确;
答案选B。
6.B
【详解】A.根据图中信息,锂和氮气反应生成,A项正确;
B.Li能与水反应,不能在水溶液中进行,B项错误;
C.③中是电解LiOH,阴极发生还原反应,其电极反应式为,C项正确;
D.根据图中信息可得,氮气与水反应生成氨气和氧气,D项正确;
故选B。
7.C
【分析】该装置有外加电源,属于电解装置,电极b上N2→NO,N元素失去电子,化合价升高,根据电解原理,电极b为阳极,电极a为阴极,据此分析;
【详解】A.根据上述分析,电极b为阳极,电解质溶液为KOH溶液,其电极反应式为N2-10e-+12OH-=2NO+6H2O,故A错误;
B.根据装置图,电极a应是H2O得电子转化成氢气,其电极反应式为2H2O+2e-=H2↑+2OH-,阳极消耗OH-,阴极产生OH-,OH-通过离子交换膜移向阳极,离子交换膜为阴离子交换膜,故B错误;
C.电极b的反应式为N2-10e-+12OH-=2NO+6H2O,消耗标况下22.4L氮气,电路转移电子物质的量为10mol,电极a电极反应式为2H2O+2e-=H2↑+2OH-,产生氢气物质的量为5mol,同时有10molOH-移向右侧,左池溶液质量减轻(5mol×2g/mol+10mol×17g/mol)=180g,故C正确;
D.固氮完成后,根据溶解度表,应采用蒸发浓缩,降温结晶的方法,也可能KOH过量,硝酸钾中混有KOH,故D错误;
答案为C。
8.C
【详解】A.淀粉水解只能生成葡萄糖,故A错误;
B.碳酸钠受热不分解,故B错误;
C.镁的金属性比Fe强,船身上放置镁合金可形成原电池,镁铝合金作负极,船体作正极,从而可减少船体腐蚀,故C正确;
D.可用铝槽车运输浓硫酸,是因为常温下铝与浓硫酸发生钝化,阻止反应继续进行,故D错误;
故选:C。
9.D
【分析】该装置有外接电源则为电解池,左侧电极上为阳极,电极反应式为2H2O-4e-=4H++ O2↑,右侧电极为阴极,电极反应式为等多种反应,以此解题。
【详解】A.由分析可知,在石墨烯基b电极发生还原反应,A错误;
B.由分析可知,I室为阳极室,在电解池中阳离子向阴极室移动,即向Ⅱ室移动,B错误;
C.Ⅱ室中CO2转化为CO、CH4、C2H4等,不是只生成CH4,则每消耗气体,转移电子不等于8mol,C错误;
D.由分析可知,a电极的电极反应式为,D正确;
故选D。
10.B
【分析】由图可知,放电时,锂电极是原电池的负极,锂失去电子发生氧化反应生成锂离子,电极反应式为Li—e—=Li+,含催化剂的多孔电极为正极,锂离子作用下空气中的氧气在正极得到电子发生还原反应生成过氧化锂,电极反应式为O2+2Li++2e—=Li2O2。
【详解】A.锂是活泼金属,能与水反应,所以锂—空气电池的电解液不能选用强电解质的水溶液,故A错误;
B.由分析可知,放电时,含催化剂的多孔电极为正极,锂离子作用下空气中的氧气在正极得到电子发生还原反应生成过氧化锂,电极反应式为O2+2Li++2e—=Li2O2,故B正确;
C.由分析可知,放电时,锂电极是原电池的负极,锂失去电子发生氧化反应生成锂离子,电极反应式为Li—e—=Li+,则每当有1.4g锂参与放电,电路中转移电子的物质的量为×1=0.2mol,故C错误;
D.由分析可知,放电时,锂电极是原电池的负极,含催化剂的多孔电极为正极,则电子流向从锂→含催化剂的多孔电极,故D错误;
故选B。
11.B
【详解】A.传感器工作时,仅Ag+能在 α -AgI晶体里迁移,O2透过聚四氟乙烯进入传感器,AgI 的物质的量增加,根据原电池原理,AlI3减少,发生反应4AlI3 +3O2 = 6I2 + 2Al2O3,正极反应式为I2+2Ag+ +2e-= 2AgI,故A正确;
B.负极反应式为Ag-e-=Ag+,故B错误;
C.根据反应原理发生反应4AlI3 +3O2 = 6I2 + 2Al2O3,O2浓度越大,产生的I2越多,则穿过电位计的电子越多,故C正确;
D.根据公式,,所以, α-AgI晶体中I-离子作体心立方堆积,2,(50410-12)3m3,故D正确;
所以本题选B.
【点睛】本题考查电化学的相关知识,需结合得失电子的关系判断原电池的正负极及电极反应式的书写
12.B
【分析】该装置是原电池和电解池组合装置,左边是微生物燃料电池,右边是电解池,在原电池中苯酚被氧化为二氧化碳,发生氧化反应是原电池的负极,重铬酸根离子被还原为Cr(OH)3,作正极,与b相连接的c是阴极发生还原反应,生成氢气,与a连接的d极为阳极,发生氧化反应,把废水中苯酚氧化成二氧化碳除去。
【详解】A.由于用微生物做催化剂,不能在高温下进行,高温不利于该电池的使用,故A正确;
B.电池工作一段时间后,a侧产生的氢氧根离子和b侧产生的H+迁移到中间室生成水,导致NaCl浓度降低,故B错误;
C.d为阳极,水失去电子发生氧化反应生成羟基自由和氢离子,故C正确;
D.c为阴极发生还原反应生成氢气,d极为阳极羟基自由基把苯酚氧化为二氧化碳,根据电子守恒,28mol电子转移会产生14mol氢气和6molCO2,C6H5OH~28e-~6CO2~14H2,c、d两极产生气体的体积比(相同条件下)为,故D正确;
答案选B。
【点睛】根据电子守恒来计算两极产生的气体的物质的量。
13.D
【分析】由装置及原理可知,实验中生成气体,应防止装置漏气,B中生成氢气,A和B之间导管a可平衡气压,C中导管短进长出,氢气将C中溶液排入D中,B与D两容器中比较,D中形成原电池后可以加快反应速率,生成的氢气将E中硫酸铜排入F中发生Cu2++4NH3 H2O═4H2O+[Cu(NH3)4]2+,然后进入G中,作H2O2的催化剂可加快反应进行,气流过快时H中过氧化氢与硫化氢反应生成S,I中NaOH溶液吸收尾气,以此解答该题。
【详解】A.进行实验前必须进行的操作检验装置的气密性,一旦漏气实验失败,故A正确;
B.氧气和硫化氢反应生成硫,H中出现浅黄色浑浊,可证明O非金属性强于S,故B正确;
C.中存在N-H极性共价键和配位键,NH3中N原子价层电子对数为3+ =4,N原子的杂化类型为杂化,故C正确;
D.装置B与D中比较,D中形成原电池后可以加快反应速率,则若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率小于D中速率,故D错误;
故选D。
14.AC
【分析】该原电池为Zn-石墨-KOH原电池,放电时Zn发生氧化反应生成氧化锌,失去电子作负极,空气中的氧气得到电子发生还原反应,石墨为正极。
【详解】A.该电池放电时,正极反应为O2+4e-+H2O=4OH-,选项A正确;
B.电池工作时,电子从Zn电极经过导线流向石墨电极,不经过溶液,选项B错误;
C.根据原电池中阴离子定向移动到负极,因此该电池放电时OH-向Zn电极移动,选项C正确;
D.该电池的总反应原理为,可知反应前后电解质溶液的pH不变,选项D错误;
答案选AC。
15.(1) Fe-2e-=Fe2+ O2+4e-+2H2O=4OH- 2Cl--2e-=Cl2↑
(2)Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2
(3) 铜 Cu2++2e-=Cu 0.08 镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,铁被保护
【详解】(1)①图1为原电池,Fe作负极,电极反应式为Fe-2e-=Fe2+,石墨作正极,电极反应式为O2+4e-+2H2O=4OH-,故答案为:Fe-2e-=Fe2+;O2+4e-+2H2O=4OH-;
②利用外加电流的阴极保护法,在虚线框内添加外接电源,使铁作阴极,电子流动方向与电流方向相反如图所示,故答案为:;
③修改后石墨为阳极,氯离子放电:2Cl- -2e-=Cl2↑,故答案为:2Cl- -2e-=Cl2↑;
(2)铁锈成分为Fe2O3,可与盐酸反应Fe2O3+6HCl=2FeCl3+3H2O,FeCl3与Fe反应2FeCl3+Fe=3FeCl2,铁与盐酸反应Fe+2HCl=FeCl2+H2↑,故答案为:Fe2O3+6HCl=2FeCl3+3H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2;
(3)①铁制品表面镀铜,则铁作阴极,铜作阳极,A电极是阳极,应为铜,B电极上Cu2+得电子被还原为Cu,电极反应为:Cu2++2e-=Cu,故答案为:铜;Cu2++2e-=Cu;
②二者质量差为5.12g,说明阳极上有2.56g铜被氧化,阴极上生成2.56g铜,转移电子的物质的量为×2=0.08mol,故答案为:0.08;
③镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,故导致铁被保护,镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,故答案为:镀铜铁中铁比铜活泼,镀层破损后在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀;而镀锌铁中,锌比铁活泼,镀层破损后在潮湿环境中形成原电池,锌为负极,被腐蚀,铁被保护。
16.(1)电能转化为化学能
(2) 氧气或 移向电极a
(3) 有蓝色沉淀生成
(4) 4 6.4
【分析】一段时间后,观察到乙池中铁片溶解,则铁片为阳极,石墨电极为阴极,甲池中电极a为负极,电极b为正极。
【详解】(1)乙池为电解池,则其中的能量转化形式为电能转化为化学能。
(2)电极b为正极,气体Y在正极发生还原反应,则Y为氧气,闭合开关K,电极a为负极,甲烷在负极发生氧化反应,电极反应为,原电池中阴离子向负极移动,则溶液中的移动方向为移向电极a。
(3)乙池中铁电极为阳极,铁发生氧化反应,电极反应为Fe 2e =Fe2+;Fe2+与铁氰化钾溶液反应可生成蓝色沉淀,则一段时间后,向铁电极附近滴入几滴铁氰化钾溶液,可观察到有蓝色沉淀生成。
(4)乙池中石墨电极为阴极,发生的电极反应依次为、,当产生(标准状况)气体时,阴极依次生成、,电路中转移电子的总物质的量为,电极上电子数守恒,根据可知,甲池中消耗的质量为,石墨电极增重。
17.(1) 太阳能转化为化学能 176
(2) 阳极 降低
(3) 阴极 左室 右室
【详解】(1)光合作用是将太阳能转化为化学能;已知植物通过光合作用每吸收需要吸收的能量约为470 kJ,若某植物通过光合作用大约吸收了能量,则吸收的的物质的量为 ,CO2的质量为。
(2)①Y电极水失电子发生氧化反应生成氧气,Y为阳极,该极上发生的电极反应为。
②总反应为,反应消耗水,该装置工作一段时间后,电解质溶液的浓度增大,pH降低。
(3)CO2生成,碳元素化合价降低发生还原反应,所以在阴极室产生;右侧为阴极室、左侧为阳极室,电解时,的移动方向为由左室向右室移动。
18.(1) CH3COO--8e-+2H2O=2CO2↑+7H+ 5∶2
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O
【详解】(1)B极电极反应式为2N+12H++10e-=N2↑+6H2O,A极电极反应式为CH3COO--8e-+2H2O=2CO2↑+7H+,A、B两极生成CO2和N2的物质的量之比为5∶2。故答案为:CH3COO--8e-+2H2O=2CO2↑+7H+;5∶2;
(2)在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O,最终实现转化为无污染的氮气,故答案为:在好氧微生物反应器中转化为:+2O2=+2H++H2O,在MFC电池正极转化为N2:2+12H++10e-=N2↑+6H2O;
