第四章 化学反应与电能 (测试卷 )(含解析)—— 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 (测试卷 )(含解析)—— 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 662.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 09:35:49 | ||
图片预览



文档简介
第四章《化学反应与电能》测试卷
一、单选题
1.下列反应中属于吸热反应的是
A.生石灰与水反应制熟石灰 B.氢氧化钠与盐酸反应
C.食物因氧化而变质 D.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
2.等物质的量的下列物质中,内能最大的是
A.水蒸气 B.液态水 C.冰 D.冰水混合物
3.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
4.下列反应属于吸热反应的是
A.碳酸钙受热分解 B.盐酸与氢氧化钠反应
C.氢气与氯气反应 D.氧化钙与水反应
5.依据如图判断,下列说法正确的是
A.氢气的燃烧热 H=-241.8kJ/mol
B.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
C.2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量低
D.2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高
6.光合作用是生物体糗以生存和繁衍的基础,其反应为。下列说法正确的是
A.反应为置换反应 B.反应吸收热量 C.是还原产物 D.葡萄糖属于电解质
7.下列四种情况下,铁的腐蚀速率由快到慢的是
A.b>a>d>c B.a>b>c>d C.d>c>b>a D.b>d>a>c
8.将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即产生电流,称为甲烷燃料电池。已知甲烷燃料电池两个电极上的反应分别为CH4-8e-+10OH-=CO32-+7H2O,2O2+8e-+4H2O=8OH-。下列有关说法中错误的是( )
A.CH4在负极上反应,O2在正极上反应
B.放电过程中电解质溶液的碱性减弱
C.此电池属于环境友好型电池
D.此电池中化学能100%转化为电能
9.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石在一定条件下转化成石墨能量变化如图所示,则金刚石稳定性较好
D.同温同压下,H2(g)+C12(g)=2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
10.下列说法错误的是
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中能量的变化常以热能、电能、光能等形式表现出来
C. ,说明石墨比金刚石稳定
D.氯化铵分解为吸热反应:
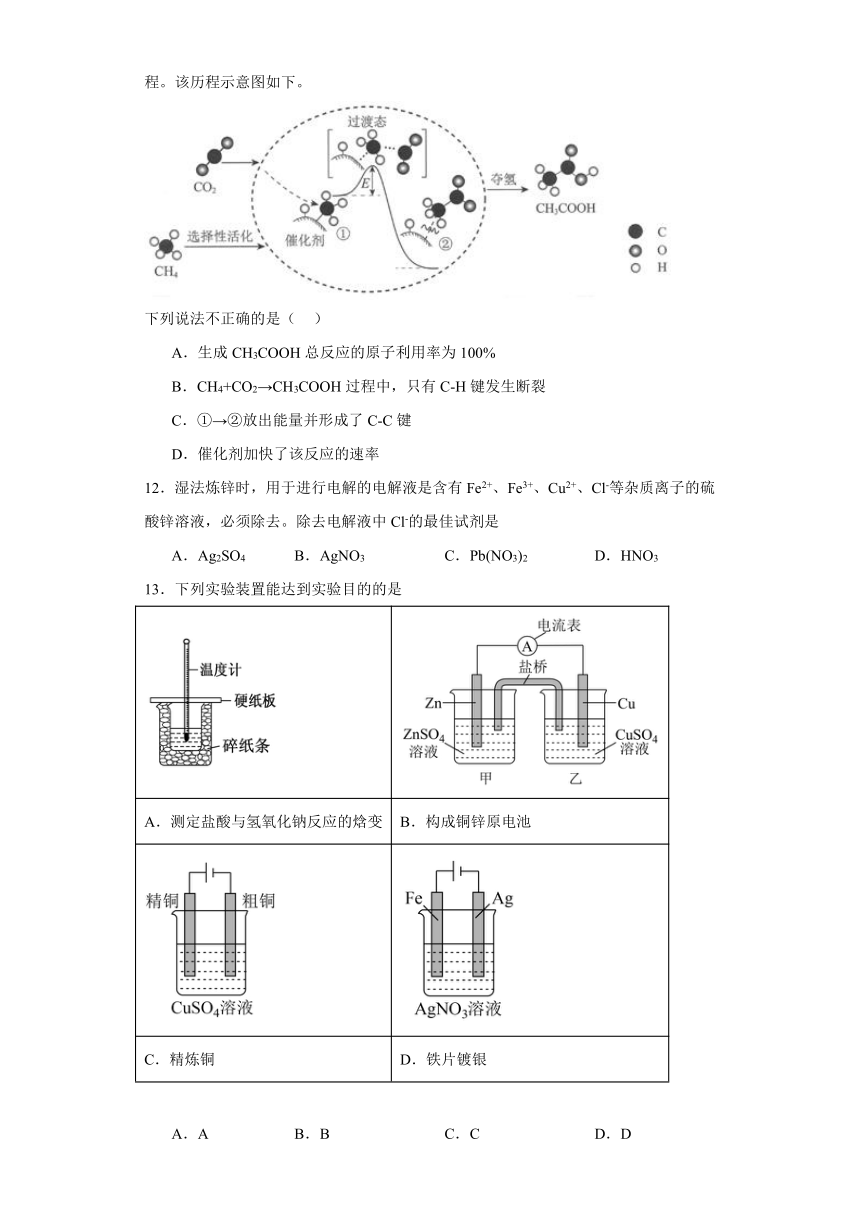
11.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.催化剂加快了该反应的速率
12.湿法炼锌时,用于进行电解的电解液是含有Fe2+、Fe3+、Cu2+、Cl-等杂质离子的硫酸锌溶液,必须除去。除去电解液中Cl-的最佳试剂是
A.Ag2SO4 B.AgNO3 C.Pb(NO3)2 D.HNO3
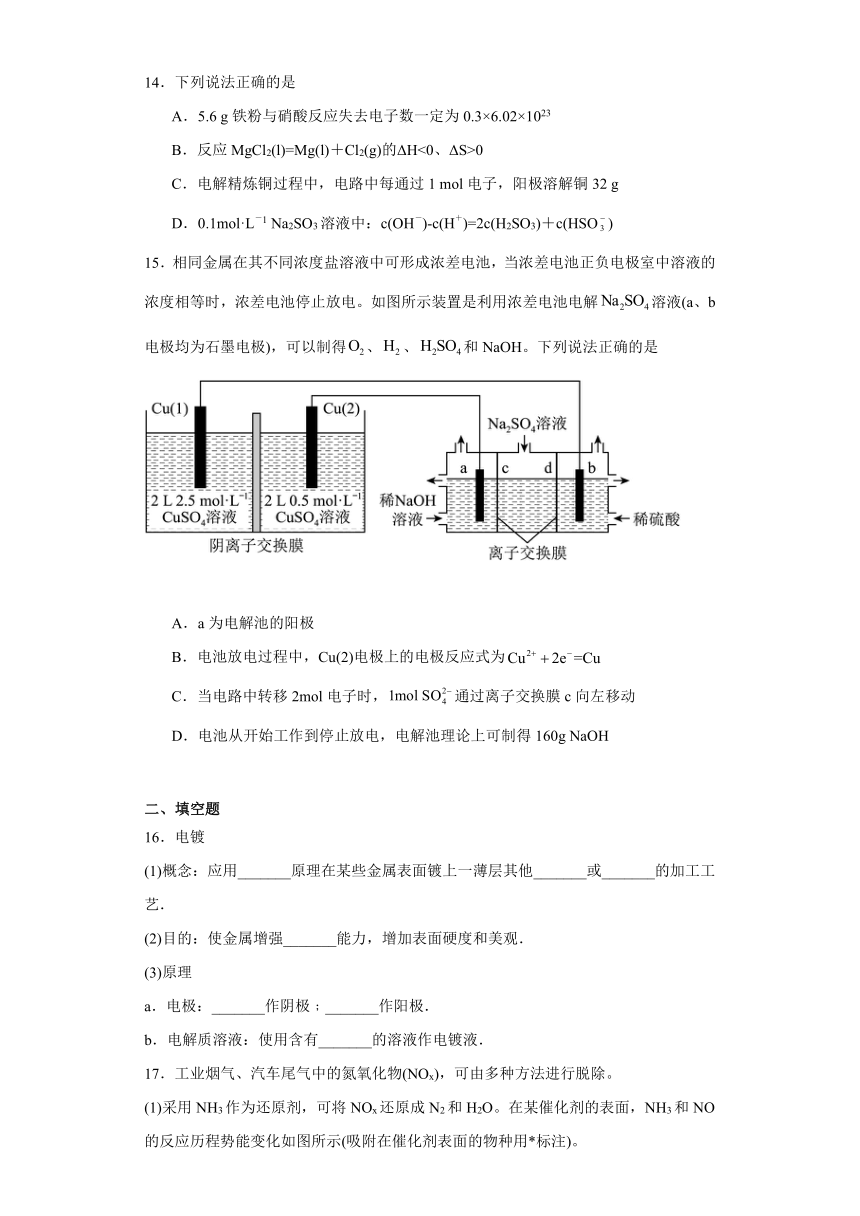
13.下列实验装置能达到实验目的的是
A.测定盐酸与氢氧化钠反应的焓变 B.构成铜锌原电池
C.精炼铜 D.铁片镀银
A.A B.B C.C D.D
14.下列说法正确的是
A.5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0、ΔS>0
C.电解精炼铜过程中,电路中每通过1 mol电子,阳极溶解铜32 g
D.0.1mol·L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO)
15.相同金属在其不同浓度盐溶液中可形成浓差电池,当浓差电池正负电极室中溶液的浓度相等时,浓差电池停止放电。如图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和NaOH。下列说法正确的是
A.a为电解池的阳极
B.电池放电过程中,Cu(2)电极上的电极反应式为
C.当电路中转移2mol电子时,通过离子交换膜c向左移动
D.电池从开始工作到停止放电,电解池理论上可制得160g NaOH
二、填空题
16.电镀
(1)概念:应用_______原理在某些金属表面镀上一薄层其他_______或_______的加工工艺.
(2)目的:使金属增强_______能力,增加表面硬度和美观.
(3)原理
a.电极:_______作阴极﹔_______作阳极.
b.电解质溶液:使用含有_______的溶液作电镀液.
17.工业烟气、汽车尾气中的氮氧化物(NOx),可由多种方法进行脱除。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。
该反应历程包括四步基元反应:
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H___0(填“>”、“=”或“<”)。整个反应历程中的控速步骤为第___步(选填a、b、c或d),其能垒(活化能)为___Kcal·mol-1。
(2)利用放热反应C(s)+2NO(g) CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
①上中表示500℃条件下pNO的是__(选填a、b、c或d,下同),表示600℃条件下pCO2的是___。
②根据图示,列出600℃时反应平衡常数Kp的计算式__。(Kp等于生成物气体分压幂之积与反应物气体分压幂之积的比值)
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。
①根据上图,下列有关说法正确的是____(填标号)。
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是____(任写一条)。
18.正负极的判断
(1)根据氧化还原反应原理:
负极:___________电子(化合价升高,发生氧化反应)
正极:___________电子(化合价降低,发生还原反应)
(2)根据电子/电流/离子流向:
电流:___________。
电子:___________。
离子:___________。
(3)根据金属活动性:一定要看电解质溶液!___________
(4)根据现象:一般来讲,___________为正极,___________为负极,氧气(空气)为正极,一般与电解质发生反应的为负极。
三、实验题
19.用如图所示装置进行中和热的测定实验。
(1)仪器A的名称是________,碎泡沫塑料的作用是________________
(2)理论上强酸强碱的中和热为57.3 kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________
20.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)做1次完整的中和热测定实验,温度计至少需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?_______________。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格__________。
21.用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:
(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____________,______________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则A溶液的pH为______________。
参考答案:
1.D
【解析】常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应、铝热反应以及食物腐败、炸药爆炸;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2) 以及某些复分解反应(如铵盐和强碱);据此解答
【详解】A.生石灰与水反应是常见放热反应,A错误;
B.盐酸与氢氧化钠溶液是中和反应,是放热反应,B错误;
C.食物因氧化而变质,属于放热反应,C错误;
D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合反应是典型的吸热反应,D正确;
故选D。
2.A
【详解】从冰到液态水,从水到水蒸气都是吸热过程,温度不变,内能增大,所以水蒸气的内能最大,故A正确;
故选A。
3.D
【详解】试题分析:三个电解槽串联,则转移的电子数相等,设均转移6e-,
由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,
则6e-~6K~3Mg~2Al,
所以析出钾、镁、铝的物质的量之比为6:3:2,
故选D。
考点:原电池和电解池的工作原理
点评:本题考查电解,明确电解中转移电子数的关系及电极反应式是解答本题的关键,题目难度不大。
4.A
【详解】A.碳酸钙受热分解是吸热反应,A正确;
B.酸碱中和反应是放热反应,B错误;
C.氢气与氯气反应是放热反应,C错误;
D.氧化钙与水反应是放热反应,D错误;
故选D。
5.D
【详解】A.据图可知2mol H2(g)与1mol O2(g)生成2mol H2O(l)放出的热量为483.6kJ+88kJ=571.6kJ,所以氢气的燃烧热 H==-285.8kJ/mol,A错误;
B.H2O(g)生成H2O(l)时,没有发生化学键的断裂和生成,B错误;
C.据图可知2mol H2(g)与1mol O2(g)生成2mol H2O(g)为放热反应,所以2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高,C错误;
D.根据C选项分析可知,D正确;
综上所述答案为D。
6.B
【详解】A.反应物中没有单质参加,该反应不是置换反应,A错误;
B.葡萄糖燃烧放热,因此其逆反应吸收热量,B正确;
C.氧元素化合价升高,是氧化产物,C错误;
D.葡萄糖不能电离,不属于电解质,属于非电解质,D错误;
答案选B。
7.A
【分析】利用腐蚀速率:电解池中阳极铁>原电池负极铁>原电池正极铁>电解池中阴极铁,据此分析;
【详解】b构成原电池,铁作负极被快速腐蚀,a也构成原电池,属于铁的吸氧腐蚀,缓慢腐蚀,d中铁构成原电池,作正极,被保护,c构成电解池,铁作阴极,被更好地保护。所以答案是b>a>d>c,选项A正确;
答案为A。
8.D
【详解】A、CH4燃料电池中,燃料失电子发生氧化反应,所以CH4在负极上反应,氧气得电子发生还原反应,所以O2在正极上反应,故A正确;
B、根据电池总反应CH4+2O2+2OH-=+3H2O知,OH-参加反应,所以溶液中OH-浓度降低,溶液的碱性减弱,故B正确;
C、该电池放电时不产生对环境有污染的物质,所以属于环境友好型电池,故C正确;
D、此电池中化学能转化为电能和少量热能,故D错误。
故选D。
9.D
【详解】A.根据图中信息,该反应是放热反应,因此反应物的键能之和小于生成物的键能之和,故A错误;
B.气态水到液态水会放出热量,因此相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量多,故B错误;
C.金刚石在一定条件下转化成石墨能量变化如图所示,根据能量越低越稳定,石墨能量低,因此石墨稳定性较好,故C错误;
D.同温同压下,H2(g)+C12(g)=2HCl(g)能量变化如图所示,焓变与反应物的总能量和生成物的总能量有关,与反应路径无关,因此无论在光照和点燃条件下,反应的△H相同,故D正确。
综上所述,答案为D。
10.A
【详解】A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应为放热反应,但需要加热至高温才进行,A项错误;
B.化学反应中反应物的总能量与生成物的总能量不相等,发生化学反应时会伴随能量变化,能量的变化常以热能、电能、光能等形式表现出来,B项正确;
C.C(s,金刚石)=C(s,石墨)为放热反应,说明1mol金刚石具有的总能量大于1mol石墨具有的总能量,能量越低、物质越稳定,故石墨比金刚石稳定,C项正确;
D.氯化铵分解为吸热反应,吸热反应的 H>0,可表示为NH4Cl(s)=NH3(g)+HCl(g) H>0,D项正确;
答案选A。
11.B
【详解】A、根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A正确;
B、CH4+CO2→CH3COOH过程中,C-H键、C=O均发生断裂,B错误;
C、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C正确;
D、催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D正确;
答案选B。
【点睛】本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
12.A
【详解】A.加入硫酸银,使其与氯离子作用,生成难溶的氯化银沉淀,然后过滤即可除去Cl-,A正确;
B.加入硝酸银引入了新杂质硝酸根离子,B错误;
C.加入硝酸铅引入了新杂质硝酸根离子,C错误;
D.加入硝酸试剂不能除去Cl-且引入了新的杂质离子,D错误;
故选A。
13.B
【详解】A.没有环形玻璃搅拌棒,不能使酸、碱充分混合,因此不能准确测定中和热,A不能达到实验目的,A不符合题意;
B.该装置具备原电池构成条件,构成铜锌原电池,B符合题意;
C.精炼铜时粗铜作阳极,与电源的正极连接;精铜作阴极,与电源负极连接,图示装置电源连接方式不对,C不符合题意;
D.铁片上镀银时,应该是镀件铁片为阴极,与电源负极连接;镀层金属银为阳极,与电源正极连接,含有Ag+的AgNO3溶液为电解质溶液,图示连接不合理,D不符合题意;
故合理选项是B。
14.D
【详解】A.5.6g铁与硝酸反应生成物可能是Fe2+或Fe3+离子,当生成Fe2+离子时,转移的电子数为0.2×6.02×1023,当生成Fe3+离子时,转移的电子数为0.3×6.02×1023,A错误;
B.MgCl2的分解反应属于吸热反应,△H>0,反应后生成气体,熵变增加,△S>0,B错误;
C.由Cu-2e=Cu2+,32g铜的物质的量为0.5mol,则转移电子数为1mol,但在阳极比铜活泼的金属锌、铁等先失去电子,故阳极溶解铜32 g时转移电子数大于1mol,C错误;
D.0.1mol L-1Na2SO3溶液中,根据物料守恒有:c(Na+)=2c(H2SO3)+2c(HSO)+2c(SO),根据溶液电中性有:c(Na+)+c(H+)=c(HSO)+2c(SO)+c(OH-),则:c(OH-)-c(H+)=c(Na+)-c(HSO)-2c(SO)=2c(H2SO3)+2c(HSO)+2c(SO)-c(HSO)-2c(SO)=2c(H2SO3)+c(HSO),D正确;
故选D。
【点睛】本题考查离子浓度的大小比较等问题,题目难度较大,本题易错点为D项,注意从溶液中存在的电荷守恒、质子守恒、物料守恒的角度分析。
15.D
【分析】电解池以制得、、和NaOH,根据电解池分析可知,电解池左边得到NaOH和,右边得到、,则a为阴极,b为阳极,则Cu(2)为负极,Cu(1)为正极。
【详解】A.根据前面分析得到a为电解池的阴极,故A错误;
B.电池放电过程中,Cu(2)为负极,则负极上铜失去电子发生氧化反应,电极反应为,则B错误;
C.当电路中转移2mol电子时,阳极区剩余2mol ,要使溶液呈电中性,则1mol通过膜d向右移动,故C错误;
D.电池放电过程中,Cu(2)的电极反应为,Cu(1)的电极反应为,反应前原电池左边硫酸铜物质的量为5mol,右边硫酸铜物质的量为1mol,电池从开始工作到停止放电,则左右硫酸铜物质的量为3mol,因此右侧有2mol铜离子生成,则转移4mol电子,根据,转移2mol电子得到2molNaOH即80g,因此电池从开始工作到停止放电,电解池理论上可制得160gNaOH,故D正确。
故选D。
16. 电解 金属 合金 抗腐蚀 待镀金属制品 镀层金属 镀层金属离子
【解析】略
17. < d 35.69 d c ABC 脱硫反应活化能低,脱硫反应速率快,二氧化硫水溶性好(任答一条即可)
【详解】(1)根据上图可知该反应是放热反应,因此总△H<0。整个反应历程中的控速步骤主要是看活化能高低,活化能越大,反应速率越慢,因此根据图中得出过渡态4活化能最大,因此整个反应历程中的控速步骤为第d步,其能垒(活化能)为 24.47Kcal mol 1 ( 60.16Kcal mol 1) =35.69Kcal mol 1;故答案为:<;d;35.69。
(2)①根据题意得到图中减少的是NO,又根据温度越高,速率越大,达到平衡所需时间短,因此表示500℃条件下pNO的是d,图中增加的是CO2,因此表示600℃条件下pCO2的是c;故答案为:d;c。
②根据图示,建立三段式得到,因此600℃时反应平衡常数;故答案为:。
(3)①A.增大压强,有利于反应正向进行,NO的转化率增大,故A正确;
B.从化学平衡的角度,采用Ca(ClO)2脱硫可生成微溶物CaSO4,有利于反应正向进行,脱硫效果优于NaClO,故B正确;
C.起始pH=2,pH较低,ClO-可能会与其还原产物Cl-反应即ClO-+Cl-+2H+=Cl2↑+H2O,因此脱硝效果降低,故C正确;
D.提高烟气的流速,反应不充分,则硝效果差,故D错误;
综上所述,答案为:ABC。
②吸收液脱硫效果优于脱硝效果的可能原因是脱硫反应活化能低,脱硫反应速率快或二氧化硫水溶性好,脱硫反应速率快;故答案为:脱硫反应活化能低,脱硫反应速率快,二氧化硫水溶性好(任答一条即可)。
18.(1) 失 得
(2) 正极经导线流向负极 负极经导线流向正极,不能经过电解质溶液或熔融的电解质 阳离子流向正极,阴离子流向负极
(3)
(4) 增重/产生气体 减重
【详解】(1)原电池中负极发生氧化反应,失去电子,所含元素化合价升高,正极上发生还原反应,得到电子,所含元素化合价降低,故答案为:失;得;
(2)原电池中电流是由正极经过导线流向负极,电流方向是正电荷定向移动的方向,电子带负电,其移动方向与电流方向相反,即电子由负极经过导线流向负极,电子不能经过电解质溶液或熔融的电解质,而电解质溶液或熔融的电解质属于内电路,内电路与外电路的电流方向相反,即其中离子的移动方向为阳离子流向正极,阴离子流向负极,故答案为:正极经导线流向负极;负极经导线流向正极,不能经过电解质溶液或熔融的电解质;阳离子流向正极,阴离子流向负极;
(3)根据金属活动性判断原电池正负极时一定要看电解质溶液,由于Al能与NaOH溶液反应,其他很多金属与NaOH溶液不反应,故若电解质溶液为NaOH溶液时,若有Al电极则为负极,其他电极为正极;由于Al、Fe在常温下遇到浓硝酸发生钝化阻止反应继续进行,故若电解质溶液为浓硝酸时,则Al或者Fe电极为正极,其他比Al、Fe更不活泼的电极作负极;若电解质溶液为稀盐酸、稀硫酸或盐溶液时,则一般是按照金属活动顺序为依据,更活泼的金属为负极,更不活泼的金属为正极,故可总结如下:,故答案为:;
(4)原电池负极上通常是金属电极本身失去电子,发生M-ne-=Mn+,正极一般为电解质中的阳离子得到电子生成金属单质或者H2,故一般来讲,电极上增重或者放出气体的一极为正极,电极质量减轻的一极为负极,氧气(空气)为正极,一般与电解质发生反应的为负极,故答案为:增重/产生气体;减重。
19. 环形玻璃搅拌棒 保温,防止热量散失,减小实验误差 NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1
【分析】分析仪器,碎泡沫塑料主要起保温,防止热量散失,再根据中和热的定义书写热化学方程式。
【详解】(1)仪器A的名称是环形玻璃搅拌棒,碎泡沫塑料的作用是保温,防止热量散失,减小实验误差;故答案为:环形玻璃搅拌棒;保温,防止热量散失,减小实验误差。
(2)稀硫酸和稀NaOH溶液反应的中和热的热化学方程式NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1;故答案为:NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1。
20. 3 不同意,因为不同的温度计误差不同
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1
2
3
【详解】(1)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,因此一共3次;由于不同温度计的误差不同,所以实验时不能使用两支温度计分别测量酸和碱的温度;
(2)中和热的实验原理:温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度一共3次,最后求出温度差,为了减少误差应重复2-3次,所以表格为:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1
2
3
。
21. 正 4AgNO3+2H2O4Ag+O2+4HNO3 石墨极有气泡产生 Cu极周围变蓝色 溶液中有沉淀生成 2
【分析】通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极,电源的E为负极,F为正极。
【详解】(1)根据分析可知F段为正极;
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O4Ag+O2+4HNO3;
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极铜放电生成铜离子,Cu极周围变蓝色,阴极水电离出的氢离子放电生成氢气,同时生成氢氧根,所以溶液生成氢氧化铜沉淀,所以现象为:石墨极有气泡产生;Cu极周围变蓝色; 溶液中有沉淀生成;
(4)根据2、3小题可知装置A中生成O2,装置B中生成H2,生成一个氧气转移4个电子,生成一个氢气转移2个电子,所以相同时间内生成的n(O2):n(H2)=1:2;共收集到标况下0.168L气体,即=0.0075mol,则其中n(O2)==0.0025mol,根据装置A中发生反应方程式可知同时产生的n(H+)=0.0025mol×4=0.01mol,则溶液中c(H+)==0.01mol/L,所以溶液的pH=2。
【点睛】电解池中阳极与外接电源正极相连,失电子发生氧化反应,若阳极为活泼金属电极,则活泼金属被氧化;阴极与外接电源负极相连,得电子发生还原反应。
一、单选题
1.下列反应中属于吸热反应的是
A.生石灰与水反应制熟石灰 B.氢氧化钠与盐酸反应
C.食物因氧化而变质 D.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
2.等物质的量的下列物质中,内能最大的是
A.水蒸气 B.液态水 C.冰 D.冰水混合物
3.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比是
A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2
4.下列反应属于吸热反应的是
A.碳酸钙受热分解 B.盐酸与氢氧化钠反应
C.氢气与氯气反应 D.氧化钙与水反应
5.依据如图判断,下列说法正确的是
A.氢气的燃烧热 H=-241.8kJ/mol
B.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
C.2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量低
D.2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高
6.光合作用是生物体糗以生存和繁衍的基础,其反应为。下列说法正确的是
A.反应为置换反应 B.反应吸收热量 C.是还原产物 D.葡萄糖属于电解质
7.下列四种情况下,铁的腐蚀速率由快到慢的是
A.b>a>d>c B.a>b>c>d C.d>c>b>a D.b>d>a>c
8.将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即产生电流,称为甲烷燃料电池。已知甲烷燃料电池两个电极上的反应分别为CH4-8e-+10OH-=CO32-+7H2O,2O2+8e-+4H2O=8OH-。下列有关说法中错误的是( )
A.CH4在负极上反应,O2在正极上反应
B.放电过程中电解质溶液的碱性减弱
C.此电池属于环境友好型电池
D.此电池中化学能100%转化为电能
9.下列有关化学反应与能量变化的说法正确的是
A.如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B.相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C.金刚石在一定条件下转化成石墨能量变化如图所示,则金刚石稳定性较好
D.同温同压下,H2(g)+C12(g)=2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
10.下列说法错误的是
A.需要加热才能进行的化学反应一定是吸热反应
B.化学反应中能量的变化常以热能、电能、光能等形式表现出来
C. ,说明石墨比金刚石稳定
D.氯化铵分解为吸热反应:
11.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C.①→②放出能量并形成了C-C键
D.催化剂加快了该反应的速率
12.湿法炼锌时,用于进行电解的电解液是含有Fe2+、Fe3+、Cu2+、Cl-等杂质离子的硫酸锌溶液,必须除去。除去电解液中Cl-的最佳试剂是
A.Ag2SO4 B.AgNO3 C.Pb(NO3)2 D.HNO3
13.下列实验装置能达到实验目的的是
A.测定盐酸与氢氧化钠反应的焓变 B.构成铜锌原电池
C.精炼铜 D.铁片镀银
A.A B.B C.C D.D
14.下列说法正确的是
A.5.6 g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0、ΔS>0
C.电解精炼铜过程中,电路中每通过1 mol电子,阳极溶解铜32 g
D.0.1mol·L-1 Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO)
15.相同金属在其不同浓度盐溶液中可形成浓差电池,当浓差电池正负电极室中溶液的浓度相等时,浓差电池停止放电。如图所示装置是利用浓差电池电解溶液(a、b电极均为石墨电极),可以制得、、和NaOH。下列说法正确的是
A.a为电解池的阳极
B.电池放电过程中,Cu(2)电极上的电极反应式为
C.当电路中转移2mol电子时,通过离子交换膜c向左移动
D.电池从开始工作到停止放电,电解池理论上可制得160g NaOH
二、填空题
16.电镀
(1)概念:应用_______原理在某些金属表面镀上一薄层其他_______或_______的加工工艺.
(2)目的:使金属增强_______能力,增加表面硬度和美观.
(3)原理
a.电极:_______作阴极﹔_______作阳极.
b.电解质溶液:使用含有_______的溶液作电镀液.
17.工业烟气、汽车尾气中的氮氧化物(NOx),可由多种方法进行脱除。
(1)采用NH3作为还原剂,可将NOx还原成N2和H2O。在某催化剂的表面,NH3和NO的反应历程势能变化如图所示(吸附在催化剂表面的物种用*标注)。
该反应历程包括四步基元反应:
a.NH3*+NO*→NH3NO* b.NH3NO*→NH2NO*+H*
c.NH2NO*+H*→HNNOH*+H* d.HNNOH*+H*→H2O*+N2*+H*
由上图可知该反应历程的总△H___0(填“>”、“=”或“<”)。整个反应历程中的控速步骤为第___步(选填a、b、c或d),其能垒(活化能)为___Kcal·mol-1。
(2)利用放热反应C(s)+2NO(g) CO2(g)+N2(g)可在脱除汽车尾气中NO的同时消除积碳。现将等量的NO通入两个相同体积的刚性容器内(碳粉足量),分别在500℃和600℃条件下发生上述反应,下图中a、b、c、d分别表示NO的分压pNO或CO2的分压pCO2随时间的变化关系。(气体分压=总压×组分物质的量分数)
①上中表示500℃条件下pNO的是__(选填a、b、c或d,下同),表示600℃条件下pCO2的是___。
②根据图示,列出600℃时反应平衡常数Kp的计算式__。(Kp等于生成物气体分压幂之积与反应物气体分压幂之积的比值)
(3)利用NaClO氧化吸收液可在脱除烟气中NOx的同时脱除SO2。研究发现在不同的初始pH条件下,吸收液对流动烟气的脱硫效率都接近100%,而NO的脱除率如下图所示。
①根据上图,下列有关说法正确的是____(填标号)。
A.增大压强,NO的转化率增大
B.从化学平衡的角度,采用Ca(ClO)2脱硫效果优于NaClO
C.起始pH=2,脱硝效率随时间降低可能是因为ClO-+Cl-+2H+=Cl2↑+H2O
D.为提高脱硫脱硝效果,应当增大NaClO浓度、提高烟气的流速
②吸收液脱硫效果优于脱硝效果的可能原因是____(任写一条)。
18.正负极的判断
(1)根据氧化还原反应原理:
负极:___________电子(化合价升高,发生氧化反应)
正极:___________电子(化合价降低,发生还原反应)
(2)根据电子/电流/离子流向:
电流:___________。
电子:___________。
离子:___________。
(3)根据金属活动性:一定要看电解质溶液!___________
(4)根据现象:一般来讲,___________为正极,___________为负极,氧气(空气)为正极,一般与电解质发生反应的为负极。
三、实验题
19.用如图所示装置进行中和热的测定实验。
(1)仪器A的名称是________,碎泡沫塑料的作用是________________
(2)理论上强酸强碱的中和热为57.3 kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________
20.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)做1次完整的中和热测定实验,温度计至少需使用________次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么?_______________。
(2)实验室用50 mL 0.50 mol·L-1盐酸,50 mL 0.55 mol·L-1 NaOH溶液进行测定中和热的实验,为了把测量数据记录下来,请你设计表格__________。
21.用如图所示的装置进行电解。A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色。则:
(1)电源的F端为_____________极。
(2)A中发生反应的化学方程式为________________。
(3)在B中观察到的现象是____________,______________,_________
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,,B中析出硫酸钠晶体。若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则A溶液的pH为______________。
参考答案:
1.D
【解析】常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应、铝热反应以及食物腐败、炸药爆炸;常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2) 以及某些复分解反应(如铵盐和强碱);据此解答
【详解】A.生石灰与水反应是常见放热反应,A错误;
B.盐酸与氢氧化钠溶液是中和反应,是放热反应,B错误;
C.食物因氧化而变质,属于放热反应,C错误;
D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合反应是典型的吸热反应,D正确;
故选D。
2.A
【详解】从冰到液态水,从水到水蒸气都是吸热过程,温度不变,内能增大,所以水蒸气的内能最大,故A正确;
故选A。
3.D
【详解】试题分析:三个电解槽串联,则转移的电子数相等,设均转移6e-,
由K++e-═K、Mg2++2e-═Mg、Al3++3e-═Al,
则6e-~6K~3Mg~2Al,
所以析出钾、镁、铝的物质的量之比为6:3:2,
故选D。
考点:原电池和电解池的工作原理
点评:本题考查电解,明确电解中转移电子数的关系及电极反应式是解答本题的关键,题目难度不大。
4.A
【详解】A.碳酸钙受热分解是吸热反应,A正确;
B.酸碱中和反应是放热反应,B错误;
C.氢气与氯气反应是放热反应,C错误;
D.氧化钙与水反应是放热反应,D错误;
故选D。
5.D
【详解】A.据图可知2mol H2(g)与1mol O2(g)生成2mol H2O(l)放出的热量为483.6kJ+88kJ=571.6kJ,所以氢气的燃烧热 H==-285.8kJ/mol,A错误;
B.H2O(g)生成H2O(l)时,没有发生化学键的断裂和生成,B错误;
C.据图可知2mol H2(g)与1mol O2(g)生成2mol H2O(g)为放热反应,所以2mol H2(g)与1mol O2(g)所具有的总能量比2mol H2O(g)所具有的总能量高,C错误;
D.根据C选项分析可知,D正确;
综上所述答案为D。
6.B
【详解】A.反应物中没有单质参加,该反应不是置换反应,A错误;
B.葡萄糖燃烧放热,因此其逆反应吸收热量,B正确;
C.氧元素化合价升高,是氧化产物,C错误;
D.葡萄糖不能电离,不属于电解质,属于非电解质,D错误;
答案选B。
7.A
【分析】利用腐蚀速率:电解池中阳极铁>原电池负极铁>原电池正极铁>电解池中阴极铁,据此分析;
【详解】b构成原电池,铁作负极被快速腐蚀,a也构成原电池,属于铁的吸氧腐蚀,缓慢腐蚀,d中铁构成原电池,作正极,被保护,c构成电解池,铁作阴极,被更好地保护。所以答案是b>a>d>c,选项A正确;
答案为A。
8.D
【详解】A、CH4燃料电池中,燃料失电子发生氧化反应,所以CH4在负极上反应,氧气得电子发生还原反应,所以O2在正极上反应,故A正确;
B、根据电池总反应CH4+2O2+2OH-=+3H2O知,OH-参加反应,所以溶液中OH-浓度降低,溶液的碱性减弱,故B正确;
C、该电池放电时不产生对环境有污染的物质,所以属于环境友好型电池,故C正确;
D、此电池中化学能转化为电能和少量热能,故D错误。
故选D。
9.D
【详解】A.根据图中信息,该反应是放热反应,因此反应物的键能之和小于生成物的键能之和,故A错误;
B.气态水到液态水会放出热量,因此相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量多,故B错误;
C.金刚石在一定条件下转化成石墨能量变化如图所示,根据能量越低越稳定,石墨能量低,因此石墨稳定性较好,故C错误;
D.同温同压下,H2(g)+C12(g)=2HCl(g)能量变化如图所示,焓变与反应物的总能量和生成物的总能量有关,与反应路径无关,因此无论在光照和点燃条件下,反应的△H相同,故D正确。
综上所述,答案为D。
10.A
【详解】A.需要加热才能进行的化学反应不一定是吸热反应,如铝热反应为放热反应,但需要加热至高温才进行,A项错误;
B.化学反应中反应物的总能量与生成物的总能量不相等,发生化学反应时会伴随能量变化,能量的变化常以热能、电能、光能等形式表现出来,B项正确;
C.C(s,金刚石)=C(s,石墨)为放热反应,说明1mol金刚石具有的总能量大于1mol石墨具有的总能量,能量越低、物质越稳定,故石墨比金刚石稳定,C项正确;
D.氯化铵分解为吸热反应,吸热反应的 H>0,可表示为NH4Cl(s)=NH3(g)+HCl(g) H>0,D项正确;
答案选A。
11.B
【详解】A、根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A正确;
B、CH4+CO2→CH3COOH过程中,C-H键、C=O均发生断裂,B错误;
C、根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C正确;
D、催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D正确;
答案选B。
【点睛】本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
12.A
【详解】A.加入硫酸银,使其与氯离子作用,生成难溶的氯化银沉淀,然后过滤即可除去Cl-,A正确;
B.加入硝酸银引入了新杂质硝酸根离子,B错误;
C.加入硝酸铅引入了新杂质硝酸根离子,C错误;
D.加入硝酸试剂不能除去Cl-且引入了新的杂质离子,D错误;
故选A。
13.B
【详解】A.没有环形玻璃搅拌棒,不能使酸、碱充分混合,因此不能准确测定中和热,A不能达到实验目的,A不符合题意;
B.该装置具备原电池构成条件,构成铜锌原电池,B符合题意;
C.精炼铜时粗铜作阳极,与电源的正极连接;精铜作阴极,与电源负极连接,图示装置电源连接方式不对,C不符合题意;
D.铁片上镀银时,应该是镀件铁片为阴极,与电源负极连接;镀层金属银为阳极,与电源正极连接,含有Ag+的AgNO3溶液为电解质溶液,图示连接不合理,D不符合题意;
故合理选项是B。
14.D
【详解】A.5.6g铁与硝酸反应生成物可能是Fe2+或Fe3+离子,当生成Fe2+离子时,转移的电子数为0.2×6.02×1023,当生成Fe3+离子时,转移的电子数为0.3×6.02×1023,A错误;
B.MgCl2的分解反应属于吸热反应,△H>0,反应后生成气体,熵变增加,△S>0,B错误;
C.由Cu-2e=Cu2+,32g铜的物质的量为0.5mol,则转移电子数为1mol,但在阳极比铜活泼的金属锌、铁等先失去电子,故阳极溶解铜32 g时转移电子数大于1mol,C错误;
D.0.1mol L-1Na2SO3溶液中,根据物料守恒有:c(Na+)=2c(H2SO3)+2c(HSO)+2c(SO),根据溶液电中性有:c(Na+)+c(H+)=c(HSO)+2c(SO)+c(OH-),则:c(OH-)-c(H+)=c(Na+)-c(HSO)-2c(SO)=2c(H2SO3)+2c(HSO)+2c(SO)-c(HSO)-2c(SO)=2c(H2SO3)+c(HSO),D正确;
故选D。
【点睛】本题考查离子浓度的大小比较等问题,题目难度较大,本题易错点为D项,注意从溶液中存在的电荷守恒、质子守恒、物料守恒的角度分析。
15.D
【分析】电解池以制得、、和NaOH,根据电解池分析可知,电解池左边得到NaOH和,右边得到、,则a为阴极,b为阳极,则Cu(2)为负极,Cu(1)为正极。
【详解】A.根据前面分析得到a为电解池的阴极,故A错误;
B.电池放电过程中,Cu(2)为负极,则负极上铜失去电子发生氧化反应,电极反应为,则B错误;
C.当电路中转移2mol电子时,阳极区剩余2mol ,要使溶液呈电中性,则1mol通过膜d向右移动,故C错误;
D.电池放电过程中,Cu(2)的电极反应为,Cu(1)的电极反应为,反应前原电池左边硫酸铜物质的量为5mol,右边硫酸铜物质的量为1mol,电池从开始工作到停止放电,则左右硫酸铜物质的量为3mol,因此右侧有2mol铜离子生成,则转移4mol电子,根据,转移2mol电子得到2molNaOH即80g,因此电池从开始工作到停止放电,电解池理论上可制得160gNaOH,故D正确。
故选D。
16. 电解 金属 合金 抗腐蚀 待镀金属制品 镀层金属 镀层金属离子
【解析】略
17. < d 35.69 d c ABC 脱硫反应活化能低,脱硫反应速率快,二氧化硫水溶性好(任答一条即可)
【详解】(1)根据上图可知该反应是放热反应,因此总△H<0。整个反应历程中的控速步骤主要是看活化能高低,活化能越大,反应速率越慢,因此根据图中得出过渡态4活化能最大,因此整个反应历程中的控速步骤为第d步,其能垒(活化能)为 24.47Kcal mol 1 ( 60.16Kcal mol 1) =35.69Kcal mol 1;故答案为:<;d;35.69。
(2)①根据题意得到图中减少的是NO,又根据温度越高,速率越大,达到平衡所需时间短,因此表示500℃条件下pNO的是d,图中增加的是CO2,因此表示600℃条件下pCO2的是c;故答案为:d;c。
②根据图示,建立三段式得到,因此600℃时反应平衡常数;故答案为:。
(3)①A.增大压强,有利于反应正向进行,NO的转化率增大,故A正确;
B.从化学平衡的角度,采用Ca(ClO)2脱硫可生成微溶物CaSO4,有利于反应正向进行,脱硫效果优于NaClO,故B正确;
C.起始pH=2,pH较低,ClO-可能会与其还原产物Cl-反应即ClO-+Cl-+2H+=Cl2↑+H2O,因此脱硝效果降低,故C正确;
D.提高烟气的流速,反应不充分,则硝效果差,故D错误;
综上所述,答案为:ABC。
②吸收液脱硫效果优于脱硝效果的可能原因是脱硫反应活化能低,脱硫反应速率快或二氧化硫水溶性好,脱硫反应速率快;故答案为:脱硫反应活化能低,脱硫反应速率快,二氧化硫水溶性好(任答一条即可)。
18.(1) 失 得
(2) 正极经导线流向负极 负极经导线流向正极,不能经过电解质溶液或熔融的电解质 阳离子流向正极,阴离子流向负极
(3)
(4) 增重/产生气体 减重
【详解】(1)原电池中负极发生氧化反应,失去电子,所含元素化合价升高,正极上发生还原反应,得到电子,所含元素化合价降低,故答案为:失;得;
(2)原电池中电流是由正极经过导线流向负极,电流方向是正电荷定向移动的方向,电子带负电,其移动方向与电流方向相反,即电子由负极经过导线流向负极,电子不能经过电解质溶液或熔融的电解质,而电解质溶液或熔融的电解质属于内电路,内电路与外电路的电流方向相反,即其中离子的移动方向为阳离子流向正极,阴离子流向负极,故答案为:正极经导线流向负极;负极经导线流向正极,不能经过电解质溶液或熔融的电解质;阳离子流向正极,阴离子流向负极;
(3)根据金属活动性判断原电池正负极时一定要看电解质溶液,由于Al能与NaOH溶液反应,其他很多金属与NaOH溶液不反应,故若电解质溶液为NaOH溶液时,若有Al电极则为负极,其他电极为正极;由于Al、Fe在常温下遇到浓硝酸发生钝化阻止反应继续进行,故若电解质溶液为浓硝酸时,则Al或者Fe电极为正极,其他比Al、Fe更不活泼的电极作负极;若电解质溶液为稀盐酸、稀硫酸或盐溶液时,则一般是按照金属活动顺序为依据,更活泼的金属为负极,更不活泼的金属为正极,故可总结如下:,故答案为:;
(4)原电池负极上通常是金属电极本身失去电子,发生M-ne-=Mn+,正极一般为电解质中的阳离子得到电子生成金属单质或者H2,故一般来讲,电极上增重或者放出气体的一极为正极,电极质量减轻的一极为负极,氧气(空气)为正极,一般与电解质发生反应的为负极,故答案为:增重/产生气体;减重。
19. 环形玻璃搅拌棒 保温,防止热量散失,减小实验误差 NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1
【分析】分析仪器,碎泡沫塑料主要起保温,防止热量散失,再根据中和热的定义书写热化学方程式。
【详解】(1)仪器A的名称是环形玻璃搅拌棒,碎泡沫塑料的作用是保温,防止热量散失,减小实验误差;故答案为:环形玻璃搅拌棒;保温,防止热量散失,减小实验误差。
(2)稀硫酸和稀NaOH溶液反应的中和热的热化学方程式NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1;故答案为:NaOH(aq) + H2SO4(aq) = Na2SO4(aq) + H2O(l) ΔH = -57.3 kJ·mol-1。
20. 3 不同意,因为不同的温度计误差不同
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1
2
3
【详解】(1)温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,因此一共3次;由于不同温度计的误差不同,所以实验时不能使用两支温度计分别测量酸和碱的温度;
(2)中和热的实验原理:温度计要测反应前酸溶液的温度,测反应前碱溶液的温度,求出两者的平均值,混合反应后测最高温度一共3次,最后求出温度差,为了减少误差应重复2-3次,所以表格为:
温度 实验次数 起始温度t1/℃ 终止温度t2/℃ 温度差(t2-t1)/℃
盐酸 NaOH溶液 平均值
1
2
3
。
21. 正 4AgNO3+2H2O4Ag+O2+4HNO3 石墨极有气泡产生 Cu极周围变蓝色 溶液中有沉淀生成 2
【分析】通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极,电源的E为负极,F为正极。
【详解】(1)根据分析可知F段为正极;
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O4Ag+O2+4HNO3;
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极铜放电生成铜离子,Cu极周围变蓝色,阴极水电离出的氢离子放电生成氢气,同时生成氢氧根,所以溶液生成氢氧化铜沉淀,所以现象为:石墨极有气泡产生;Cu极周围变蓝色; 溶液中有沉淀生成;
(4)根据2、3小题可知装置A中生成O2,装置B中生成H2,生成一个氧气转移4个电子,生成一个氢气转移2个电子,所以相同时间内生成的n(O2):n(H2)=1:2;共收集到标况下0.168L气体,即=0.0075mol,则其中n(O2)==0.0025mol,根据装置A中发生反应方程式可知同时产生的n(H+)=0.0025mol×4=0.01mol,则溶液中c(H+)==0.01mol/L,所以溶液的pH=2。
【点睛】电解池中阳极与外接电源正极相连,失电子发生氧化反应,若阳极为活泼金属电极,则活泼金属被氧化;阴极与外接电源负极相连,得电子发生还原反应。
