4.1原电池 (同步练习题)(含解析)—— 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1原电池 (同步练习题)(含解析)—— 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 195.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 09:37:19 | ||
图片预览



文档简介
4.1原电池同步练习题
一、选择题
1.下列叙述正确的是
A.原电池是把电能转化为化学能的装置
B.使用催化剂能降低化学反应的反应热()
C.平衡正向移动时,和原平衡相比,正反应速率一定增大
D.醋酸钠溶液中离子浓度的关系满足
2.记录学习笔记是学习过程中的良好习惯,可以帮助我们归纳概括、整理提升学习的内容。下面是一位同学学习Zn-Cu原电池后整理的学习笔记,呈现了原电池知识的思维导图。
学习笔记中记录错误的是
A.①表示电流方向
B.②表示移动方向
C.③表示电池负极的物质转化及反应类型
D.该装置把化学能转化为电能
3.Fe-Cu原电池的示意图如图,电池工作时,下列说法正确的是
A.Fe电极为正极
B.Cu电极上发生还原反应
C.移向Fe电极
D.外电路中电子的流动方向:Cu→导线→Fe
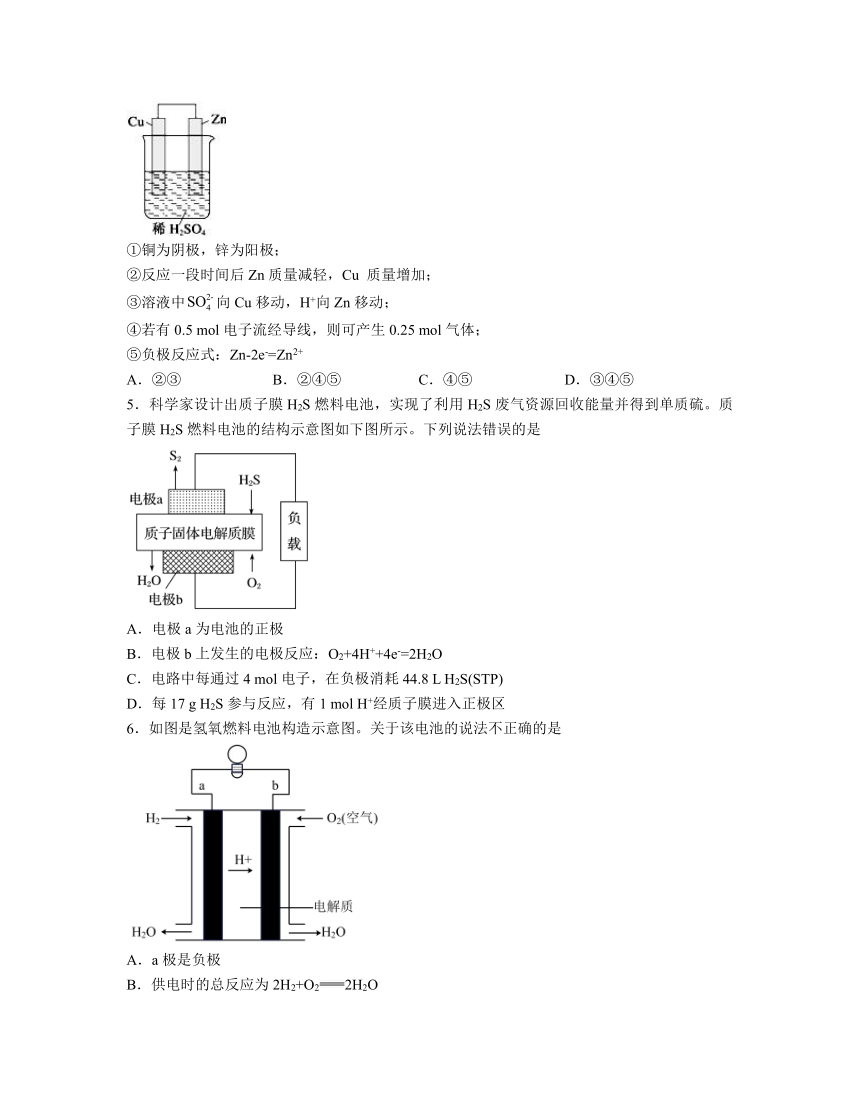
4.如图是Zn、Cu 和稀硫酸形成的原电池,则下列结论中正确的是
①铜为阴极,锌为阳极;
②反应一段时间后Zn质量减轻,Cu 质量增加;
③溶液中向Cu移动,H+向Zn移动;
④若有0.5 mol电子流经导线,则可产生0.25 mol气体;
⑤负极反应式:Zn-2e-=Zn2+
A.②③ B.②④⑤ C.④⑤ D.③④⑤
5.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法错误的是
A.电极a为电池的正极
B.电极b上发生的电极反应:O2+4H++4e-=2H2O
C.电路中每通过4 mol电子,在负极消耗44.8 L H2S(STP)
D.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
6.如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
A.a极是负极
B.供电时的总反应为2H2+O22H2O
C.电子由b通过灯泡流向a
D.燃料电池由外设装备提供燃料和氧化剂
7.Cu-Zn (假设起始时两电极质量完全相同)原电池的装置示意图如图,下列说法正确的是(不考虑水解反应)
A.M为Zn电极,发生还原反应,失去电子
B.电池工作一段时间后,溶液的pH保持不变
C.电池工作一段时间后,M和N两电极质量仍相同
D.每转移0.2 mol电子,同时生成2.24 L
8.对于原电池的电极名称,下列叙述有错误的是( )
A.发生氧化反应的为负极 B.正极为电子流入的一极
C.比较不活泼的金属为负极 D.电流的方向由正极到负极
二、非选择题
9.亚铁氰化钾K4[Fe(CN)6]俗名黄血盐,可溶于水,不溶于乙醇,应用广泛。工业上可以用电镀厂排放的含NaCN废液为主要原料制备黄血盐;常温下,HCN的电离常数Ka=6.2×10-10。回答下列问题:
(1)实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是___________。浓度均为0.5mol·L 1的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:___________。
(2)工业生产中NaCN、FeSO4、KCl等物质经过一系列操作可转化为K4[(Fe(CN)6],相同温度下溶解度:Na4[Fe(CN)6]___________K4[Fe(CN)6](填“大于”、“小于”或“等于”)。
(3)实验室中,K4[(Fe(CN)6]可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______。
(4)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[(Fe(CN)6]和亚铁氰化钾K4[(Fe(CN)6]的混合溶液。
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为___________。
10.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向Mg
根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同?___________。
(2)实验3中铝为___________极,电极反应式为;石墨为___________极,电极反应式为;电池总反应式为___________。
(3)实验4中的铝为___________极,原因是___________。写出铝电极的电极反应式:___________。
(4)根据以上实验结果,在原电池中相对活泼的金属作正极还是作负极受到哪些因素的影响___________?
【参考答案】
一、选择题
1.D
解析:A.原电池是把化学能转化为电能的装置,故A错误;
B.催化剂只能改变活化能,但是不能改变反应的反应热,故B错误;
C.若减小生成物的浓度使平衡正向移动,则反应速率减小,故C错误;
D.醋酸钠溶液中根据质子守恒可得,故D正确;
故选D。
2.A
【分析】该装置为原电池,存在自发的氧化还原反应,锌失去电子,发生氧化反应,为负极,铜为正极,发生得电子的还原反应生成氢气。
解析:A. 原电池中,电子从负极经导线流向正极,①表示电子移动的方向,故A错误;
B. 原电池中,阳离子移动向正极,②表示移动方向,故B正确;
C.锌为负极,失去电子发生氧化反应,故③表示电池负极的物质转化及反应类型,故C正确;
D. 该装置为原电池,把化学能转化为电能,故D正确;
故选A。
3.B
解析:A.Fe-Cu原电池中,Fe电极为负极,故A错误;
B.Fe-Cu原电池,Cu为正极,发生还原反应;故B正确;
C.Fe为负极,Cu为正极,正离子向正极移动,移向Cu电极,故C错误;
D.外电路中电子的流动方向:Fe→导线→Cu,故D错误;
故答案选B。
4.C
【分析】该图为铜锌原电池,Zn作负极,Cu作正极,负极上电极反应为:Zn-2e-=Zn2+,正极上电极反应为:2H++2e-=H2↑。
解析:①根据分析,铜为正极,锌为负极,故①错误;
②根据分析中电极反应可知,反应一段时间后Zn质量减轻,Cu 质量不变,故②错误;
③原电池中,阳离子向正极移动,阴离子向负极移动,溶液中向Zn移动,H+向Cu移动,故③错误;
④若有0.5 mol电子流经导线,根据正极上电极反应:2H++2e-=H2↑,则可产生0.25 mol气体,故④正确;
⑤根据分析,负极反应式:Zn-2e-=Zn2+,故⑤正确;
综上分析,结论正确的为④⑤,答案选C。
5.A
【分析】该燃料电池中,a电极上H2S失电子生成S2和H+,为负极,负极反应式为2H2S 4e =S2+4H+;b电极为正极,正极上O2得电子和氢离子反应生成H2O,电极反应式为O2+4H++4e =2H2O,质子从负极流向正极。
解析:A.通过以上分析知,a电极上H2S失电子生成S2,为负极,故A错误;
B.b电极上氧气得电子和氢离子反应生成水,O2+4H++4e =2H2O,故B正确;
C.负极反应式为2H2S 4e =S2+4H+,电路中每通过4 mol电子,反应硫化氢的物质的量为2mol,在STP下体积为44.8 L,故C正确;
D.,根据2H2S 4e =S2+4H+,每17gH2S参与反应,有1molH+经质子膜进入正极区,故D正确;
故选A。
6.C
解析:A.氢氧燃料电池总反应为2H2+O2=2H2O,氢气被氧化,所以a为负极,b为正极,故A正确;
B.电池放电时氢气被氧化生成水,氧气被还原生成水,所以电池总反应为2H2+O2=2H2O,故B正确;
C.原电池中电子由负极经外电路流向正极,即由a通过灯泡流向b,故C错误;
D.燃料电池中将化学能转化为电能,需要外设备提供燃料(氢气)和氧化剂(氧气),故D正确;
综上所述答案为C。
7.B
【分析】由题干图示中电子转移的方向可知,M即为负极,失去电子,发生氧化反应,故M为Zn,电极反应为:Zn-2e-=Zn2+,N为Cu,电极反应为:Cu2++2e-=Cu,据此分析解题。
解析:A.由分析可知,M为Zn电极,发生氧化反应,失去电子,电极反应为:Zn-2e-=Zn2+,A错误;
B.由分析可知,电池工作一段时间后,溶液溶质由CuCl2转化为ZnCl2,若不考虑水解反应,溶液的pH保持不变,B正确;
C.由分析可知,M为Zn,电极反应为:Zn-2e-=Zn2+,N为Cu,电极反应为:Cu2++2e-=Cu,电池工作一段时间后,M电极质量减少,N电极质量增大,故两电极质量不相同M<N,C错误;
D.由分析可知,该电极反应中不生成Cl2,D错误;
故答案为:B。
8.C
解析:A.原电池中,失电子发生氧化反应的为负极,故A正确;
B.原电池中电子由负极经外电路流向正极,则正极为电子流入的一极,故B正确;
C.一般情况下,比较不活泼的金属为正极,活泼金属为负极,故C错误;
D.原电池中电子由负极经外电路流向正极,电子与电流流向相反,电流的方向由正极到负极,故D正确;
答案选C。
【点睛】
原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是负极,电流从正极沿导线流向负极,电子与电流流向相反。
二、非选择题
9.(1) 抑制CN 水解 碱 Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性
(2)大于
(3)KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq)
(4) b Fe(CN) e =Fe(CN)
解析:(1)由于CN 要发生水解,因此将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是抑制CN 水解。HCN的电离常数Ka=6.2×10 10,Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,因此浓度均为0.5mol·L 1的NaCN和HCN的混合溶液显所以溶液呈碱性;故答案为:抑制CN 水解;碱;Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性。
(2)工业生产中NaCN、FeSO4、KCl等物质经过一系列操作可转化为K4[(Fe(CN)6],反应都是向离子浓度减小的方向进行,因此相同温度下溶解度:Na4[Fe(CN)6] 大于K4[Fe(CN)6];故答案为:大于。
(3)实验室中,K4[(Fe(CN)6]可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物TlFe[Fe(CN)6],其治疗Tl2SO4中毒的离子方程式:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);故答案为:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq)。
(4)①根据题中得到催化剂a为负极,b为正极,根据原电池“同性相吸”原理,因此K+移向正极即催化剂b;故答案为:b。②催化剂a是负极,失去电子,因此催化剂a表面发生的反应为Fe(CN) e =Fe(CN);故答案为:Fe(CN) e =Fe(CN)。
10.(1)不相同
(2) 负 正 2Al+6H+=2Al3++3H2↑
(3)负 尽管金属活动性:Mg>Al,但是Al能够与NaOH溶液反应,而Mg不能发生反应 Al-3e-+4OH-=+2H2O
(4)电极活动性强弱、电解液种类
解析:(1)在实验1中,Mg、Al都可以与盐酸发生反应,由于金属活动性:Mg>Al,所以在构成的原电池反应中,Mg为负极,Al为正极;在实验2中,Al、Cu及盐酸构成原电池,由于Al的活动性比Cu强,所以Al电极为负极,Cu电极为正极,因此实验1、2中Al电极的作用不相同;
(2)实验3中由于电极活动性:Al>C,Al能够与HCl发生置换反应,所以在构成的原电池反应中,Al为负极;石墨电极为正极,正极上溶液中的H+得到电子发生还原反应产生H2;根据电极反应可知铝和氢离子反应生成氢气和铝离子,可知总反应方程式为2Al+6H+=2Al3++3H2↑;
(3)在实验4中,尽管金属活动性:Mg>Al,但是Al能够与NaOH溶液反应,而Mg不能发生反应,故在构成的原电池反应中,Al为负极,Mg为正极,负极的电极反应式为:Al-3e-+4OH-=+2H2O。
(4)根据以上实验结果,在原电池中相对活泼的金属作正极还是作负极受到电极活动性强弱、电解液种类的影响。
一、选择题
1.下列叙述正确的是
A.原电池是把电能转化为化学能的装置
B.使用催化剂能降低化学反应的反应热()
C.平衡正向移动时,和原平衡相比,正反应速率一定增大
D.醋酸钠溶液中离子浓度的关系满足
2.记录学习笔记是学习过程中的良好习惯,可以帮助我们归纳概括、整理提升学习的内容。下面是一位同学学习Zn-Cu原电池后整理的学习笔记,呈现了原电池知识的思维导图。
学习笔记中记录错误的是
A.①表示电流方向
B.②表示移动方向
C.③表示电池负极的物质转化及反应类型
D.该装置把化学能转化为电能
3.Fe-Cu原电池的示意图如图,电池工作时,下列说法正确的是
A.Fe电极为正极
B.Cu电极上发生还原反应
C.移向Fe电极
D.外电路中电子的流动方向:Cu→导线→Fe
4.如图是Zn、Cu 和稀硫酸形成的原电池,则下列结论中正确的是
①铜为阴极,锌为阳极;
②反应一段时间后Zn质量减轻,Cu 质量增加;
③溶液中向Cu移动,H+向Zn移动;
④若有0.5 mol电子流经导线,则可产生0.25 mol气体;
⑤负极反应式:Zn-2e-=Zn2+
A.②③ B.②④⑤ C.④⑤ D.③④⑤
5.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法错误的是
A.电极a为电池的正极
B.电极b上发生的电极反应:O2+4H++4e-=2H2O
C.电路中每通过4 mol电子,在负极消耗44.8 L H2S(STP)
D.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
6.如图是氢氧燃料电池构造示意图。关于该电池的说法不正确的是
A.a极是负极
B.供电时的总反应为2H2+O22H2O
C.电子由b通过灯泡流向a
D.燃料电池由外设装备提供燃料和氧化剂
7.Cu-Zn (假设起始时两电极质量完全相同)原电池的装置示意图如图,下列说法正确的是(不考虑水解反应)
A.M为Zn电极,发生还原反应,失去电子
B.电池工作一段时间后,溶液的pH保持不变
C.电池工作一段时间后,M和N两电极质量仍相同
D.每转移0.2 mol电子,同时生成2.24 L
8.对于原电池的电极名称,下列叙述有错误的是( )
A.发生氧化反应的为负极 B.正极为电子流入的一极
C.比较不活泼的金属为负极 D.电流的方向由正极到负极
二、非选择题
9.亚铁氰化钾K4[Fe(CN)6]俗名黄血盐,可溶于水,不溶于乙醇,应用广泛。工业上可以用电镀厂排放的含NaCN废液为主要原料制备黄血盐;常温下,HCN的电离常数Ka=6.2×10-10。回答下列问题:
(1)实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是___________。浓度均为0.5mol·L 1的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:___________。
(2)工业生产中NaCN、FeSO4、KCl等物质经过一系列操作可转化为K4[(Fe(CN)6],相同温度下溶解度:Na4[Fe(CN)6]___________K4[Fe(CN)6](填“大于”、“小于”或“等于”)。
(3)实验室中,K4[(Fe(CN)6]可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______。
(4)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[(Fe(CN)6]和亚铁氰化钾K4[(Fe(CN)6]的混合溶液。
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为___________。
10.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 电极材料 电解质溶液 电流表指针偏转方向
1 Mg、Al 稀盐酸 偏向Al
2 Al、Cu 稀盐酸 偏向Cu
3 Al、石墨 稀盐酸 偏向石墨
4 Mg、Al NaOH溶液 偏向Mg
根据上表中记录的实验现象,回答下列问题。
(1)实验1、2中Al电极的作用是否相同?___________。
(2)实验3中铝为___________极,电极反应式为;石墨为___________极,电极反应式为;电池总反应式为___________。
(3)实验4中的铝为___________极,原因是___________。写出铝电极的电极反应式:___________。
(4)根据以上实验结果,在原电池中相对活泼的金属作正极还是作负极受到哪些因素的影响___________?
【参考答案】
一、选择题
1.D
解析:A.原电池是把化学能转化为电能的装置,故A错误;
B.催化剂只能改变活化能,但是不能改变反应的反应热,故B错误;
C.若减小生成物的浓度使平衡正向移动,则反应速率减小,故C错误;
D.醋酸钠溶液中根据质子守恒可得,故D正确;
故选D。
2.A
【分析】该装置为原电池,存在自发的氧化还原反应,锌失去电子,发生氧化反应,为负极,铜为正极,发生得电子的还原反应生成氢气。
解析:A. 原电池中,电子从负极经导线流向正极,①表示电子移动的方向,故A错误;
B. 原电池中,阳离子移动向正极,②表示移动方向,故B正确;
C.锌为负极,失去电子发生氧化反应,故③表示电池负极的物质转化及反应类型,故C正确;
D. 该装置为原电池,把化学能转化为电能,故D正确;
故选A。
3.B
解析:A.Fe-Cu原电池中,Fe电极为负极,故A错误;
B.Fe-Cu原电池,Cu为正极,发生还原反应;故B正确;
C.Fe为负极,Cu为正极,正离子向正极移动,移向Cu电极,故C错误;
D.外电路中电子的流动方向:Fe→导线→Cu,故D错误;
故答案选B。
4.C
【分析】该图为铜锌原电池,Zn作负极,Cu作正极,负极上电极反应为:Zn-2e-=Zn2+,正极上电极反应为:2H++2e-=H2↑。
解析:①根据分析,铜为正极,锌为负极,故①错误;
②根据分析中电极反应可知,反应一段时间后Zn质量减轻,Cu 质量不变,故②错误;
③原电池中,阳离子向正极移动,阴离子向负极移动,溶液中向Zn移动,H+向Cu移动,故③错误;
④若有0.5 mol电子流经导线,根据正极上电极反应:2H++2e-=H2↑,则可产生0.25 mol气体,故④正确;
⑤根据分析,负极反应式:Zn-2e-=Zn2+,故⑤正确;
综上分析,结论正确的为④⑤,答案选C。
5.A
【分析】该燃料电池中,a电极上H2S失电子生成S2和H+,为负极,负极反应式为2H2S 4e =S2+4H+;b电极为正极,正极上O2得电子和氢离子反应生成H2O,电极反应式为O2+4H++4e =2H2O,质子从负极流向正极。
解析:A.通过以上分析知,a电极上H2S失电子生成S2,为负极,故A错误;
B.b电极上氧气得电子和氢离子反应生成水,O2+4H++4e =2H2O,故B正确;
C.负极反应式为2H2S 4e =S2+4H+,电路中每通过4 mol电子,反应硫化氢的物质的量为2mol,在STP下体积为44.8 L,故C正确;
D.,根据2H2S 4e =S2+4H+,每17gH2S参与反应,有1molH+经质子膜进入正极区,故D正确;
故选A。
6.C
解析:A.氢氧燃料电池总反应为2H2+O2=2H2O,氢气被氧化,所以a为负极,b为正极,故A正确;
B.电池放电时氢气被氧化生成水,氧气被还原生成水,所以电池总反应为2H2+O2=2H2O,故B正确;
C.原电池中电子由负极经外电路流向正极,即由a通过灯泡流向b,故C错误;
D.燃料电池中将化学能转化为电能,需要外设备提供燃料(氢气)和氧化剂(氧气),故D正确;
综上所述答案为C。
7.B
【分析】由题干图示中电子转移的方向可知,M即为负极,失去电子,发生氧化反应,故M为Zn,电极反应为:Zn-2e-=Zn2+,N为Cu,电极反应为:Cu2++2e-=Cu,据此分析解题。
解析:A.由分析可知,M为Zn电极,发生氧化反应,失去电子,电极反应为:Zn-2e-=Zn2+,A错误;
B.由分析可知,电池工作一段时间后,溶液溶质由CuCl2转化为ZnCl2,若不考虑水解反应,溶液的pH保持不变,B正确;
C.由分析可知,M为Zn,电极反应为:Zn-2e-=Zn2+,N为Cu,电极反应为:Cu2++2e-=Cu,电池工作一段时间后,M电极质量减少,N电极质量增大,故两电极质量不相同M<N,C错误;
D.由分析可知,该电极反应中不生成Cl2,D错误;
故答案为:B。
8.C
解析:A.原电池中,失电子发生氧化反应的为负极,故A正确;
B.原电池中电子由负极经外电路流向正极,则正极为电子流入的一极,故B正确;
C.一般情况下,比较不活泼的金属为正极,活泼金属为负极,故C错误;
D.原电池中电子由负极经外电路流向正极,电子与电流流向相反,电流的方向由正极到负极,故D正确;
答案选C。
【点睛】
原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是负极,电流从正极沿导线流向负极,电子与电流流向相反。
二、非选择题
9.(1) 抑制CN 水解 碱 Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性
(2)大于
(3)KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq)
(4) b Fe(CN) e =Fe(CN)
解析:(1)由于CN 要发生水解,因此将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是抑制CN 水解。HCN的电离常数Ka=6.2×10 10,Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,因此浓度均为0.5mol·L 1的NaCN和HCN的混合溶液显所以溶液呈碱性;故答案为:抑制CN 水解;碱;Kh= 1.6×10 5>6.2×10 10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性。
(2)工业生产中NaCN、FeSO4、KCl等物质经过一系列操作可转化为K4[(Fe(CN)6],反应都是向离子浓度减小的方向进行,因此相同温度下溶解度:Na4[Fe(CN)6] 大于K4[Fe(CN)6];故答案为:大于。
(3)实验室中,K4[(Fe(CN)6]可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物TlFe[Fe(CN)6],其治疗Tl2SO4中毒的离子方程式:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);故答案为:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq)。
(4)①根据题中得到催化剂a为负极,b为正极,根据原电池“同性相吸”原理,因此K+移向正极即催化剂b;故答案为:b。②催化剂a是负极,失去电子,因此催化剂a表面发生的反应为Fe(CN) e =Fe(CN);故答案为:Fe(CN) e =Fe(CN)。
10.(1)不相同
(2) 负 正 2Al+6H+=2Al3++3H2↑
(3)负 尽管金属活动性:Mg>Al,但是Al能够与NaOH溶液反应,而Mg不能发生反应 Al-3e-+4OH-=+2H2O
(4)电极活动性强弱、电解液种类
解析:(1)在实验1中,Mg、Al都可以与盐酸发生反应,由于金属活动性:Mg>Al,所以在构成的原电池反应中,Mg为负极,Al为正极;在实验2中,Al、Cu及盐酸构成原电池,由于Al的活动性比Cu强,所以Al电极为负极,Cu电极为正极,因此实验1、2中Al电极的作用不相同;
(2)实验3中由于电极活动性:Al>C,Al能够与HCl发生置换反应,所以在构成的原电池反应中,Al为负极;石墨电极为正极,正极上溶液中的H+得到电子发生还原反应产生H2;根据电极反应可知铝和氢离子反应生成氢气和铝离子,可知总反应方程式为2Al+6H+=2Al3++3H2↑;
(3)在实验4中,尽管金属活动性:Mg>Al,但是Al能够与NaOH溶液反应,而Mg不能发生反应,故在构成的原电池反应中,Al为负极,Mg为正极,负极的电极反应式为:Al-3e-+4OH-=+2H2O。
(4)根据以上实验结果,在原电池中相对活泼的金属作正极还是作负极受到电极活动性强弱、电解液种类的影响。
