福建省厦门重点中学2023-2024学年高二上学期期中考试化学试题(含解析)
文档属性
| 名称 | 福建省厦门重点中学2023-2024学年高二上学期期中考试化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 09:45:16 | ||
图片预览


文档简介
2023—2024学年高二上学期期中考试
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Li-7 P-31 S-32
一、选择题(本题共10小题,每小题4分,共40分,每小题只有一个正确答案)
1.对于反应2NO(g)+O2(g)=2NO2(g) ΔH=-116.4 kJ·mol-1,下列说法正确的是
A.该反应能够自发的原因是ΔS > 0
B.工业上使用合适的催化剂可提高NO2的生产效率
C.升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动
D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1
2.下列说法中正确的是
A.若 ,则1 mol 置于密闭容器中充分反应放出的热量为28.45kJ
B.若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为
C.在稀溶液中,强酸与强碱反应的中和热为,若将含有0.5 mol 的浓硫酸和含有1 mol NaOH的溶液混合,放出的热量等于57.3kJ
D.的摩尔燃烧焓是,则
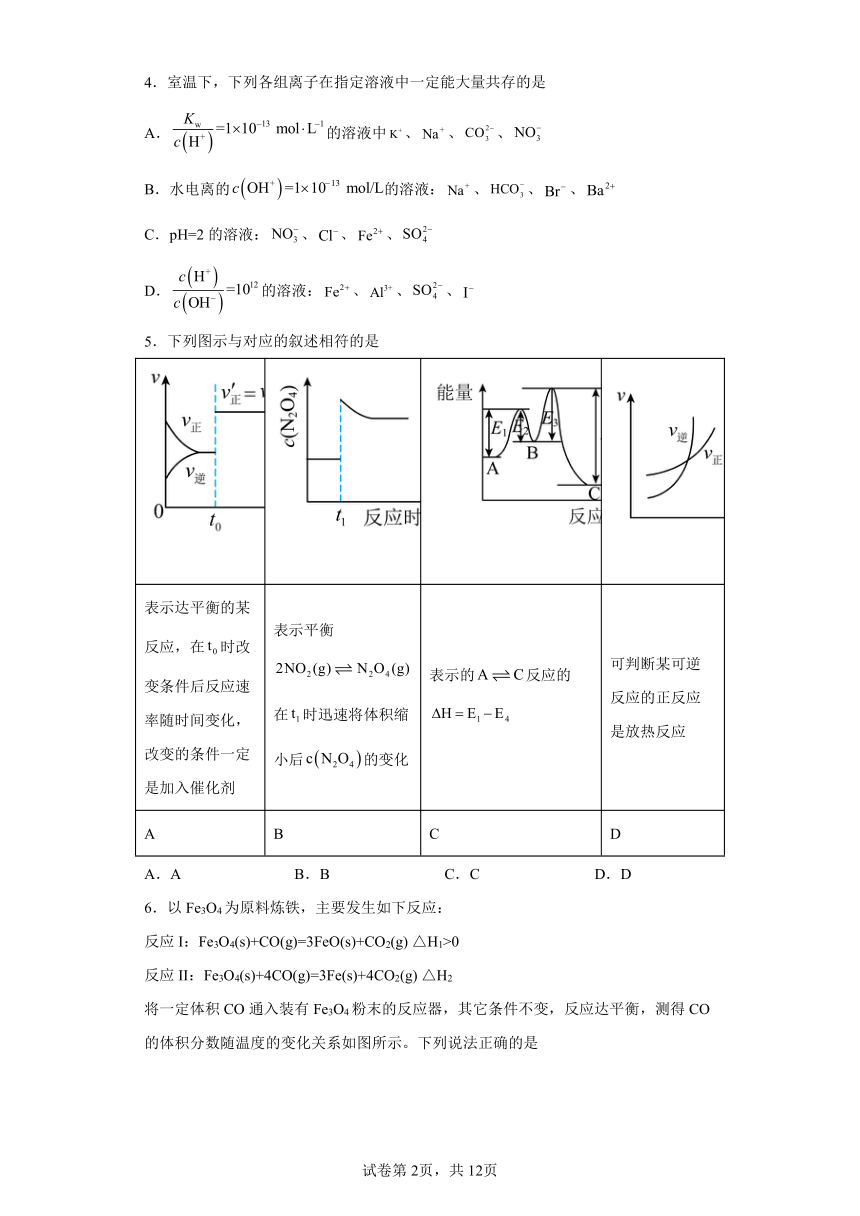
3.下列有关电化学装置的说法正确的是
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
4.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中、、、
B.水电离的的溶液:、、、
C.pH=2的溶液:、、、
D.的溶液:、、、
5.下列图示与对应的叙述相符的是
表示达平衡的某反应,在时改变条件后反应速率随时间变化,改变的条件一定是加入催化剂 表示平衡在时迅速将体积缩小后的变化 表示的反应的 可判断某可逆反应的正反应是放热反应
A B C D
A.A B.B C.C D.D
6.以Fe3O4为原料炼铁,主要发生如下反应:
反应I:Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H1>0
反应II:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是
A.△H2>0
B.反应温度较低时,Fe3O4主要还原产物为Fe
C.1040℃时,反应I的化学平衡常数K=0.25
D.在恒温、恒容条件下,当容器压强保持不变,反应I、II均达到平衡状态
7.某学习小组为了探究的反应速率(v)与反应物浓度(c)的关系,在20℃条件下进行实验,所得的数据如下:
实验编号 相关数据 ① ② ③ ④ ⑤
0.008 0.008 0.004 0.008 0.004
0.001 0.001 0.001 0.002 0.002
0.10 0.20 0.20 0.10 0.40
v1
已知:该反应的速率方程为:(k为常数)
下列结论不正确的是
A.若温度升高到40℃,则化学反应速率增大
B.等浓度的和,对反应速率的影响小
C.速率方程中的
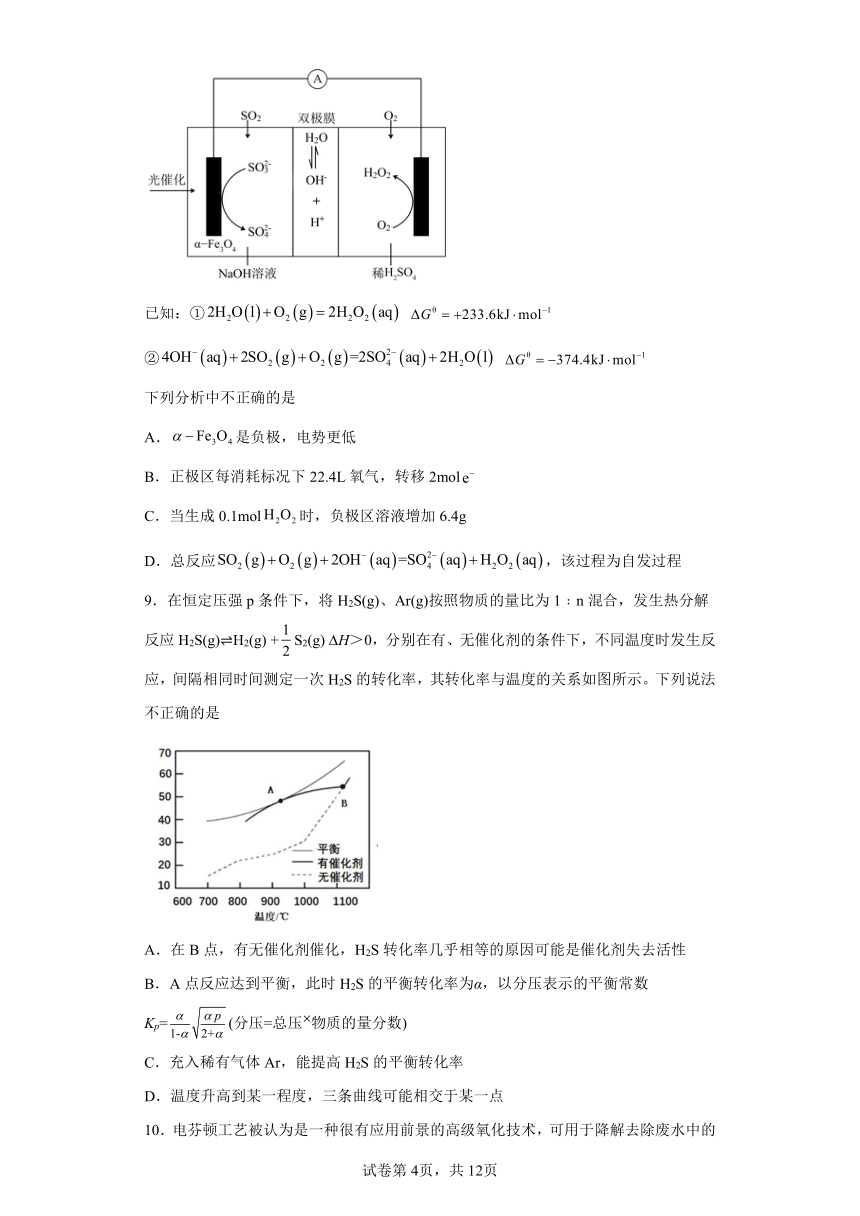
D.实验⑤中,
8.上海交通大学利用光电催化脱除与制备相耦合,高效协同转化过程如图。(双极膜可将水解离为和,向两极移动)
已知:①
②
下列分析中不正确的是
A.是负极,电势更低
B.正极区每消耗标况下22.4L氧气,转移2mol
C.当生成0.1mol时,负极区溶液增加6.4g
D.总反应,该过程为自发过程
9.在恒定压强p条件下,将H2S(g)、Ar(g)按照物质的量比为1﹕n混合,发生热分解反应H2S(g) H2(g) +S2(g) H>0,分别在有、无催化剂的条件下,不同温度时发生反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示。下列说法不正确的是
A.在B点,有无催化剂催化,H2S转化率几乎相等的原因可能是催化剂失去活性
B.A点反应达到平衡,此时H2S的平衡转化率为α,以分压表示的平衡常数Kp=(分压=总压物质的量分数)
C.充入稀有气体Ar,能提高H2S的平衡转化率
D.温度升高到某一程度,三条曲线可能相交于某一点
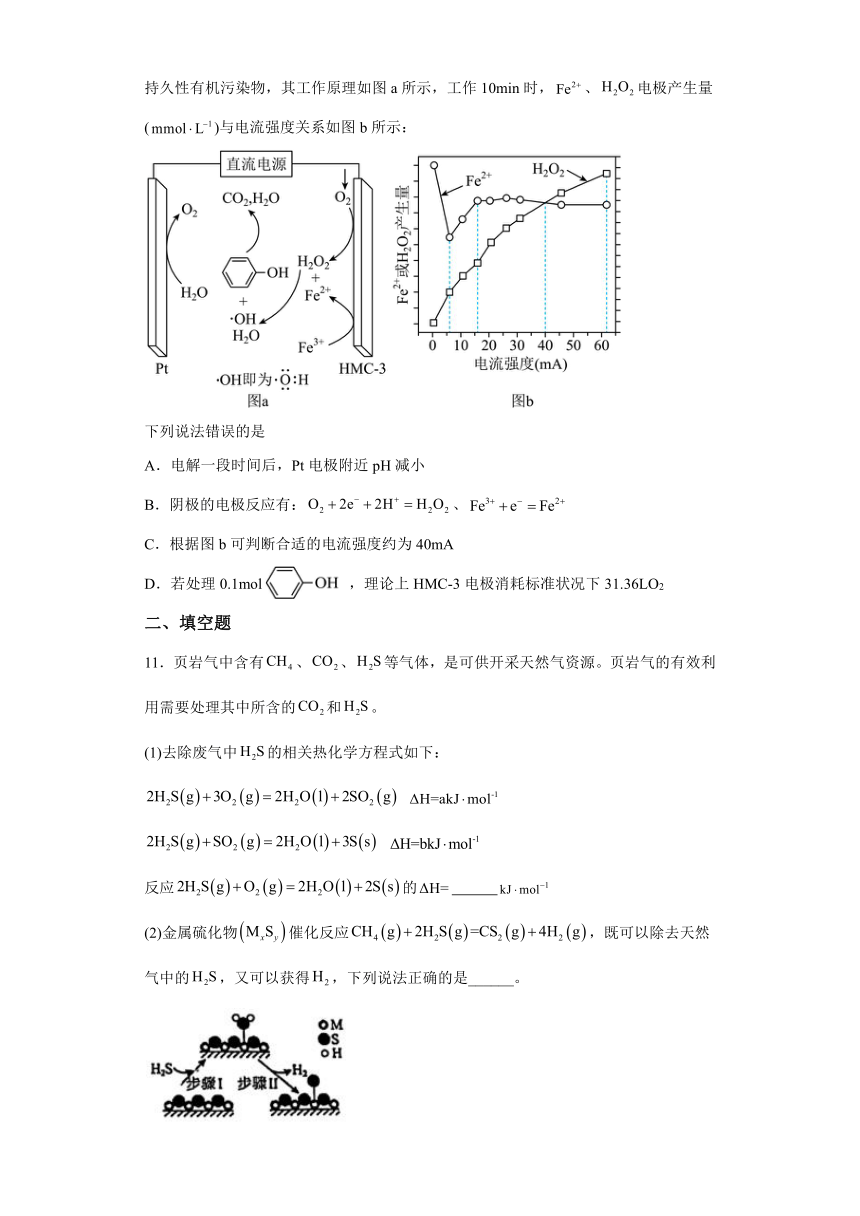
10.电芬顿工艺被认为是一种很有应用前景的高级氧化技术,可用于降解去除废水中的持久性有机污染物,其工作原理如图a所示,工作10min时,、电极产生量()与电流强度关系如图b所示:
下列说法错误的是
A.电解一段时间后,Pt电极附近pH减小
B.阴极的电极反应有:、
C.根据图b可判断合适的电流强度约为40mA
D.若处理0.1mol ,理论上HMC-3电极消耗标准状况下31.36LO2
二、填空题
11.页岩气中含有、、等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的和。
(1)去除废气中的相关热化学方程式如下:
反应的
(2)金属硫化物催化反应,既可以除去天然气中的,又可以获得,下列说法正确的是______。
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗1mol,转移电子的数目约为
(3)通过电化学循环法可将转化为和(如图所示),其中氧化过程发生如下两步反应:、。
①电极a上发生反应的电极反应式为 。
②理论上1mol参加反应可产生的物质的量为 。
(4)我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
①Zno@石墨烯是 极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.
ⅱ. 。
12.合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究和直接合成。在、250℃时,将1mol和1mol加入aL刚性容器中充分反应,测得体积分数为0.04;其他条件不变,温度升高至450℃,测得体积分数为0.025,则可判断合成氮反应为 (填“吸热”或“放热”)反应。
(2)在、250℃时,将2mol和2mol加入aL密闭容器中充分反应,平衡转化率可能为
__________________(填标号)。
A.=4% B.<4% C.4%~ D.>11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氮产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
需要吸收能量最大的能量(活化能)E= ev,该步骤的化学方程式为 。若通入体积分数过大时导致催化剂效率降低的原因是 。
(4)近年来,电化学催化氮气还原合成氨的催化剂研究取得了较大发展。氮掺杂金红石表面固定氮气过程如图所示,总方程式为 。
(5)常温常压下,以和为原料的电化学合成氨是极具应用前途的绿色合成氨过程。在阳极室、阴极室中加入电解液,以镍的有机配位化合物与炭黑合成的物质以及铂为电极,实验室模拟氨的电化学合成过程如图所示。
①Pt电极连接电源的 极。电催化合成氨的化学方程式为 。
②电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L(标准状况),可能的原因为 。
13.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)对于反应,R.A.Ogg提出如下反应历程:
第一步快速平衡
第二步慢反应
第三步协反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有
C.第二步中与的碰撞仅部分有效
D.第三步反应活化能较高
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的和在催化剂的作用下转化成两种无污染的气体:。若在恒容的密闭容器中,充入1molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是______。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.
(3)与之间存在反应。在一定条件下,该反应、的消耗速率与自身压强间存在关系,,其中、是与反应温度有关的常数。相应的速率、压强关系如图1所示,一定温度下,、与平衡常数的关系是 ,在图上标出的点中,能表示反应达到平衡状态的点为 (填字母代号)。
(4)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀可以通过电化学还原法处理,还原为的电化学装置如图所示:
i.阴极发生的反应为:
ii.阴极区溶液中发生反应:、
①阴极上发生的副反应为: 。
②阴极区溶液中加入的目的是 。
③电还原处理+6价的铀转移1,阴极区减少 mol。
14.低碳烷烃脱氢制低碳烯烃对有效利用化石能源有重要意义。
(1)乙烷脱氢制乙烯
主反应:
副反应:
①标准摩尔生成焓是指在25℃和101kPa,由最稳定的单质生成1mol化合物的焓变。利用下表数据计算 。
物质
标准摩尔主成焓/ +52.3
②恒容条件下,有利于提高平衡转化率的措施是 (填标号)。
A.高温 B.高压 C.原料气中掺入 D原料气中掺入
③在800℃、恒容条件下加入1mol,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol、0.6mol、0.1mol和0.7mol,则主反应 。
(2)乙烷裂解中各基元反应及对应活化能如下表。根据表格数据判断:
反应类型 反应 活化能
链引发 ⅰ 451
ⅱ 417
链传递 ⅲ 47
ⅳ 54
ⅴ 181
链终止 ⅵ 0
ⅶ 0
①链引发过程中,更容易断裂的化学键是 。
②链传递的主要途径为反应 →反应 (填序号),造成产物甲烷含量不高。
(3)使用进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
①550~620℃,在反应初始阶段,温度越高,乙烷转化率越大的原因是 。
②该催化剂的最佳工作温度为 。
15.利用软锰矿和浓盐酸制取纯净干燥氯气的装置如下:
(1)装置A为 (填标号),发生反应的化学方程式为 。
(2)装置E中盛放的试剂是 溶液(填化学式)。
(3)某学习小组进行以下实验探究。
【实验任务】探究常温下饱和NaCl溶液抑制溶解的原因。
【理论分析】存在反应: 反应1
【提出猜想】猜想a:可抑制溶解。
猜想b:可抑制溶解。
【实验验证】
实验1 测定在不同浓度、HCl溶液中的溶解度
实验 浓度/mol/L 溶解度/mol/L 物质 0.1 0.2 0.5 1.0 3.0 5.0
ⅰ - - 0.0627 0.0568 0.0435 0.0407
ⅱ HCl 0.0634 0.0619 0.0630 0.0665 0.0824 0.1004
实验ⅰ的结果符合猜想a,实验ⅱ的结果说明还有其他因素会影响在水中的溶解度。
【交流讨论】查阅资料: 反应2
①饱和氯水中,, ,此时的溶解主要受反应1影响。
②在HCl溶液中,时,对溶解起 (填“促进”或“抑制”)作用;时,随着浓度增大,溶解度增大的原因是 。
实验2 测定在不同浓度NaCl溶液中的溶解度
NaCl浓度 0.5 1.0 3.0 5.0
溶解度 0.0658 0.0580 0.0416 0.0360
③综合以上数据,对溶解的抑制效果: (填“>”或“<”),证据是 。
【实验结论】
④常温下饱和NaCl溶液抑制溶解的原因是 。
试卷第12页,共12页
1.B
【详解】A.根据自由能公式,当反应能够自发,该反应的△H<0,△S<0,A错误;
B.催化剂可加快反应速率,缩短生产时间,从而可以提高NO2的生产效率,B正确;
C.升高温度,v(逆)、v(正)增大,但平衡向吸热反应方向移动即逆反应方向移动,C错误;
D.根据,△H<0,得到2molNO(g)和1molO2(g)中所含化学键能总和比2molNO2(g)中所含化学键能总和小116.4 kJ mol 1,D错误。
故选B。
2.B
【详解】A.若 H =-56.9kJ·mol-1,将1mol 置于密闭容器中,参加反应的NO2小于1mol,则充分反应放出的热量小于28.45kJ,A不正确;
B.31 g白磷P4的物质的量为0.25mol,若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为 ,B正确;
C.浓硫酸溶于水时,会放出热量,若将含有0.5mol H2SO4的浓硫酸和含有1mol NaOH的溶液混合,放出的热量大于57.3kJ,C不正确;
D.的摩尔燃烧焓是,则2H2O(l)=2H2(g)+O2(g) H =+571.6kJ·mol-1,2H2O(g)=2H2(g)+O2(g) H<+571.6kJ·mol-1,D不正确;
故选B。
3.A
【详解】A.形成原电池时,Al为负极被氧化,Ag2S为正极被还原,正极反应式为:Ag2S+2e-=2Ag+S2-,A正确;
B.铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,故B错误;
C.X极为负极,粗铜极为阴极,而电解精练时,粗铜作阳极,纯铜作阴极,不能进行铜的精练,C错误;
D.该装置有外接电源,属于外加电源的阴极保护法,D错误;
答案选A。
4.D
【详解】A.的溶液为酸性溶液,与H+不能共存,故A不符合题意;
B.水电离的的溶液为酸性或碱性溶液,在酸性或碱性溶液中都不能大量共存,故B不符合题意;
C.pH=2的溶液为酸性溶液,酸性条件下,可以氧化,故C不符合题意;
D.的溶液为酸性溶液,酸性条件下,、、、可以大量共存,故D符合题意;
故选D。
5.D
【详解】A.由图可知,反应达到化学平衡时,改变条件,正、逆反应速率均增大,但仍然相等,若反应为气体体积不变的可逆反应,增大压强,平衡不移动,正、逆反应速率均增大,但仍然相等,则题给图示改变的条件不一定是加入催化剂,故A错误;
B.该反应为气体体积减小的反应,将容器体积缩小后,气体压强增大,平衡向正反应方向移动,四氧化二氮的浓度增大,由图可知,达到平衡时,四氧化二氮的浓度突然增大,后又逐渐减小,说明平衡向逆反应方向移动,改变的条件是增大四氧化二氮的浓度,不是将容器体积缩小,故B错误;
C.由图可知,A生成B的反应为①AB H1=E1—E2,B生成C的反应为①BC H2= E3—E4,则A生成C的反应为AC H1+ H2=E1—E2+E3—E4,故C错误;
D.由图可知,反应达到平衡后,升高温度,逆反应速率大于正反应速率,说明平衡向逆反应方向移动,该反应为放热反应,故D正确;
故选D。
6.B
【详解】A.570℃之前,随着温度的升高,CO的体积分数增大,而反应①是吸热反应,随着温度的升高,平衡正向移动,说明570℃前影响CO体积分数的主要反应为反应II,所以反应II是放热反应,A错误;
B.由图像可知,高于570℃时,随着温度的升高,CO体积分数减小,说明以反应I为主,低于570℃时,随着温度的升高,CO体积分数增大,说明以反应II为主,所以反应温度较低时,Fe3O4主要还原产物为Fe ,B正确;
C.1040℃时,发生的主要反应是反应I,化学平衡常数K=,C错误;
D.反应I、II均为反应前后气体体积不变的反应,因此在恒温、恒容条件下,无论反应是否达到平衡,体系的压强始终不变,因此当容器压强保持不变,不能确定反应I、II是否达到平衡状态,D错误;
故选B。
7.B
【详解】A.温度升高,化学反应速率增大,故A正确;
B.由①②得b=1, 由①④得a=1,由②③得c=2,则等浓度的和,对反应速率的影响大,故B错误;
C.由②③得速率方程中的,故C正确;
D.根据a=b=1,c=2,及实验③⑤得 ,故D正确;
故选B。
8.C
【分析】该装置原理为原电池原理,左侧电极材料为,该区发生转化为后,发生电极反应生成化合价升高,该极为负极,右侧电极发生反应转化为,化合价降低,该极为正极。
【详解】A.电流由正极经导线流向负极,由高电势流向低电势,负极电势低,是负极,电势更低,A正确;
B.正极区电极反应式为,每消耗标况下22.4L氧气(物质的量为1mol),转移2mol,B正确;
C.由电极反应式,生成0.1mol时,有0.2mol电子转移,负极区变化为、,有0.2mol电子转移时,吸收0.1mol,同时双极膜将水解离产生的有0.2mol移向负极区,负极区溶液增加,C错误;
D.由已知①
② ,根据盖斯定律,可得总反应,<0,该反应为自发过程,D正确;
答案选C。
9.B
【详解】A. 在B点,同一温度下,有无催化剂催化,H2S转化率几乎相等的原因可能是催化剂失去活性,A正确;
B. 设起始H2S(g)的物质的量为1mol,Ar(g)的物质的量为n mol,A点反应达到平衡,此时H2S的平衡转化率为α,可列出三段式(单位为mol):,则此时容器中气体总物质的量为,则以分压表示的平衡常数,B错误;
C. 恒压充入稀有气体Ar,相当于反应体系减压,使平衡正向移动,则能提高H2S的平衡转化率,C正确;
D. 温度升高,反应速率加快,间隔相同时间,反应达到平衡状态,则三条曲线可能相交于某一点,D正确;
故选B。
10.D
【分析】由图可知,电极上铁元素、氧元素价态降低得电子,故电极为阴极,电极反应式分别为、,后发生反应,氧化苯酚,反应为,Pt电极为阳极,电极反应式为2H2O-4e =4H++O2↑。
【详解】A.电极为阳极,电极反应式为2H2O-4e =4H++O2↑,电解一段时间后,Pt电极附近pH减小,故A正确;
B.据分析,阴极的电极反应有:、,故B正确;
C.过量的过氧化氢会氧化亚铁离子,导致生成的羟基自由基减少,使得降解去除废水中的持久性有机污染物的效率下降,故据图b可判断合适的电流强度范围为40mA左右,故C正确;
D.由分析可知,苯酚转化为二氧化碳和水,,由图可知,反应中氧气转化为H2O2,H2O2转化为,转化关系为,故而,若处理0.1mol ,则阴极消耗氧气的物质的量为2.8mol,理论上消耗标准状况下氧气的体积为,故D错误;
选D。
11.(1)
(2)C
(3) 2mol
(4) 阴
【详解】(1)将已知反应依次编号为①②,由盖斯定律可知,反应可得反应,则反应ΔH=kJ/mol,故答案为:;
(2)A.由方程式可知,该反应为熵增的反应,反应ΔS>0,故A错误;
B.由方程式可知,该反应的平衡常数K=,故B错误;
C.由图可知,步骤Ⅰ发生的反应为硫化氢中硫原子与催化剂MxSy中的M原子结合形成了M—S键,故C正确;
D.由方程式可知,反应中碳元素的化合价升高被氧化,甲烷是反应的还原剂,氢元素的化合价降低被还原,甲烷和硫化氢是反应的氧化剂,反应消耗2mol硫化氢,转移电子的物质的量为8mol,则消耗1mol硫化氢时,反应转移电子数目约为1mol×4×6.02×1023mol—1=4×6.02×1023,故D错误;
故选C;
(3)由图可知,电极a为原电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸,放电生成的硫酸与硫化氢反应生成二氧化硫、硫和水,硫与通入的氧气反应生成硫,电极b为正极,酸性条件下碘在正极得到电子发生还原反应生成氢碘酸,氢碘酸分解生成可以循环使用的碘和氢气;
①由分析可知,电极a为原电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸,电极反应式为,故答案为:;
②由题给方程式可知,氧化过程的总反应为H2S+H2SO4+O2=2SO2↑+2H2O,由得失电子数目守恒可知,1mol硫化氢参加反应时,碘化氢分解生成氢气的物质的量为=2mol,故答案为:2mol;
(4)由图可知,该装置为电解池,ZnO@石墨烯为电解池的阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成一氧化碳,石墨烯是阳极,EDTA—Fe2+失去电子发生氧化反应生成EDTA—Fe3+,生成的EDTA—Fe3+与天然气中的硫化氢反应生成EDTA—Fe2+、硫沉淀和氢离子;
①由分析可知,ZnO@石墨烯为电解池的阴极,故答案为:阴;
②由分析可知,石墨烯是阳极,EDTA—Fe2+失去电子发生氧化反应生成EDTA—Fe3+,生成的EDTA—Fe3+与天然气中的硫化氢反应生成EDTA—Fe2+、硫沉淀和氢离子,则ⅱ的反应方程式为,故答案为:。
12.(1)放热
(2)D
(3) 1.54 占据催化剂活性中心过多或体积分数过大时,催化剂吸附了较多的,阻碍了与催化剂的接触,导致催化剂催化效率降低
(4)
(5) 正极 制得的氨部分溶解在电解液中
【详解】(1)升高温度,NH3的体积分数降低,说明升高温度平衡逆向移动,正反应为放热反应;
(2)将1mol和1mol加入aL刚性容器中充分反应,测得体积分数为0.04;列三段式如下:
平衡时氨气的体积分数==0.04,解得x=0.03846,则H2的转化率等于=11.5%,在、250℃时,将2mol和2mol加入aL密闭容器中充分反应,同等比例加入反应物,压强增大,平衡正向移动,H2的平衡转化率会增大,即>11.5%,答案为D;
(3)根据图示,吸收能量最大能垒,即相对能量的差最大为-1.02-(-2.56)=1.54;根据图示,该步反应的方程式为NH3*+NH3=2NH3;若通入H2的体积分数过大,占据催化剂活性中心过多或体积分数过大时,催化剂吸附了较多的,阻碍了与催化剂的接触,导致催化剂催化效率降低;
(4)依据图2转化关系可知反应物为N2、H+和e-,生成物为NH3,根据图示所示反应量书写总反应式为:N2+6H++6e-=2NH3;
(5)①电催化氮气还原合成氨为电解池,电解池左边通N2转变成NH3发生还原反应为阴极,则电解池右边为阳极极,即Pt电极连接电源的正极;阴极的电极反应式为:N 2 +6H2O+6e-=NH3+6OH-,阳极的电极反应式为:4OH--4e-=O2↑+2H2O,电解的总反应式为:;
②阴极的电极反应为:N 2 +6H2O+6e-=NH3+6OH-,阴极产生氨气,制得的氨气部分溶于溶液中,当电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L。
13.(1)AC
(2)AB
(3) BD
(4) 消耗反应中生成的,防止与反应 1
【详解】(1)A.第一步反应快,所以第一步的逆反应速率大于第二步的逆反应速率,故A正确;
B.根据第二步和第三步反应可知中间产物还有NO,故B错误;
C.根据第二步反应生成物中有NO2可知,NO2与NO3的碰撞仅部分有效,故C正确;
D.第三步反应快,所以第三步反应的活化能较低,故D错误;
故选:AC;
(2)A.判断平衡状态的依据是变化量不再改变,比值不变不能作为判断依据,故A错误;
B.反应前后气体质量不变,所以密度不变,不能作为判断依据,故B错误;
C.恒容的密闭容器中,充入1molCO和1molNO,如果压强不变可以判断平衡,故C正确;
D.2v(N2)正=2v(CO)逆,速率之比等于系数比值,且方向相反,可以作为判断依据,故D正确;
故选:AB;
(3)根据N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)达到平衡时,v(NO2)=2v(N2O4),则k1 p2(NO2)=2k2 p(N2O4),k1=KPK2;
反应达到平衡状态时,消耗速率满足v(NO2)=2v(N2O4),则能表示反应达到平衡状态的点是BD;
(4)阴极上发生的副反应为+3H++2e =HNO2+H2O;
阴极区溶液中加入N2H5NO3的目的是消耗反应中生成的HNO2,防止HNO2与U4+反应;
根据电子守恒和电荷守恒,转移1mole ,阴极区H+减少1mol。
14.(1) +137.0 A 140kPa
(2) 键 ⅲ ⅴ
(3) 温度越高反应速率越快;乙烷脱氢反应为吸热,温度升高,平衡正向移动 550℃
【详解】(1)①由标准摩尔生成焓定义可写出以下热化学方程式:
(Ⅰ) ΔHⅠ= 84.7kJ·mol-1
(Ⅱ) ΔHⅡ=+52.3kJ·mol-1
(Ⅲ) ΔHⅢ= 74.8kJ·mol-1
由(Ⅱ)-(Ⅰ)式得主反应式,则ΔH1=ΔHⅡ ΔHⅠ=+52.3kJ·mol-1 ( 84.7kJ·mol-1)=+137kJ·mol-1
同理可得ΔH2=2ΔHⅢ+ΔHⅡ 2ΔHⅠ=+72.1kJ·mol-1,ΔH3= ΔHⅠ=+84.7kJ·mol-1;
②A.主、副反应均为吸热反应,升高温度,平衡正向移动,可以提高C2H6平衡转化率,A符合题意;
B.主、副反应均为气体体积增大的反应,增大压强,平衡逆向移动,C2H6平衡转化率降低,B不符合题意;
C.原料气中掺入H2,H2浓度增大,主反应和第二个副反应平衡逆向移动,C2H6平衡转化率降低,C不符合题意;
D.原料气中掺入N2,不影响主、副反应各组分浓度,平衡不移动,不影响C2H6平衡转化率,D不符合题意;
故选A。
③平衡时各气体总的物质的量为n2=(0.3+0.6+0.1+0.7)mol=1.7mol,恒温恒容时,,则P2=170kPa,平衡时,,
,,所以;
(2)①反应ⅰ的活化能大于反应ⅱ的活化能,可知断裂C-H键比断裂C-C所需能量高,所以更容易断裂的化学键C-C键;
②反应ⅳ生成甲烷,而甲烷含量较低,说明链传递的主要途径为反应ⅲ→反应ⅴ;
(3)①温度越高反应速率越快,乙烷脱氢反应为吸热反应,温度升高,平衡正向移动,所以温度越高,乙烷转化率越大;
②据图可知当温度为550℃时乙烷的转化率可以长时间保持较高转化率,且乙烯的选择性较高,所以该催化剂的最佳工作温度550℃。
15.(1) a
(2)NaOH
(3) 抑制 此条件下的溶解主要受反应2的影响,增大该平衡正向移动 > 相同浓度下,在NaCl溶液中的溶解度比在HCl溶液中的小 饱和NaCl溶液中对溶解的抑制效果大于对溶解的促进效果
【分析】利用软锰矿和浓盐酸制取纯净干燥氯气,装置A为氯气发生装置,生成的氯气中混有HCl气体,B装置中饱和食盐水可以除去氯气中混有的HCl,C中浓硫酸可以干燥氯气,D装置收集氯气,E装置可以吸收过量的氯气,以此解答。
【详解】(1)装置A中和浓盐酸在加热的条件下发生反应生成氯气,可以使用装置a,发生反应的化学方程式为:。
(2)E装置可以吸收过量的氯气,盛放的试剂是NaOH溶液。
(3)①0.19,饱和氯水中c(Cl )=0.03mol L 1,c[Cl2(aq)]=0.062mol L 1,则=;
②图表数据可知,在HCl溶液中,c(HCl)<0.2mol L-1时,反应以Cl2(aq)+H2O H++Cl-+HClO为主,Cl-对Cl2溶解起抑制作用,c(HCl)>0.5mol L-1时,Cl2溶解度增大的原因是:此条件下Cl2的溶解主要受反应 的影响,c(Cl-)增大该平衡正向移动;
③综合以上数据分析可知,相同浓度下,Cl2在NaCl溶液中的溶解度比在HCl溶液中的小,对Cl2溶解的抑制效果:Na+>H+,证据是相同浓度下,Cl2在NaCl溶液中的溶解度比在HCl溶液中的小;
④常温下饱和NaCl溶液抑制Cl2溶解的原因是:饱和NaCl溶液中Na+对Cl2溶解的抑制效果大于Cl-对Cl2溶解的促进效果。
答案第10页,共10页
答案第9页,共10页
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Li-7 P-31 S-32
一、选择题(本题共10小题,每小题4分,共40分,每小题只有一个正确答案)
1.对于反应2NO(g)+O2(g)=2NO2(g) ΔH=-116.4 kJ·mol-1,下列说法正确的是
A.该反应能够自发的原因是ΔS > 0
B.工业上使用合适的催化剂可提高NO2的生产效率
C.升高温度,该反应v(逆)增大,v(正)减小,平衡向逆反应方向移动
D.2 mol NO(g)和1 mol O2(g)中所含化学键能总和比2 mol NO2(g)中大116.4 kJ·mol-1
2.下列说法中正确的是
A.若 ,则1 mol 置于密闭容器中充分反应放出的热量为28.45kJ
B.若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为
C.在稀溶液中,强酸与强碱反应的中和热为,若将含有0.5 mol 的浓硫酸和含有1 mol NaOH的溶液混合,放出的热量等于57.3kJ
D.的摩尔燃烧焓是,则
3.下列有关电化学装置的说法正确的是
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
4.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液中、、、
B.水电离的的溶液:、、、
C.pH=2的溶液:、、、
D.的溶液:、、、
5.下列图示与对应的叙述相符的是
表示达平衡的某反应,在时改变条件后反应速率随时间变化,改变的条件一定是加入催化剂 表示平衡在时迅速将体积缩小后的变化 表示的反应的 可判断某可逆反应的正反应是放热反应
A B C D
A.A B.B C.C D.D
6.以Fe3O4为原料炼铁,主要发生如下反应:
反应I:Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H1>0
反应II:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) △H2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是
A.△H2>0
B.反应温度较低时,Fe3O4主要还原产物为Fe
C.1040℃时,反应I的化学平衡常数K=0.25
D.在恒温、恒容条件下,当容器压强保持不变,反应I、II均达到平衡状态
7.某学习小组为了探究的反应速率(v)与反应物浓度(c)的关系,在20℃条件下进行实验,所得的数据如下:
实验编号 相关数据 ① ② ③ ④ ⑤
0.008 0.008 0.004 0.008 0.004
0.001 0.001 0.001 0.002 0.002
0.10 0.20 0.20 0.10 0.40
v1
已知:该反应的速率方程为:(k为常数)
下列结论不正确的是
A.若温度升高到40℃,则化学反应速率增大
B.等浓度的和,对反应速率的影响小
C.速率方程中的
D.实验⑤中,
8.上海交通大学利用光电催化脱除与制备相耦合,高效协同转化过程如图。(双极膜可将水解离为和,向两极移动)
已知:①
②
下列分析中不正确的是
A.是负极,电势更低
B.正极区每消耗标况下22.4L氧气,转移2mol
C.当生成0.1mol时,负极区溶液增加6.4g
D.总反应,该过程为自发过程
9.在恒定压强p条件下,将H2S(g)、Ar(g)按照物质的量比为1﹕n混合,发生热分解反应H2S(g) H2(g) +S2(g) H>0,分别在有、无催化剂的条件下,不同温度时发生反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示。下列说法不正确的是
A.在B点,有无催化剂催化,H2S转化率几乎相等的原因可能是催化剂失去活性
B.A点反应达到平衡,此时H2S的平衡转化率为α,以分压表示的平衡常数Kp=(分压=总压物质的量分数)
C.充入稀有气体Ar,能提高H2S的平衡转化率
D.温度升高到某一程度,三条曲线可能相交于某一点
10.电芬顿工艺被认为是一种很有应用前景的高级氧化技术,可用于降解去除废水中的持久性有机污染物,其工作原理如图a所示,工作10min时,、电极产生量()与电流强度关系如图b所示:
下列说法错误的是
A.电解一段时间后,Pt电极附近pH减小
B.阴极的电极反应有:、
C.根据图b可判断合适的电流强度约为40mA
D.若处理0.1mol ,理论上HMC-3电极消耗标准状况下31.36LO2
二、填空题
11.页岩气中含有、、等气体,是可供开采天然气资源。页岩气的有效利用需要处理其中所含的和。
(1)去除废气中的相关热化学方程式如下:
反应的
(2)金属硫化物催化反应,既可以除去天然气中的,又可以获得,下列说法正确的是______。
A.该反应的
B.该反应的平衡常数
C.题图所示的反应机理中,步骤Ⅰ可理解为中带部分负电荷的S与催化剂中的M之间发生作用
D.该反应中每消耗1mol,转移电子的数目约为
(3)通过电化学循环法可将转化为和(如图所示),其中氧化过程发生如下两步反应:、。
①电极a上发生反应的电极反应式为 。
②理论上1mol参加反应可产生的物质的量为 。
(4)我国科学家设计了一种协同转化装置,实现对天然气中和的高效去除,装置如下图所示,电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯。
①Zno@石墨烯是 极(填“阳”或“阴”)。
②石墨烯电极区发生反应为:
ⅰ.
ⅱ. 。
12.合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究和直接合成。在、250℃时,将1mol和1mol加入aL刚性容器中充分反应,测得体积分数为0.04;其他条件不变,温度升高至450℃,测得体积分数为0.025,则可判断合成氮反应为 (填“吸热”或“放热”)反应。
(2)在、250℃时,将2mol和2mol加入aL密闭容器中充分反应,平衡转化率可能为
__________________(填标号)。
A.=4% B.<4% C.4%~ D.>11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氮产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
需要吸收能量最大的能量(活化能)E= ev,该步骤的化学方程式为 。若通入体积分数过大时导致催化剂效率降低的原因是 。
(4)近年来,电化学催化氮气还原合成氨的催化剂研究取得了较大发展。氮掺杂金红石表面固定氮气过程如图所示,总方程式为 。
(5)常温常压下,以和为原料的电化学合成氨是极具应用前途的绿色合成氨过程。在阳极室、阴极室中加入电解液,以镍的有机配位化合物与炭黑合成的物质以及铂为电极,实验室模拟氨的电化学合成过程如图所示。
①Pt电极连接电源的 极。电催化合成氨的化学方程式为 。
②电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L(标准状况),可能的原因为 。
13.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及相关反应是新型科研热点。回答下列问题:
(1)对于反应,R.A.Ogg提出如下反应历程:
第一步快速平衡
第二步慢反应
第三步协反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有
C.第二步中与的碰撞仅部分有效
D.第三步反应活化能较高
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的和在催化剂的作用下转化成两种无污染的气体:。若在恒容的密闭容器中,充入1molCO和1molNO,下列选项中不能说明该反应已经达到平衡状态的是______。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.
(3)与之间存在反应。在一定条件下,该反应、的消耗速率与自身压强间存在关系,,其中、是与反应温度有关的常数。相应的速率、压强关系如图1所示,一定温度下,、与平衡常数的关系是 ,在图上标出的点中,能表示反应达到平衡状态的点为 (填字母代号)。
(4)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀可以通过电化学还原法处理,还原为的电化学装置如图所示:
i.阴极发生的反应为:
ii.阴极区溶液中发生反应:、
①阴极上发生的副反应为: 。
②阴极区溶液中加入的目的是 。
③电还原处理+6价的铀转移1,阴极区减少 mol。
14.低碳烷烃脱氢制低碳烯烃对有效利用化石能源有重要意义。
(1)乙烷脱氢制乙烯
主反应:
副反应:
①标准摩尔生成焓是指在25℃和101kPa,由最稳定的单质生成1mol化合物的焓变。利用下表数据计算 。
物质
标准摩尔主成焓/ +52.3
②恒容条件下,有利于提高平衡转化率的措施是 (填标号)。
A.高温 B.高压 C.原料气中掺入 D原料气中掺入
③在800℃、恒容条件下加入1mol,此时压强为100kPa,进行脱氢反应,若测得平衡体系中气体有0.3mol、0.6mol、0.1mol和0.7mol,则主反应 。
(2)乙烷裂解中各基元反应及对应活化能如下表。根据表格数据判断:
反应类型 反应 活化能
链引发 ⅰ 451
ⅱ 417
链传递 ⅲ 47
ⅳ 54
ⅴ 181
链终止 ⅵ 0
ⅶ 0
①链引发过程中,更容易断裂的化学键是 。
②链传递的主要途径为反应 →反应 (填序号),造成产物甲烷含量不高。
(3)使用进行乙烷脱氢催化性能研究。不同温度下,乙烷转化率及乙烯选择性随反应时间的变化曲线分别如图a、图b。
①550~620℃,在反应初始阶段,温度越高,乙烷转化率越大的原因是 。
②该催化剂的最佳工作温度为 。
15.利用软锰矿和浓盐酸制取纯净干燥氯气的装置如下:
(1)装置A为 (填标号),发生反应的化学方程式为 。
(2)装置E中盛放的试剂是 溶液(填化学式)。
(3)某学习小组进行以下实验探究。
【实验任务】探究常温下饱和NaCl溶液抑制溶解的原因。
【理论分析】存在反应: 反应1
【提出猜想】猜想a:可抑制溶解。
猜想b:可抑制溶解。
【实验验证】
实验1 测定在不同浓度、HCl溶液中的溶解度
实验 浓度/mol/L 溶解度/mol/L 物质 0.1 0.2 0.5 1.0 3.0 5.0
ⅰ - - 0.0627 0.0568 0.0435 0.0407
ⅱ HCl 0.0634 0.0619 0.0630 0.0665 0.0824 0.1004
实验ⅰ的结果符合猜想a,实验ⅱ的结果说明还有其他因素会影响在水中的溶解度。
【交流讨论】查阅资料: 反应2
①饱和氯水中,, ,此时的溶解主要受反应1影响。
②在HCl溶液中,时,对溶解起 (填“促进”或“抑制”)作用;时,随着浓度增大,溶解度增大的原因是 。
实验2 测定在不同浓度NaCl溶液中的溶解度
NaCl浓度 0.5 1.0 3.0 5.0
溶解度 0.0658 0.0580 0.0416 0.0360
③综合以上数据,对溶解的抑制效果: (填“>”或“<”),证据是 。
【实验结论】
④常温下饱和NaCl溶液抑制溶解的原因是 。
试卷第12页,共12页
1.B
【详解】A.根据自由能公式,当反应能够自发,该反应的△H<0,△S<0,A错误;
B.催化剂可加快反应速率,缩短生产时间,从而可以提高NO2的生产效率,B正确;
C.升高温度,v(逆)、v(正)增大,但平衡向吸热反应方向移动即逆反应方向移动,C错误;
D.根据,△H<0,得到2molNO(g)和1molO2(g)中所含化学键能总和比2molNO2(g)中所含化学键能总和小116.4 kJ mol 1,D错误。
故选B。
2.B
【详解】A.若 H =-56.9kJ·mol-1,将1mol 置于密闭容器中,参加反应的NO2小于1mol,则充分反应放出的热量小于28.45kJ,A不正确;
B.31 g白磷P4的物质的量为0.25mol,若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为 ,B正确;
C.浓硫酸溶于水时,会放出热量,若将含有0.5mol H2SO4的浓硫酸和含有1mol NaOH的溶液混合,放出的热量大于57.3kJ,C不正确;
D.的摩尔燃烧焓是,则2H2O(l)=2H2(g)+O2(g) H =+571.6kJ·mol-1,2H2O(g)=2H2(g)+O2(g) H<+571.6kJ·mol-1,D不正确;
故选B。
3.A
【详解】A.形成原电池时,Al为负极被氧化,Ag2S为正极被还原,正极反应式为:Ag2S+2e-=2Ag+S2-,A正确;
B.铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,故B错误;
C.X极为负极,粗铜极为阴极,而电解精练时,粗铜作阳极,纯铜作阴极,不能进行铜的精练,C错误;
D.该装置有外接电源,属于外加电源的阴极保护法,D错误;
答案选A。
4.D
【详解】A.的溶液为酸性溶液,与H+不能共存,故A不符合题意;
B.水电离的的溶液为酸性或碱性溶液,在酸性或碱性溶液中都不能大量共存,故B不符合题意;
C.pH=2的溶液为酸性溶液,酸性条件下,可以氧化,故C不符合题意;
D.的溶液为酸性溶液,酸性条件下,、、、可以大量共存,故D符合题意;
故选D。
5.D
【详解】A.由图可知,反应达到化学平衡时,改变条件,正、逆反应速率均增大,但仍然相等,若反应为气体体积不变的可逆反应,增大压强,平衡不移动,正、逆反应速率均增大,但仍然相等,则题给图示改变的条件不一定是加入催化剂,故A错误;
B.该反应为气体体积减小的反应,将容器体积缩小后,气体压强增大,平衡向正反应方向移动,四氧化二氮的浓度增大,由图可知,达到平衡时,四氧化二氮的浓度突然增大,后又逐渐减小,说明平衡向逆反应方向移动,改变的条件是增大四氧化二氮的浓度,不是将容器体积缩小,故B错误;
C.由图可知,A生成B的反应为①AB H1=E1—E2,B生成C的反应为①BC H2= E3—E4,则A生成C的反应为AC H1+ H2=E1—E2+E3—E4,故C错误;
D.由图可知,反应达到平衡后,升高温度,逆反应速率大于正反应速率,说明平衡向逆反应方向移动,该反应为放热反应,故D正确;
故选D。
6.B
【详解】A.570℃之前,随着温度的升高,CO的体积分数增大,而反应①是吸热反应,随着温度的升高,平衡正向移动,说明570℃前影响CO体积分数的主要反应为反应II,所以反应II是放热反应,A错误;
B.由图像可知,高于570℃时,随着温度的升高,CO体积分数减小,说明以反应I为主,低于570℃时,随着温度的升高,CO体积分数增大,说明以反应II为主,所以反应温度较低时,Fe3O4主要还原产物为Fe ,B正确;
C.1040℃时,发生的主要反应是反应I,化学平衡常数K=,C错误;
D.反应I、II均为反应前后气体体积不变的反应,因此在恒温、恒容条件下,无论反应是否达到平衡,体系的压强始终不变,因此当容器压强保持不变,不能确定反应I、II是否达到平衡状态,D错误;
故选B。
7.B
【详解】A.温度升高,化学反应速率增大,故A正确;
B.由①②得b=1, 由①④得a=1,由②③得c=2,则等浓度的和,对反应速率的影响大,故B错误;
C.由②③得速率方程中的,故C正确;
D.根据a=b=1,c=2,及实验③⑤得 ,故D正确;
故选B。
8.C
【分析】该装置原理为原电池原理,左侧电极材料为,该区发生转化为后,发生电极反应生成化合价升高,该极为负极,右侧电极发生反应转化为,化合价降低,该极为正极。
【详解】A.电流由正极经导线流向负极,由高电势流向低电势,负极电势低,是负极,电势更低,A正确;
B.正极区电极反应式为,每消耗标况下22.4L氧气(物质的量为1mol),转移2mol,B正确;
C.由电极反应式,生成0.1mol时,有0.2mol电子转移,负极区变化为、,有0.2mol电子转移时,吸收0.1mol,同时双极膜将水解离产生的有0.2mol移向负极区,负极区溶液增加,C错误;
D.由已知①
② ,根据盖斯定律,可得总反应,<0,该反应为自发过程,D正确;
答案选C。
9.B
【详解】A. 在B点,同一温度下,有无催化剂催化,H2S转化率几乎相等的原因可能是催化剂失去活性,A正确;
B. 设起始H2S(g)的物质的量为1mol,Ar(g)的物质的量为n mol,A点反应达到平衡,此时H2S的平衡转化率为α,可列出三段式(单位为mol):,则此时容器中气体总物质的量为,则以分压表示的平衡常数,B错误;
C. 恒压充入稀有气体Ar,相当于反应体系减压,使平衡正向移动,则能提高H2S的平衡转化率,C正确;
D. 温度升高,反应速率加快,间隔相同时间,反应达到平衡状态,则三条曲线可能相交于某一点,D正确;
故选B。
10.D
【分析】由图可知,电极上铁元素、氧元素价态降低得电子,故电极为阴极,电极反应式分别为、,后发生反应,氧化苯酚,反应为,Pt电极为阳极,电极反应式为2H2O-4e =4H++O2↑。
【详解】A.电极为阳极,电极反应式为2H2O-4e =4H++O2↑,电解一段时间后,Pt电极附近pH减小,故A正确;
B.据分析,阴极的电极反应有:、,故B正确;
C.过量的过氧化氢会氧化亚铁离子,导致生成的羟基自由基减少,使得降解去除废水中的持久性有机污染物的效率下降,故据图b可判断合适的电流强度范围为40mA左右,故C正确;
D.由分析可知,苯酚转化为二氧化碳和水,,由图可知,反应中氧气转化为H2O2,H2O2转化为,转化关系为,故而,若处理0.1mol ,则阴极消耗氧气的物质的量为2.8mol,理论上消耗标准状况下氧气的体积为,故D错误;
选D。
11.(1)
(2)C
(3) 2mol
(4) 阴
【详解】(1)将已知反应依次编号为①②,由盖斯定律可知,反应可得反应,则反应ΔH=kJ/mol,故答案为:;
(2)A.由方程式可知,该反应为熵增的反应,反应ΔS>0,故A错误;
B.由方程式可知,该反应的平衡常数K=,故B错误;
C.由图可知,步骤Ⅰ发生的反应为硫化氢中硫原子与催化剂MxSy中的M原子结合形成了M—S键,故C正确;
D.由方程式可知,反应中碳元素的化合价升高被氧化,甲烷是反应的还原剂,氢元素的化合价降低被还原,甲烷和硫化氢是反应的氧化剂,反应消耗2mol硫化氢,转移电子的物质的量为8mol,则消耗1mol硫化氢时,反应转移电子数目约为1mol×4×6.02×1023mol—1=4×6.02×1023,故D错误;
故选C;
(3)由图可知,电极a为原电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸,放电生成的硫酸与硫化氢反应生成二氧化硫、硫和水,硫与通入的氧气反应生成硫,电极b为正极,酸性条件下碘在正极得到电子发生还原反应生成氢碘酸,氢碘酸分解生成可以循环使用的碘和氢气;
①由分析可知,电极a为原电池的负极,水分子作用下二氧化硫在负极失去电子发生氧化反应生成硫酸,电极反应式为,故答案为:;
②由题给方程式可知,氧化过程的总反应为H2S+H2SO4+O2=2SO2↑+2H2O,由得失电子数目守恒可知,1mol硫化氢参加反应时,碘化氢分解生成氢气的物质的量为=2mol,故答案为:2mol;
(4)由图可知,该装置为电解池,ZnO@石墨烯为电解池的阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成一氧化碳,石墨烯是阳极,EDTA—Fe2+失去电子发生氧化反应生成EDTA—Fe3+,生成的EDTA—Fe3+与天然气中的硫化氢反应生成EDTA—Fe2+、硫沉淀和氢离子;
①由分析可知,ZnO@石墨烯为电解池的阴极,故答案为:阴;
②由分析可知,石墨烯是阳极,EDTA—Fe2+失去电子发生氧化反应生成EDTA—Fe3+,生成的EDTA—Fe3+与天然气中的硫化氢反应生成EDTA—Fe2+、硫沉淀和氢离子,则ⅱ的反应方程式为,故答案为:。
12.(1)放热
(2)D
(3) 1.54 占据催化剂活性中心过多或体积分数过大时,催化剂吸附了较多的,阻碍了与催化剂的接触,导致催化剂催化效率降低
(4)
(5) 正极 制得的氨部分溶解在电解液中
【详解】(1)升高温度,NH3的体积分数降低,说明升高温度平衡逆向移动,正反应为放热反应;
(2)将1mol和1mol加入aL刚性容器中充分反应,测得体积分数为0.04;列三段式如下:
平衡时氨气的体积分数==0.04,解得x=0.03846,则H2的转化率等于=11.5%,在、250℃时,将2mol和2mol加入aL密闭容器中充分反应,同等比例加入反应物,压强增大,平衡正向移动,H2的平衡转化率会增大,即>11.5%,答案为D;
(3)根据图示,吸收能量最大能垒,即相对能量的差最大为-1.02-(-2.56)=1.54;根据图示,该步反应的方程式为NH3*+NH3=2NH3;若通入H2的体积分数过大,占据催化剂活性中心过多或体积分数过大时,催化剂吸附了较多的,阻碍了与催化剂的接触,导致催化剂催化效率降低;
(4)依据图2转化关系可知反应物为N2、H+和e-,生成物为NH3,根据图示所示反应量书写总反应式为:N2+6H++6e-=2NH3;
(5)①电催化氮气还原合成氨为电解池,电解池左边通N2转变成NH3发生还原反应为阴极,则电解池右边为阳极极,即Pt电极连接电源的正极;阴极的电极反应式为:N 2 +6H2O+6e-=NH3+6OH-,阳极的电极反应式为:4OH--4e-=O2↑+2H2O,电解的总反应式为:;
②阴极的电极反应为:N 2 +6H2O+6e-=NH3+6OH-,阴极产生氨气,制得的氨气部分溶于溶液中,当电路上转移1.5mol电子时,阴极收集到的气体体积小于11.2L。
13.(1)AC
(2)AB
(3) BD
(4) 消耗反应中生成的,防止与反应 1
【详解】(1)A.第一步反应快,所以第一步的逆反应速率大于第二步的逆反应速率,故A正确;
B.根据第二步和第三步反应可知中间产物还有NO,故B错误;
C.根据第二步反应生成物中有NO2可知,NO2与NO3的碰撞仅部分有效,故C正确;
D.第三步反应快,所以第三步反应的活化能较低,故D错误;
故选:AC;
(2)A.判断平衡状态的依据是变化量不再改变,比值不变不能作为判断依据,故A错误;
B.反应前后气体质量不变,所以密度不变,不能作为判断依据,故B错误;
C.恒容的密闭容器中,充入1molCO和1molNO,如果压强不变可以判断平衡,故C正确;
D.2v(N2)正=2v(CO)逆,速率之比等于系数比值,且方向相反,可以作为判断依据,故D正确;
故选:AB;
(3)根据N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2)达到平衡时,v(NO2)=2v(N2O4),则k1 p2(NO2)=2k2 p(N2O4),k1=KPK2;
反应达到平衡状态时,消耗速率满足v(NO2)=2v(N2O4),则能表示反应达到平衡状态的点是BD;
(4)阴极上发生的副反应为+3H++2e =HNO2+H2O;
阴极区溶液中加入N2H5NO3的目的是消耗反应中生成的HNO2,防止HNO2与U4+反应;
根据电子守恒和电荷守恒,转移1mole ,阴极区H+减少1mol。
14.(1) +137.0 A 140kPa
(2) 键 ⅲ ⅴ
(3) 温度越高反应速率越快;乙烷脱氢反应为吸热,温度升高,平衡正向移动 550℃
【详解】(1)①由标准摩尔生成焓定义可写出以下热化学方程式:
(Ⅰ) ΔHⅠ= 84.7kJ·mol-1
(Ⅱ) ΔHⅡ=+52.3kJ·mol-1
(Ⅲ) ΔHⅢ= 74.8kJ·mol-1
由(Ⅱ)-(Ⅰ)式得主反应式,则ΔH1=ΔHⅡ ΔHⅠ=+52.3kJ·mol-1 ( 84.7kJ·mol-1)=+137kJ·mol-1
同理可得ΔH2=2ΔHⅢ+ΔHⅡ 2ΔHⅠ=+72.1kJ·mol-1,ΔH3= ΔHⅠ=+84.7kJ·mol-1;
②A.主、副反应均为吸热反应,升高温度,平衡正向移动,可以提高C2H6平衡转化率,A符合题意;
B.主、副反应均为气体体积增大的反应,增大压强,平衡逆向移动,C2H6平衡转化率降低,B不符合题意;
C.原料气中掺入H2,H2浓度增大,主反应和第二个副反应平衡逆向移动,C2H6平衡转化率降低,C不符合题意;
D.原料气中掺入N2,不影响主、副反应各组分浓度,平衡不移动,不影响C2H6平衡转化率,D不符合题意;
故选A。
③平衡时各气体总的物质的量为n2=(0.3+0.6+0.1+0.7)mol=1.7mol,恒温恒容时,,则P2=170kPa,平衡时,,
,,所以;
(2)①反应ⅰ的活化能大于反应ⅱ的活化能,可知断裂C-H键比断裂C-C所需能量高,所以更容易断裂的化学键C-C键;
②反应ⅳ生成甲烷,而甲烷含量较低,说明链传递的主要途径为反应ⅲ→反应ⅴ;
(3)①温度越高反应速率越快,乙烷脱氢反应为吸热反应,温度升高,平衡正向移动,所以温度越高,乙烷转化率越大;
②据图可知当温度为550℃时乙烷的转化率可以长时间保持较高转化率,且乙烯的选择性较高,所以该催化剂的最佳工作温度550℃。
15.(1) a
(2)NaOH
(3) 抑制 此条件下的溶解主要受反应2的影响,增大该平衡正向移动 > 相同浓度下,在NaCl溶液中的溶解度比在HCl溶液中的小 饱和NaCl溶液中对溶解的抑制效果大于对溶解的促进效果
【分析】利用软锰矿和浓盐酸制取纯净干燥氯气,装置A为氯气发生装置,生成的氯气中混有HCl气体,B装置中饱和食盐水可以除去氯气中混有的HCl,C中浓硫酸可以干燥氯气,D装置收集氯气,E装置可以吸收过量的氯气,以此解答。
【详解】(1)装置A中和浓盐酸在加热的条件下发生反应生成氯气,可以使用装置a,发生反应的化学方程式为:。
(2)E装置可以吸收过量的氯气,盛放的试剂是NaOH溶液。
(3)①0.19,饱和氯水中c(Cl )=0.03mol L 1,c[Cl2(aq)]=0.062mol L 1,则=;
②图表数据可知,在HCl溶液中,c(HCl)<0.2mol L-1时,反应以Cl2(aq)+H2O H++Cl-+HClO为主,Cl-对Cl2溶解起抑制作用,c(HCl)>0.5mol L-1时,Cl2溶解度增大的原因是:此条件下Cl2的溶解主要受反应 的影响,c(Cl-)增大该平衡正向移动;
③综合以上数据分析可知,相同浓度下,Cl2在NaCl溶液中的溶解度比在HCl溶液中的小,对Cl2溶解的抑制效果:Na+>H+,证据是相同浓度下,Cl2在NaCl溶液中的溶解度比在HCl溶液中的小;
④常温下饱和NaCl溶液抑制Cl2溶解的原因是:饱和NaCl溶液中Na+对Cl2溶解的抑制效果大于Cl-对Cl2溶解的促进效果。
答案第10页,共10页
答案第9页,共10页
同课章节目录
