2.3.1共价键的极性课件(共33张PPT)2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.1共价键的极性课件(共33张PPT)2023-2024学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 10:19:15 | ||
图片预览






文档简介
(共33张PPT)
第三节
分子结构与物质的性质
第1课时
键的极性
人教版(2019)化学选择性必修二
第二章 分子结构与性质
1.能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
2.知道分子可以分为极性分子和非极性分子。
3.知道分子极性和分子中键的极性、分子的空间结构密切相关。
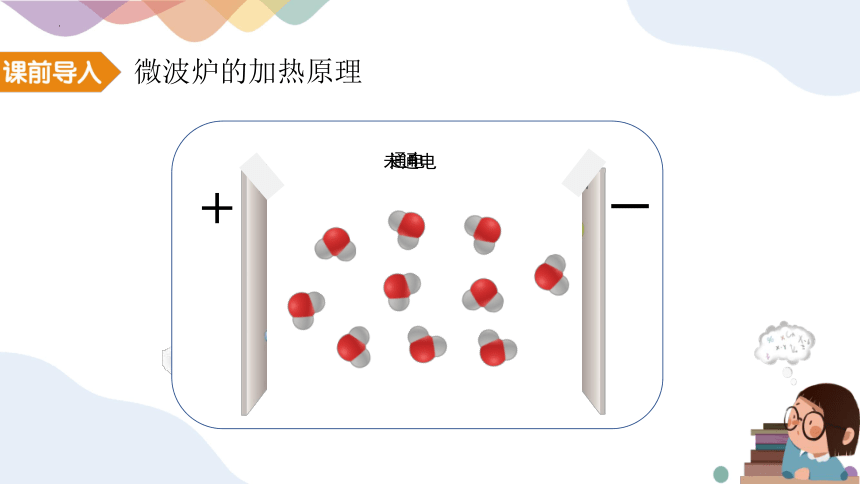
微波炉的加热原理
未通电
+
通电
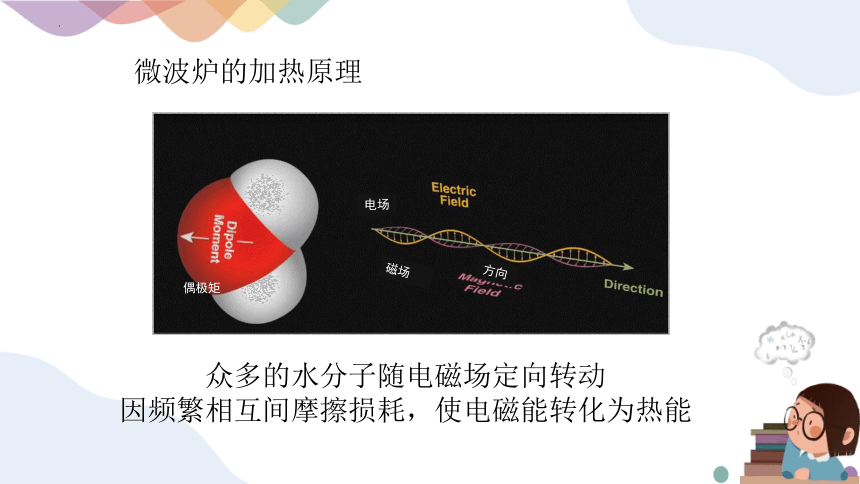
众多的水分子随电磁场定向转动
因频繁相互间摩擦损耗,使电磁能转化为热能
电场
磁场
方向
偶极矩
微波炉的加热原理
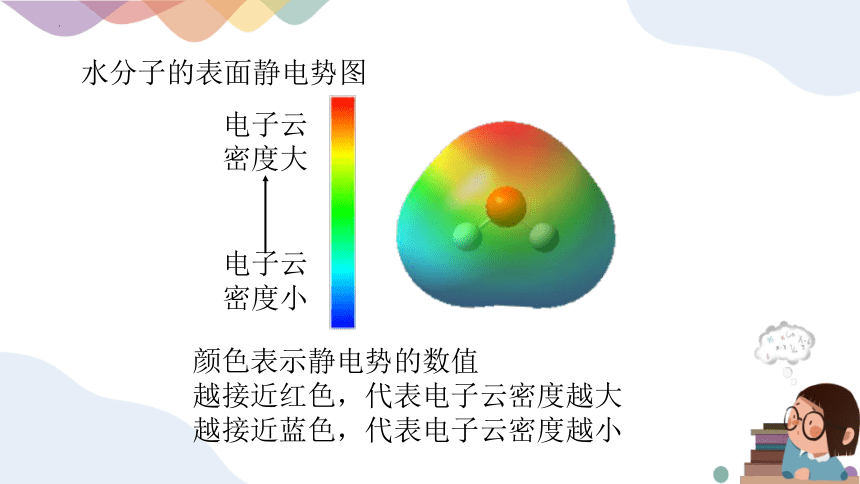
水分子的表面静电势图
电子云
密度大
电子云
密度小
颜色表示静电势的数值
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
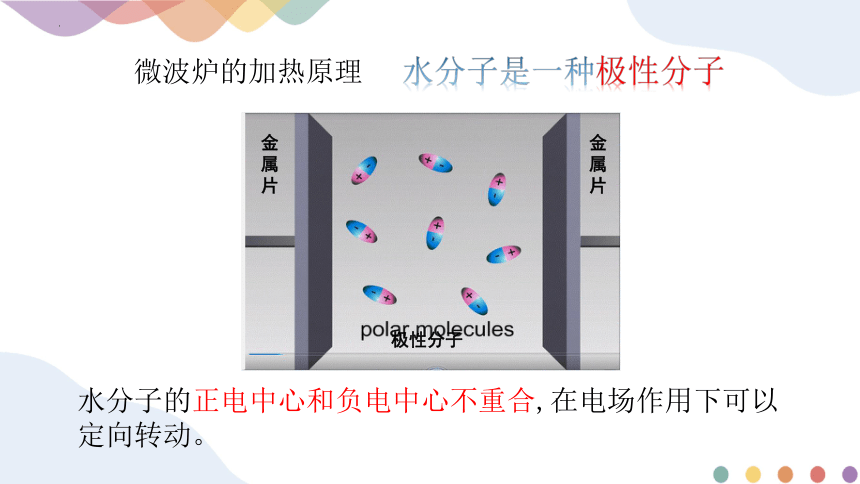
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理
水分子是一种极性分子
分子的极性
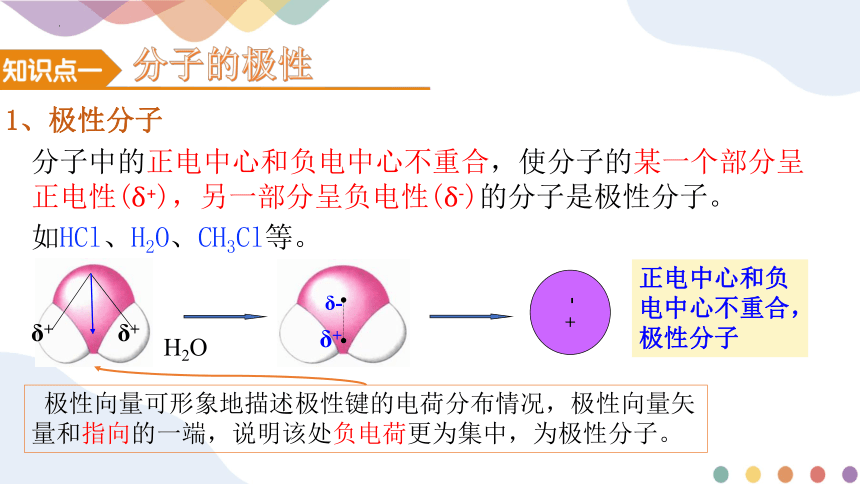
1、极性分子
分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子是极性分子。
H2O
δ+
δ+
δ-
δ+
+ -
正电中心和负电中心不重合,极性分子
如HCl、H2O、CH3Cl等。
极性向量可形象地描述极性键的电荷分布情况,极性向量矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
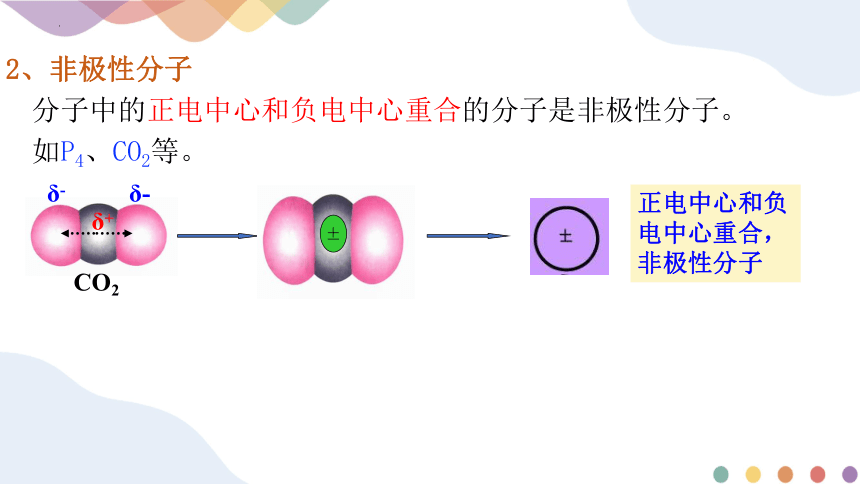
2、非极性分子
分子中的正电中心和负电中心重合的分子是非极性分子。
如P4、CO2等。
δ+
δ-
δ-
CO2
±
正电中心和负电中心重合,非极性分子
根据共用电子对是否偏移,共价键有极性键、非极性键之分。 以共价键结合的分子也有极性分子、非极性分子之分。
分子的极性可以通过哪些方法确定?
问题1:
问题2:
分子的极性和共价键的极性有关系吗?是否极性分子一定含有极性共价键,非极性分子一定含有非极性共价键?
键的极性
不同原子形成的共价键,因两个原子吸引电子的能力不同,共用电子对发生偏移,使两个键合原子一个呈正电性( +),一个呈负电性( -),这种共价键叫作极性共价键,简称极性键。
(1)极性键
在形成氯化氢分子时,氯原子吸引电子的能力比氢原子强,共用电子偏向氯原子使氯原子呈负电性( -) 、偏离氢原子使氢原子呈正电性( +)。
H
Cl
×
δ+
δ-
相同原子形成的共价键,因两个原子吸引电子的能力相同,共用电子对不发生偏移,两个键合原子呈中性,这种共价键叫作非极性共价键,简称非极性键。
(2)非极性键
在形成氢气分子时,两个氢原子吸引电子的能力相等,共用电子不偏移,两个成键氢原子不显电性。
H
H
(3)成键特点
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
成键元素电负性值差异越大,共价键的极性越强
共价键
极性键
非极性键
不同原子间
同种原子间
共用电子对偏移
成键原子呈电性
共用电子对不偏移
成键原子呈电中性
①CO2
②H2O
只存在极性共价键的分子:
非极性分子
极性分子
结论:
含极性共价键的分子不一定是极性分子,非极性分子也不一定只含非极性共价键。
判断分子的极性不能只看分子共价键类型。
分子的极性是由分子中所含共价键的极性与分子的立体构型两方面共同决定。
3、分子极性判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
分子极性取决共价键是否有极性:由非极性键组成的双原子分子一定是非极性分子,由极性键组成的双原子分子一定是极性分子。
如Cl2、O2、N2
如HCl、NO、SiC
(3)多原子分子(ABn型)
——取决于分子空间构型
判断方法:
①物理模型法(从力的角度分析)
在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断:F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)。
O
O
C
180
F1
F2
F合=0
C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消(F合=0),故整个分子没有极性,电荷分布均匀,是非极性分子。
如CO2:
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,H2O分子是V形、不对称分子,两个O-H键的极性不能抵消(F合≠0),故整个分子电荷分布不均匀,是极性分子。
如H2O:
如NH3:
H
H
H
N
107
三角锥形, 不对称分子,键的极性不能抵消,是极性分子。
如BF3:
120
F1
F2
F3
F′
平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子
109 28'
正四面体型,对称结构,C-H键的极性互相抵消(F合=0),非极性分子
C
H
H
H
H
如CH4:
②化合价法
中心原子化合价绝对值
该元素的价电子数
=
分子的空间结构中心对称
≠
该元素的价电子数
分子的空间结构非中心对称
该分子为非极性分子
直线形
平面正三角形
正四面体
……
该分子为极性分子
V形
三角锥形
四面体
……
如:BF3
B原子化合价绝对值=价电子数=3
非极性分子
如:SO2
S原子化合价绝对值为4≠价电子数6
极性分子
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
常见分子的极性、非极性判断
③根据所含共价键的类型及分子的空间结构判断
当ABn型分子的空间构型是空间对称结构时,由于分子的正负电荷中心重合,故为非极性分子。
当分子的空间构型不是空间对称结构时,一般为极性分子
分子类型 键的极性 分子空间结构 分子极性 代表物
双原子 分子
三原子 分子
A2
AB
A2B
(AB2)
非极性键
极性键
极性键
极性键
直线形(对称)
直线形(不对称)
直线形(对称)
V形(不对称)
非极性
非极性
极性
极性
H2、O2、Cl2、N2等
HF、HCl、CO、NO等
CO2、CS2
等(键角180°)
H2O(键角105°)等
分子类型 键的极性 分子空间结构 分子极性 代表物
四原子 分子
五原子 分子
AB3
极性键
平面三角
形(对称)
非极性
BF3、BCl3等
极性键
三角锥形
(不对称)
极性
NH3(键角107°)等
AB4
极性键
极性键
ABnC4-n
(n<4且为整数)
正四面体
形(对称)
四面体形
(不对称)
非极性
极性
CH4、CCl4(键角
109°28')等
CHCl3、CH2Cl2等
1、上述九种物质中含非极性共价键的物质有哪些?
P4中的P—P为非极性共价键,C60中的C—C为非极性共价键
2、上述九种物质中,哪些是非极性分子?哪些是极性分子?
P4、C60、CO2、BF3、CH4为非极性分子
HCN、H2O、NH3、CH3Cl为极性分子
3、为什么臭氧是极性分子?
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
由于臭氧极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度。
离域π键
离域π键
δ+
δ-
δ-
比较臭氧在水中的溶解度和CCl4中的溶解度?
4、双氧水是一种医用消毒杀菌剂,能有效灭杀新冠病毒,已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个H原子犹如在半展开的书的两页纸上,书面夹角为93°52′,而两个O—H与O—O的夹角为96°52′。如图所示:
H2O2分子中正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
不重合;H2O2属于极性分子
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH →2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
分析:
键的极性影响分子化学性质
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、 为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
所以酸性:甲酸>乙酸>丙酸
随着烃基加长,酸性的差异越来越小
羧酸的酸性大小与其分子的组成和结构有关,如下表所示。
2、比较三氟乙酸和三氯乙酸的酸性强弱,并解释其原因。
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C-F键的极性大于C-Cl键,导致羧基中的O-H键的极性更大,更易电离出H+。
Cl-C-C-O-H
O
=
Cl
-
-
Cl
+
-
F-C-C-O-H
O
=
F
-
-
F
+
-
3、 比较氯乙酸和三氯乙酸的酸性强弱,并解释其原因。
由于氯的电负性较大,极性:Cl3C- > Cl2CH- > ClCH2- ,导致三氯乙酸中的羧基的极性最大,更易电离出氢离子。
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
CH3
O
H
δ+
δ-
O
C
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
1.下列物质中含有非极性键的分子是( )
A.CaF2 B.H2O2
C.CO2 D.NaOH
2.(2022·四川遂宁期中)下列各组物质中,都是非极性分子且只含极性键的是( )
A.CO2、BF3 B.CS2、H2O2
C.S8、PCl5 D.CH4、C2H2
B
A
4.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
3.(2022·山东威海期末)下列关于分子极性及分子的空间结构的判断错误的是( )
选项 A B C D
化学式 PCl3 CS2 SO2 CH4
分子极性 极性 非极性 极性 非极性
空间结构 平面三角形 直线形 V形 正四面体形
A
A
第三节
分子结构与物质的性质
第1课时
键的极性
人教版(2019)化学选择性必修二
第二章 分子结构与性质
1.能从共用电子对是否发生偏移的角度认识键的极性的实质是成键原子分别带正电和负电。
2.知道分子可以分为极性分子和非极性分子。
3.知道分子极性和分子中键的极性、分子的空间结构密切相关。
微波炉的加热原理
未通电
+
通电
众多的水分子随电磁场定向转动
因频繁相互间摩擦损耗,使电磁能转化为热能
电场
磁场
方向
偶极矩
微波炉的加热原理
水分子的表面静电势图
电子云
密度大
电子云
密度小
颜色表示静电势的数值
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理
水分子是一种极性分子
分子的极性
1、极性分子
分子中的正电中心和负电中心不重合,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-)的分子是极性分子。
H2O
δ+
δ+
δ-
δ+
+ -
正电中心和负电中心不重合,极性分子
如HCl、H2O、CH3Cl等。
极性向量可形象地描述极性键的电荷分布情况,极性向量矢量和指向的一端,说明该处负电荷更为集中,为极性分子。
2、非极性分子
分子中的正电中心和负电中心重合的分子是非极性分子。
如P4、CO2等。
δ+
δ-
δ-
CO2
±
正电中心和负电中心重合,非极性分子
根据共用电子对是否偏移,共价键有极性键、非极性键之分。 以共价键结合的分子也有极性分子、非极性分子之分。
分子的极性可以通过哪些方法确定?
问题1:
问题2:
分子的极性和共价键的极性有关系吗?是否极性分子一定含有极性共价键,非极性分子一定含有非极性共价键?
键的极性
不同原子形成的共价键,因两个原子吸引电子的能力不同,共用电子对发生偏移,使两个键合原子一个呈正电性( +),一个呈负电性( -),这种共价键叫作极性共价键,简称极性键。
(1)极性键
在形成氯化氢分子时,氯原子吸引电子的能力比氢原子强,共用电子偏向氯原子使氯原子呈负电性( -) 、偏离氢原子使氢原子呈正电性( +)。
H
Cl
×
δ+
δ-
相同原子形成的共价键,因两个原子吸引电子的能力相同,共用电子对不发生偏移,两个键合原子呈中性,这种共价键叫作非极性共价键,简称非极性键。
(2)非极性键
在形成氢气分子时,两个氢原子吸引电子的能力相等,共用电子不偏移,两个成键氢原子不显电性。
H
H
(3)成键特点
同种非金属元素原子间形成的共价键是非极性键
不同种非金属元素原子间形成的共价键是极性键
成键元素电负性值差异越大,共价键的极性越强
共价键
极性键
非极性键
不同原子间
同种原子间
共用电子对偏移
成键原子呈电性
共用电子对不偏移
成键原子呈电中性
①CO2
②H2O
只存在极性共价键的分子:
非极性分子
极性分子
结论:
含极性共价键的分子不一定是极性分子,非极性分子也不一定只含非极性共价键。
判断分子的极性不能只看分子共价键类型。
分子的极性是由分子中所含共价键的极性与分子的立体构型两方面共同决定。
3、分子极性判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
分子极性取决共价键是否有极性:由非极性键组成的双原子分子一定是非极性分子,由极性键组成的双原子分子一定是极性分子。
如Cl2、O2、N2
如HCl、NO、SiC
(3)多原子分子(ABn型)
——取决于分子空间构型
判断方法:
①物理模型法(从力的角度分析)
在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断:F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)。
O
O
C
180
F1
F2
F合=0
C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消(F合=0),故整个分子没有极性,电荷分布均匀,是非极性分子。
如CO2:
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,H2O分子是V形、不对称分子,两个O-H键的极性不能抵消(F合≠0),故整个分子电荷分布不均匀,是极性分子。
如H2O:
如NH3:
H
H
H
N
107
三角锥形, 不对称分子,键的极性不能抵消,是极性分子。
如BF3:
120
F1
F2
F3
F′
平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子
109 28'
正四面体型,对称结构,C-H键的极性互相抵消(F合=0),非极性分子
C
H
H
H
H
如CH4:
②化合价法
中心原子化合价绝对值
该元素的价电子数
=
分子的空间结构中心对称
≠
该元素的价电子数
分子的空间结构非中心对称
该分子为非极性分子
直线形
平面正三角形
正四面体
……
该分子为极性分子
V形
三角锥形
四面体
……
如:BF3
B原子化合价绝对值=价电子数=3
非极性分子
如:SO2
S原子化合价绝对值为4≠价电子数6
极性分子
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
常见分子的极性、非极性判断
③根据所含共价键的类型及分子的空间结构判断
当ABn型分子的空间构型是空间对称结构时,由于分子的正负电荷中心重合,故为非极性分子。
当分子的空间构型不是空间对称结构时,一般为极性分子
分子类型 键的极性 分子空间结构 分子极性 代表物
双原子 分子
三原子 分子
A2
AB
A2B
(AB2)
非极性键
极性键
极性键
极性键
直线形(对称)
直线形(不对称)
直线形(对称)
V形(不对称)
非极性
非极性
极性
极性
H2、O2、Cl2、N2等
HF、HCl、CO、NO等
CO2、CS2
等(键角180°)
H2O(键角105°)等
分子类型 键的极性 分子空间结构 分子极性 代表物
四原子 分子
五原子 分子
AB3
极性键
平面三角
形(对称)
非极性
BF3、BCl3等
极性键
三角锥形
(不对称)
极性
NH3(键角107°)等
AB4
极性键
极性键
ABnC4-n
(n<4且为整数)
正四面体
形(对称)
四面体形
(不对称)
非极性
极性
CH4、CCl4(键角
109°28')等
CHCl3、CH2Cl2等
1、上述九种物质中含非极性共价键的物质有哪些?
P4中的P—P为非极性共价键,C60中的C—C为非极性共价键
2、上述九种物质中,哪些是非极性分子?哪些是极性分子?
P4、C60、CO2、BF3、CH4为非极性分子
HCN、H2O、NH3、CH3Cl为极性分子
3、为什么臭氧是极性分子?
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
由于臭氧极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度。
离域π键
离域π键
δ+
δ-
δ-
比较臭氧在水中的溶解度和CCl4中的溶解度?
4、双氧水是一种医用消毒杀菌剂,能有效灭杀新冠病毒,已知H2O2分子的结构如图所示,H2O2分子不是直线形的,两个H原子犹如在半展开的书的两页纸上,书面夹角为93°52′,而两个O—H与O—O的夹角为96°52′。如图所示:
H2O2分子中正电中心和负电中心是否重合?H2O2属于极性分子还是非极性分子?
不重合;H2O2属于极性分子
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH →2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
分析:
键的极性影响分子化学性质
键的极性对化学性质的影响
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
1、 为什么甲酸、乙酸、丙酸的酸性逐渐减弱?
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
所以酸性:甲酸>乙酸>丙酸
随着烃基加长,酸性的差异越来越小
羧酸的酸性大小与其分子的组成和结构有关,如下表所示。
2、比较三氟乙酸和三氯乙酸的酸性强弱,并解释其原因。
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C-F键的极性大于C-Cl键,导致羧基中的O-H键的极性更大,更易电离出H+。
Cl-C-C-O-H
O
=
Cl
-
-
Cl
+
-
F-C-C-O-H
O
=
F
-
-
F
+
-
3、 比较氯乙酸和三氯乙酸的酸性强弱,并解释其原因。
由于氯的电负性较大,极性:Cl3C- > Cl2CH- > ClCH2- ,导致三氯乙酸中的羧基的极性最大,更易电离出氢离子。
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
CH3
O
H
δ+
δ-
O
C
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
1.下列物质中含有非极性键的分子是( )
A.CaF2 B.H2O2
C.CO2 D.NaOH
2.(2022·四川遂宁期中)下列各组物质中,都是非极性分子且只含极性键的是( )
A.CO2、BF3 B.CS2、H2O2
C.S8、PCl5 D.CH4、C2H2
B
A
4.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
3.(2022·山东威海期末)下列关于分子极性及分子的空间结构的判断错误的是( )
选项 A B C D
化学式 PCl3 CS2 SO2 CH4
分子极性 极性 非极性 极性 非极性
空间结构 平面三角形 直线形 V形 正四面体形
A
A
