2024届高三化学二轮复习 化学新情境训练2:聚焦科技前沿(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习 化学新情境训练2:聚焦科技前沿(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 414.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 00:00:00 | ||
图片预览




文档简介
2024年高考化学新情境训练2 聚焦科技前沿
1.(2023·茂名统考)我国在一些关键核心技术实现了突破,载人航天、探月探火、深海深地探测、超级计算机、卫星导航等领域取得重大成果。下列成果中所用材料属于合金的是( )
A.天问一号用的SiO2气凝胶 B.天和核心舱用的BN陶瓷 C.“奋斗者”号潜水艇的钛铝外壳 D.北斗导航卫星的太阳能电池用的氮化镓
2.(2023·青岛高三统考)2022年中国十大科技新闻之一是物理化学科学家联合突破海水无淡化原位直接电解制氢技术,向大海要水要资源又有新进展。下列说法正确的是( )
A.该过程将化学能转化为电能
B.H2O、D2O、T2O互为同位素
C.氢能源代替化石能源可缓解海水酸化
D.实验室电解水常加入少量稀盐酸增强导电性
3.(2023·梅州统考)我国科学家在月壤粉末的部分铁橄榄石颗粒表面非晶层中发现了单质铁,产生的原因为:铁橄榄石被撞击时在高温与高压下发生熔融,同时其中的Fe2+发生歧化反应生成Fe与Fe3+。下列说法正确的是( )
A.Fe2+在生成Fe3+时失去电子,发生还原反应
B.可用X射线衍射实验测定铁橄榄石的晶体结构
C.Fe2+和Fe含有的电子数相同
D.基态Fe3+的核外电子有26种不同的运动状态
4.(2023·温州二模)2022年诺贝尔化学奖颁发给为点击化学发展做出贡献的3位科学家。点击反应的原料之一——化合物M(结构如图),下列说法正确的是( )
A.属于烃,能使酸性高锰酸钾溶液褪色
B.分子中所有碳原子共平面
C.分子中没有手性碳原子
D.1 mol该物质与H2反应,最多可消耗5 mol H2
5.(2023·榆林二模)我国科学家利用M制备的有机—金属框架(MO)可以高效快速分离CO2和N2,M的结构式如图所示。短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10。下列说法正确的是( )
A.最简单氢化物的沸点:R >Z>Y
B.R的单质与X2Z不发生反应
C.简单离子半径:Z >R
D.YX3YX2ZX不溶于水
6.(2023·南通高三统考)我国科学家在苯炔不对称芳基化反应方面取得重要进展,一定条件下该反应转化如下:
下列说法正确的是( )
A.箭头a所示C—H比箭头b所示C—H活泼
B.1 mol苯炔中所含σ键的数目为10NA
C.1 mol有机物Y最多可与3 mol H2发生加成反应
D.有机物Y可能易溶于水
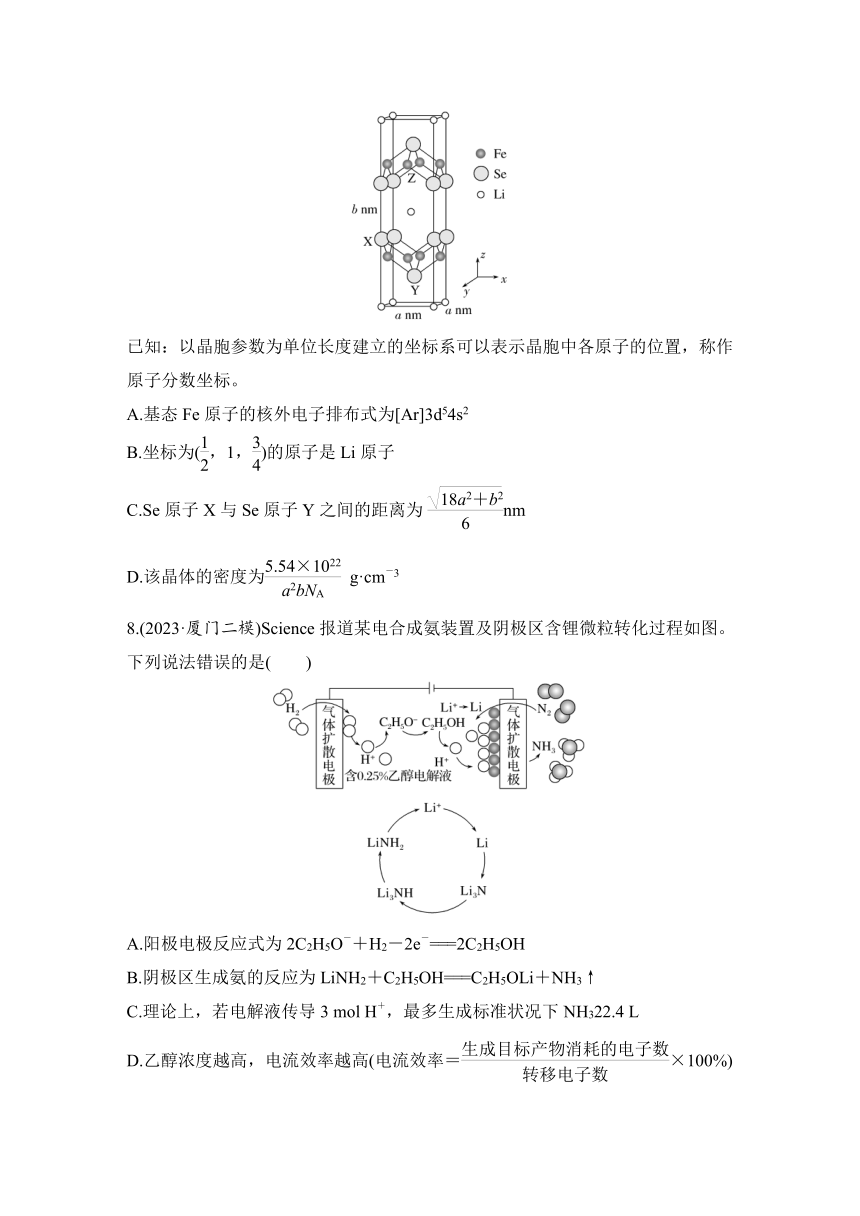
7.(2023·锦州高三联考)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为(,,),设NA为阿伏加德罗常数的值。下列说法正确的是( )
已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
A.基态Fe原子的核外电子排布式为[Ar]3d54s2
B.坐标为(,1,)的原子是Li原子
C.Se原子X与Se原子Y之间的距离为nm
D.该晶体的密度为 g·cm-3
8.(2023·厦门二模)Science报道某电合成氨装置及阴极区含锂微粒转化过程如图。下列说法错误的是( )
A.阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH
B.阴极区生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑
C.理论上,若电解液传导3 mol H+,最多生成标准状况下NH322.4 L
D.乙醇浓度越高,电流效率越高(电流效率=×100%)
9.(2023·福建百校联盟三模)金属镓被称为“电子工业脊梁”,与铝同族,性质与铝相似。氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为Ga2O3、Al2O3、SiO2,还有少量Fe2O3等杂质)制备镓和氮化镓的流程如下:
常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
回答下列问题:
(1)“焙烧”过程中Al2O3变为NaAlO2,则Ga2O3与纯碱反应的化学方程式为_____________________________________________________________________。
(2)“碱浸”后滤渣的主要成分为________________(写化学式)。用惰性电极电解含[Ga(OH)4]-的溶液可得到金属Ga,阴极的电极反应式为_____________________________________________________________________
_____________________________________________________________________。
(3)常温下,反应[Ga(OH)4]-(aq)??Ga(OH)3(s)+OH-(aq)的平衡常数K=________。
(4)“碱浸”后溶液的主要成分为Na[Ga(OH)4]、Na2SiO3、Na[Al(OH)4]。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值)。
(实验中须使用的试剂:0.1 mol·L-1 H2SO4溶液、0.1 mol·L-1 NaOH溶液)
(5)用石墨为电极电解熔融Ga2O3得到Ga单质,电极材料需要定期补充的是________极(填“阴”或“阳”)。
10.(2023·郑州统考)2022年11月30日,神舟十五号与神舟十四号乘组在“太空会师”。太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
写出H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式____________________________________________________________________。
(2)一定条件下,反应CO2(g)+4H2(g)??CH4(g)+2H2O(g)达到平衡状态。
①下列操作中,能提高此平衡转化率的是________。
a.加入催化剂
b.降低反应温度
c.移除H2O(g)
d.恒温恒压下通入惰性气体
②某科研小组在一定温度下模拟该反应,向容积为5L的抽空的密闭容器中通入0.2 mol CO2和0.6 mol H2,反应平衡后测得CO2的转化率为50%,则该反应的平衡常数为________。
(3)在相同条件下,CO2(g)与H2(g)还会发生以下副反应:CO2(g)+3H2(g)??CH3OH(g)+H2O(g),该副反应的发生不利于氧循环,原因是_______
____________________________________________________________________。
(4)已知反应CO2(g)+3H2(g)??CH3OH(g)+H2O(g),CO2(g)+H2(g)??CO(g)+H2O(g)。为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3 MPa,温度为260 ℃,向密闭容器中按投料比=3投入一定量CO2和H2,不同反应模式下CO2的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
实验组 反应模式 温度/℃ CO2的平衡转化率/% CH3OH的选择性/%
Ⅰ 普通催化反应器 3 260 21.9 67.3
Ⅱ 分子筛膜催化反应器 3 260 36.1 100
①双功能的分子筛膜催化反应器模式下,恒温恒容时发生反应CO2(g)+3H2(g)??CH3OH(g)+H2O(g),不能说明反应达到化学平衡状态的是________。
a.c(H2O)的浓度不变
b.混合气体的平均相对分子质量不变
c.混合气密度不变
d.断裂3 mol H—H的同时断裂2 mol O—H
②由表中数据可知,双功能的分子筛膜催化反应器模式下,CO2的转化率明显提高,可能的原因是:____________________________________________________。
参考答案
1.C [A.SiO2属于无机非金属材料,A错误;B.BN陶瓷是新型陶瓷材料,属于无机非金属材料,B错误;C.钛铝外壳属于合金材料,C正确;D.氮化镓是化合物,不是合金材料,D错误。]
2.C [A.该电解制氢过程是将电能转化为化学能,A错误;B.同一元素的不同原子之间互称为同位素,H2O、D2O和T2O均为分子,不互为同位素,B错误;C.化石能源燃烧产生大量CO2,溶于水使海水酸化,而氢能源是清洁能源,燃烧产物为水无污染,因此氢能源代替化石能源可缓解海水酸化,C正确;D.为增强导电性,实验室电解水可加入少量NaOH或Na2SO4溶液而不是稀盐酸,否则电解的是HCl而不是水,D错误。]
3.B [A.Fe2+在生成Fe3+时失去电子,被氧化,发生的是氧化反应,A错误;B.X射线衍射实验可区分晶体和非晶体,可测定铁橄榄石的晶体结构,B正确;C.Fe2+含有的电子数=26-2=24,Fe含有的电子数=质子数=26,两者电子数不相同,C错误;D.基态Fe3+的核外有23个电子,所以有23种不同的运动状态,D错误。]
4.C [A.M中除含有C、H元素外还含有O、Br元素,不属于烃,分子中含有碳碳三键,能使酸性高锰酸钾溶液褪色,选项A错误;B.M中存在-C(CH3)3结构,根据甲烷的正四面体结构,该结构中的碳原子不可能全共平面,选项B错误;C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,分子中不存在手性碳原子,选项C正确;D.分子中含有二个碳碳三键和一个苯环,1 mol该物质与H2反应,最多可消耗7 mol H2,选项D错误。]
5.C [短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10,通过分析M的结构式可知,Y能形成4个键,即Y为C;Z能形成2个键,即Z为O;R、X均形成1个键,且R、X的原子半径依次减小,说明R为F、X为H。A.H2O和HF能形成分子间氢键,使沸点升高且H2O分子形成的氢键数目较多,因此最简单氢化物沸点的顺序为H2O >HF >CH4,A错误;B.F2能与H2O发生氧化还原反应生成HF和O2,B错误;C.核外电子排布相同,核电荷数越小,半径越大,简单离子半径顺序为:r(O2-) >r(F-),C正确;D.CH3CH2OH能与水以任意比例互溶,D错误。]
6.B [A.由图可知,有机物X中箭头b所示的氢原子和苯炔发生了加成反应,说明箭头b所示C—H比箭头a所示C—H活泼,故A错误;B.苯炔中含有碳碳之间以及碳氢之间形成的9个σ键和碳碳三键中的1个σ键,则1 mol苯炔中所含σ键的数目为10NA,故B正确;C.有机物Y中苯环和羰基可以和H2发生加成反应,1 mol有机物Y最多可与4 mol H2发生加成反应,故C错误;D.有机物Y中含有苯环和酯基这样的疏水基团,不可能易溶于水,故D错误。]
7.C [A.Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,故A错误;B.由晶胞结构可知坐标为(,1,)的原子是Z原子,即Fe原子,故B错误;C.Se原子X与Se原子Y,沿x轴方向的距离为,沿y轴方向的距离为,沿z轴方向的距离为,两点间的距离为 nm,故C正确;D.Li原子有8个位于顶点,1个位于体心,个数为8×+1=2;Fe有8个位于面上,个数为8×=2;Se原子8个位于棱上,2个位于体内,个数为8×+2=4,晶胞的质量为=g,晶胞体积为a2b×10-21 cm3,密度为 g·cm-3,故D错误。]
8.D [A.阳极发生失电子的氧化反应,由图可知,阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH,A项正确;B.由图可知,阴极区氮气得电子,并结合锂离子先转化为LiNH2,后与C2H5OH反应生成了氨气,即生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑,B项正确;C.LiNH2和C2H5OH羟基中的H均来自电解液传导的氢离子,理论上,若电解液传导3 mol H+,根据生成氨的反应:LiNH2+C2H5OH===C2H5OLi+NH3↑可知,最多生成1 mol NH3,标准状况下为22.4 L,C项正确;D.由电池总反应:N2+3H2===2NH3可知,乙醇属于中间产物,乙醇浓度增大,电流效率无明显变化,D项错误。]
9.(1)Ga2O3+Na2CO32NaGaO2+CO2↑
(2)Fe2O3 [Ga(OH)4]-+3e-===Ga+4OH-
(3)100.4 (4)H2SO4 NaOH 3.7 (5)阳
解析 粉煤灰(主要成分为Ga2O3、Al2O3、SiO2,还有少量Fe2O3等杂质)与纯碱反应,镓转化为可溶性盐、二氧化硅转化为硅酸钠、氧化铝转化为偏铝酸钠,加入碱性溶液碳酸钠,只有氧化铁不反应不溶解,过滤除去氧化铁,得到滤液经过一系列操作得到[Ga(OH)4]-,电解得到镓,最终转化为氮化镓。(1)由图可知,加入碳酸钠焙烧,“焙烧”的目的是将Ga2O3和碳酸钠反应生成NaGaO2和二氧化碳,该反应的化学方程式为Ga2O3+Na2CO32NaGaO2+CO2↑;(2)焙烧后,镓转化为可溶性盐、二氧化硅转化为硅酸钠、氧化铝转化为偏铝酸钠,加入碱性溶液,只有氧化铁不反应不溶解,故过滤后“滤渣1”主要成分为Fe2O3;“电解”可得金属Ga,阴极[Ga(OH)4]-发生还原反应得到金属镓,电极反应式[Ga(OH)4]-+3e-===Ga+4OH-;(3)由图可知,[Ga(OH)4]-=10-5 mol·L-1时,pH为9.4,则pOH=4.6,故常温下,反应[Ga(OH)4]-(aq)??Ga(OH)3(s)+OH-(aq)的平衡常数K===100.4;(4)“碱浸”后溶液的主要成分为Na[Ga(OH)4]、Na2SiO3、Na[Al(OH)4],通入0.1 mol·L-1 H2SO4溶液至生成的沉淀不再溶解,得硅酸沉淀和铝离子、镓离子,向滤液中再次滴入0.1 mol·L-1 NaOH溶液至pH为3.7时停止,过滤洗涤得氢氧化镓沉淀,氢氧化镓沉淀加入0.1 mol·L-1氢氧化钠溶解得到[Ga(OH)4]-溶液;(5)阴极上发生还原反应,即阴极反应式为Ga3++3e-===Ga;阳极产生的氧气与阳极材料中的碳发生反应,故需定期补充的是阳极材料。
10.(1)CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1
(2)①bc ②625
(3)副反应中,氢气转化为水的量少,不利于氧循环
(4)①cd ②双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大
解析 (1)①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
③H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
则H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的方程式为:④CO2(g)+4H2(g)??CH4(g)+2H2O(g),根据盖斯定律可知,②×2-③×2-①得,该反应的ΔH=-166 kJ· mol-1,其热化学方程式为:CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1;(2)①a.加入催化剂只能改变反应速率,平衡不移动,不能改变转化率,a错误;b.该反应为放热反应,降低反应温度平衡正向移动,可以提高平衡转化率,b正确;c.移除H2O(g),则水蒸气的浓度减小,平衡正向移动,转化率增大,c正确;d.恒温恒压下通入惰性气体,容器体积增大,平衡逆向移动,转化率减小,d错误;故选bc;
②根据题给信息可得三段式如下,
则平衡常数K==625;
(3)副反应中,氢气转化为水的量少,不利于氧循环;(4)①a.c(H2O)的浓度不变,说明正逆反应速率相等,反应达到平衡状态,a正确;b.该反应前后气体的计量系数不同,且反应都是气体,则混合气体的平均相对分子质量是一个变量,当其不变的时候可以证明反应达到平衡,b正确;c.容器的体积不变,且反应物和产物都是气体,总质量不变,则混合气密度不是变量,其不变的时候,不能证明反应达到平衡,c错误;d.水中和甲醇中都含有O—H,则断裂3 mol H—H的同时断裂2 mol O—H不能证明正逆反应速率相等,不能证明反应达到平衡,d错误;故选cd;②由表中数据可知双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大
1.(2023·茂名统考)我国在一些关键核心技术实现了突破,载人航天、探月探火、深海深地探测、超级计算机、卫星导航等领域取得重大成果。下列成果中所用材料属于合金的是( )
A.天问一号用的SiO2气凝胶 B.天和核心舱用的BN陶瓷 C.“奋斗者”号潜水艇的钛铝外壳 D.北斗导航卫星的太阳能电池用的氮化镓
2.(2023·青岛高三统考)2022年中国十大科技新闻之一是物理化学科学家联合突破海水无淡化原位直接电解制氢技术,向大海要水要资源又有新进展。下列说法正确的是( )
A.该过程将化学能转化为电能
B.H2O、D2O、T2O互为同位素
C.氢能源代替化石能源可缓解海水酸化
D.实验室电解水常加入少量稀盐酸增强导电性
3.(2023·梅州统考)我国科学家在月壤粉末的部分铁橄榄石颗粒表面非晶层中发现了单质铁,产生的原因为:铁橄榄石被撞击时在高温与高压下发生熔融,同时其中的Fe2+发生歧化反应生成Fe与Fe3+。下列说法正确的是( )
A.Fe2+在生成Fe3+时失去电子,发生还原反应
B.可用X射线衍射实验测定铁橄榄石的晶体结构
C.Fe2+和Fe含有的电子数相同
D.基态Fe3+的核外电子有26种不同的运动状态
4.(2023·温州二模)2022年诺贝尔化学奖颁发给为点击化学发展做出贡献的3位科学家。点击反应的原料之一——化合物M(结构如图),下列说法正确的是( )
A.属于烃,能使酸性高锰酸钾溶液褪色
B.分子中所有碳原子共平面
C.分子中没有手性碳原子
D.1 mol该物质与H2反应,最多可消耗5 mol H2
5.(2023·榆林二模)我国科学家利用M制备的有机—金属框架(MO)可以高效快速分离CO2和N2,M的结构式如图所示。短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10。下列说法正确的是( )
A.最简单氢化物的沸点:R >Z>Y
B.R的单质与X2Z不发生反应
C.简单离子半径:Z >R
D.YX3YX2ZX不溶于水
6.(2023·南通高三统考)我国科学家在苯炔不对称芳基化反应方面取得重要进展,一定条件下该反应转化如下:
下列说法正确的是( )
A.箭头a所示C—H比箭头b所示C—H活泼
B.1 mol苯炔中所含σ键的数目为10NA
C.1 mol有机物Y最多可与3 mol H2发生加成反应
D.有机物Y可能易溶于水
7.(2023·锦州高三联考)Li、Fe、Se可形成新型超导材料,晶胞如图所示(Fe原子均位于面上)。晶胞棱边夹角均为90°,X的坐标为(0,1, ),Y的坐标为(,,),设NA为阿伏加德罗常数的值。下列说法正确的是( )
已知:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。
A.基态Fe原子的核外电子排布式为[Ar]3d54s2
B.坐标为(,1,)的原子是Li原子
C.Se原子X与Se原子Y之间的距离为nm
D.该晶体的密度为 g·cm-3
8.(2023·厦门二模)Science报道某电合成氨装置及阴极区含锂微粒转化过程如图。下列说法错误的是( )
A.阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH
B.阴极区生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑
C.理论上,若电解液传导3 mol H+,最多生成标准状况下NH322.4 L
D.乙醇浓度越高,电流效率越高(电流效率=×100%)
9.(2023·福建百校联盟三模)金属镓被称为“电子工业脊梁”,与铝同族,性质与铝相似。氮化镓是5G技术中广泛应用的新型半导体材料。利用粉煤灰(主要成分为Ga2O3、Al2O3、SiO2,还有少量Fe2O3等杂质)制备镓和氮化镓的流程如下:
常温下,相关元素可溶性组分的物质的量浓度的对数与pH的关系如下图所示,当溶液中可溶性组分浓度c≤10-5 mol·L-1时,可认为已除尽。
回答下列问题:
(1)“焙烧”过程中Al2O3变为NaAlO2,则Ga2O3与纯碱反应的化学方程式为_____________________________________________________________________。
(2)“碱浸”后滤渣的主要成分为________________(写化学式)。用惰性电极电解含[Ga(OH)4]-的溶液可得到金属Ga,阴极的电极反应式为_____________________________________________________________________
_____________________________________________________________________。
(3)常温下,反应[Ga(OH)4]-(aq)??Ga(OH)3(s)+OH-(aq)的平衡常数K=________。
(4)“碱浸”后溶液的主要成分为Na[Ga(OH)4]、Na2SiO3、Na[Al(OH)4]。请补充完整流程中“操作”过程的步骤(在方框内填入试剂的化学式或pH值)。
(实验中须使用的试剂:0.1 mol·L-1 H2SO4溶液、0.1 mol·L-1 NaOH溶液)
(5)用石墨为电极电解熔融Ga2O3得到Ga单质,电极材料需要定期补充的是________极(填“阴”或“阳”)。
10.(2023·郑州统考)2022年11月30日,神舟十五号与神舟十四号乘组在“太空会师”。太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
写出H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式____________________________________________________________________。
(2)一定条件下,反应CO2(g)+4H2(g)??CH4(g)+2H2O(g)达到平衡状态。
①下列操作中,能提高此平衡转化率的是________。
a.加入催化剂
b.降低反应温度
c.移除H2O(g)
d.恒温恒压下通入惰性气体
②某科研小组在一定温度下模拟该反应,向容积为5L的抽空的密闭容器中通入0.2 mol CO2和0.6 mol H2,反应平衡后测得CO2的转化率为50%,则该反应的平衡常数为________。
(3)在相同条件下,CO2(g)与H2(g)还会发生以下副反应:CO2(g)+3H2(g)??CH3OH(g)+H2O(g),该副反应的发生不利于氧循环,原因是_______
____________________________________________________________________。
(4)已知反应CO2(g)+3H2(g)??CH3OH(g)+H2O(g),CO2(g)+H2(g)??CO(g)+H2O(g)。为了提高甲醇的选择性,某科研团队研制了一种具有反应和分离双功能的分子筛膜催化反应器,原理如图所示。
保持压强为3 MPa,温度为260 ℃,向密闭容器中按投料比=3投入一定量CO2和H2,不同反应模式下CO2的平衡转化率和甲醇的选择性的相关实验数据如下表所示。
实验组 反应模式 温度/℃ CO2的平衡转化率/% CH3OH的选择性/%
Ⅰ 普通催化反应器 3 260 21.9 67.3
Ⅱ 分子筛膜催化反应器 3 260 36.1 100
①双功能的分子筛膜催化反应器模式下,恒温恒容时发生反应CO2(g)+3H2(g)??CH3OH(g)+H2O(g),不能说明反应达到化学平衡状态的是________。
a.c(H2O)的浓度不变
b.混合气体的平均相对分子质量不变
c.混合气密度不变
d.断裂3 mol H—H的同时断裂2 mol O—H
②由表中数据可知,双功能的分子筛膜催化反应器模式下,CO2的转化率明显提高,可能的原因是:____________________________________________________。
参考答案
1.C [A.SiO2属于无机非金属材料,A错误;B.BN陶瓷是新型陶瓷材料,属于无机非金属材料,B错误;C.钛铝外壳属于合金材料,C正确;D.氮化镓是化合物,不是合金材料,D错误。]
2.C [A.该电解制氢过程是将电能转化为化学能,A错误;B.同一元素的不同原子之间互称为同位素,H2O、D2O和T2O均为分子,不互为同位素,B错误;C.化石能源燃烧产生大量CO2,溶于水使海水酸化,而氢能源是清洁能源,燃烧产物为水无污染,因此氢能源代替化石能源可缓解海水酸化,C正确;D.为增强导电性,实验室电解水可加入少量NaOH或Na2SO4溶液而不是稀盐酸,否则电解的是HCl而不是水,D错误。]
3.B [A.Fe2+在生成Fe3+时失去电子,被氧化,发生的是氧化反应,A错误;B.X射线衍射实验可区分晶体和非晶体,可测定铁橄榄石的晶体结构,B正确;C.Fe2+含有的电子数=26-2=24,Fe含有的电子数=质子数=26,两者电子数不相同,C错误;D.基态Fe3+的核外有23个电子,所以有23种不同的运动状态,D错误。]
4.C [A.M中除含有C、H元素外还含有O、Br元素,不属于烃,分子中含有碳碳三键,能使酸性高锰酸钾溶液褪色,选项A错误;B.M中存在-C(CH3)3结构,根据甲烷的正四面体结构,该结构中的碳原子不可能全共平面,选项B错误;C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,分子中不存在手性碳原子,选项C正确;D.分子中含有二个碳碳三键和一个苯环,1 mol该物质与H2反应,最多可消耗7 mol H2,选项D错误。]
5.C [短周期主族元素Y、Z、R、X的原子半径依次减小,四种元素的原子序数均不超过10,通过分析M的结构式可知,Y能形成4个键,即Y为C;Z能形成2个键,即Z为O;R、X均形成1个键,且R、X的原子半径依次减小,说明R为F、X为H。A.H2O和HF能形成分子间氢键,使沸点升高且H2O分子形成的氢键数目较多,因此最简单氢化物沸点的顺序为H2O >HF >CH4,A错误;B.F2能与H2O发生氧化还原反应生成HF和O2,B错误;C.核外电子排布相同,核电荷数越小,半径越大,简单离子半径顺序为:r(O2-) >r(F-),C正确;D.CH3CH2OH能与水以任意比例互溶,D错误。]
6.B [A.由图可知,有机物X中箭头b所示的氢原子和苯炔发生了加成反应,说明箭头b所示C—H比箭头a所示C—H活泼,故A错误;B.苯炔中含有碳碳之间以及碳氢之间形成的9个σ键和碳碳三键中的1个σ键,则1 mol苯炔中所含σ键的数目为10NA,故B正确;C.有机物Y中苯环和羰基可以和H2发生加成反应,1 mol有机物Y最多可与4 mol H2发生加成反应,故C错误;D.有机物Y中含有苯环和酯基这样的疏水基团,不可能易溶于水,故D错误。]
7.C [A.Fe为26号元素,基态Fe原子的核外电子排布式为[Ar]3d64s2,故A错误;B.由晶胞结构可知坐标为(,1,)的原子是Z原子,即Fe原子,故B错误;C.Se原子X与Se原子Y,沿x轴方向的距离为,沿y轴方向的距离为,沿z轴方向的距离为,两点间的距离为 nm,故C正确;D.Li原子有8个位于顶点,1个位于体心,个数为8×+1=2;Fe有8个位于面上,个数为8×=2;Se原子8个位于棱上,2个位于体内,个数为8×+2=4,晶胞的质量为=g,晶胞体积为a2b×10-21 cm3,密度为 g·cm-3,故D错误。]
8.D [A.阳极发生失电子的氧化反应,由图可知,阳极电极反应式为2C2H5O-+H2-2e-===2C2H5OH,A项正确;B.由图可知,阴极区氮气得电子,并结合锂离子先转化为LiNH2,后与C2H5OH反应生成了氨气,即生成氨的反应为LiNH2+C2H5OH===C2H5OLi+NH3↑,B项正确;C.LiNH2和C2H5OH羟基中的H均来自电解液传导的氢离子,理论上,若电解液传导3 mol H+,根据生成氨的反应:LiNH2+C2H5OH===C2H5OLi+NH3↑可知,最多生成1 mol NH3,标准状况下为22.4 L,C项正确;D.由电池总反应:N2+3H2===2NH3可知,乙醇属于中间产物,乙醇浓度增大,电流效率无明显变化,D项错误。]
9.(1)Ga2O3+Na2CO32NaGaO2+CO2↑
(2)Fe2O3 [Ga(OH)4]-+3e-===Ga+4OH-
(3)100.4 (4)H2SO4 NaOH 3.7 (5)阳
解析 粉煤灰(主要成分为Ga2O3、Al2O3、SiO2,还有少量Fe2O3等杂质)与纯碱反应,镓转化为可溶性盐、二氧化硅转化为硅酸钠、氧化铝转化为偏铝酸钠,加入碱性溶液碳酸钠,只有氧化铁不反应不溶解,过滤除去氧化铁,得到滤液经过一系列操作得到[Ga(OH)4]-,电解得到镓,最终转化为氮化镓。(1)由图可知,加入碳酸钠焙烧,“焙烧”的目的是将Ga2O3和碳酸钠反应生成NaGaO2和二氧化碳,该反应的化学方程式为Ga2O3+Na2CO32NaGaO2+CO2↑;(2)焙烧后,镓转化为可溶性盐、二氧化硅转化为硅酸钠、氧化铝转化为偏铝酸钠,加入碱性溶液,只有氧化铁不反应不溶解,故过滤后“滤渣1”主要成分为Fe2O3;“电解”可得金属Ga,阴极[Ga(OH)4]-发生还原反应得到金属镓,电极反应式[Ga(OH)4]-+3e-===Ga+4OH-;(3)由图可知,[Ga(OH)4]-=10-5 mol·L-1时,pH为9.4,则pOH=4.6,故常温下,反应[Ga(OH)4]-(aq)??Ga(OH)3(s)+OH-(aq)的平衡常数K===100.4;(4)“碱浸”后溶液的主要成分为Na[Ga(OH)4]、Na2SiO3、Na[Al(OH)4],通入0.1 mol·L-1 H2SO4溶液至生成的沉淀不再溶解,得硅酸沉淀和铝离子、镓离子,向滤液中再次滴入0.1 mol·L-1 NaOH溶液至pH为3.7时停止,过滤洗涤得氢氧化镓沉淀,氢氧化镓沉淀加入0.1 mol·L-1氢氧化钠溶解得到[Ga(OH)4]-溶液;(5)阴极上发生还原反应,即阴极反应式为Ga3++3e-===Ga;阳极产生的氧气与阳极材料中的碳发生反应,故需定期补充的是阳极材料。
10.(1)CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1
(2)①bc ②625
(3)副反应中,氢气转化为水的量少,不利于氧循环
(4)①cd ②双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大
解析 (1)①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1=-890 kJ· mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH2=-572 kJ· mol-1
③H2O(l)===H2O(g) ΔH=+44 kJ· mol-1
则H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的方程式为:④CO2(g)+4H2(g)??CH4(g)+2H2O(g),根据盖斯定律可知,②×2-③×2-①得,该反应的ΔH=-166 kJ· mol-1,其热化学方程式为:CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH=-166 kJ· mol-1;(2)①a.加入催化剂只能改变反应速率,平衡不移动,不能改变转化率,a错误;b.该反应为放热反应,降低反应温度平衡正向移动,可以提高平衡转化率,b正确;c.移除H2O(g),则水蒸气的浓度减小,平衡正向移动,转化率增大,c正确;d.恒温恒压下通入惰性气体,容器体积增大,平衡逆向移动,转化率减小,d错误;故选bc;
②根据题给信息可得三段式如下,
则平衡常数K==625;
(3)副反应中,氢气转化为水的量少,不利于氧循环;(4)①a.c(H2O)的浓度不变,说明正逆反应速率相等,反应达到平衡状态,a正确;b.该反应前后气体的计量系数不同,且反应都是气体,则混合气体的平均相对分子质量是一个变量,当其不变的时候可以证明反应达到平衡,b正确;c.容器的体积不变,且反应物和产物都是气体,总质量不变,则混合气密度不是变量,其不变的时候,不能证明反应达到平衡,c错误;d.水中和甲醇中都含有O—H,则断裂3 mol H—H的同时断裂2 mol O—H不能证明正逆反应速率相等,不能证明反应达到平衡,d错误;故选cd;②由表中数据可知双功能的分子筛膜催化反应器模式下,只发生第一个反应,双功能的分子筛膜能及时分离出水蒸气,平衡右移,二氧化碳产率增大
同课章节目录
