1.1.3电子云和原子轨道 课件 (共15张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.1.3电子云和原子轨道 课件 (共15张PPT) 2023-2024学年高二化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 00:00:00 | ||
图片预览




文档简介
(共15张PPT)
第一节 原子结构
课时3
电子云和原子轨道
第一章 原子结构与性质
读课本P12-13
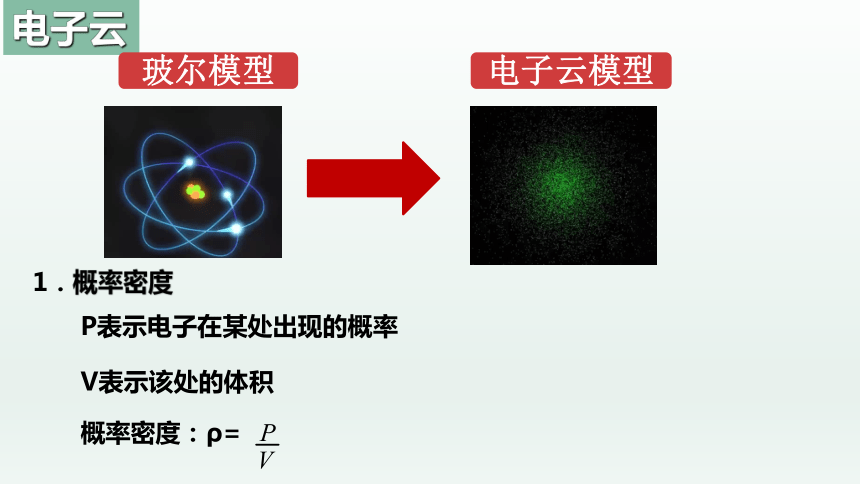
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
1.概率密度
电子云
玻尔模型
电子云模型
氢原子的1s电子在原子核外出现的概率分布图
P12小点是1s电子在原子核外出现外出现的概率密度的形象描述,s电子云为球形。
小点越密,表明概率密度越大
电子云
(1)电子云图表示电子在核外空间某处出现的概率,不代表电子的运
动轨迹。
电子云
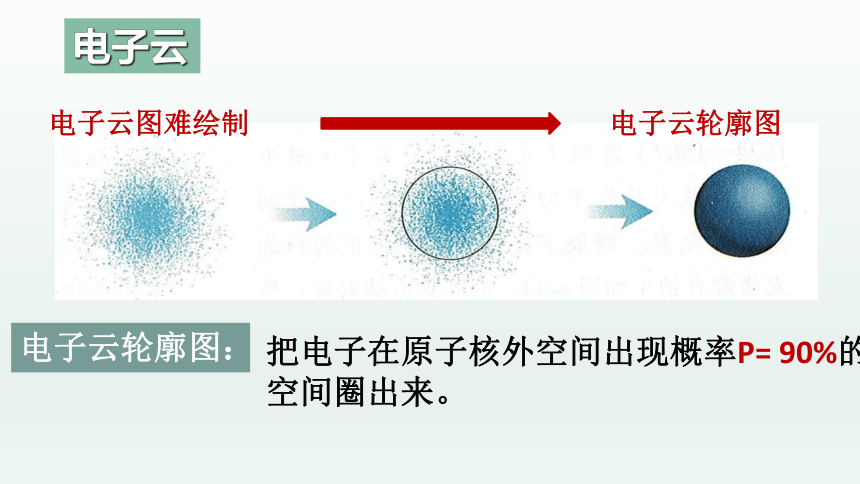
(2)电子云图中的小黑点是电子在原子核外出现的概率密度的形象
描述,小黑点越密,表明电子在核外出现的概率密度越大。
电子云
把电子在原子核外空间出现概率P= 90%的空间圈出来。
电子云轮廓图:
电子云图难绘制
电子云轮廓图
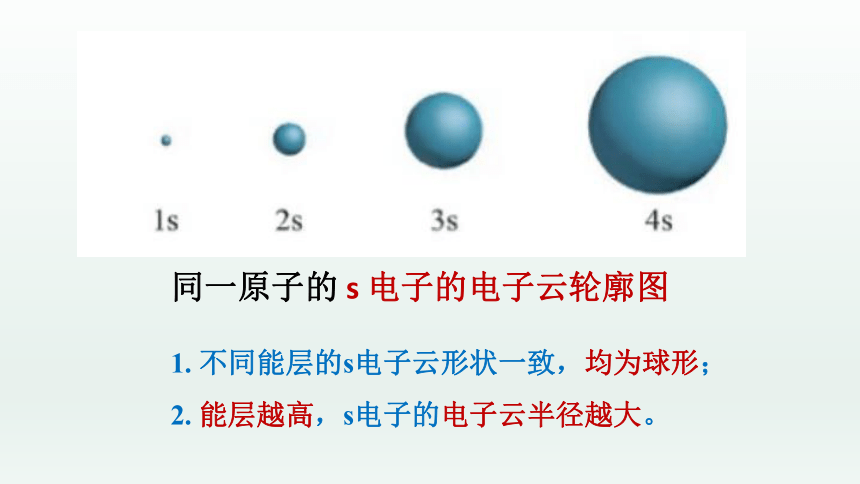
同一原子的 s 电子的电子云轮廓图
1. 不同能层的s电子云形状一致,均为球形;
2. 能层越高,s电子的电子云半径越大。
s电子云呈球形 p电子云呈哑铃形
电子云
除s电子云外,其他电子云都不是球形的。 例如 p电子的原子轨道呈哑铃状。
p能级有三个原子轨道,它们互相垂直,分别以px、py、pz表示,同一能层中px、py、pz的能量相同,是简并轨道。
原子轨道
原子轨道
P14表格
能层 能级 原子轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s 1 1s 球形 -
L 2s 1 2s 球形 -
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 -
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 - - -
[归纳总结] 能层、能级和原子轨道之间的关系。
各能级包含的原子轨道数
(1)ns能级各有1个原子轨道;
(2)np能级各有3个原子轨道;
(3)nd能级各有5个原子轨道;
(4)nf能级各有7个原子轨道;
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
n
n2
原子轨道
构造原理与电子排布式
电子云&原子轨道
电子排布式的书写
电子填充: 依据构造原理
书写电子排布式:按能层序号由低到高;
构造原理
E(4s)<E(4p)<E(4d)<E(4f)
相同能层:
同类能级:
E(1s)<E(2s)<E(3s)<E(4s)
能级交错
s电子的原子轨道呈 形
p电子的原子轨道呈_______形
球
哑铃
M
9
4
D
【课堂练习】
【课堂练习】
下列说法正确的是( )
A.p电子云是平面“8”字形的
B.3p2表示3p能级中有两个原子轨道
C.2d能级包含5个原子轨道,最多容纳10个电子
D.处于最低能量的原子叫基态原子
D
下列有关原子轨道和电子云的说法正确的是( )
A.s轨道呈球形,随电子层数的增加,s轨道数也增加
B.p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C.电子云是笼罩在原子核外的云雾
D.电子云图中小点的疏密程度表示电子在原子核外空间出现概
率的大小
D
【课堂练习】
如图是2pz原子轨道电子云形状的示意图,请观察图示并判断下列说法中不正确的是( )
A.2pz轨道上的电子在空间出现的概率分布是z轴对称
B.s电子的电子云形状是球形对称的
C.电子先沿z轴正半轴运动,然后再沿负半轴运动
D.2pz原子轨道形状为哑铃形
C
【课堂练习】
第一节 原子结构
课时3
电子云和原子轨道
第一章 原子结构与性质
读课本P12-13
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
1.概率密度
电子云
玻尔模型
电子云模型
氢原子的1s电子在原子核外出现的概率分布图
P12小点是1s电子在原子核外出现外出现的概率密度的形象描述,s电子云为球形。
小点越密,表明概率密度越大
电子云
(1)电子云图表示电子在核外空间某处出现的概率,不代表电子的运
动轨迹。
电子云
(2)电子云图中的小黑点是电子在原子核外出现的概率密度的形象
描述,小黑点越密,表明电子在核外出现的概率密度越大。
电子云
把电子在原子核外空间出现概率P= 90%的空间圈出来。
电子云轮廓图:
电子云图难绘制
电子云轮廓图
同一原子的 s 电子的电子云轮廓图
1. 不同能层的s电子云形状一致,均为球形;
2. 能层越高,s电子的电子云半径越大。
s电子云呈球形 p电子云呈哑铃形
电子云
除s电子云外,其他电子云都不是球形的。 例如 p电子的原子轨道呈哑铃状。
p能级有三个原子轨道,它们互相垂直,分别以px、py、pz表示,同一能层中px、py、pz的能量相同,是简并轨道。
原子轨道
原子轨道
P14表格
能层 能级 原子轨道数 原子轨道符号 电子云轮廓图 形状 取向
K 1s 1 1s 球形 -
L 2s 1 2s 球形 -
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 -
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 - - -
[归纳总结] 能层、能级和原子轨道之间的关系。
各能级包含的原子轨道数
(1)ns能级各有1个原子轨道;
(2)np能级各有3个原子轨道;
(3)nd能级各有5个原子轨道;
(4)nf能级各有7个原子轨道;
能层数 K L M N O P Q n
能级数 1 2 3 4 5 6 7
轨道数 1 4 9 16 25 36 49
n
n2
原子轨道
构造原理与电子排布式
电子云&原子轨道
电子排布式的书写
电子填充: 依据构造原理
书写电子排布式:按能层序号由低到高;
构造原理
E(4s)<E(4p)<E(4d)<E(4f)
相同能层:
同类能级:
E(1s)<E(2s)<E(3s)<E(4s)
能级交错
s电子的原子轨道呈 形
p电子的原子轨道呈_______形
球
哑铃
M
9
4
D
【课堂练习】
【课堂练习】
下列说法正确的是( )
A.p电子云是平面“8”字形的
B.3p2表示3p能级中有两个原子轨道
C.2d能级包含5个原子轨道,最多容纳10个电子
D.处于最低能量的原子叫基态原子
D
下列有关原子轨道和电子云的说法正确的是( )
A.s轨道呈球形,随电子层数的增加,s轨道数也增加
B.p轨道呈哑铃形,p轨道电子绕核做“∞”形运动
C.电子云是笼罩在原子核外的云雾
D.电子云图中小点的疏密程度表示电子在原子核外空间出现概
率的大小
D
【课堂练习】
如图是2pz原子轨道电子云形状的示意图,请观察图示并判断下列说法中不正确的是( )
A.2pz轨道上的电子在空间出现的概率分布是z轴对称
B.s电子的电子云形状是球形对称的
C.电子先沿z轴正半轴运动,然后再沿负半轴运动
D.2pz原子轨道形状为哑铃形
C
【课堂练习】
