4.1.2元素周期表 课件 (共29张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2元素周期表 课件 (共29张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 15:57:38 | ||
图片预览







文档简介
(共29张PPT)
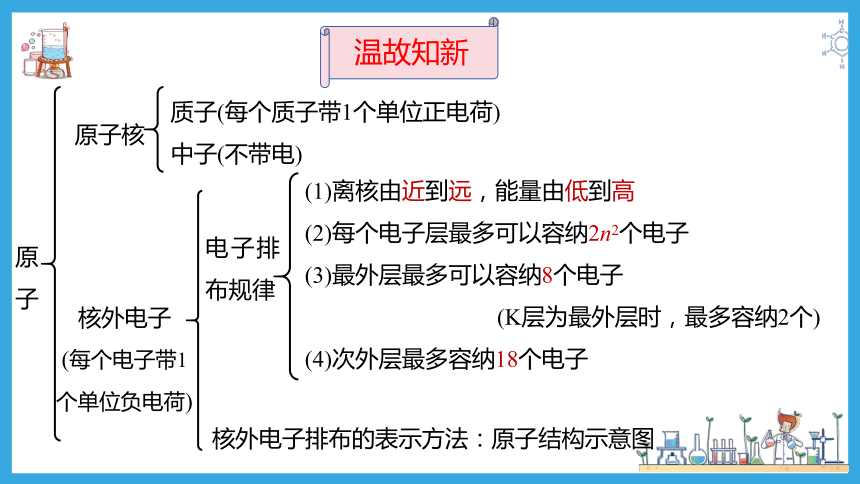
原子核
质子(每个质子带1个单位正电荷)
中子(不带电)
核外电子
(每个电子带1个单位负电荷)
电子排布规律
(1)离核由近到远,能量由低到高
(2)每个电子层最多可以容纳2n2个电子
(3)最外层最多可以容纳8个电子
(K层为最外层时,最多容纳2个)
(4)次外层最多容纳18个电子
核外电子排布的表示方法:原子结构示意图
温故知新
原子
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第 2课时 元素周期表
【学习目标】
1.元素周期表。
2.元素周期表的中元素原子结构与性质的关系。
3.元素“位—构—性”的关系。
元素周期表
1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表的发展历程
1869年,俄国化学家门捷列夫编制出第一张元素周期表。
按照相对原子质量由小到大的顺序依次排列,
将化学性质相似的元素放在同一纵行。
揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中为未知元素留下的空位先后被填满。
当原子的组成及结构的奥秘被发现后,编排依据由相对原子质量
改为原子的核电荷数,形成现行的元素周期表。
诞生
依据
意义
发展
成熟
俄国化学家门捷列夫
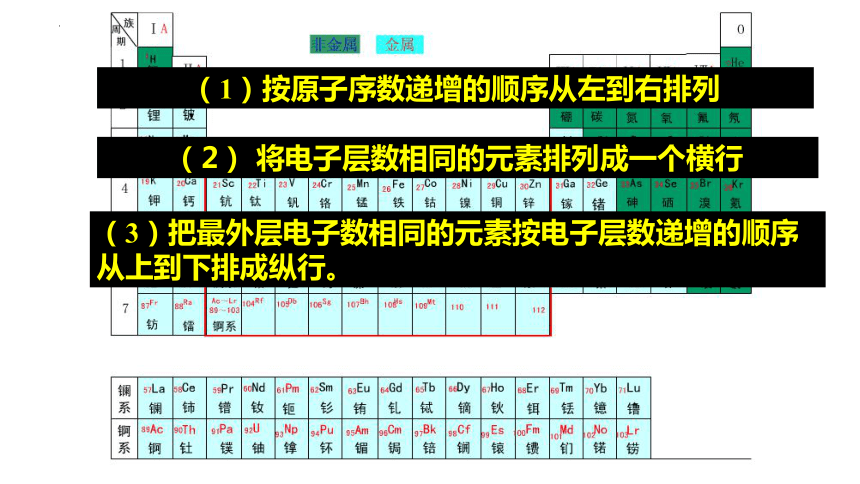
(1)按原子序数递增的顺序从左到右排列
(2) 将电子层数相同的元素排列成一个横行
(3)把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。
1.元素周期表的编排原则
(3)横行:周期——从左到右:电子层数相同、最外层电子数递增排列,7个横行分别称为7个周期。
(4)纵列:族——从上到下:最外层电子数相同、电子层数递增排列,共18列,分为16个族。
(1)原子序数:按照元素在周期表中的顺序给元素编的序号。
(2)原子序数=核电荷数=质子数=核外电子数
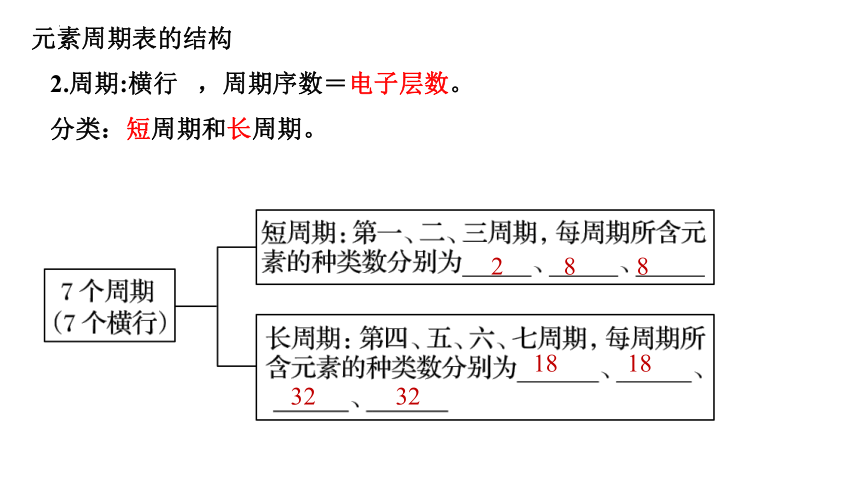
2、周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
短周期
第七周期:32种元素
周期数=电子层数
(镧系元素) 15个
第六周期:32 种元素
长周期
(锕系元素) 15个
元素周期表的结构
2.周期:横行 ,周期序数=电子层数。
分类:短周期和长周期。
2
8
8
18
18
32
32
思考讨论
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2
3
长周期 4
5
6
7 Fr~Og(118号)
2
1
2
8
2
10
8
3
18
18
4
36
18
5
54
32
6
86
32
7
118
=
Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
3、族(纵行)
主族序数=最外层电子数
主族
主族
副族
副族
第Ⅷ族
0族
A:主族七
B:副族七
0 族
主族用“A”表示,长、短周期共同组成
副族用“B”表示,仅由长周期组成
3.族
个数 元素周期表中有___个纵列,共有____个族
特点 主族元素的族序数=_____________
分类 主族 共有___个,包括第________________________________
____族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、
ⅦA
7
8、9、10
18
8
周期
a.个数:元素周期表中有____个周期。
b.特点:每一周期中元素的_____________相同
c.分类:
短周期:包括___________________________。
长周期:包括___________________________。
小结元素周期表结构
7
电子层数
第一、二、三周期
第四、五、六、七周期
族
a.个数:元素周期表有_____个纵行,但只有 ____个族。
b.特点: ____个主族A 、 ____个副族B、VIII族和0族。
16
18
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
7
7
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,VIII族
4.常见族的别称
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB-ⅦB族和Ⅷ族称为过渡元素(过渡金属)
①镧系:在元素周期表的第六周期ⅢB族,57--71共15种元素。
②锕系:在元素周期表的第七周期ⅢB族,89--103共15种元素。
5.元素周期表的特殊位置
ⅠB-ⅦB族和Ⅷ族称为过渡元素(过渡金属)
3.元素周期表方格中的符号的意义
原子序数
元素符号
相对
原子质量
元素名称
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
1、周期(横行)
2
8
8
18
18
32
32
短周期
长周期
周期数=电子层数
元素的种类
周期的名称
元素周期表
三短四长七周期
2、族(纵行)
主族
副族
0族
【注意】第VIII族,包括第8、9、10 纵行
元素周期表
七主七副一八一零族
第VIII族
稀有气体
卤族
碱金属
碱金属元素
11
3
4
5
6
7
8、9、10
12
1
2
13
14
15
16
17
18
卤族元素
元素周期表中:硅元素排在第几列?第几周期第几族?
第 14 列,第三周期第IVA族?
相隔10个纵行
稀有气体元素
第七主族
第VII族
第III周期
第三周期
第3周期
不看元素周期表,结合以上学习,你能不能写出0族元素原子序数?
2
10
18
36
54
86
118
Cl 原子的位置的描述?
哪周期元素种类最多?哪族元素种类最多呢?
第六周期、第七周期
第ⅢB族
思考:
(1)元素的位置与原子结构的互相推断
6.元素周期表的应用:
① X元素是第三周期第ⅠA族元素
则该元素原子有___个电子层,最外层电子数是___,即___为元素。
3
1
钠
② Y元素的原子序数是16,则该元素的原子结构示意图是
其在周期表中的位置是_____________________。
第三周期第ⅥA族
(2)零族定位法
6.元素周期表的应用:
① 第 17 号元素位于第____周期第______族。
② 第 56 号元素位于第____周期第______族。
根据0族元素原子序数判断周期数
根据差值确定族序数
三
VIIA
六
IIA
0族元素 周期序数 原子序数
He 一 2
Ne 二 10
Ar 三 18
Kr 四 36
Xe 五 54
Rn 六 86
Og 七 118
(3)十字定位法
X、Y、Z 均为短周期元素,它们在周期表中的相对位置如图所示。
已知X、Y、Z 三种元素的质子数之和为40,则X、Y、Z分别是( )
A.N、S、Cl B.B、Si、P
C.C、P、S D.Be、Al、Si
A
X
Y
Z
6.元素周期表的应用:
(4)元素位置记忆法
①同周期相邻两元素原子序数差(右与左)
IIIA与IIA
短周期
原子序数差:1
长周期
第四、五周期
原子序数差:11
第六、七周期
原子序数差:25
同一周期其他相邻主族原子序数相差为1
6.元素周期表的应用:
2
8
8
18
18
32
8
8
18
18
32
32
②不同周期相邻主族元素原子序数差(上与下)如下
归纳总结:
①短周期:
原子序数差 =序数差
②长周期:
a.若两元素分布在过渡元素同侧时,
原子序数差 =族序数差
b.若两元素分布在过渡元素两侧时,
四、五周期:原子序数差=族序数差+10
六、七周期:原子序数差=族序数差+24。
7.元素周期表中方格里的符号的意义
原子序数
元素符号
同位素的质量数(加底线的是天然丰度最大的同位素,红色指放射性同位素)
元素名称
相对原子质量量(加括号的是放射性元素最长寿命同位素的质量数)
外层电子构型
归纳
元素的位置与原子结构的关系
(1)短周期元素原子结构与位置的关系
①族序数等于周期序数的元素有H、Be、Al。
②族序数是周期序数的2倍的元素有C、S。
③族序数是周期序数的3倍的元素是O。
④周期序数是族序数的2倍的元素是Li。
⑤周期序数是族序数的3倍的元素是Na。
课堂小结
课堂小结
编排
横行:周期
纵族:列
按照核电荷数(质子数)由小到大排列
周期序数=电子层数
主族序数=最外层电子数
短周期:1、2、3
长周期:4、5、6、7
主族:ⅠA、ⅡA、ⅢA、ⅣA、
ⅤA、ⅥA、ⅦA
副族:ⅠB、ⅡB、ⅢB、ⅣB、
ⅤB、ⅥB、ⅦB、Ⅷ
0族:稀有气体
七个周期
16个族
元素的化学性质与其原子的最外层电子数有关(原子最外层电子数相同,其化学性质相似,氢和氦除外)。
元素周期表
原子核
质子(每个质子带1个单位正电荷)
中子(不带电)
核外电子
(每个电子带1个单位负电荷)
电子排布规律
(1)离核由近到远,能量由低到高
(2)每个电子层最多可以容纳2n2个电子
(3)最外层最多可以容纳8个电子
(K层为最外层时,最多容纳2个)
(4)次外层最多容纳18个电子
核外电子排布的表示方法:原子结构示意图
温故知新
原子
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第 2课时 元素周期表
【学习目标】
1.元素周期表。
2.元素周期表的中元素原子结构与性质的关系。
3.元素“位—构—性”的关系。
元素周期表
1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵列,制出了第一张元素周期表。
元素周期表的发展历程
1869年,俄国化学家门捷列夫编制出第一张元素周期表。
按照相对原子质量由小到大的顺序依次排列,
将化学性质相似的元素放在同一纵行。
揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中为未知元素留下的空位先后被填满。
当原子的组成及结构的奥秘被发现后,编排依据由相对原子质量
改为原子的核电荷数,形成现行的元素周期表。
诞生
依据
意义
发展
成熟
俄国化学家门捷列夫
(1)按原子序数递增的顺序从左到右排列
(2) 将电子层数相同的元素排列成一个横行
(3)把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。
1.元素周期表的编排原则
(3)横行:周期——从左到右:电子层数相同、最外层电子数递增排列,7个横行分别称为7个周期。
(4)纵列:族——从上到下:最外层电子数相同、电子层数递增排列,共18列,分为16个族。
(1)原子序数:按照元素在周期表中的顺序给元素编的序号。
(2)原子序数=核电荷数=质子数=核外电子数
2、周期(横行)
第一周期:2 种元素
第二周期:8 种元素
第三周期:8 种元素
第四周期:18 种元素
第五周期:18 种元素
短周期
第七周期:32种元素
周期数=电子层数
(镧系元素) 15个
第六周期:32 种元素
长周期
(锕系元素) 15个
元素周期表的结构
2.周期:横行 ,周期序数=电子层数。
分类:短周期和长周期。
2
8
8
18
18
32
32
思考讨论
类别 周期序数 起止元素 包括元 素种数 核外电 子层数 稀有气体 原子序数 位置与结
构的关系
短周期 1 H~He 周期序数___电子层数
2
3
长周期 4
5
6
7 Fr~Og(118号)
2
1
2
8
2
10
8
3
18
18
4
36
18
5
54
32
6
86
32
7
118
=
Li~Ne
Na~Ar
K~Kr
Rb~Xe
Cs~Rn
3、族(纵行)
主族序数=最外层电子数
主族
主族
副族
副族
第Ⅷ族
0族
A:主族七
B:副族七
0 族
主族用“A”表示,长、短周期共同组成
副族用“B”表示,仅由长周期组成
3.族
个数 元素周期表中有___个纵列,共有____个族
特点 主族元素的族序数=_____________
分类 主族 共有___个,包括第________________________________
____族
副族 共有___个,包括第ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB族
Ⅷ族 包括第__________三个纵列
0族 占据元素周期表的第___纵列,最外层电子数为__(He为2)
18
16
最外层电子数
7
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、
ⅦA
7
8、9、10
18
8
周期
a.个数:元素周期表中有____个周期。
b.特点:每一周期中元素的_____________相同
c.分类:
短周期:包括___________________________。
长周期:包括___________________________。
小结元素周期表结构
7
电子层数
第一、二、三周期
第四、五、六、七周期
族
a.个数:元素周期表有_____个纵行,但只有 ____个族。
b.特点: ____个主族A 、 ____个副族B、VIII族和0族。
16
18
ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
7
7
ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB,VIII族
4.常见族的别称
族 别名
第ⅠA族(除氢外) _______元素
第ⅦA族 _____元素
0族 稀有气体元素
碱金属
卤族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ⅠB-ⅦB族和Ⅷ族称为过渡元素(过渡金属)
①镧系:在元素周期表的第六周期ⅢB族,57--71共15种元素。
②锕系:在元素周期表的第七周期ⅢB族,89--103共15种元素。
5.元素周期表的特殊位置
ⅠB-ⅦB族和Ⅷ族称为过渡元素(过渡金属)
3.元素周期表方格中的符号的意义
原子序数
元素符号
相对
原子质量
元素名称
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
1、周期(横行)
2
8
8
18
18
32
32
短周期
长周期
周期数=电子层数
元素的种类
周期的名称
元素周期表
三短四长七周期
2、族(纵行)
主族
副族
0族
【注意】第VIII族,包括第8、9、10 纵行
元素周期表
七主七副一八一零族
第VIII族
稀有气体
卤族
碱金属
碱金属元素
11
3
4
5
6
7
8、9、10
12
1
2
13
14
15
16
17
18
卤族元素
元素周期表中:硅元素排在第几列?第几周期第几族?
第 14 列,第三周期第IVA族?
相隔10个纵行
稀有气体元素
第七主族
第VII族
第III周期
第三周期
第3周期
不看元素周期表,结合以上学习,你能不能写出0族元素原子序数?
2
10
18
36
54
86
118
Cl 原子的位置的描述?
哪周期元素种类最多?哪族元素种类最多呢?
第六周期、第七周期
第ⅢB族
思考:
(1)元素的位置与原子结构的互相推断
6.元素周期表的应用:
① X元素是第三周期第ⅠA族元素
则该元素原子有___个电子层,最外层电子数是___,即___为元素。
3
1
钠
② Y元素的原子序数是16,则该元素的原子结构示意图是
其在周期表中的位置是_____________________。
第三周期第ⅥA族
(2)零族定位法
6.元素周期表的应用:
① 第 17 号元素位于第____周期第______族。
② 第 56 号元素位于第____周期第______族。
根据0族元素原子序数判断周期数
根据差值确定族序数
三
VIIA
六
IIA
0族元素 周期序数 原子序数
He 一 2
Ne 二 10
Ar 三 18
Kr 四 36
Xe 五 54
Rn 六 86
Og 七 118
(3)十字定位法
X、Y、Z 均为短周期元素,它们在周期表中的相对位置如图所示。
已知X、Y、Z 三种元素的质子数之和为40,则X、Y、Z分别是( )
A.N、S、Cl B.B、Si、P
C.C、P、S D.Be、Al、Si
A
X
Y
Z
6.元素周期表的应用:
(4)元素位置记忆法
①同周期相邻两元素原子序数差(右与左)
IIIA与IIA
短周期
原子序数差:1
长周期
第四、五周期
原子序数差:11
第六、七周期
原子序数差:25
同一周期其他相邻主族原子序数相差为1
6.元素周期表的应用:
2
8
8
18
18
32
8
8
18
18
32
32
②不同周期相邻主族元素原子序数差(上与下)如下
归纳总结:
①短周期:
原子序数差 =序数差
②长周期:
a.若两元素分布在过渡元素同侧时,
原子序数差 =族序数差
b.若两元素分布在过渡元素两侧时,
四、五周期:原子序数差=族序数差+10
六、七周期:原子序数差=族序数差+24。
7.元素周期表中方格里的符号的意义
原子序数
元素符号
同位素的质量数(加底线的是天然丰度最大的同位素,红色指放射性同位素)
元素名称
相对原子质量量(加括号的是放射性元素最长寿命同位素的质量数)
外层电子构型
归纳
元素的位置与原子结构的关系
(1)短周期元素原子结构与位置的关系
①族序数等于周期序数的元素有H、Be、Al。
②族序数是周期序数的2倍的元素有C、S。
③族序数是周期序数的3倍的元素是O。
④周期序数是族序数的2倍的元素是Li。
⑤周期序数是族序数的3倍的元素是Na。
课堂小结
课堂小结
编排
横行:周期
纵族:列
按照核电荷数(质子数)由小到大排列
周期序数=电子层数
主族序数=最外层电子数
短周期:1、2、3
长周期:4、5、6、7
主族:ⅠA、ⅡA、ⅢA、ⅣA、
ⅤA、ⅥA、ⅦA
副族:ⅠB、ⅡB、ⅢB、ⅣB、
ⅤB、ⅥB、ⅦB、Ⅷ
0族:稀有气体
七个周期
16个族
元素的化学性质与其原子的最外层电子数有关(原子最外层电子数相同,其化学性质相似,氢和氦除外)。
元素周期表
