人教版化学九年级下册 9.2 溶解度 同步练习(含答案)
文档属性
| 名称 | 人教版化学九年级下册 9.2 溶解度 同步练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 484.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-11 09:49:52 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
9.2 溶解度
一、单选题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,充满水的鱼缸壁上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
2.在相同温度下,在盛有等质量饱和食盐水和不饱和食盐水的两只烧杯中,各放一个完全相同的乒乓球,则下列说法不正确的是( )
A.两只烧杯中溶液的溶质质量分数不相同
B.两个乒乓球受到的浮力相同
C.两个乒乓球高出液面的部分不相同
D.两只烧杯中溶液的导电能力相同
3.一定温度下,把1克熟石灰加入到100克水中,充分搅拌后仍有少许的熟石灰未溶解,静置后取上层清液,关于此清液的叙述正确的是( )
A.它是不饱和溶液
B.它是浓溶液
C.它是该温度下的饱和溶液
D.它的溶质质量分数为1%
4.下列有关溶液的说法正确的是( )
A.溶质可以是固体、液体或气体
B.均一、稳定的液体都是溶液
C.将汽油与水混合,得到的是溶液
D.饱和溶液中一定不能再溶解其他物质
5.下列因素中不会影响气体物质溶解度的是( )
A.溶剂的量 B.温度 C.溶质的种类 D.压强
6.将60℃饱和的硝酸钾溶液降温至20℃,没有发生变化的是( )
A.溶液的质量 B.溶剂的质量
C.溶质的质量 D.溶质的质量分数
7.今年5月4日,习总书记在推进南水北调后续工程高质量发展座谈会上强调:“水是生存之本,文明之源,要坚持节水优先,抓好水污染的防治工作”。下列有关水与溶液的说法错误的是( )
A.实验室的废水和废液不能直接排入下水道
B.溶液是均一、稳定的混合物
C.饱和溶液就是不能再溶解任何物质的溶液
D.电解水时,负极产生的是氢气
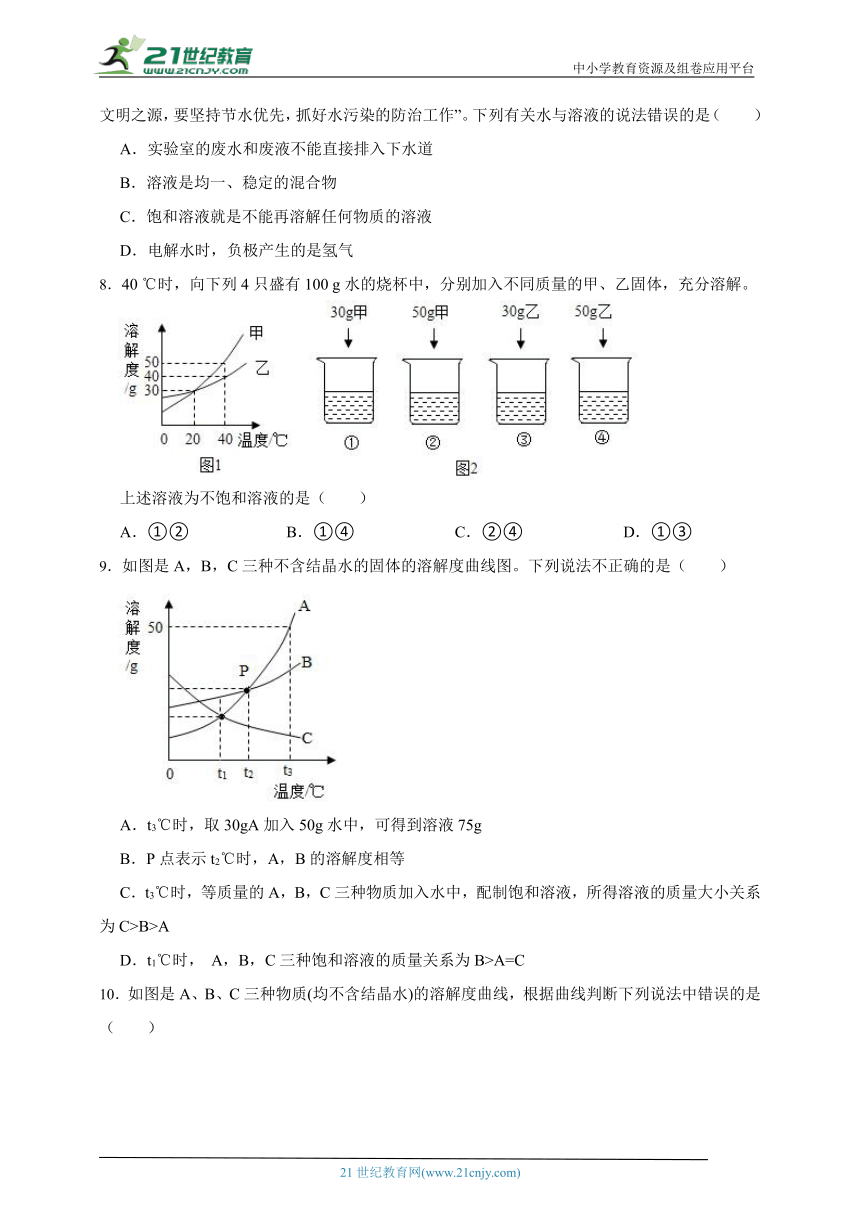
8.40 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的甲、乙固体,充分溶解。
上述溶液为不饱和溶液的是( )
A.①② B.①④ C.②④ D.①③
9.如图是A,B,C三种不含结晶水的固体的溶解度曲线图。下列说法不正确的是( )
A.t3℃时,取30gA加入50g水中,可得到溶液75g
B.P点表示t2℃时,A,B的溶解度相等
C.t3℃时,等质量的A,B,C三种物质加入水中,配制饱和溶液,所得溶液的质量大小关系为C>B>A
D.t1℃时, A,B,C三种饱和溶液的质量关系为B>A=C
10.如图是A、B、C三种物质(均不含结晶水)的溶解度曲线,根据曲线判断下列说法中错误的是( )
A.t2℃时,等质量的A,B,C饱和溶液中溶剂质量最少的是C
B.可通过升温将接近饱和的C溶液变成饱和溶液
C.t1℃时,A,B饱和溶液中溶质的质量分数一定相等
D.A中含有少量B,可用降温结晶法提纯A
11.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,小洁同学由图得出以下几条结论:
①t1℃时,A的饱和溶液和C的饱和溶液中溶质的质量相等
②要使C的饱和溶液转化为不饱和溶液,可采用升温的方法
③从含有少量B的A饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法
④t2℃时,若从A和B两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是A物质的饱和溶液
⑤将t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数B>A=C
以上说法中正确的数目有( )
A.1种 B.2种 C.3种 D.4种
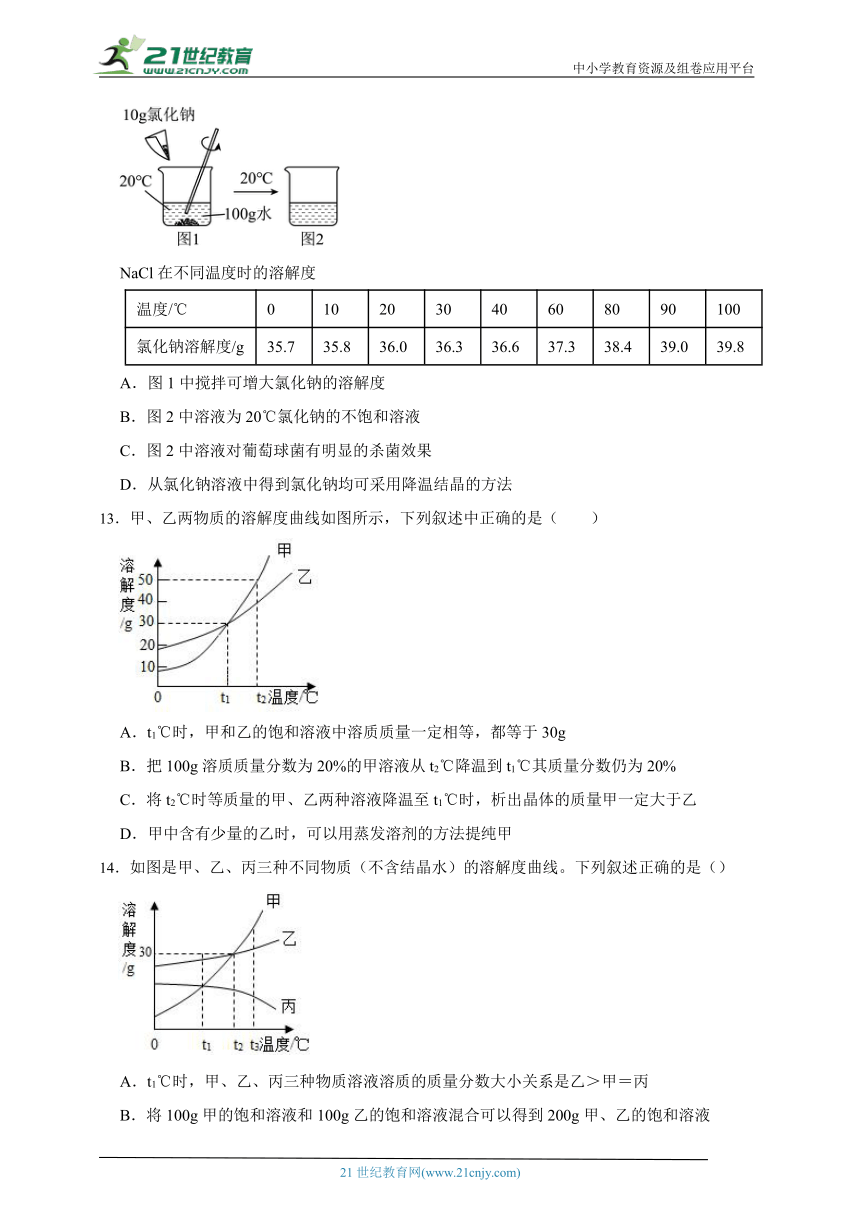
12.浓度为10%的氯化钠溶液对葡萄球菌具有明显的抑制效果。下图为配制氯化钠杀菌液的过程,结合图表信息,有关分析正确的一项是( )
NaCl在不同温度时的溶解度
温度/℃ 0 10 20 30 40 60 80 90 100
氯化钠溶解度/g 35.7 35.8 36.0 36.3 36.6 37.3 38.4 39.0 39.8
A.图1中搅拌可增大氯化钠的溶解度
B.图2中溶液为20℃氯化钠的不饱和溶液
C.图2中溶液对葡萄球菌有明显的杀菌效果
D.从氯化钠溶液中得到氯化钠均可采用降温结晶的方法
13.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
A.t1℃时,甲和乙的饱和溶液中溶质质量一定相等,都等于30g
B.把100g溶质质量分数为20%的甲溶液从t2℃降温到t1℃其质量分数仍为20%
C.将t2℃时等质量的甲、乙两种溶液降温至t1℃时,析出晶体的质量甲一定大于乙
D.甲中含有少量的乙时,可以用蒸发溶剂的方法提纯甲
14.如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线。下列叙述正确的是()
A.t1℃时,甲、乙、丙三种物质溶液溶质的质量分数大小关系是乙>甲=丙
B.将100g甲的饱和溶液和100g乙的饱和溶液混合可以得到200g甲、乙的饱和溶液
C.t1℃时,向50g水中加入10g甲恰好溶解,则t1℃时丙的溶解度为20g
D.将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,甲析出的质量比乙多
15.下列关于溶液的说法错误的是()
A.用洗洁精洗去餐具上的油污,利用的是乳化原理
B.气体的溶解度与温度和压强有关
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.汽油作溶剂可以去除衣物上的油污
16.时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示图像。下列说法不正确的是( )
A.时,100克水最多溶解该固体物质的质量为88g
B.C点所对应的溶液是不饱和溶液
C.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
D.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
二、填空题
17.化学与生活
①喝了汽水以后,常常会打嗝,说明气体溶解度与 有关。
②炒菜时油锅中的油不慎着火,可采取的灭火方法是 或放入较多蔬菜。
18.打开易拉罐拉环有大量的气泡冒出的原因是 ?
19.认识溶液的变化。
根据如图甲、乙、丙三种固体的溶解度曲线回答:
①M点表示的含义是 。
②50℃时,将40g甲物质投入到50g水中,形成的溶液中溶质与溶剂的质量比为 。
③20℃时,处于a点状态甲溶液,升温至50℃,溶质质量分数 (填“变大”、“变小”或“不变”)。
④分别将50℃的三种物质的饱和溶液100g降温到20℃时,甲、乙、丙溶液质量大小关系为 。
20.如图是甲、乙两种固体的溶解度曲线。
甲、乙溶解度相等时的温度为 ℃;t2℃时向80g甲的饱和溶液中加入20g水,所得溶液中溶质的质量分数为 ;将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量关系为甲 乙(填“>”“<”或“=”)。
三、实验探究题
21.化学通过实验研究物质的组成、性质和变化规律。
①实验甲中,发现B中固体可溶,A中几乎不溶,说明影响物质溶解性的因素是 ,补充C试管实验,想探究的影响因素是 。
②实验乙中,观察到集气瓶内壁有 产生。可以得出结论:水由 两种元素组成。
③实验丙中,观察到的现象是 ,体现了二氧化碳 性质。
④实验丁中,磷燃烧的化学方程式 ,其中热水的作用是 。
22.水在化学实验中的作用不可忽视,下图中四个实验分别用到水。
(1)当电源接通一段时间后,正负极产生气体的体积比 。
(2)实验B集气瓶中装满水的目的 。
(3)实验C中同学们做了①试管和②试管的对比实验,发现②试管中固体可溶,①试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是 ,同学们又补充了③试管所示实验,他们想探究的影响因素是 。
(4)实验D中集气瓶中水的作用是 。
四、综合题
23.根据图中KNO3、NaCl的溶解度曲线,回答以下问题:
(1)40 ℃时,KNO3的溶解度 (填“大于”“小于”或“等于”)NaCl的溶解度。
(2)t ℃时,将45 g KNO3固体放入50 g水中充分溶解,此时所得溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质与溶剂的质量比为 (填最简整数比),此时所形成的溶液中溶质质量分数为 (计算结果精确至0.1%)。
(3)KNO3溶液中含有少量NaCl,可以采用 (填“降温结晶”或“蒸发结晶”)的方法提纯KNO3。
(4)40 ℃时,将KNO3的饱和溶液降温至20 ℃,溶液的溶质质量分数 (填“变大”“变小”或“不变”)。
五、计算题
24.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某综合实践活动小组测定葡萄酒中SO2的含量,取320mL某葡萄酒(加适量稀酸),加热使SO2全部逸出,并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液100g。请回答下列问题:
(1)从上述信息可知:当压强一定时,升高温度,SO2气体在水中的溶解度 。(选填“增大”、“减小”或“不变”)
(2)通过计算判断该葡萄酒中SO2的含量是否符合国家标准?(写出计算过程)
答案解析部分
1.【答案】C
【解析】【解答】A、水在烧开的过程中温度不断升高,溶解在水中的气体会由于温度升高溶解度降低而溢出,A不符合题意;
B、阳光充足水温升高,原来溶解在水中的气体由于溶解度变小而冒出并形成小气泡,B不符合题意;
C、启开啤酒瓶盖,有大量气泡逸出,是由于压强变小气体的溶解度变小而导致的,C符合题意;
D、夏季黄昏天气闷热,温度升高,气体的溶解度变小,水中氧气量变少,鱼银缺氧而浮于水面,D不符合题意。
故答案为:C。
【分析】本题主要考查气体的溶解度影响因素,气体的溶解度受温度、压强及气体和溶剂种类影响。
2.【答案】D
【解析】【解答】A. 相同温度下,同种物质的饱和溶液比不饱和溶液的溶质质量分数大,故正确,不符合题意;
B. 两个完全相同的乒乓球受到的浮力相同,故正确,不符合题意;
C. 两个完全相同的乒乓球受到的浮力相同,但由于两种溶液的密度不同,所以两个乒乓球高出液面的部分不相同,故正确,不符合题意;
D. 饱和食盐水导电能力强于不饱和溶液食盐水,故错误,符合题意。
故答案为:D。
【分析】根据溶液的导电能力与溶液中自由移动粒子的多少有关,进行分析。
3.【答案】C
【解析】【解答】A充分搅拌后仍有少许的熟石灰未溶解,因此所得的溶液为该温度下饱和溶液,A不符合题意;
B溶液的浓稀是相比较而言的,只有一种溶液,无法判断溶液的浓稀,B不符合题意;
C在该温度下,不能再溶解熟石灰了,因此所得的溶液是该温度下的饱和溶液,C符合题意;
D由于1克熟石灰未完全溶解,无法计算溶质质量分数,D不符合题意。
故答案为:C。
【分析】在一定温度下,向一定量溶剂中加入某种溶质,当溶质不能再继续溶解时,所的得溶液为饱和溶液,而浓溶液是相对于稀溶液而言的,根溶液是否饱和没有关系,据此分析解答
4.【答案】A
【解析】【解答】A. 溶质可以是固体、液体或气体,故符合题意;
B. 均一、稳定的液体不一定都是溶液,例如水是纯净物,故不符合题意;
C. 将汽油与水混合,不能形成均一稳定的混合物,得到的不是溶液,故不符合题意;
D. 饱和溶液中不能再溶解该种溶质,可能还能溶解其他物质,故不符合题意。
故答案为:A。
【分析】根据溶液的特点,饱和溶液的特点,进行分析。
5.【答案】A
【解析】【解答】A.溶剂的质量不会影响气体物质的溶解度;
B.温度影响气体物质的溶解度,温度越高,气体溶解度越小;
C.溶剂的种类影响气体物质的溶解度;
D.压强影响气体物质的溶解度,压强越大,气体溶解度越大;
故答案为:A。
【分析】根据气体溶解度的影响因素有压强、温度、溶质溶剂的种类分析。
6.【答案】B
【解析】【解答】A、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶液的质量减小,A不符合题意;。
B、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶剂的质量不变,B符合题意;
C、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶质的质量减小,C不符合题意;
D、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶质的质量减少,溶剂的质量不变,溶质的质量分数减小,D不符合题意;。
故答案为:B。
【分析】硝酸钾的溶解度随温度的升高而增大,则降温60℃的饱和溶液,会有晶体析出,导致溶液中溶质的质量减少,溶剂的质量不变,溶液的质量减少,溶质的质量分数减小。
7.【答案】C
【解析】【解答】A. 实验室的废水和废液不能直接排入下水道,以免破坏管道,污染环境,造成危险等,故正确,不符合题意。
B. 溶液是均一、稳定的混合物,故正确,不符合题意。
C. 饱和溶液不能溶解达到饱和的溶质,但还可以溶解其它物质。故错误,符合题意。
D. 电解水时,负极产生的是氢气,正极产生的是氧气,故正确,不符合题意。
故答案为:C。
【分析】一种溶质的饱和溶液可以溶解其他溶质。
8.【答案】D
【解析】【解答】①是甲的不饱和溶液,②是甲的饱和溶液,③是乙的不饱和溶液,④是乙的过饱和溶液。
故答案为:D。
【分析】根据溶解度曲线在40 ℃时,100g水最多能溶解甲物质50g,乙物质40g;判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
9.【答案】D
【解析】【解答】A、t3℃时,A物质的溶解度为50g,取30gA加入50g水中,只能溶解25g,可得到溶液的质量=25g+50g=75g,不符合题意;
B、P点表示t2℃时,A、B的溶解度相等符合题意,因为P点是的交点,不符合题意;
C、t3℃时,等质量的A、B、C三种物质加入水中,配制饱和溶液,所得溶液的质量大小关系为C>B>A符合题意,因为t3℃时,溶解度A>B>C,它们所需水的质量是C>B>A,不符合题意;
D、t1℃时,A、B、C三种饱和溶液的质量分数的关系为B>A=C,溶液质量错误,符合题意;
故答案为:D。
【分析】A、根据 t3℃时A的溶解度和固体物质溶解度的概念分析;
B、理解某温度下溶解度曲线的交点,表示该温度下两物质的溶解度相等;
C、 t3℃时ABC三种物质溶解度的大小关系是A>B>C,故 等质量的A,B,C三种物质溶解度最小的需要的水最多,故溶液的大小关系是: C>B>A
D、t1℃时, A,B,C三种饱和溶液的溶质质量关系为B>A=C ,但无法确定三种物质饱和溶液的质量。
10.【答案】A
【解析】【解答】A、溶液质量=溶质质量+溶剂质量,溶液质量相等,溶质质量越大,溶剂质量越小,t2℃时,A物质的饱和溶液中溶质质量最大,故三种物质的饱和溶液中,溶剂最少的是A,故A符合题意;
B、C的溶解度随温度的升高而减小,通过升温或添加溶质的方法,可将C的不饱和溶液转化成饱和溶液,B不符合题意;
C、t1℃时,A、B两物质的溶解度相同,故在此温度下,无论溶液的质量是否相等,只要是两物质的饱和溶液,则溶液的质量分数相等,C不符合题意;
D、A、B两种物质的溶解度都随温度的降低而减小,但是A变化的幅度较大,受温度影响大,B变化的幅度较小,受温度影响小,因此A中含有少量B,可用降温结晶法提纯A,D不符合题意。
故答案为:A。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
11.【答案】A
【解析】【解答】①由溶解度曲线可知,t1℃时,A和C的溶解度相等,则A的饱和溶液和C的饱和溶液中溶质的质量分数相等,因为两种溶液的质量不能确定,所以溶质质量不一定相等,此选项不符合题意;②C的溶解度随温度的降低而增大,要使C的饱和溶液转化为不饱和溶液,可采用降温的方法,此选项不符合题意;③A的溶解度受温度影响较大,对于溶解度受温度影响较大的物质,采用冷却热饱和溶液的方法使溶质从溶液中结晶析出,所以从含有少量B的A饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法,此选项符合题意;④t2℃时,A的溶解度大于B的溶解度,若从A和B两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是B物质的饱和溶液,此选项不符合题意;⑤将t2℃时,A、B、C的饱和溶液分别降温至t1℃,A、B的溶解度减小,溶质质量分数减小,C的溶解度增大,变为不饱和溶液,溶质质量分数不变,因为t1℃,A的溶解度小于B的溶解度,t1℃,A的溶解度大于t2℃时C的溶解度,所以将t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数B>A>C,此选项不符合题意。
故答案为:A。
【分析】根据溶解度曲线图可以得出,不同物质在同一温度下的溶解度,从而比较物质的溶解性,同一物质在不同温度下的溶解度,从而确定物质得出提纯方法,据此分析
12.【答案】B
【解析】【解答】A.搅拌只能增大溶解速率,不能增大氯化钠的溶解度。A错误。
B.在20℃时,氯化钠的溶解度为36.0g,即在20℃时,100g水最多溶解氯化钠36.0g。所以在20℃时,在100g水中放入10g氯化钠,得到的是氯化钠的不饱和溶液。B正确。
C.配好的溶液的溶质质量分数=,并不是10%。C错误。
D.从表中数据可知,氯化钠的溶解度受温度变化影响不大。所以从氯化钠溶液中获得氯化钠应采用蒸发结晶的方法。D错误。
故选B。
【分析】判断溶液是否饱和,需要判断的是溶液是否能继续溶解某种溶质,如果能继续溶解,则为该种溶质的不饱和溶液,如果不能继续溶解,则为该种溶质的饱和溶液。
13.【答案】B
【解析】【解答】A、t1℃时,两种物质的溶解度相等,甲和乙的饱和溶液中溶质质量分数一定相等,由于没有确定溶液的质量不能确定溶质质量都等于30g,故A不符合题意;
B、根据溶解度曲线可知,t1℃时,甲溶解度为30g,t1℃时,甲的饱和溶液的溶质质量分数= ,t1℃时,20%的甲溶液是不饱和溶液, 把100g溶质质量分数为20%的甲溶液从t2℃降温到t1℃没有溶质析出,其质量分数仍为20%,故B符合题意;
C、没有确定溶液是否饱和,不能确定将t2℃时等质量的甲、乙两种溶液降温至t1℃时,析出晶体的质量甲一定大于乙,故C不符合题意;
D、根据溶解度曲线可知,甲、乙两种物质的溶解度都随温度的降低而减小,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,甲中含有少量的乙时,可以用降温结晶的方法提纯甲,故D不符合题意。
故答案为:B。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
14.【答案】C
【解析】【解答】A. t1℃时,甲、乙、丙三种物质溶液是否饱和不能确定,所以溶液的溶质的质量分数大小也不能确定,故选项A不符合题意;
B. 混合后溶剂质量增加,没有说明温度,甲、乙物质的溶解度不能确定,所以将100g甲的饱和溶液和100g乙的饱和溶液混合不一定得到200g甲、乙的饱和溶液,故选项B不符合题意;
C. t1℃时,向50g水中加入10g甲恰好溶解,则100g水中加入20g甲就能恰好溶解,而t1℃时甲和丙的溶解度相等,因此t1℃时丙的溶解度为20g,故C符合题意;
D. 将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,饱和溶液的质量没有确定,所以析出晶体的质量也就不能确定,故选项D不符合题意。
故答案为:C。
【分析】A、t1℃时,甲、乙、丙三种物质的溶解度大小关系是 乙>甲=丙 ,所以它们饱和溶液的溶质的质量分数大小关系是 乙>甲=丙。
B、溶液没有说明温度,所以甲、乙物质的溶解度不能确定,那么溶液混合不一定得到200g甲、乙的饱和溶液。
C、t1℃时,甲与乙有交点,说明甲与乙在此温度条件下,溶解度相同。
D、根据溶解度曲线图,找出在t2℃时,甲物质和乙物质的溶解度相同;在t1℃时,乙的溶解度大于甲的溶解度。但是此小题中饱和溶液的质量没有确定,所以析出晶体的质量也就不能确定。
15.【答案】C
【解析】【解答】A.洗洁精中含有乳化剂,能将大的油珠分散成无数小的油滴随水流走,用洗洁精洗去餐具上的油污,利用的是乳化原理,A不符合题意;
B.温度越低、压强越大,气体的溶解度越大,气体的溶解度与温度和压强有关,B不符合题意;
C.饱和溶液、不饱和溶液和溶液的浓稀无关,C符合题意;
D.汽油能溶解植物油,汽油作溶剂可以去除衣物上的油污,D不符合题意。
故答案为:C。
【分析】A、根据洗涤剂具有乳化作用分析
B、根据气体溶解度的影响因素分析
C、根据溶液的饱和度和溶液的浓稀没有关系分析
D、根据汽油能溶解油污分析
16.【答案】D
17.【答案】温度;用锅盖盖灭
【解析】【解答】①喝了汽水以后,常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,说明气体溶解度与温度;②炒菜时油锅中的油不慎着火,用锅盖盖灭的目的是隔绝氧气,放入较多的蔬菜能降低温度。
【分析】此题考查气体的溶解度与温度成反比与压强成正比。而汽水就是二氧化碳的溶液,喝汽水是与温度有关,人体的温度高于汽水的温度,故温度升高溶解度减小,因此会打嗝。2小题就是考查燃烧的条件与灭火的原理。
18.【答案】压强减小,气体的溶解度减小
【解析】【解答】气体的溶解度除与温度、压强有关,气体的溶解度随着温度升高而减少,而当温度一定时,其溶解度随压强增大而显著增大,随压强减小而减小。瓶盖打开,瓶中压强变小,气体的溶解度减小,不能溶解的气体就会冒出。
【分析】根据气体溶解度随压强的减小而减小分析。
19.【答案】在50℃时,甲、乙物质的溶解度相等;2:5;不变;丙>乙>甲
【解析】【解答】①通过分析溶解度曲线可知,M点表示的含义是:在50℃时,甲、乙物质的溶解度相等;②50℃时,甲物质的溶解度是40g,所以将40g甲物质投入到50g水中,形成的溶液中溶质与溶剂的质量比为20g:50g=2:5;③20℃时,处于a点状态甲溶液,升温至50℃,溶解度增大,不会析出晶体,所以溶质质量分数不变;④分别将50℃的三种物质的饱和溶液100g降温到20℃时,甲物质的溶解度变化较大,析出晶体最多,乙物质的溶解度变化较小,析出晶体次之,丙物质的溶解度随温度降低溶解度增大,不会析出晶体,所以甲、乙、丙溶液质量大小关系为 丙>乙>甲。
【分析】根据溶解度曲线含义分析,溶解度曲线的交点表示对应温度下两物质溶解度相等,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
20.【答案】t1;30%;<
【解析】【解答】根据物质的溶解度曲线可以看出,甲、乙溶解度相等时的温度为t1℃;
t2℃时甲的溶解度为60g,80g甲的饱和溶液中溶质的质量为:80g× ×100%=30g,向80g甲的饱和溶液中加入20g水,所得溶液中溶质的质量分数为 ×100%=30%;
t2℃时甲的溶解度大于乙,甲、乙饱和溶液各100g,其中溶剂水的质量是甲小于乙,将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃时仍是饱和溶液,t1℃时甲乙溶解度相等,溶剂质量越大,溶解度溶质越多,所得溶液中溶质的质量关系甲<乙。
【分析】根据固体溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质的溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析
21.【答案】溶剂种类;溶质种类;水珠;氢、氧;蜡烛由下而上先后熄灭;密度比空气大、不可燃、不助燃;4P+5O2 2P2O5;隔绝氧气、提供热量
【解析】【解答】①发现B中固体可溶,A中几乎不溶,碘能溶解在汽油里,不能溶解在水里,溶质种类相同,溶剂不同,溶解能力不同,该对比实验说明了影响物质溶解性的因素是溶剂的种类;补充了如图C所示实验,高锰酸钾能溶在水里,碘不能溶解在水里,在同一溶剂中,溶质种类不同,溶解能力不同,说明他想探究的影响因素是溶质的种类;②氢气在氧气中燃烧生成水,实验乙中可观察到集气瓶内壁有水珠产生。可以得出结论:水由氢、氧两种元素组成;③由于二氧化碳不燃烧,也不支持燃烧且密度比空气大,实验丙中可观察到的现象是:蜡烛由下而上先后熄灭;
④磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2 2P2O5;热水的作用是使白磷达到着火点,而红磷不能达到着火点,且使水中的白磷与氧气隔绝,故填:隔绝氧气、提供热量。
【分析】 ① 根据影响固体溶解的因素既有溶质的因素也有溶剂的因素分析;用补充实验C和A比较,即可知道想探究的是不同溶质在同种溶剂中溶解能力的不同;
② 根据氢气在氧气中燃烧生成水来分析;根据质量守恒定律推断水的组成;
③ 根据二氧化碳密度比空气大和不燃烧一般不支持燃烧分析;
④ 磷的燃烧是磷和氧气在点燃条件下生成五氧化二磷,据此书写化学方程式;热水的作用一是把水中的白磷和空气隔绝,二是加热薄铜片上的白磷和红磷。
22.【答案】(1)1:2
(2)排尽集气瓶内的空气,使收集到的气体的更纯净
(3)溶剂的种类;溶质的种类
(4)防止生成物熔化溅落下来使瓶底炸裂
【解析】【解答】(1)电解水负极生成氢气,正极生成氧气,氢气和氧气的体积比为2:1。电解水时,与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多,且两者的体积之比大约是1:2;(2)实验B集气瓶中装满水的目的是排尽集气瓶内的空气,使收集到的气体的更纯净;(3)②试管中固体可溶,①试管中固体几乎不溶,溶质相同,溶剂不同,说明了同种溶质在不同的溶剂中溶解能力不同,该对比实验说明了影响物质溶解性的因素是溶剂的种类;同学们又补充了③试管所示实验,高锰酸钾易溶于水形成紫红色溶液,与①对比,说明了不同的溶质在同一种溶剂中溶解能力不同,他们想探究的影响因素是溶质的种类;(4)铁丝在氧气中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水。
故答案为:(1) 1:2 ; 排尽集气瓶内的空气,使收集到的气体的更纯净 (2) 排尽集气瓶内的空气,使收集到的气体的更纯净 (3) 溶剂的种类 ; 溶质的种类 (4) 防止生成物熔化溅落下来使瓶底炸裂
【分析】(1)根据水通电,正极产生氧气负极产生氢气,体积比为1:2解答
(2)根据排水法收集气体的原理分析解答
(3)根据 ②试管 中固体可溶, ①试管 中固体不可溶分析解答
(4)根据铁丝燃烧的注意事项解答
23.【答案】(1)大于
(2)饱和;4∶5;44.4%
(3)降温结晶
(4)变小
【解析】【解答】
(1)、根据 KNO3、NaCl的溶解度曲线图可知: 40 ℃时,KNO3的溶解度大于 NaCl的溶解度。 故填:大于
(2)、t ℃时,KNO3的溶解度为80克,说明50克水中最多可溶解40克 KNO3固体 ,故此时所得溶液为 饱和溶液, 溶液中溶质与溶剂的质量比为 40:50, 此时所形成的溶液中溶质质量分数为 。故三空依次填:饱和、4∶5、44.4%。
(3)、KNO3的溶解度随温度升高明显增大, NaCl 的溶解度受温度影响不明显。故 KNO3溶液中含有少量NaCl时,可以采用降温结晶的方法提纯KNO3 。故填:降温结晶
(4)、KNO3的溶解度随温度升高明显增大, 将KNO3的饱和溶液降温时,有KNO3晶体析出,故溶液的溶质质量分数变小。 故填:变小。
【分析】
(1)、根据 KNO3、NaCl的溶解度曲线图分析得出答案。
(2)、根据t ℃时KNO3的溶解度,通过计算得出答案。
(3)、根据KNO3、NaCl的溶解度受温度影响强弱分析出答案。
(4)、根据KNO3的溶解度受温度影响趋势分析出答案。
24.【答案】(1)减小
(2)解:设加热逸出的SO2的质量为x
已知某葡萄酒为320mL,即0.32L。
则该葡萄酒中SO2的使用量为。
答:该葡萄酒中SO2的含量符合国家标准。
【解析】【解答】(1)题中提示“加热使SO2全部逸出”,说明当压强一定时,升高温度,SO2气体在水中的溶解度减小。
【分析】(1)根据气体溶解度随温度升高而减小分析;
(2)根据化学反应前后元素质量不变,结合元素质量为物质质量×元素质量分数分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
9.2 溶解度
一、单选题
1.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( )
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,充满水的鱼缸壁上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池塘里的鱼浮出水面
2.在相同温度下,在盛有等质量饱和食盐水和不饱和食盐水的两只烧杯中,各放一个完全相同的乒乓球,则下列说法不正确的是( )
A.两只烧杯中溶液的溶质质量分数不相同
B.两个乒乓球受到的浮力相同
C.两个乒乓球高出液面的部分不相同
D.两只烧杯中溶液的导电能力相同
3.一定温度下,把1克熟石灰加入到100克水中,充分搅拌后仍有少许的熟石灰未溶解,静置后取上层清液,关于此清液的叙述正确的是( )
A.它是不饱和溶液
B.它是浓溶液
C.它是该温度下的饱和溶液
D.它的溶质质量分数为1%
4.下列有关溶液的说法正确的是( )
A.溶质可以是固体、液体或气体
B.均一、稳定的液体都是溶液
C.将汽油与水混合,得到的是溶液
D.饱和溶液中一定不能再溶解其他物质
5.下列因素中不会影响气体物质溶解度的是( )
A.溶剂的量 B.温度 C.溶质的种类 D.压强
6.将60℃饱和的硝酸钾溶液降温至20℃,没有发生变化的是( )
A.溶液的质量 B.溶剂的质量
C.溶质的质量 D.溶质的质量分数
7.今年5月4日,习总书记在推进南水北调后续工程高质量发展座谈会上强调:“水是生存之本,文明之源,要坚持节水优先,抓好水污染的防治工作”。下列有关水与溶液的说法错误的是( )
A.实验室的废水和废液不能直接排入下水道
B.溶液是均一、稳定的混合物
C.饱和溶液就是不能再溶解任何物质的溶液
D.电解水时,负极产生的是氢气
8.40 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的甲、乙固体,充分溶解。
上述溶液为不饱和溶液的是( )
A.①② B.①④ C.②④ D.①③
9.如图是A,B,C三种不含结晶水的固体的溶解度曲线图。下列说法不正确的是( )
A.t3℃时,取30gA加入50g水中,可得到溶液75g
B.P点表示t2℃时,A,B的溶解度相等
C.t3℃时,等质量的A,B,C三种物质加入水中,配制饱和溶液,所得溶液的质量大小关系为C>B>A
D.t1℃时, A,B,C三种饱和溶液的质量关系为B>A=C
10.如图是A、B、C三种物质(均不含结晶水)的溶解度曲线,根据曲线判断下列说法中错误的是( )
A.t2℃时,等质量的A,B,C饱和溶液中溶剂质量最少的是C
B.可通过升温将接近饱和的C溶液变成饱和溶液
C.t1℃时,A,B饱和溶液中溶质的质量分数一定相等
D.A中含有少量B,可用降温结晶法提纯A
11.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,小洁同学由图得出以下几条结论:
①t1℃时,A的饱和溶液和C的饱和溶液中溶质的质量相等
②要使C的饱和溶液转化为不饱和溶液,可采用升温的方法
③从含有少量B的A饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法
④t2℃时,若从A和B两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是A物质的饱和溶液
⑤将t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数B>A=C
以上说法中正确的数目有( )
A.1种 B.2种 C.3种 D.4种
12.浓度为10%的氯化钠溶液对葡萄球菌具有明显的抑制效果。下图为配制氯化钠杀菌液的过程,结合图表信息,有关分析正确的一项是( )
NaCl在不同温度时的溶解度
温度/℃ 0 10 20 30 40 60 80 90 100
氯化钠溶解度/g 35.7 35.8 36.0 36.3 36.6 37.3 38.4 39.0 39.8
A.图1中搅拌可增大氯化钠的溶解度
B.图2中溶液为20℃氯化钠的不饱和溶液
C.图2中溶液对葡萄球菌有明显的杀菌效果
D.从氯化钠溶液中得到氯化钠均可采用降温结晶的方法
13.甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
A.t1℃时,甲和乙的饱和溶液中溶质质量一定相等,都等于30g
B.把100g溶质质量分数为20%的甲溶液从t2℃降温到t1℃其质量分数仍为20%
C.将t2℃时等质量的甲、乙两种溶液降温至t1℃时,析出晶体的质量甲一定大于乙
D.甲中含有少量的乙时,可以用蒸发溶剂的方法提纯甲
14.如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线。下列叙述正确的是()
A.t1℃时,甲、乙、丙三种物质溶液溶质的质量分数大小关系是乙>甲=丙
B.将100g甲的饱和溶液和100g乙的饱和溶液混合可以得到200g甲、乙的饱和溶液
C.t1℃时,向50g水中加入10g甲恰好溶解,则t1℃时丙的溶解度为20g
D.将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,甲析出的质量比乙多
15.下列关于溶液的说法错误的是()
A.用洗洁精洗去餐具上的油污,利用的是乳化原理
B.气体的溶解度与温度和压强有关
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.汽油作溶剂可以去除衣物上的油污
16.时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量,绘制成如图所示图像。下列说法不正确的是( )
A.时,100克水最多溶解该固体物质的质量为88g
B.C点所对应的溶液是不饱和溶液
C.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
D.图中A、B、C、D四点所对应的溶液溶质质量分数大小关系为
二、填空题
17.化学与生活
①喝了汽水以后,常常会打嗝,说明气体溶解度与 有关。
②炒菜时油锅中的油不慎着火,可采取的灭火方法是 或放入较多蔬菜。
18.打开易拉罐拉环有大量的气泡冒出的原因是 ?
19.认识溶液的变化。
根据如图甲、乙、丙三种固体的溶解度曲线回答:
①M点表示的含义是 。
②50℃时,将40g甲物质投入到50g水中,形成的溶液中溶质与溶剂的质量比为 。
③20℃时,处于a点状态甲溶液,升温至50℃,溶质质量分数 (填“变大”、“变小”或“不变”)。
④分别将50℃的三种物质的饱和溶液100g降温到20℃时,甲、乙、丙溶液质量大小关系为 。
20.如图是甲、乙两种固体的溶解度曲线。
甲、乙溶解度相等时的温度为 ℃;t2℃时向80g甲的饱和溶液中加入20g水,所得溶液中溶质的质量分数为 ;将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量关系为甲 乙(填“>”“<”或“=”)。
三、实验探究题
21.化学通过实验研究物质的组成、性质和变化规律。
①实验甲中,发现B中固体可溶,A中几乎不溶,说明影响物质溶解性的因素是 ,补充C试管实验,想探究的影响因素是 。
②实验乙中,观察到集气瓶内壁有 产生。可以得出结论:水由 两种元素组成。
③实验丙中,观察到的现象是 ,体现了二氧化碳 性质。
④实验丁中,磷燃烧的化学方程式 ,其中热水的作用是 。
22.水在化学实验中的作用不可忽视,下图中四个实验分别用到水。
(1)当电源接通一段时间后,正负极产生气体的体积比 。
(2)实验B集气瓶中装满水的目的 。
(3)实验C中同学们做了①试管和②试管的对比实验,发现②试管中固体可溶,①试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是 ,同学们又补充了③试管所示实验,他们想探究的影响因素是 。
(4)实验D中集气瓶中水的作用是 。
四、综合题
23.根据图中KNO3、NaCl的溶解度曲线,回答以下问题:
(1)40 ℃时,KNO3的溶解度 (填“大于”“小于”或“等于”)NaCl的溶解度。
(2)t ℃时,将45 g KNO3固体放入50 g水中充分溶解,此时所得溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质与溶剂的质量比为 (填最简整数比),此时所形成的溶液中溶质质量分数为 (计算结果精确至0.1%)。
(3)KNO3溶液中含有少量NaCl,可以采用 (填“降温结晶”或“蒸发结晶”)的方法提纯KNO3。
(4)40 ℃时,将KNO3的饱和溶液降温至20 ℃,溶液的溶质质量分数 (填“变大”“变小”或“不变”)。
五、计算题
24.中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某综合实践活动小组测定葡萄酒中SO2的含量,取320mL某葡萄酒(加适量稀酸),加热使SO2全部逸出,并将SO2通入足量的H2O2溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液100g。请回答下列问题:
(1)从上述信息可知:当压强一定时,升高温度,SO2气体在水中的溶解度 。(选填“增大”、“减小”或“不变”)
(2)通过计算判断该葡萄酒中SO2的含量是否符合国家标准?(写出计算过程)
答案解析部分
1.【答案】C
【解析】【解答】A、水在烧开的过程中温度不断升高,溶解在水中的气体会由于温度升高溶解度降低而溢出,A不符合题意;
B、阳光充足水温升高,原来溶解在水中的气体由于溶解度变小而冒出并形成小气泡,B不符合题意;
C、启开啤酒瓶盖,有大量气泡逸出,是由于压强变小气体的溶解度变小而导致的,C符合题意;
D、夏季黄昏天气闷热,温度升高,气体的溶解度变小,水中氧气量变少,鱼银缺氧而浮于水面,D不符合题意。
故答案为:C。
【分析】本题主要考查气体的溶解度影响因素,气体的溶解度受温度、压强及气体和溶剂种类影响。
2.【答案】D
【解析】【解答】A. 相同温度下,同种物质的饱和溶液比不饱和溶液的溶质质量分数大,故正确,不符合题意;
B. 两个完全相同的乒乓球受到的浮力相同,故正确,不符合题意;
C. 两个完全相同的乒乓球受到的浮力相同,但由于两种溶液的密度不同,所以两个乒乓球高出液面的部分不相同,故正确,不符合题意;
D. 饱和食盐水导电能力强于不饱和溶液食盐水,故错误,符合题意。
故答案为:D。
【分析】根据溶液的导电能力与溶液中自由移动粒子的多少有关,进行分析。
3.【答案】C
【解析】【解答】A充分搅拌后仍有少许的熟石灰未溶解,因此所得的溶液为该温度下饱和溶液,A不符合题意;
B溶液的浓稀是相比较而言的,只有一种溶液,无法判断溶液的浓稀,B不符合题意;
C在该温度下,不能再溶解熟石灰了,因此所得的溶液是该温度下的饱和溶液,C符合题意;
D由于1克熟石灰未完全溶解,无法计算溶质质量分数,D不符合题意。
故答案为:C。
【分析】在一定温度下,向一定量溶剂中加入某种溶质,当溶质不能再继续溶解时,所的得溶液为饱和溶液,而浓溶液是相对于稀溶液而言的,根溶液是否饱和没有关系,据此分析解答
4.【答案】A
【解析】【解答】A. 溶质可以是固体、液体或气体,故符合题意;
B. 均一、稳定的液体不一定都是溶液,例如水是纯净物,故不符合题意;
C. 将汽油与水混合,不能形成均一稳定的混合物,得到的不是溶液,故不符合题意;
D. 饱和溶液中不能再溶解该种溶质,可能还能溶解其他物质,故不符合题意。
故答案为:A。
【分析】根据溶液的特点,饱和溶液的特点,进行分析。
5.【答案】A
【解析】【解答】A.溶剂的质量不会影响气体物质的溶解度;
B.温度影响气体物质的溶解度,温度越高,气体溶解度越小;
C.溶剂的种类影响气体物质的溶解度;
D.压强影响气体物质的溶解度,压强越大,气体溶解度越大;
故答案为:A。
【分析】根据气体溶解度的影响因素有压强、温度、溶质溶剂的种类分析。
6.【答案】B
【解析】【解答】A、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶液的质量减小,A不符合题意;。
B、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶剂的质量不变,B符合题意;
C、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶质的质量减小,C不符合题意;
D、硝酸钾的溶解度随着温度的降低而减小,将60℃时饱和的硝酸钾溶液降温至20℃,有硝酸钾晶体析出,溶质的质量减少,溶剂的质量不变,溶质的质量分数减小,D不符合题意;。
故答案为:B。
【分析】硝酸钾的溶解度随温度的升高而增大,则降温60℃的饱和溶液,会有晶体析出,导致溶液中溶质的质量减少,溶剂的质量不变,溶液的质量减少,溶质的质量分数减小。
7.【答案】C
【解析】【解答】A. 实验室的废水和废液不能直接排入下水道,以免破坏管道,污染环境,造成危险等,故正确,不符合题意。
B. 溶液是均一、稳定的混合物,故正确,不符合题意。
C. 饱和溶液不能溶解达到饱和的溶质,但还可以溶解其它物质。故错误,符合题意。
D. 电解水时,负极产生的是氢气,正极产生的是氧气,故正确,不符合题意。
故答案为:C。
【分析】一种溶质的饱和溶液可以溶解其他溶质。
8.【答案】D
【解析】【解答】①是甲的不饱和溶液,②是甲的饱和溶液,③是乙的不饱和溶液,④是乙的过饱和溶液。
故答案为:D。
【分析】根据溶解度曲线在40 ℃时,100g水最多能溶解甲物质50g,乙物质40g;判断溶液是否饱和的方法:继续加入该种溶质,如果该物质的质量减少,那么溶液是不饱和溶液;如果该物质的质量不变,那么溶液是饱和溶液。
9.【答案】D
【解析】【解答】A、t3℃时,A物质的溶解度为50g,取30gA加入50g水中,只能溶解25g,可得到溶液的质量=25g+50g=75g,不符合题意;
B、P点表示t2℃时,A、B的溶解度相等符合题意,因为P点是的交点,不符合题意;
C、t3℃时,等质量的A、B、C三种物质加入水中,配制饱和溶液,所得溶液的质量大小关系为C>B>A符合题意,因为t3℃时,溶解度A>B>C,它们所需水的质量是C>B>A,不符合题意;
D、t1℃时,A、B、C三种饱和溶液的质量分数的关系为B>A=C,溶液质量错误,符合题意;
故答案为:D。
【分析】A、根据 t3℃时A的溶解度和固体物质溶解度的概念分析;
B、理解某温度下溶解度曲线的交点,表示该温度下两物质的溶解度相等;
C、 t3℃时ABC三种物质溶解度的大小关系是A>B>C,故 等质量的A,B,C三种物质溶解度最小的需要的水最多,故溶液的大小关系是: C>B>A
D、t1℃时, A,B,C三种饱和溶液的溶质质量关系为B>A=C ,但无法确定三种物质饱和溶液的质量。
10.【答案】A
【解析】【解答】A、溶液质量=溶质质量+溶剂质量,溶液质量相等,溶质质量越大,溶剂质量越小,t2℃时,A物质的饱和溶液中溶质质量最大,故三种物质的饱和溶液中,溶剂最少的是A,故A符合题意;
B、C的溶解度随温度的升高而减小,通过升温或添加溶质的方法,可将C的不饱和溶液转化成饱和溶液,B不符合题意;
C、t1℃时,A、B两物质的溶解度相同,故在此温度下,无论溶液的质量是否相等,只要是两物质的饱和溶液,则溶液的质量分数相等,C不符合题意;
D、A、B两种物质的溶解度都随温度的降低而减小,但是A变化的幅度较大,受温度影响大,B变化的幅度较小,受温度影响小,因此A中含有少量B,可用降温结晶法提纯A,D不符合题意。
故答案为:A。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
11.【答案】A
【解析】【解答】①由溶解度曲线可知,t1℃时,A和C的溶解度相等,则A的饱和溶液和C的饱和溶液中溶质的质量分数相等,因为两种溶液的质量不能确定,所以溶质质量不一定相等,此选项不符合题意;②C的溶解度随温度的降低而增大,要使C的饱和溶液转化为不饱和溶液,可采用降温的方法,此选项不符合题意;③A的溶解度受温度影响较大,对于溶解度受温度影响较大的物质,采用冷却热饱和溶液的方法使溶质从溶液中结晶析出,所以从含有少量B的A饱和溶液中得到较多的A晶体,通常可采用冷却热饱和溶液的方法,此选项符合题意;④t2℃时,A的溶解度大于B的溶解度,若从A和B两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是B物质的饱和溶液,此选项不符合题意;⑤将t2℃时,A、B、C的饱和溶液分别降温至t1℃,A、B的溶解度减小,溶质质量分数减小,C的溶解度增大,变为不饱和溶液,溶质质量分数不变,因为t1℃,A的溶解度小于B的溶解度,t1℃,A的溶解度大于t2℃时C的溶解度,所以将t2℃时,A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数B>A>C,此选项不符合题意。
故答案为:A。
【分析】根据溶解度曲线图可以得出,不同物质在同一温度下的溶解度,从而比较物质的溶解性,同一物质在不同温度下的溶解度,从而确定物质得出提纯方法,据此分析
12.【答案】B
【解析】【解答】A.搅拌只能增大溶解速率,不能增大氯化钠的溶解度。A错误。
B.在20℃时,氯化钠的溶解度为36.0g,即在20℃时,100g水最多溶解氯化钠36.0g。所以在20℃时,在100g水中放入10g氯化钠,得到的是氯化钠的不饱和溶液。B正确。
C.配好的溶液的溶质质量分数=,并不是10%。C错误。
D.从表中数据可知,氯化钠的溶解度受温度变化影响不大。所以从氯化钠溶液中获得氯化钠应采用蒸发结晶的方法。D错误。
故选B。
【分析】判断溶液是否饱和,需要判断的是溶液是否能继续溶解某种溶质,如果能继续溶解,则为该种溶质的不饱和溶液,如果不能继续溶解,则为该种溶质的饱和溶液。
13.【答案】B
【解析】【解答】A、t1℃时,两种物质的溶解度相等,甲和乙的饱和溶液中溶质质量分数一定相等,由于没有确定溶液的质量不能确定溶质质量都等于30g,故A不符合题意;
B、根据溶解度曲线可知,t1℃时,甲溶解度为30g,t1℃时,甲的饱和溶液的溶质质量分数= ,t1℃时,20%的甲溶液是不饱和溶液, 把100g溶质质量分数为20%的甲溶液从t2℃降温到t1℃没有溶质析出,其质量分数仍为20%,故B符合题意;
C、没有确定溶液是否饱和,不能确定将t2℃时等质量的甲、乙两种溶液降温至t1℃时,析出晶体的质量甲一定大于乙,故C不符合题意;
D、根据溶解度曲线可知,甲、乙两种物质的溶解度都随温度的降低而减小,甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,甲中含有少量的乙时,可以用降温结晶的方法提纯甲,故D不符合题意。
故答案为:B。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
14.【答案】C
【解析】【解答】A. t1℃时,甲、乙、丙三种物质溶液是否饱和不能确定,所以溶液的溶质的质量分数大小也不能确定,故选项A不符合题意;
B. 混合后溶剂质量增加,没有说明温度,甲、乙物质的溶解度不能确定,所以将100g甲的饱和溶液和100g乙的饱和溶液混合不一定得到200g甲、乙的饱和溶液,故选项B不符合题意;
C. t1℃时,向50g水中加入10g甲恰好溶解,则100g水中加入20g甲就能恰好溶解,而t1℃时甲和丙的溶解度相等,因此t1℃时丙的溶解度为20g,故C符合题意;
D. 将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,饱和溶液的质量没有确定,所以析出晶体的质量也就不能确定,故选项D不符合题意。
故答案为:C。
【分析】A、t1℃时,甲、乙、丙三种物质的溶解度大小关系是 乙>甲=丙 ,所以它们饱和溶液的溶质的质量分数大小关系是 乙>甲=丙。
B、溶液没有说明温度,所以甲、乙物质的溶解度不能确定,那么溶液混合不一定得到200g甲、乙的饱和溶液。
C、t1℃时,甲与乙有交点,说明甲与乙在此温度条件下,溶解度相同。
D、根据溶解度曲线图,找出在t2℃时,甲物质和乙物质的溶解度相同;在t1℃时,乙的溶解度大于甲的溶解度。但是此小题中饱和溶液的质量没有确定,所以析出晶体的质量也就不能确定。
15.【答案】C
【解析】【解答】A.洗洁精中含有乳化剂,能将大的油珠分散成无数小的油滴随水流走,用洗洁精洗去餐具上的油污,利用的是乳化原理,A不符合题意;
B.温度越低、压强越大,气体的溶解度越大,气体的溶解度与温度和压强有关,B不符合题意;
C.饱和溶液、不饱和溶液和溶液的浓稀无关,C符合题意;
D.汽油能溶解植物油,汽油作溶剂可以去除衣物上的油污,D不符合题意。
故答案为:C。
【分析】A、根据洗涤剂具有乳化作用分析
B、根据气体溶解度的影响因素分析
C、根据溶液的饱和度和溶液的浓稀没有关系分析
D、根据汽油能溶解油污分析
16.【答案】D
17.【答案】温度;用锅盖盖灭
【解析】【解答】①喝了汽水以后,常常会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,说明气体溶解度与温度;②炒菜时油锅中的油不慎着火,用锅盖盖灭的目的是隔绝氧气,放入较多的蔬菜能降低温度。
【分析】此题考查气体的溶解度与温度成反比与压强成正比。而汽水就是二氧化碳的溶液,喝汽水是与温度有关,人体的温度高于汽水的温度,故温度升高溶解度减小,因此会打嗝。2小题就是考查燃烧的条件与灭火的原理。
18.【答案】压强减小,气体的溶解度减小
【解析】【解答】气体的溶解度除与温度、压强有关,气体的溶解度随着温度升高而减少,而当温度一定时,其溶解度随压强增大而显著增大,随压强减小而减小。瓶盖打开,瓶中压强变小,气体的溶解度减小,不能溶解的气体就会冒出。
【分析】根据气体溶解度随压强的减小而减小分析。
19.【答案】在50℃时,甲、乙物质的溶解度相等;2:5;不变;丙>乙>甲
【解析】【解答】①通过分析溶解度曲线可知,M点表示的含义是:在50℃时,甲、乙物质的溶解度相等;②50℃时,甲物质的溶解度是40g,所以将40g甲物质投入到50g水中,形成的溶液中溶质与溶剂的质量比为20g:50g=2:5;③20℃时,处于a点状态甲溶液,升温至50℃,溶解度增大,不会析出晶体,所以溶质质量分数不变;④分别将50℃的三种物质的饱和溶液100g降温到20℃时,甲物质的溶解度变化较大,析出晶体最多,乙物质的溶解度变化较小,析出晶体次之,丙物质的溶解度随温度降低溶解度增大,不会析出晶体,所以甲、乙、丙溶液质量大小关系为 丙>乙>甲。
【分析】根据溶解度曲线含义分析,溶解度曲线的交点表示对应温度下两物质溶解度相等,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
20.【答案】t1;30%;<
【解析】【解答】根据物质的溶解度曲线可以看出,甲、乙溶解度相等时的温度为t1℃;
t2℃时甲的溶解度为60g,80g甲的饱和溶液中溶质的质量为:80g× ×100%=30g,向80g甲的饱和溶液中加入20g水,所得溶液中溶质的质量分数为 ×100%=30%;
t2℃时甲的溶解度大于乙,甲、乙饱和溶液各100g,其中溶剂水的质量是甲小于乙,将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃时仍是饱和溶液,t1℃时甲乙溶解度相等,溶剂质量越大,溶解度溶质越多,所得溶液中溶质的质量关系甲<乙。
【分析】根据固体溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质的溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析
21.【答案】溶剂种类;溶质种类;水珠;氢、氧;蜡烛由下而上先后熄灭;密度比空气大、不可燃、不助燃;4P+5O2 2P2O5;隔绝氧气、提供热量
【解析】【解答】①发现B中固体可溶,A中几乎不溶,碘能溶解在汽油里,不能溶解在水里,溶质种类相同,溶剂不同,溶解能力不同,该对比实验说明了影响物质溶解性的因素是溶剂的种类;补充了如图C所示实验,高锰酸钾能溶在水里,碘不能溶解在水里,在同一溶剂中,溶质种类不同,溶解能力不同,说明他想探究的影响因素是溶质的种类;②氢气在氧气中燃烧生成水,实验乙中可观察到集气瓶内壁有水珠产生。可以得出结论:水由氢、氧两种元素组成;③由于二氧化碳不燃烧,也不支持燃烧且密度比空气大,实验丙中可观察到的现象是:蜡烛由下而上先后熄灭;
④磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2 2P2O5;热水的作用是使白磷达到着火点,而红磷不能达到着火点,且使水中的白磷与氧气隔绝,故填:隔绝氧气、提供热量。
【分析】 ① 根据影响固体溶解的因素既有溶质的因素也有溶剂的因素分析;用补充实验C和A比较,即可知道想探究的是不同溶质在同种溶剂中溶解能力的不同;
② 根据氢气在氧气中燃烧生成水来分析;根据质量守恒定律推断水的组成;
③ 根据二氧化碳密度比空气大和不燃烧一般不支持燃烧分析;
④ 磷的燃烧是磷和氧气在点燃条件下生成五氧化二磷,据此书写化学方程式;热水的作用一是把水中的白磷和空气隔绝,二是加热薄铜片上的白磷和红磷。
22.【答案】(1)1:2
(2)排尽集气瓶内的空气,使收集到的气体的更纯净
(3)溶剂的种类;溶质的种类
(4)防止生成物熔化溅落下来使瓶底炸裂
【解析】【解答】(1)电解水负极生成氢气,正极生成氧气,氢气和氧气的体积比为2:1。电解水时,与电源正极相连的试管内产生的气体体积少,与电源负极相连的试管内的气体体积多,且两者的体积之比大约是1:2;(2)实验B集气瓶中装满水的目的是排尽集气瓶内的空气,使收集到的气体的更纯净;(3)②试管中固体可溶,①试管中固体几乎不溶,溶质相同,溶剂不同,说明了同种溶质在不同的溶剂中溶解能力不同,该对比实验说明了影响物质溶解性的因素是溶剂的种类;同学们又补充了③试管所示实验,高锰酸钾易溶于水形成紫红色溶液,与①对比,说明了不同的溶质在同一种溶剂中溶解能力不同,他们想探究的影响因素是溶质的种类;(4)铁丝在氧气中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水。
故答案为:(1) 1:2 ; 排尽集气瓶内的空气,使收集到的气体的更纯净 (2) 排尽集气瓶内的空气,使收集到的气体的更纯净 (3) 溶剂的种类 ; 溶质的种类 (4) 防止生成物熔化溅落下来使瓶底炸裂
【分析】(1)根据水通电,正极产生氧气负极产生氢气,体积比为1:2解答
(2)根据排水法收集气体的原理分析解答
(3)根据 ②试管 中固体可溶, ①试管 中固体不可溶分析解答
(4)根据铁丝燃烧的注意事项解答
23.【答案】(1)大于
(2)饱和;4∶5;44.4%
(3)降温结晶
(4)变小
【解析】【解答】
(1)、根据 KNO3、NaCl的溶解度曲线图可知: 40 ℃时,KNO3的溶解度大于 NaCl的溶解度。 故填:大于
(2)、t ℃时,KNO3的溶解度为80克,说明50克水中最多可溶解40克 KNO3固体 ,故此时所得溶液为 饱和溶液, 溶液中溶质与溶剂的质量比为 40:50, 此时所形成的溶液中溶质质量分数为 。故三空依次填:饱和、4∶5、44.4%。
(3)、KNO3的溶解度随温度升高明显增大, NaCl 的溶解度受温度影响不明显。故 KNO3溶液中含有少量NaCl时,可以采用降温结晶的方法提纯KNO3 。故填:降温结晶
(4)、KNO3的溶解度随温度升高明显增大, 将KNO3的饱和溶液降温时,有KNO3晶体析出,故溶液的溶质质量分数变小。 故填:变小。
【分析】
(1)、根据 KNO3、NaCl的溶解度曲线图分析得出答案。
(2)、根据t ℃时KNO3的溶解度,通过计算得出答案。
(3)、根据KNO3、NaCl的溶解度受温度影响强弱分析出答案。
(4)、根据KNO3的溶解度受温度影响趋势分析出答案。
24.【答案】(1)减小
(2)解:设加热逸出的SO2的质量为x
已知某葡萄酒为320mL,即0.32L。
则该葡萄酒中SO2的使用量为。
答:该葡萄酒中SO2的含量符合国家标准。
【解析】【解答】(1)题中提示“加热使SO2全部逸出”,说明当压强一定时,升高温度,SO2气体在水中的溶解度减小。
【分析】(1)根据气体溶解度随温度升高而减小分析;
(2)根据化学反应前后元素质量不变,结合元素质量为物质质量×元素质量分数分析。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
