人教版化学九年级下册 10.2 酸和碱的中和反应 同步练习(含答案)
文档属性
| 名称 | 人教版化学九年级下册 10.2 酸和碱的中和反应 同步练习(含答案) | 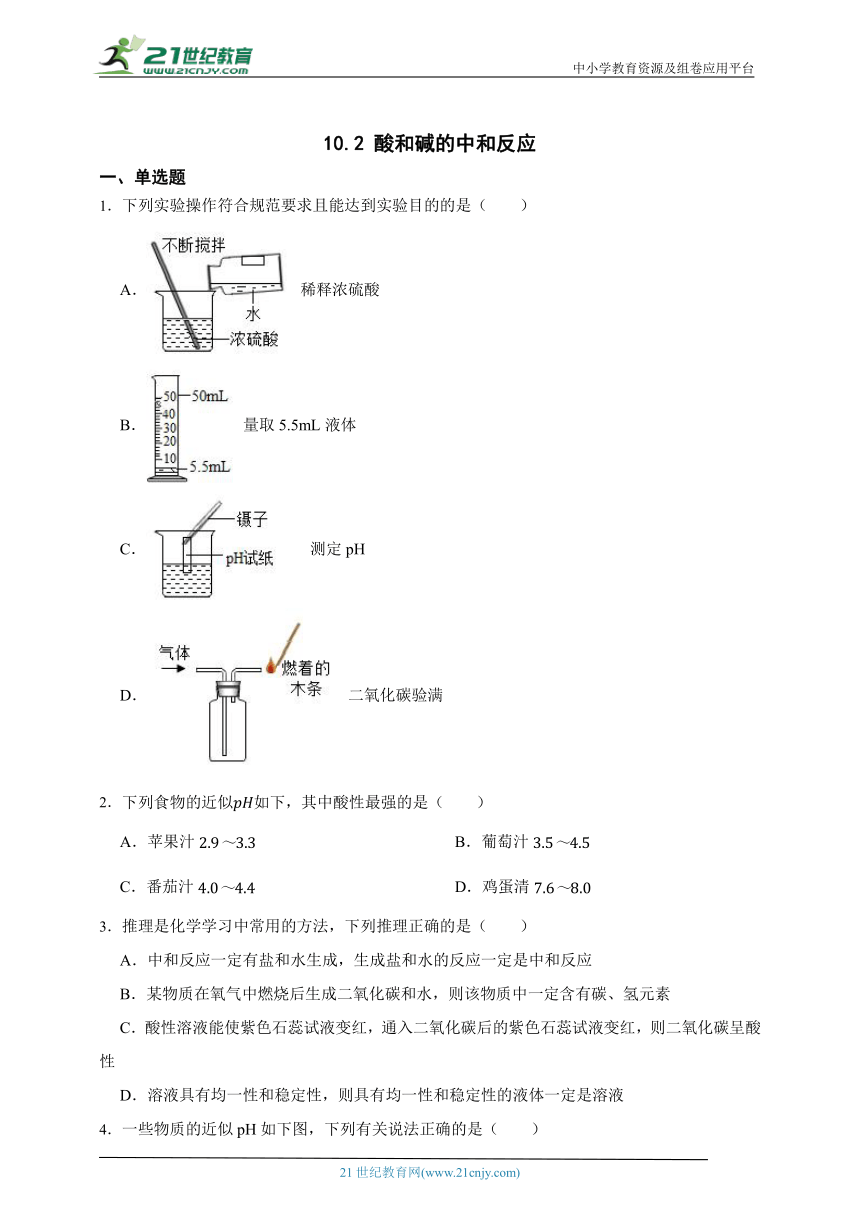 | |
| 格式 | docx | ||
| 文件大小 | 348.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-27 14:27:54 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
10.2 酸和碱的中和反应
一、单选题
1.下列实验操作符合规范要求且能达到实验目的的是( )
A. 稀释浓硫酸
B. 量取5.5mL液体
C. 测定pH
D. 二氧化碳验满
2.下列食物的近似如下,其中酸性最强的是( )
A.苹果汁 B.葡萄汁
C.番茄汁 D.鸡蛋清
3.推理是化学学习中常用的方法,下列推理正确的是( )
A.中和反应一定有盐和水生成,生成盐和水的反应一定是中和反应
B.某物质在氧气中燃烧后生成二氧化碳和水,则该物质中一定含有碳、氢元素
C.酸性溶液能使紫色石蕊试液变红,通入二氧化碳后的紫色石蕊试液变红,则二氧化碳呈酸性
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
4.一些物质的近似pH如下图,下列有关说法正确的是( )
A.纯鲜牛奶的酸性比苹果汁的酸性强
B.一般被蚊虫叮咬后可涂抹肥皂水以减轻痛痒
C.炉具清洁剂的碱性比肥皂水的碱性弱
D.厕所清洁剂与炉具清洁剂混合去污效果更好
5.“浸土选种”是现代农业生产常用的科学方法,取武当山特区某村土壤浸出的溶液,加入无色酚酞溶液后显红色。下表为四种农作物适宜生长的pH范围,你认为该村土壤比较适宜种植的农作物是()
农作物 水稻 茶树 玉米 马铃薯
pH 6.0~7.0 6.0~7.0 7.0~8.1 4.8~5.5
A.玉米 B.茶树 C.水稻 D.马铃薯
6.测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。人体内的一些液体的正常pH范围如下表,其中碱性最强的是( )
液体 胃液 胆汁 胰液 血浆
pH 0.9~1.5 7.1~7.3 7.5~7.8 7.3~7.4
A.胃液 B.胆汁 C.胰液 D.血浆
7.下列人体体液中,酸性最强的是( )
A B C D
体液 唾液 血液 胆汁 胃液
pH范围 6.6 -7.1 7. 35 -7.45 6.8 -7.4 0.8 -1.5
A.A B.B C.C D.D
8.逻辑推理是学习化学常用的思维方法。下列推理正确的是( )
A.pH<7的溶液呈酸性,所以pH<7的雨水是酸雨
B.分子可以构成物质,所以物质都是由分子构成
C.Fe在潮湿的空气中易被腐蚀,所以金属在潮湿的空气中都易被腐蚀
D.点燃氢气、一氧化碳或甲烷前需要检验纯度,所以点燃可燃性气体前要检验纯度
9.如所示是稀盐酸和氢氧化钠溶液反应过程中溶液pH变化规律的坐标曲线图。请认真观察,判断下列说法,有关该实验事实的说法正确的是( )
A.用滴管滴加的溶液为氢氧化钠溶液
B.向A点时的溶液中滴加紫色石蕊试液,溶液会变红
C.盐酸和氢氧化钠恰好完全反应时,对应的点为B点
D.曲线上C点对应的溶液中,溶质只有氯化钠
10.下列反应属于中和反应的是( )
A. B.
C. D.
11.关注健康、预防疾病.下列叙述错误的是( )
A.人体胃液正常的pH范围在0.9﹣1.5
B.人体缺乏维生素A会引起坏血病
C.香烟的烟气中含多种对人体有害的物质
D.人体缺碘会引起甲状腺肿大,碘过量也会引起甲状腺肿大
12.酸雨对农作物以及一些建筑有不利影响。下列措施中与酸雨的防治有关的是( )
A.控制二氧化碳的排放量 B.减少使用一次性塑料制品
C.分类回收处理生活垃圾 D.减少含硫化石燃料的燃烧
二、填空题
13.含氯消毒液是一种高效消毒剂,pH≈11,呈 性,常用于家庭、宾馆、 等公共场所消毒。
14.同学们可以通过下列方式认识空气。
在氮气、氧气、氦气、二氧化碳、二氧化硫气体中。用化学用语填写:
不是空气的组成成分会引起酸雨的气体是 ;可用于代替氢气填充气球的是 ;人类时刻都离不开空气,是因为有 ;
会引起温室效应的气体是 ,写出实验室制取该气体的化学方程式 。
15.如图是氢氧化钠溶液和稀硫酸反应的示意图,“”中的微粒符号是 。恰好中和100g溶质质量分数为7.3%的稀盐酸,需要100g溶质质量分数为8%的氢氧化钠溶液,若将氢氧化钠溶液换成100g溶质质量分数为8%的氢氧化钾与该稀盐酸反应,则充分反应后溶液的pH (填“<”“>”或“=”)7。
16.已知:在水溶液中,乙醇(C2H5OH)不发生电离;溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-);氢氧化钠电离产生钠离子和氢氧根离子。请回答下列问题:
(1)根据这三种溶液的组成推断,溴化氢的水溶液显 性。
(2)写出上述物质之间发生中和反应的化学方程式 。
三、实验探究题
17.同学们为了探究盐酸和氢氧化钠是否发生反应,设计并进行了实验。
(1)小丽同学用如图进行实验,实验中观察到 现象能证明盐酸和氢氧化钠发生了化学反应,其理由是 。
(2)小明同学用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
①盐酸和氢氧化钠反应的化学方程式为 。
②60 s时,烧瓶内溶液中的溶质有 。
18.用下列实验研究酸与碱的反应。
(1)实验一中溶液由红色变为无色。用化学方程式解释该现象产生的原因: 。
(2)实验二在滴加盐酸过程中,多次测量溶液的pH。证明反应发生的依据是 。
四、综合题
19.某同学用相同溶质质量分数的稀盐酸和烧碱溶液进行实验,反应过程中pH的变化如图。
(1)当稀盐酸和烧碱溶液的质量相等时,所得溶液pH 7 (填“大于”、“小于”或“等于”)。
(2)从图中可以看出该实验“用滴管加入”的是 溶液。
(3)某同学取A、B、C三处溶液中的一份进行探究,他向所取溶液中滴加少量硝酸银溶液,观察到有白色沉淀,由此他判断所取溶液为A处溶液。你同意他的判断吗,为什么: 。
五、选择题
20.为了证明CuO属于碱性氧化物,应选用的反应是( )
A.与木炭混合后加热 B.与稀酸混合后加热
C.通入氢气后加热 D.通入一氧化碳后加热
六、计算题
21.常温下,向盛有50.0gNaOH溶液的烧杯中逐滴加入60.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如下:
加入稀盐酸的质量/g 30.0 40.0 50.0 60.0
烧杯中溶液的pH 13.7 13.3 7.0 0.7
(1)恰好完全反应时,消耗稀盐酸的质量为 。
(2)求该NaOH溶液中溶质的质量分数。
答案解析部分
1.【答案】D
【解析】【解答】A、稀释浓硫酸时,要把浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌,A不符合题意;
B、量取5.5mL液体,不能用50毫升的量筒,所要量取的液体体积与量筒的量程相差太大,造成量取液体体积误差较大;B不符合题意;
C、测定pH,不能把pH试纸直接放入溶液中测量,应该用玻璃棒蘸取少量溶液滴到pH试纸上,C不符合题意;
D、二氧化碳的密度比空气的密度大,气体从左(长)导管口进入,气体装满集气瓶时,会从右(短)导管口逸出,验满时把燃着的木条放到右(短)导管出口处,D符合题意。
故答案为:D。
【分析】A、浓硫酸的稀释方法,酸入水,沿器壁,慢慢倒,不断搅。
B、量筒量程选择的依据有两点:一是保证量取一次,二是量程与液体的取用量最接近。
C、根据溶液测定pH值的正确操作,进行分析。
D、根据二氧化碳的密度比空气的密度大,进行分析。
2.【答案】A
【解析】【解答】pH越小,酸性越强, 酸性最强的是苹果汁,
故答案为:A。
【分析】pH越大,碱性越强,pH为7则为中性。
3.【答案】B
【解析】【解答】A. 中和反应一定有盐和水生成,生成盐和水的反应不一定是中和反应,例如氢氧化钙和二氧化碳生成碳酸钙和水,故不符合题意;
B. 化学反应前后元素种类不变;某物质在氧气中燃烧后生成二氧化碳和水,则该物质中一定含有碳、氢元素,故符合题意;
C. 酸性溶液能使紫色石蕊试液变红,通入二氧化碳后的紫色石蕊试液变红,是因为二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红色,故不符合题意;
D. 溶液具有均一性和稳定性,具有均一性和稳定性的液体不一定是溶液,例如水,故不符合题意。
故答案为:B。
【分析】A、根据中和反应的概念,进行分析。
B、根据质量守恒定律,化学反应前后元素种类不变,进行分析。
C、酸性溶液能使紫色石蕊试液变红,二氧化碳不显酸性。
D、溶液是混合物,具有均一性和稳定性。
4.【答案】B
【解析】【解答】A. 纯鲜牛奶pH大于苹果汁,其酸性比苹果汁的酸性弱,不符合题意;
B. 蚊虫叮咬后会分泌酸性毒液,可涂抹肥皂水中和以减轻痛痒,符合题意;
C. 炉具清洁剂的pH大于肥皂水,其碱性比肥皂水的碱性强,不符合题意;
D. 厕所清洁剂与炉具清洁剂混合会发生反应,降低效果,不符合题意;
故答案为:B
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
5.【答案】A
【解析】【解答】该土壤加入无色酚酞后显红色,说明土壤显碱性,而以上作物只有玉米适合在碱性土壤中生长。
【分析】根据表中所给作物适宜的土壤的pH结合土壤能使酚酞变红呈碱性分析。
6.【答案】C
【解析】【解答】pH大于7时,液体呈碱性,pH越大,碱性越强,胰液pH最大,
故答案为:C。
【分析】根据酸性溶液pH小于7,pH越小,酸性越强,碱性溶液pH大于7,pH越大,碱性越强分析
7.【答案】D
【解析】【解答】A、唾液的pH是6.6-7.1,呈中性、弱碱性或弱酸性.A不符合题意;
B、血液的pH是7.35-7.45,呈弱碱性.B不符合题意;
C、胆汁的pH是6.8-7.4,呈中性、弱碱性或弱酸性.C不符合题意;
D、胃液的pH是0.8-1.5,酸性很强.D符合题意.
故答案为:D.
【分析】根据溶液的pH小于7是酸性的,大于7是碱性的分析
8.【答案】D
【解析】【解答】A、酸雨是指溶液pH小于5.6的雨水,酸雨的pH小于7,但pH小于7的雨水不一定是酸雨,故A不符合题意;
B、分子、原子、离子都可以构成物质,物质不一定都是由分子构成的,故B不符合题意;
C、化学性质不活泼的金属在潮湿的空气中不易被腐蚀,如金,故C不符合题意;
D、氢气、一氧化碳或甲烷都是可燃性气体,可燃性气体与空气混合后点燃可能发生爆炸,所以点燃可燃性气体前一定要检验纯度,故D符合题意。
故答案为:D。
【分析】A、根据酸雨是指溶液pH小于5.6的雨水分析;
B、根据构成物质的粒子有分子、原子和离子三种分析;
C、根据金等化学性质稳定分析;
D、根据点燃可燃性气体前都要验纯分析。
9.【答案】C
【解析】【解答】A. 根据图中曲线的起点pH大于7,可知容器里的液体为碱性,是氢氧化钠溶液;根据曲线终点pH小于7可知,滴加的液体为酸性,也就是说,横坐标的溶液是稀盐酸,故A不符合题意;
B. A点时的溶液的pH>7,溶液显碱性,能使紫色石蕊试液变蓝,故B不符合题意;
C. B点时的溶液的pH=7,为中性,说明酸碱恰好完全反应,故C符合题意;
D、曲线上C点的pH小于7,说明酸过量,此刻溶液中的溶质有NaCl和HCl,故D不符合题意。
故答案为:C。
【分析】根据图中曲线的起点pH大于7,说明是稀盐酸滴加到氢氧化钠溶液,碱性溶液能使紫色石蕊试液变蓝,盐酸与氢氧化钠反应生成氯化钠和水,中性溶液不能使无色酚酞试液变色分析。
10.【答案】C
【解析】【解答】A、 ,该反应的反应物是碱和非金属氧化物,不属于中和反应,不符合题意。
B、 ,氧化镁属于金属氧化物,该反应的反应物是酸和金属氧化物,不属于中和反应,不符合题意。
C、 ,该反应的反应物是酸和碱,生成物是盐和水,属于中和反应,符合题意。
D、 ,该反应的反应物是酸和盐,不属于中和反应,不符合题意。
故答案为:C。
【分析】酸和碱反应生成盐和水才是中和反应。
11.【答案】B
【解析】【解答】A、人体胃液正常的pH范围在0.9﹣1.5 之间,故选项说法正确;
B、人体缺乏维生素A会引起夜盲症,不是坏血病,故选项说法错误;
C、香烟的烟气中含一氧化碳、焦油等对人体有害的物质,所以吸烟对人体健康有害,故选项说法正确;
D、碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大;碘过量也会引起甲状腺肿大,故选项说法正确;
答案:B
【分析】A、根据人体胃液正常的pH范围进行分析判断;
B、根据维生素的生理作用进行分析判断;
C、根据香烟的烟气中含一氧化碳、焦油等对人体有害的物质进行解答;
D、根据碘的生理功能和缺乏症进行分析判断.
12.【答案】D
【解析】【解答】A. 控制二氧化碳的排放量,与酸雨无关,故A不符合题意;
B. 减少使用一次性塑料制品,防止环境污染,与酸雨无关,故B不符合题意;
C. 分类回收处理生活垃圾,回收再利用资源,与酸雨无关,故C不符合题意;
D. 导致酸雨的主要气体为硫氧化物和氮氧化物,防治酸雨,应减少含硫化石燃料的燃烧,减少硫氧化物和氮氧化物的排放,故D符合题意;
故答案为:D。
【分析】根据酸雨的形成原因分析。
13.【答案】碱;学校/图书馆(合理即可)
【解析】【解答】含氯消毒液的pH≈11>7,溶液显碱性;常用于家庭、宾馆、学校、图书馆、电影院(合理即可)等公共场所消毒。
【分析】根据碱性溶液的pH大于7分析
14.【答案】SO2;He;O2;CO2;CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】【解答】上述气体中不是空气的组成成分会引起酸雨的气体是二氧化硫,化学式故填SO2;可用于代替氢气填充气球的是氦气,化学式故填He;人类时刻都离不开空气,是因为空气中有氧气,故填O2; 会引起温室效应的气体是二氧化碳,故填 CO2;二氧化碳一般用澄清的石灰水检验,把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳,二氧化碳和澄清石灰水反应生成碳酸钙沉淀和水,化学方程式故填CO2+Ca(OH)2=CaCO3↓+H2O。
【分析】酸雨是主要由二氧化硫和二氧化氮引起的;氦气密度比空气小,可以代替氢气添充气球;空气中有氧气,可以帮助人们呼吸;二氧化碳是引起温室效应的主要气体;实验室用大理石和稀盐酸来制取二氧化碳;
15.【答案】H2O;<
【解析】【解答】氢氧化钠和稀硫酸反应生成硫酸钠和水,结合图示可得表示水分子,100g溶质质量分数为8%的氢氧化钠中含有氢氧根的质量为100g8%=3.4g,100g溶质质量分数为8%的氢氧化钾中氢氧根的质量为100g8%=2.4g,则 将氢氧化钠溶液换成100g溶质质量分数为8%的氢氧化钾与该稀盐酸反应稀硫酸剩余,溶液的pH小于7,故答案为:H2O;<;
【分析】根据氢氧化钠和稀硫酸反应的方程式及中和反应的实质进行分析。
16.【答案】(1)酸
(2)
【解析】【解答】(1)溴化氢在水中电离出的阳离子全部是氢离子,因此水溶液显酸性,故填:酸。(2)溴化氢在水中电离出的阳离子全部是氢离子,符合酸的组成特点,属于酸,氢氧化钠在水溶液中电离出的阴离子全部是氢氧根离子,符合碱的组成特点,属于碱,酸和碱反应生成盐和水的反应属于中和反应,溴化氢和氢氧化钠反应生成溴化钠和水,反应的化学方程式: ,故填:
【分析】(1)根据酸的概念分析
(2)根据溴化氢和氢氧化钠反应生成溴化钠和水分析
17.【答案】(1)溶液由红色变为无色;氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完
(2)NaOH+HCl=NaCl+H2O;HCl、NaCl
【解析】【解答】(1)酚酞试液遇碱性溶液变红,氢氧化钠溶液显碱性,所以可观察到溶液由红色变为无色。氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完。
(2)①盐酸和氢氧化钠反应生成氯化钠水。②60s时,烧瓶内溶液的pH<7,溶液显酸性,所以溶液中的溶质有生成的NaCl和过量盐酸中的HCl。
【分析】本题主要考察如何判断溶液的酸碱性,需要记住紫色石蕊和酚酞遇酸或碱的颜色变化。
18.【答案】(1)NaOH + HCl = NaCl + H2O
(2)pH由大于7逐渐变为等于7(或小于7)
【解析】【解答】(1)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液由碱性变为中性,溶液由红色变为无色,故填:NaOH + HCl = NaCl + H2O。(2)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液由碱性增加减弱,pH逐渐减小,故填:pH由大于7逐渐变为等于7。
【分析】(1)根据氢氧化钠与盐酸反应生成氯化钠和水分析;
(2)根据向碱溶液中加入酸溶液时,溶液pH会从大于7逐渐变为等于7,然后再小于7分析。
19.【答案】(1)小于
(2)烧碱溶液
(3)不同意。A、B、C三处溶液中均含有氯离子,都能与硝酸银反应产生白色沉淀。
【解析】【解答】(1)由 可知,用相同溶质质量分数的稀盐酸和烧碱溶液进行实验,当稀盐酸和烧碱溶液的质量相等时,稀盐酸有剩余,所得溶液pH小于7;
(2)从图中可以看出,用滴管加入溶液之前,溶液的pH<7,此时溶液显酸性,所以该实验“用滴管加入”的是烧碱溶液溶液。
(3)某同学取A、B、C三处溶液中的一份进行探究,他向所取溶液中滴加少量硝酸银溶液,观察到有白色沉淀,由此他判断所取溶液为A处溶液,不同意他的判断,因为A、B、C三处溶液中均含有氯离子,都能与硝酸银反应产生白色沉淀。
【分析】(1)根据盐酸和氢氧化钠反应的质量关系分析;
(2)根据变化过程中溶液pH的变化分析;
(3)根据反应后溶液中含有氯离子都能与硝酸银反应生成氯化银沉淀分析。
20.【答案】B
【解析】【解答】A、C、D都是利用物质的还原性与金属氧化物作用,ACD不符合题意;B是利用酸与碱性氧化物作用,B符合题意。
故答案为:B。
【分析】要证明是酸性可以选择用碱性物质和它反应。
21.【答案】(1)50g
(2)解:设NaOH溶液中溶质的质量为
=4g
NaOH的质量分数=
答:NaOH的质量分数是8%。
【解析】【解答】(1)氢氧化钠与盐酸反应生成氯化钠和水,氯化钠溶液为中性,pH为7,故当溶液的pH为7时,盐酸和氢氧化钠恰好反应,故恰好完全反应时,消耗稀盐酸的质量为50g;
【分析】(1)氢氧化钠与盐酸反应生成氯化钠和水,氯化钠溶液为中性,pH=7
(2)先设未知数,正确写出氢氧化钠与盐酸反应的化学方程式;再找准有关物质,已知量是盐酸的质量,未知量是氢氧化钠的质量;列比例式计算。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
10.2 酸和碱的中和反应
一、单选题
1.下列实验操作符合规范要求且能达到实验目的的是( )
A. 稀释浓硫酸
B. 量取5.5mL液体
C. 测定pH
D. 二氧化碳验满
2.下列食物的近似如下,其中酸性最强的是( )
A.苹果汁 B.葡萄汁
C.番茄汁 D.鸡蛋清
3.推理是化学学习中常用的方法,下列推理正确的是( )
A.中和反应一定有盐和水生成,生成盐和水的反应一定是中和反应
B.某物质在氧气中燃烧后生成二氧化碳和水,则该物质中一定含有碳、氢元素
C.酸性溶液能使紫色石蕊试液变红,通入二氧化碳后的紫色石蕊试液变红,则二氧化碳呈酸性
D.溶液具有均一性和稳定性,则具有均一性和稳定性的液体一定是溶液
4.一些物质的近似pH如下图,下列有关说法正确的是( )
A.纯鲜牛奶的酸性比苹果汁的酸性强
B.一般被蚊虫叮咬后可涂抹肥皂水以减轻痛痒
C.炉具清洁剂的碱性比肥皂水的碱性弱
D.厕所清洁剂与炉具清洁剂混合去污效果更好
5.“浸土选种”是现代农业生产常用的科学方法,取武当山特区某村土壤浸出的溶液,加入无色酚酞溶液后显红色。下表为四种农作物适宜生长的pH范围,你认为该村土壤比较适宜种植的农作物是()
农作物 水稻 茶树 玉米 马铃薯
pH 6.0~7.0 6.0~7.0 7.0~8.1 4.8~5.5
A.玉米 B.茶树 C.水稻 D.马铃薯
6.测定人体内或排出的液体的pH,可以帮助人们了解身体的健康状况。人体内的一些液体的正常pH范围如下表,其中碱性最强的是( )
液体 胃液 胆汁 胰液 血浆
pH 0.9~1.5 7.1~7.3 7.5~7.8 7.3~7.4
A.胃液 B.胆汁 C.胰液 D.血浆
7.下列人体体液中,酸性最强的是( )
A B C D
体液 唾液 血液 胆汁 胃液
pH范围 6.6 -7.1 7. 35 -7.45 6.8 -7.4 0.8 -1.5
A.A B.B C.C D.D
8.逻辑推理是学习化学常用的思维方法。下列推理正确的是( )
A.pH<7的溶液呈酸性,所以pH<7的雨水是酸雨
B.分子可以构成物质,所以物质都是由分子构成
C.Fe在潮湿的空气中易被腐蚀,所以金属在潮湿的空气中都易被腐蚀
D.点燃氢气、一氧化碳或甲烷前需要检验纯度,所以点燃可燃性气体前要检验纯度
9.如所示是稀盐酸和氢氧化钠溶液反应过程中溶液pH变化规律的坐标曲线图。请认真观察,判断下列说法,有关该实验事实的说法正确的是( )
A.用滴管滴加的溶液为氢氧化钠溶液
B.向A点时的溶液中滴加紫色石蕊试液,溶液会变红
C.盐酸和氢氧化钠恰好完全反应时,对应的点为B点
D.曲线上C点对应的溶液中,溶质只有氯化钠
10.下列反应属于中和反应的是( )
A. B.
C. D.
11.关注健康、预防疾病.下列叙述错误的是( )
A.人体胃液正常的pH范围在0.9﹣1.5
B.人体缺乏维生素A会引起坏血病
C.香烟的烟气中含多种对人体有害的物质
D.人体缺碘会引起甲状腺肿大,碘过量也会引起甲状腺肿大
12.酸雨对农作物以及一些建筑有不利影响。下列措施中与酸雨的防治有关的是( )
A.控制二氧化碳的排放量 B.减少使用一次性塑料制品
C.分类回收处理生活垃圾 D.减少含硫化石燃料的燃烧
二、填空题
13.含氯消毒液是一种高效消毒剂,pH≈11,呈 性,常用于家庭、宾馆、 等公共场所消毒。
14.同学们可以通过下列方式认识空气。
在氮气、氧气、氦气、二氧化碳、二氧化硫气体中。用化学用语填写:
不是空气的组成成分会引起酸雨的气体是 ;可用于代替氢气填充气球的是 ;人类时刻都离不开空气,是因为有 ;
会引起温室效应的气体是 ,写出实验室制取该气体的化学方程式 。
15.如图是氢氧化钠溶液和稀硫酸反应的示意图,“”中的微粒符号是 。恰好中和100g溶质质量分数为7.3%的稀盐酸,需要100g溶质质量分数为8%的氢氧化钠溶液,若将氢氧化钠溶液换成100g溶质质量分数为8%的氢氧化钾与该稀盐酸反应,则充分反应后溶液的pH (填“<”“>”或“=”)7。
16.已知:在水溶液中,乙醇(C2H5OH)不发生电离;溴化氢(HBr)电离产生氢离子(H+)和溴离子(Br-);氢氧化钠电离产生钠离子和氢氧根离子。请回答下列问题:
(1)根据这三种溶液的组成推断,溴化氢的水溶液显 性。
(2)写出上述物质之间发生中和反应的化学方程式 。
三、实验探究题
17.同学们为了探究盐酸和氢氧化钠是否发生反应,设计并进行了实验。
(1)小丽同学用如图进行实验,实验中观察到 现象能证明盐酸和氢氧化钠发生了化学反应,其理由是 。
(2)小明同学用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
①盐酸和氢氧化钠反应的化学方程式为 。
②60 s时,烧瓶内溶液中的溶质有 。
18.用下列实验研究酸与碱的反应。
(1)实验一中溶液由红色变为无色。用化学方程式解释该现象产生的原因: 。
(2)实验二在滴加盐酸过程中,多次测量溶液的pH。证明反应发生的依据是 。
四、综合题
19.某同学用相同溶质质量分数的稀盐酸和烧碱溶液进行实验,反应过程中pH的变化如图。
(1)当稀盐酸和烧碱溶液的质量相等时,所得溶液pH 7 (填“大于”、“小于”或“等于”)。
(2)从图中可以看出该实验“用滴管加入”的是 溶液。
(3)某同学取A、B、C三处溶液中的一份进行探究,他向所取溶液中滴加少量硝酸银溶液,观察到有白色沉淀,由此他判断所取溶液为A处溶液。你同意他的判断吗,为什么: 。
五、选择题
20.为了证明CuO属于碱性氧化物,应选用的反应是( )
A.与木炭混合后加热 B.与稀酸混合后加热
C.通入氢气后加热 D.通入一氧化碳后加热
六、计算题
21.常温下,向盛有50.0gNaOH溶液的烧杯中逐滴加入60.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如下:
加入稀盐酸的质量/g 30.0 40.0 50.0 60.0
烧杯中溶液的pH 13.7 13.3 7.0 0.7
(1)恰好完全反应时,消耗稀盐酸的质量为 。
(2)求该NaOH溶液中溶质的质量分数。
答案解析部分
1.【答案】D
【解析】【解答】A、稀释浓硫酸时,要把浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌,A不符合题意;
B、量取5.5mL液体,不能用50毫升的量筒,所要量取的液体体积与量筒的量程相差太大,造成量取液体体积误差较大;B不符合题意;
C、测定pH,不能把pH试纸直接放入溶液中测量,应该用玻璃棒蘸取少量溶液滴到pH试纸上,C不符合题意;
D、二氧化碳的密度比空气的密度大,气体从左(长)导管口进入,气体装满集气瓶时,会从右(短)导管口逸出,验满时把燃着的木条放到右(短)导管出口处,D符合题意。
故答案为:D。
【分析】A、浓硫酸的稀释方法,酸入水,沿器壁,慢慢倒,不断搅。
B、量筒量程选择的依据有两点:一是保证量取一次,二是量程与液体的取用量最接近。
C、根据溶液测定pH值的正确操作,进行分析。
D、根据二氧化碳的密度比空气的密度大,进行分析。
2.【答案】A
【解析】【解答】pH越小,酸性越强, 酸性最强的是苹果汁,
故答案为:A。
【分析】pH越大,碱性越强,pH为7则为中性。
3.【答案】B
【解析】【解答】A. 中和反应一定有盐和水生成,生成盐和水的反应不一定是中和反应,例如氢氧化钙和二氧化碳生成碳酸钙和水,故不符合题意;
B. 化学反应前后元素种类不变;某物质在氧气中燃烧后生成二氧化碳和水,则该物质中一定含有碳、氢元素,故符合题意;
C. 酸性溶液能使紫色石蕊试液变红,通入二氧化碳后的紫色石蕊试液变红,是因为二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红色,故不符合题意;
D. 溶液具有均一性和稳定性,具有均一性和稳定性的液体不一定是溶液,例如水,故不符合题意。
故答案为:B。
【分析】A、根据中和反应的概念,进行分析。
B、根据质量守恒定律,化学反应前后元素种类不变,进行分析。
C、酸性溶液能使紫色石蕊试液变红,二氧化碳不显酸性。
D、溶液是混合物,具有均一性和稳定性。
4.【答案】B
【解析】【解答】A. 纯鲜牛奶pH大于苹果汁,其酸性比苹果汁的酸性弱,不符合题意;
B. 蚊虫叮咬后会分泌酸性毒液,可涂抹肥皂水中和以减轻痛痒,符合题意;
C. 炉具清洁剂的pH大于肥皂水,其碱性比肥皂水的碱性强,不符合题意;
D. 厕所清洁剂与炉具清洁剂混合会发生反应,降低效果,不符合题意;
故答案为:B
【分析】根据溶液pH与酸碱性关系分析,溶液pH<7时,呈酸性,且越小酸性越强,溶液pH>7时,呈碱性,且越大碱性越强,溶液pH=7时,呈中性。
5.【答案】A
【解析】【解答】该土壤加入无色酚酞后显红色,说明土壤显碱性,而以上作物只有玉米适合在碱性土壤中生长。
【分析】根据表中所给作物适宜的土壤的pH结合土壤能使酚酞变红呈碱性分析。
6.【答案】C
【解析】【解答】pH大于7时,液体呈碱性,pH越大,碱性越强,胰液pH最大,
故答案为:C。
【分析】根据酸性溶液pH小于7,pH越小,酸性越强,碱性溶液pH大于7,pH越大,碱性越强分析
7.【答案】D
【解析】【解答】A、唾液的pH是6.6-7.1,呈中性、弱碱性或弱酸性.A不符合题意;
B、血液的pH是7.35-7.45,呈弱碱性.B不符合题意;
C、胆汁的pH是6.8-7.4,呈中性、弱碱性或弱酸性.C不符合题意;
D、胃液的pH是0.8-1.5,酸性很强.D符合题意.
故答案为:D.
【分析】根据溶液的pH小于7是酸性的,大于7是碱性的分析
8.【答案】D
【解析】【解答】A、酸雨是指溶液pH小于5.6的雨水,酸雨的pH小于7,但pH小于7的雨水不一定是酸雨,故A不符合题意;
B、分子、原子、离子都可以构成物质,物质不一定都是由分子构成的,故B不符合题意;
C、化学性质不活泼的金属在潮湿的空气中不易被腐蚀,如金,故C不符合题意;
D、氢气、一氧化碳或甲烷都是可燃性气体,可燃性气体与空气混合后点燃可能发生爆炸,所以点燃可燃性气体前一定要检验纯度,故D符合题意。
故答案为:D。
【分析】A、根据酸雨是指溶液pH小于5.6的雨水分析;
B、根据构成物质的粒子有分子、原子和离子三种分析;
C、根据金等化学性质稳定分析;
D、根据点燃可燃性气体前都要验纯分析。
9.【答案】C
【解析】【解答】A. 根据图中曲线的起点pH大于7,可知容器里的液体为碱性,是氢氧化钠溶液;根据曲线终点pH小于7可知,滴加的液体为酸性,也就是说,横坐标的溶液是稀盐酸,故A不符合题意;
B. A点时的溶液的pH>7,溶液显碱性,能使紫色石蕊试液变蓝,故B不符合题意;
C. B点时的溶液的pH=7,为中性,说明酸碱恰好完全反应,故C符合题意;
D、曲线上C点的pH小于7,说明酸过量,此刻溶液中的溶质有NaCl和HCl,故D不符合题意。
故答案为:C。
【分析】根据图中曲线的起点pH大于7,说明是稀盐酸滴加到氢氧化钠溶液,碱性溶液能使紫色石蕊试液变蓝,盐酸与氢氧化钠反应生成氯化钠和水,中性溶液不能使无色酚酞试液变色分析。
10.【答案】C
【解析】【解答】A、 ,该反应的反应物是碱和非金属氧化物,不属于中和反应,不符合题意。
B、 ,氧化镁属于金属氧化物,该反应的反应物是酸和金属氧化物,不属于中和反应,不符合题意。
C、 ,该反应的反应物是酸和碱,生成物是盐和水,属于中和反应,符合题意。
D、 ,该反应的反应物是酸和盐,不属于中和反应,不符合题意。
故答案为:C。
【分析】酸和碱反应生成盐和水才是中和反应。
11.【答案】B
【解析】【解答】A、人体胃液正常的pH范围在0.9﹣1.5 之间,故选项说法正确;
B、人体缺乏维生素A会引起夜盲症,不是坏血病,故选项说法错误;
C、香烟的烟气中含一氧化碳、焦油等对人体有害的物质,所以吸烟对人体健康有害,故选项说法正确;
D、碘是合成甲状腺激素的主要元素,缺乏会患甲状腺肿大;碘过量也会引起甲状腺肿大,故选项说法正确;
答案:B
【分析】A、根据人体胃液正常的pH范围进行分析判断;
B、根据维生素的生理作用进行分析判断;
C、根据香烟的烟气中含一氧化碳、焦油等对人体有害的物质进行解答;
D、根据碘的生理功能和缺乏症进行分析判断.
12.【答案】D
【解析】【解答】A. 控制二氧化碳的排放量,与酸雨无关,故A不符合题意;
B. 减少使用一次性塑料制品,防止环境污染,与酸雨无关,故B不符合题意;
C. 分类回收处理生活垃圾,回收再利用资源,与酸雨无关,故C不符合题意;
D. 导致酸雨的主要气体为硫氧化物和氮氧化物,防治酸雨,应减少含硫化石燃料的燃烧,减少硫氧化物和氮氧化物的排放,故D符合题意;
故答案为:D。
【分析】根据酸雨的形成原因分析。
13.【答案】碱;学校/图书馆(合理即可)
【解析】【解答】含氯消毒液的pH≈11>7,溶液显碱性;常用于家庭、宾馆、学校、图书馆、电影院(合理即可)等公共场所消毒。
【分析】根据碱性溶液的pH大于7分析
14.【答案】SO2;He;O2;CO2;CaCO3+2HCl=CaCl2+H2O+CO2↑
【解析】【解答】上述气体中不是空气的组成成分会引起酸雨的气体是二氧化硫,化学式故填SO2;可用于代替氢气填充气球的是氦气,化学式故填He;人类时刻都离不开空气,是因为空气中有氧气,故填O2; 会引起温室效应的气体是二氧化碳,故填 CO2;二氧化碳一般用澄清的石灰水检验,把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳,二氧化碳和澄清石灰水反应生成碳酸钙沉淀和水,化学方程式故填CO2+Ca(OH)2=CaCO3↓+H2O。
【分析】酸雨是主要由二氧化硫和二氧化氮引起的;氦气密度比空气小,可以代替氢气添充气球;空气中有氧气,可以帮助人们呼吸;二氧化碳是引起温室效应的主要气体;实验室用大理石和稀盐酸来制取二氧化碳;
15.【答案】H2O;<
【解析】【解答】氢氧化钠和稀硫酸反应生成硫酸钠和水,结合图示可得表示水分子,100g溶质质量分数为8%的氢氧化钠中含有氢氧根的质量为100g8%=3.4g,100g溶质质量分数为8%的氢氧化钾中氢氧根的质量为100g8%=2.4g,则 将氢氧化钠溶液换成100g溶质质量分数为8%的氢氧化钾与该稀盐酸反应稀硫酸剩余,溶液的pH小于7,故答案为:H2O;<;
【分析】根据氢氧化钠和稀硫酸反应的方程式及中和反应的实质进行分析。
16.【答案】(1)酸
(2)
【解析】【解答】(1)溴化氢在水中电离出的阳离子全部是氢离子,因此水溶液显酸性,故填:酸。(2)溴化氢在水中电离出的阳离子全部是氢离子,符合酸的组成特点,属于酸,氢氧化钠在水溶液中电离出的阴离子全部是氢氧根离子,符合碱的组成特点,属于碱,酸和碱反应生成盐和水的反应属于中和反应,溴化氢和氢氧化钠反应生成溴化钠和水,反应的化学方程式: ,故填:
【分析】(1)根据酸的概念分析
(2)根据溴化氢和氢氧化钠反应生成溴化钠和水分析
17.【答案】(1)溶液由红色变为无色;氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完
(2)NaOH+HCl=NaCl+H2O;HCl、NaCl
【解析】【解答】(1)酚酞试液遇碱性溶液变红,氢氧化钠溶液显碱性,所以可观察到溶液由红色变为无色。氢氧化钠溶液能使酚酞试液变为红色,实验中溶液由红色变为无色,说明溶液不是碱性了,即氢氧化钠已反应完。
(2)①盐酸和氢氧化钠反应生成氯化钠水。②60s时,烧瓶内溶液的pH<7,溶液显酸性,所以溶液中的溶质有生成的NaCl和过量盐酸中的HCl。
【分析】本题主要考察如何判断溶液的酸碱性,需要记住紫色石蕊和酚酞遇酸或碱的颜色变化。
18.【答案】(1)NaOH + HCl = NaCl + H2O
(2)pH由大于7逐渐变为等于7(或小于7)
【解析】【解答】(1)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液由碱性变为中性,溶液由红色变为无色,故填:NaOH + HCl = NaCl + H2O。(2)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液由碱性增加减弱,pH逐渐减小,故填:pH由大于7逐渐变为等于7。
【分析】(1)根据氢氧化钠与盐酸反应生成氯化钠和水分析;
(2)根据向碱溶液中加入酸溶液时,溶液pH会从大于7逐渐变为等于7,然后再小于7分析。
19.【答案】(1)小于
(2)烧碱溶液
(3)不同意。A、B、C三处溶液中均含有氯离子,都能与硝酸银反应产生白色沉淀。
【解析】【解答】(1)由 可知,用相同溶质质量分数的稀盐酸和烧碱溶液进行实验,当稀盐酸和烧碱溶液的质量相等时,稀盐酸有剩余,所得溶液pH小于7;
(2)从图中可以看出,用滴管加入溶液之前,溶液的pH<7,此时溶液显酸性,所以该实验“用滴管加入”的是烧碱溶液溶液。
(3)某同学取A、B、C三处溶液中的一份进行探究,他向所取溶液中滴加少量硝酸银溶液,观察到有白色沉淀,由此他判断所取溶液为A处溶液,不同意他的判断,因为A、B、C三处溶液中均含有氯离子,都能与硝酸银反应产生白色沉淀。
【分析】(1)根据盐酸和氢氧化钠反应的质量关系分析;
(2)根据变化过程中溶液pH的变化分析;
(3)根据反应后溶液中含有氯离子都能与硝酸银反应生成氯化银沉淀分析。
20.【答案】B
【解析】【解答】A、C、D都是利用物质的还原性与金属氧化物作用,ACD不符合题意;B是利用酸与碱性氧化物作用,B符合题意。
故答案为:B。
【分析】要证明是酸性可以选择用碱性物质和它反应。
21.【答案】(1)50g
(2)解:设NaOH溶液中溶质的质量为
=4g
NaOH的质量分数=
答:NaOH的质量分数是8%。
【解析】【解答】(1)氢氧化钠与盐酸反应生成氯化钠和水,氯化钠溶液为中性,pH为7,故当溶液的pH为7时,盐酸和氢氧化钠恰好反应,故恰好完全反应时,消耗稀盐酸的质量为50g;
【分析】(1)氢氧化钠与盐酸反应生成氯化钠和水,氯化钠溶液为中性,pH=7
(2)先设未知数,正确写出氢氧化钠与盐酸反应的化学方程式;再找准有关物质,已知量是盐酸的质量,未知量是氢氧化钠的质量;列比例式计算。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
