第四章第1节第1课时原子结构课件(共29张PPT)-2023-2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章第1节第1课时原子结构课件(共29张PPT)-2023-2024学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 47.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 17:26:37 | ||
图片预览





文档简介
(共29张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
课时1 原子结构
目
录
1、原子的构成
2、原子核外电子排布
3、常见题型训练
大爆炸理论认为
宇宙诞生约140亿年前的一次大爆炸。大爆炸后约2h,诞生了大量氢核,少量氦核。
我们今天所熟悉的各种原子都是从那时起经历了漫长的物理、化学变化,分批分期合成而来的。
原子的产生
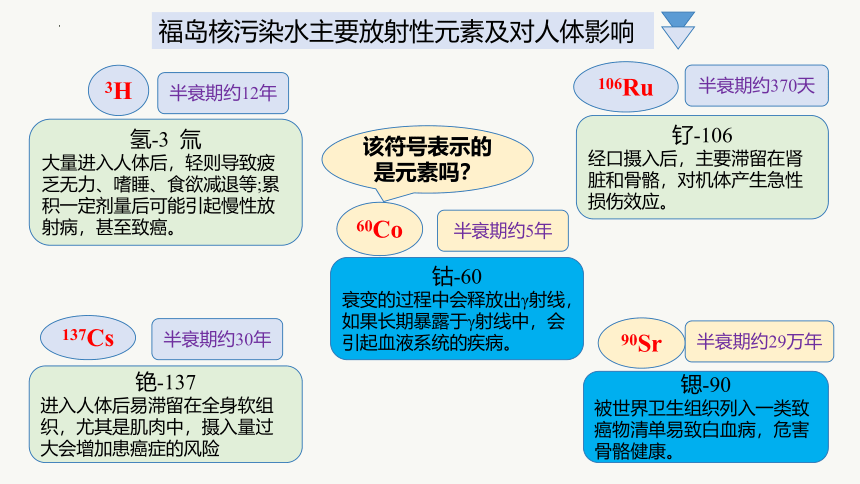
福岛核污染水主要放射性元素及对人体影响
3H
半衰期约12年
氢-3 氚
大量进入人体后,轻则导致疲乏无力、嗜睡、食欲减退等;累积一定剂量后可能引起慢性放射病,甚至致癌。
106Ru
半衰期约370天
钌-106
经口摄入后,主要滞留在肾脏和骨骼,对机体产生急性损伤效应。
60Co
钴-60
衰变的过程中会释放出γ射线,如果长期暴露于γ射线中,会引起血液系统的疾病。
半衰期约5年
90Sr
半衰期约29万年
锶-90
被世界卫生组织列入一类致癌物清单易致白血病,危害骨骼健康。
137Cs
铯-137
进入人体后易滞留在全身软组织,尤其是肌肉中,摄入量过大会增加患癌症的风险
半衰期约30年
该符号表示的是元素吗?
原子构成
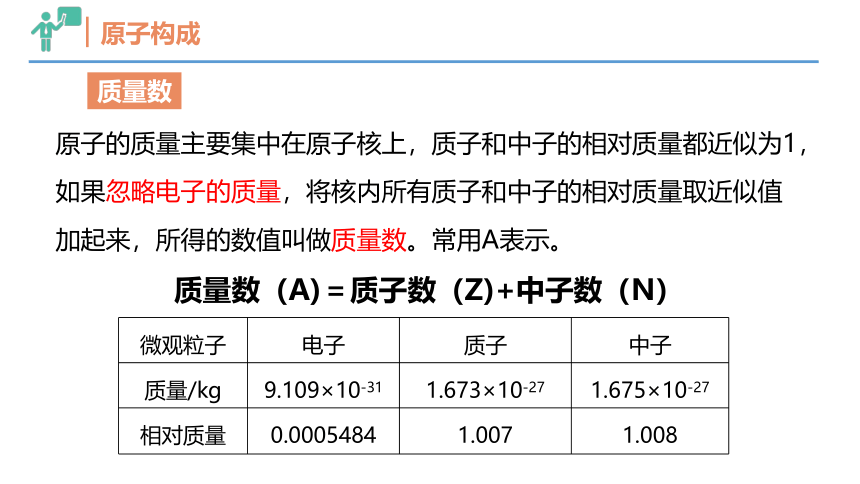
质量数
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,所得的数值叫做质量数。常用A表示。
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
质量数(A)=质子数(Z)+中子数(N)
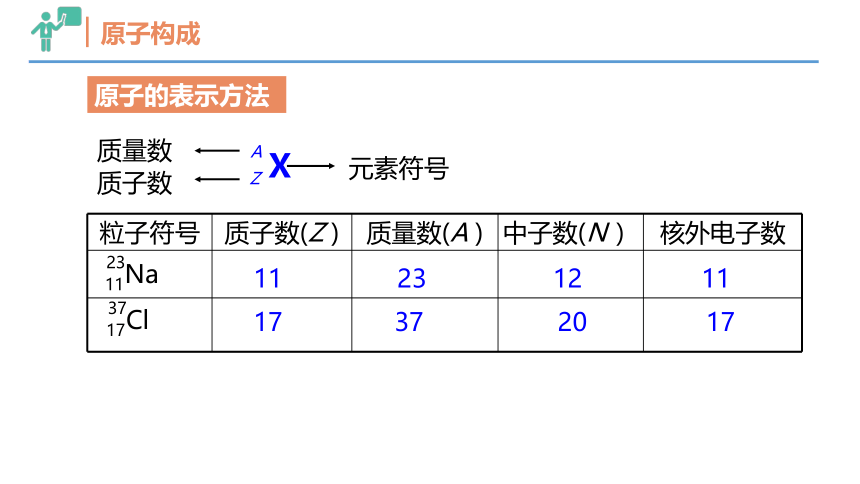
原子构成
X
Z
A
质子数
质量数
元素符号
粒子符号 质子数(Z ) 质量数(A ) 中子数(N ) 核外电子数
Na
11
23
17 37 20 17
原子的表示方法
Cl
17
37
23 12 11
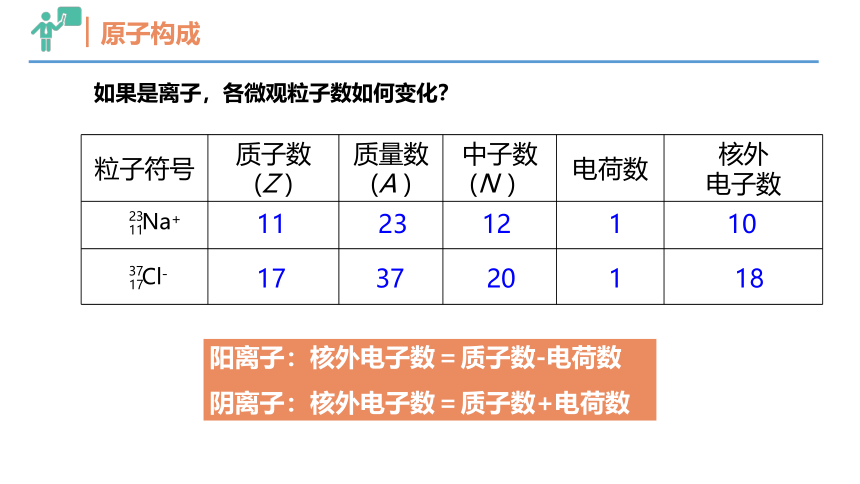
原子构成
如果是离子,各微观粒子数如何变化?
粒子符号 质子数 (Z ) 质量数 (A ) 中子数 (N ) 电荷数 核外
电子数
23 12
17 37 20
1 10
1 18
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
Na+
11
23
Cl-
17
37
1. 常 用于核裂变反应,下列关于 的叙述正确的是( )
A.质子数为235 B.电子数为143
C.核电荷数为235 D.中子数为143
2.钼(Mo)是生命必需的元素,参与人体内硝酸盐的代谢,阻止致癌物亚硝胺的形成。下列关于 的说法中,不正确的是 ( )
A.中子数是66 B.原子核内中子数与质子数之差为28
C.核外电子数是42 D.质量数是108
D
B
3.质子数和中子数相同的原子A,其阳离子An+核外共有x 个电子,则A的质量数为( )
A.2(x+n) B.2(x-n)
C.2x D.n+2
A
核外电子排布
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ K
L
M
N
O
P
Q
近
远
低
高
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
2、第 n 层最多容纳______个电子
2n2
1、K、L、M、N 层分别最多容纳________________个电子
2、 8、18、32
核外电子排布
1、K层为最外层时,电子数不超过____个
2
3、次外层最多容纳_____个电子
18
2、其他层为最外层时,电子数最多不超过____个
8
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
核外电子排布
核外电子排布规律总结:
最外层电子数不超过8个(当K层为最外层时不超过2个)
次外层电子数不超过18个
倒数第3层电子数不超过32个
各层电子数不超过2n2个(n为电子层数)
能量最低原理 (先从内层排起,当一层充满后再填充下一层)
核外电子排布
4.下列叙述正确的是 ( )
A.电子的能量越低,运动区域离核越远
B.电子一般总是先从内层排起,当一层充满后再填充下一层
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
5.(2023河南郑州一中月考)某元素的原子,L层上的电子数是M层上电子数的4倍,该元素是 ( )
A.K B.O C.Mg D.S
B
C
短周期元素中常见原子的核外电子排布规律总结:
原子核中无中子的原子:
1
1 H
最外层只有一个电子的原子:
H、Li、Na
最外层有两个电子的原子:
Be、Mg、He
最外层电子数等于次外层电子数的原子:
Be、Ar
最外层电子数是次外层电子数两倍的原子是:
C
四倍的原子是:
三倍的原子是:
O
Ne
核外电子排布
电子层数与最外层电子数相等的原子:
H、Be、Al
电子总数为最外层电子数2倍的原子:
Be
次外层电子数是最外层电子数2倍的原子:
Li、Si
内层电子数是最外层电子数2倍的原子:
Li、P
核外电子排布
③ 电子层数与最外层电子数相等的元素:__________
① 最外层电子数等于次外层电子数的一半的元素: 。
④ M层电子数是L层电子数的一半的元素:__________
⑤ 核电荷数是电子层数的5倍的元素:__________
C
O
H、Be、Al
Si
P
6.根据电子排布情况,推断前20号元素中,符合要求的所有元素
Li、Si
② 最外层电子数是次外层电子数的2倍的元素:_____
是次外层3倍的是:____________
常见“10e-”的微粒
常见的10e-和18e-微粒
“10e-”微粒的转化关系
(1)若10电子的微粒满足关系
A
B
C
D
的一定是
NH4++OH-=NH3↑+H2O
(2)若10电子的微粒满足关系:
B++C-=2D
只有
H3O++OH-=2H2O
常见的10e-和18e-微粒
常见“18e-”的微粒
常见的10e-和18e-微粒
原子
原子核
质子(每个质子带1个单位正电荷)
中子(不带电)
核外电子
(每个电子带1个单位负电荷)
电子
排布
规律
(1)离核由近到远,能量由低到高
(2)每个电子层最多可以容纳2n2个电子
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个)
(4)次外层最多容纳18个电子
核外电子排布的表示方法:原子结构示意图
课堂小结
7.下列是原子或离子的核外电子排布,其中错误的是( )
C
常见题型训练
8
D
常见题型训练
B
9
常见题型训练
10.下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
① 核外电子是分层运动的
② 所有电子在同一区域里运动
③ 能量高的电子在离核近的区域内运动
④ 能量低的电子在离核近的区域内运动
A. ①④ B. ②③ C. ①③ D. ②④
A
常见题型训练
11.下列各组粒子中,具有相同的质子数和电子数的是( )
A. OH-、F-、O2-、Ne
B.CH4、NH3、H2O、HF
C. NH4+、Na+、H3O+、PH4+
D. F-、O2-、Mg2+、A13+
B
常见题型训练
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
课时1 原子结构
目
录
1、原子的构成
2、原子核外电子排布
3、常见题型训练
大爆炸理论认为
宇宙诞生约140亿年前的一次大爆炸。大爆炸后约2h,诞生了大量氢核,少量氦核。
我们今天所熟悉的各种原子都是从那时起经历了漫长的物理、化学变化,分批分期合成而来的。
原子的产生
福岛核污染水主要放射性元素及对人体影响
3H
半衰期约12年
氢-3 氚
大量进入人体后,轻则导致疲乏无力、嗜睡、食欲减退等;累积一定剂量后可能引起慢性放射病,甚至致癌。
106Ru
半衰期约370天
钌-106
经口摄入后,主要滞留在肾脏和骨骼,对机体产生急性损伤效应。
60Co
钴-60
衰变的过程中会释放出γ射线,如果长期暴露于γ射线中,会引起血液系统的疾病。
半衰期约5年
90Sr
半衰期约29万年
锶-90
被世界卫生组织列入一类致癌物清单易致白血病,危害骨骼健康。
137Cs
铯-137
进入人体后易滞留在全身软组织,尤其是肌肉中,摄入量过大会增加患癌症的风险
半衰期约30年
该符号表示的是元素吗?
原子构成
质量数
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,所得的数值叫做质量数。常用A表示。
微观粒子 电子 质子 中子
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.0005484 1.007 1.008
质量数(A)=质子数(Z)+中子数(N)
原子构成
X
Z
A
质子数
质量数
元素符号
粒子符号 质子数(Z ) 质量数(A ) 中子数(N ) 核外电子数
Na
11
23
17 37 20 17
原子的表示方法
Cl
17
37
23 12 11
原子构成
如果是离子,各微观粒子数如何变化?
粒子符号 质子数 (Z ) 质量数 (A ) 中子数 (N ) 电荷数 核外
电子数
23 12
17 37 20
1 10
1 18
阳离子:核外电子数=质子数-电荷数
阴离子:核外电子数=质子数+电荷数
Na+
11
23
Cl-
17
37
1. 常 用于核裂变反应,下列关于 的叙述正确的是( )
A.质子数为235 B.电子数为143
C.核电荷数为235 D.中子数为143
2.钼(Mo)是生命必需的元素,参与人体内硝酸盐的代谢,阻止致癌物亚硝胺的形成。下列关于 的说法中,不正确的是 ( )
A.中子数是66 B.原子核内中子数与质子数之差为28
C.核外电子数是42 D.质量数是108
D
B
3.质子数和中子数相同的原子A,其阳离子An+核外共有x 个电子,则A的质量数为( )
A.2(x+n) B.2(x-n)
C.2x D.n+2
A
核外电子排布
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 ___ ___ ___ ___ ___ ___ ___
离核远近 由___到___ 能量高低 由___到___ K
L
M
N
O
P
Q
近
远
低
高
核电 荷数 元素 名称 元素 符号 各电子层的电子数 K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
2、第 n 层最多容纳______个电子
2n2
1、K、L、M、N 层分别最多容纳________________个电子
2、 8、18、32
核外电子排布
1、K层为最外层时,电子数不超过____个
2
3、次外层最多容纳_____个电子
18
2、其他层为最外层时,电子数最多不超过____个
8
元素 各电子层的电子数 K L M N O P
2He(氦) 2
10Ne(氖) 2 8
18Ar(氩) 2 8 8
36Kr(氪) 2 8 18 8
54Xe(氙) 2 8 18 18 8
86Rn(氡) 2 8 18 32 18 8
核外电子排布
核外电子排布规律总结:
最外层电子数不超过8个(当K层为最外层时不超过2个)
次外层电子数不超过18个
倒数第3层电子数不超过32个
各层电子数不超过2n2个(n为电子层数)
能量最低原理 (先从内层排起,当一层充满后再填充下一层)
核外电子排布
4.下列叙述正确的是 ( )
A.电子的能量越低,运动区域离核越远
B.电子一般总是先从内层排起,当一层充满后再填充下一层
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
5.(2023河南郑州一中月考)某元素的原子,L层上的电子数是M层上电子数的4倍,该元素是 ( )
A.K B.O C.Mg D.S
B
C
短周期元素中常见原子的核外电子排布规律总结:
原子核中无中子的原子:
1
1 H
最外层只有一个电子的原子:
H、Li、Na
最外层有两个电子的原子:
Be、Mg、He
最外层电子数等于次外层电子数的原子:
Be、Ar
最外层电子数是次外层电子数两倍的原子是:
C
四倍的原子是:
三倍的原子是:
O
Ne
核外电子排布
电子层数与最外层电子数相等的原子:
H、Be、Al
电子总数为最外层电子数2倍的原子:
Be
次外层电子数是最外层电子数2倍的原子:
Li、Si
内层电子数是最外层电子数2倍的原子:
Li、P
核外电子排布
③ 电子层数与最外层电子数相等的元素:__________
① 最外层电子数等于次外层电子数的一半的元素: 。
④ M层电子数是L层电子数的一半的元素:__________
⑤ 核电荷数是电子层数的5倍的元素:__________
C
O
H、Be、Al
Si
P
6.根据电子排布情况,推断前20号元素中,符合要求的所有元素
Li、Si
② 最外层电子数是次外层电子数的2倍的元素:_____
是次外层3倍的是:____________
常见“10e-”的微粒
常见的10e-和18e-微粒
“10e-”微粒的转化关系
(1)若10电子的微粒满足关系
A
B
C
D
的一定是
NH4++OH-=NH3↑+H2O
(2)若10电子的微粒满足关系:
B++C-=2D
只有
H3O++OH-=2H2O
常见的10e-和18e-微粒
常见“18e-”的微粒
常见的10e-和18e-微粒
原子
原子核
质子(每个质子带1个单位正电荷)
中子(不带电)
核外电子
(每个电子带1个单位负电荷)
电子
排布
规律
(1)离核由近到远,能量由低到高
(2)每个电子层最多可以容纳2n2个电子
(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个)
(4)次外层最多容纳18个电子
核外电子排布的表示方法:原子结构示意图
课堂小结
7.下列是原子或离子的核外电子排布,其中错误的是( )
C
常见题型训练
8
D
常见题型训练
B
9
常见题型训练
10.下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
① 核外电子是分层运动的
② 所有电子在同一区域里运动
③ 能量高的电子在离核近的区域内运动
④ 能量低的电子在离核近的区域内运动
A. ①④ B. ②③ C. ①③ D. ②④
A
常见题型训练
11.下列各组粒子中,具有相同的质子数和电子数的是( )
A. OH-、F-、O2-、Ne
B.CH4、NH3、H2O、HF
C. NH4+、Na+、H3O+、PH4+
D. F-、O2-、Mg2+、A13+
B
常见题型训练
