第1章认识化学科学 单元过关训练题(含解析)-2023-2024学年高一化学鲁科版必修1
文档属性
| 名称 | 第1章认识化学科学 单元过关训练题(含解析)-2023-2024学年高一化学鲁科版必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 988.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 10:40:01 | ||
图片预览


文档简介
第1章 认识化学科学 单元过关训练题
一、单选题
1.固体化合物X由3种元素组成。某学习小组进行了如下实验:
下列推既不正确的是
A.由现象1得出化合物X含有O元素
B.X的化学式Na2CuO2
C.固体混合物Y的成分是Cu和NaOH
D.化合物X中两金属元素的化合价不同
2.下列实验操作、现象及实验结论相对应且正确的是
实验操作 现象 实验结论
A 用铂丝蘸取某溶液做焰色反应 火焰呈黄色 溶液中一定不含K+
B 将过量加入无色酚酞溶液中 酚酞变红后不褪色 生成了碱性物质
C 向某溶液中加入酸化的溶液 有白色沉淀产生 溶液中含有
D 某气体通入淀粉-溶液中 溶液变蓝 该气体一定为
A.A B.B C.C D.D
3.下列物质性质与用途对应关系错误的是
A.漂白粉其有效成分为,具有氧化性,可用作游泳池等场所的消毒剂
B.和均有氧化性,可在呼吸面具或潜艇中作为氧气的来源
C.的溶液显碱性,医疗上可用作中和胃酸
D.有氧化性,可作为自来水的新型消毒剂
4.下列说法正确的是
A.金属钠着火时用水扑灭
B.等物质的量的Na2O和Na2O2所含离子总数相等
C.可利用碱石灰干燥Cl2
D.将氯气与氢气混合后光照制备HCl
5.某100mL溶液可能含有 l 中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法正确的是
已知:
A.原溶液一定存在Na
B.原溶液中可能存在Ca2+
C.原溶液中c(Cl-)≥0.1mol/L
D.原溶液中 Cl 和的物质的量之比一定为1:1
6.下列溶液中,的物质的量浓度最大的是
A.溶液 B.溶液
C.溶液 D.溶液
7.通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列实验操作和现象或结论不正确的是
选项 实验操作和现象 结论
A 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,脱脂棉燃烧 过氧化钠与水反应放热
B 氢气在氯气中燃烧时瓶口上方出现白雾 氯化氢与空气中的水蒸气结合而呈现雾状
C 向某溶液中先加入盐酸酸化,再加入硝酸银溶液,生成白色沉淀 该溶液中一定含Cl-
D 向饱和Na2CO3溶液中通入足量的CO2气体,产生白色沉淀 NaHCO3溶解度大于Na2CO3
A.A B.B C.C D.D
8.下列说法正确的是
A.可以通过单质间的化合反应直接制取
B.工业上将通入澄清石灰水制取漂白粉
C.有很强的氧化性,在化学反应中只能作氧化剂
D.氯水能使鲜花褪色是因为有次氯酸生成
9.下列事实与所述的化学知识无关的是
选项 事实 化学知识
A 用作航天员的供氧剂 能与、反应产生
B 用小苏打作膨松剂烘焙面包 能与酸反应产生气体
C 用、漂白粉对环境消毒 含氯消毒剂具有强氧化性
D 金属钠用作传热介质 金属钠导热性好
A.A B.B C.C D.D
10.某溶液含有①②③④⑤等五种阴离子,向其中加入少量的固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化)
A.① B.①②④ C.①③⑤ D.①③④⑤
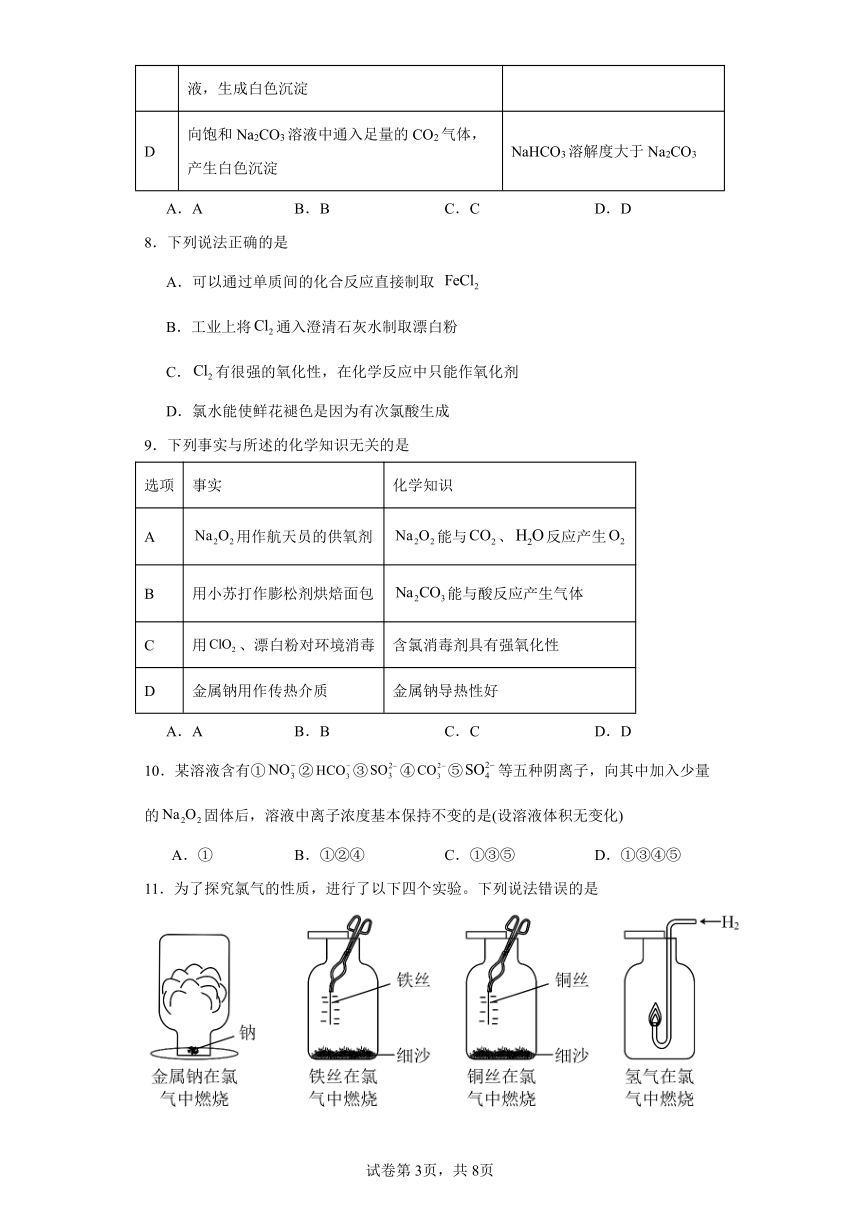
11.为了探究氯气的性质,进行了以下四个实验。下列说法错误的是
A.四个实验中氯气均表现氧化性
B.氯气是无色,有刺激性气味的气体
C.金属铁和铜在实验中均燃烧得到高价态的金属氯化物
D.氢气在氯气中燃烧,火焰呈苍白色
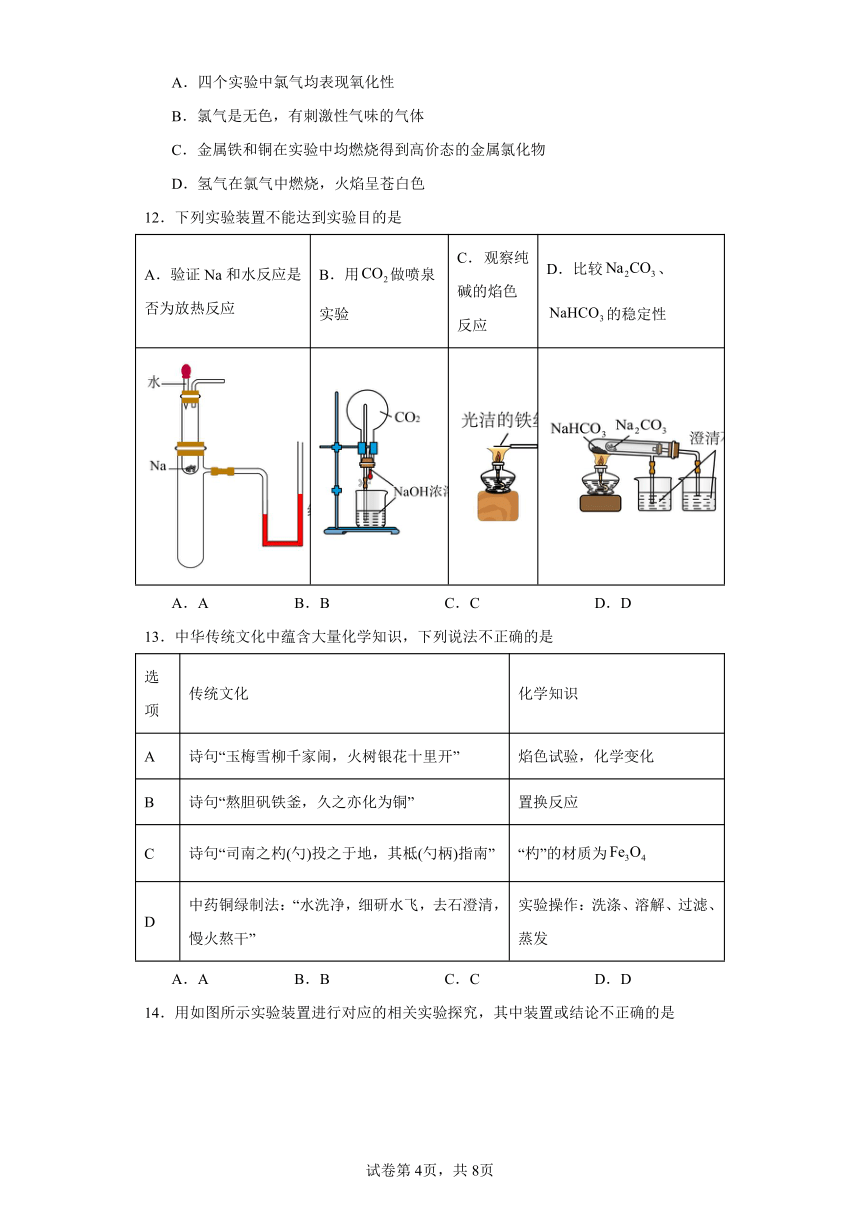
12.下列实验装置不能达到实验目的是
A.验证Na和水反应是否为放热反应 B.用做喷泉实验 C. 观察纯碱的焰色反应 D.比较、的稳定性
A.A B.B C.C D.D
13.中华传统文化中蕴含大量化学知识,下列说法不正确的是
选项 传统文化 化学知识
A 诗句“玉梅雪柳千家闹,火树银花十里开” 焰色试验,化学变化
B 诗句“熬胆矾铁釜,久之亦化为铜” 置换反应
C 诗句“司南之杓(勺)投之于地,其柢(勺柄)指南” “杓”的材质为
D 中药铜绿制法:“水洗净,细研水飞,去石澄清,慢火熬干” 实验操作:洗涤、溶解、过滤、蒸发
A.A B.B C.C D.D
14.用如图所示实验装置进行对应的相关实验探究,其中装置或结论不正确的是
A.甲:样品分别为碳酸钠和碳酸氢钠时,只有碳酸氢钠加热时澄清石灰水变浑浊,证明碳酸氢钠热稳定性弱于碳酸钠
B.乙:观察到脱脂棉燃烧,证明Na2O2与水反应放热
C.丙:观察到溶液变红,说明钠与水反应生成了碱性物质
D.丁:探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气
二、非选择题
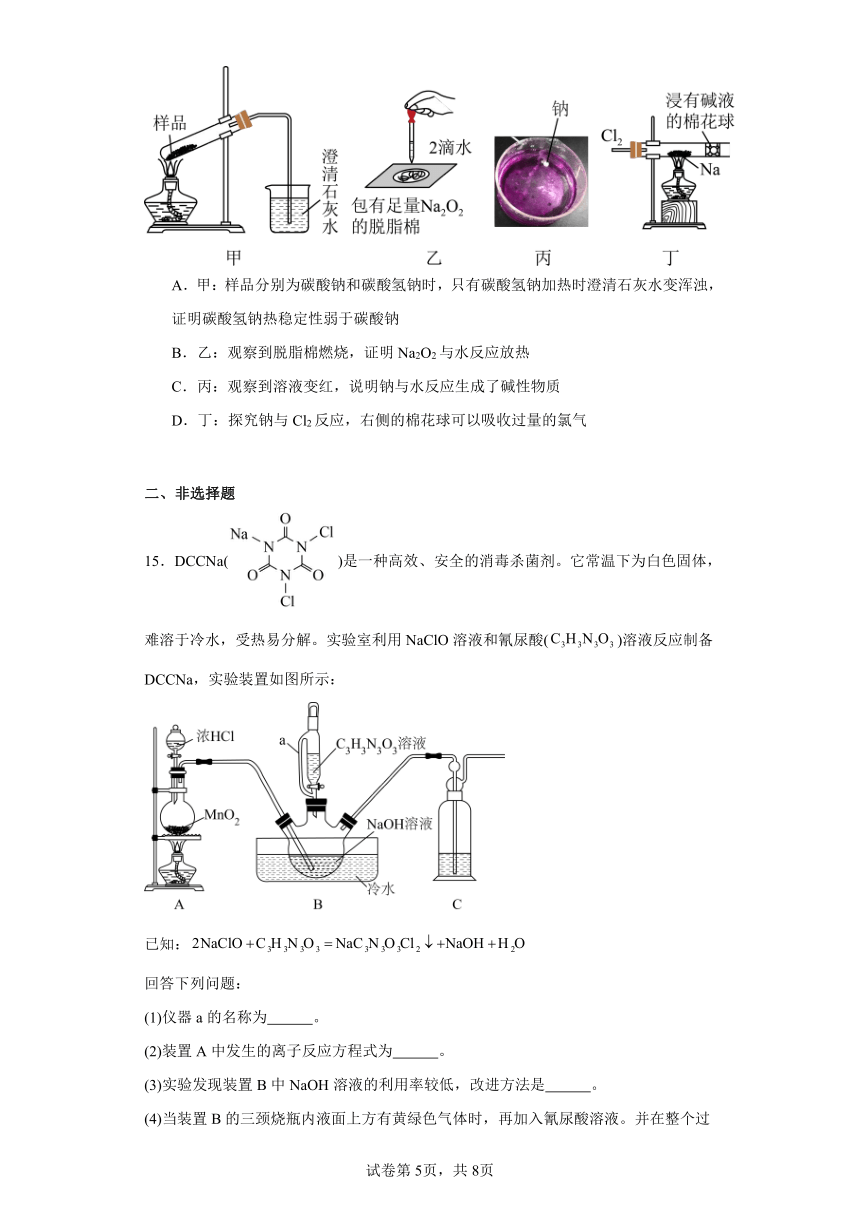
15.DCCNa()是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸()溶液反应制备DCCNa,实验装置如图所示:
已知:
回答下列问题:
(1)仪器a的名称为 。
(2)装置A中发生的离子反应方程式为 。
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是 。
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是 。
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低,在溶液中会与发生副反应生成和等,写出该副反应的化学方程式: 。
(6)装置C的试剂可选用 (填标号)。
a. b.NaCl c. d。
(7)反应结束后,装置B中的浊液经过滤、 、干燥得DCCNa粗产品。
16.化学是一门以实验为基础的学科,研究小组需要经常做实验。
I.某研究小组甲在探究Na2O2的性质实验时,发现Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性KMnO4溶液褪色,同时放出氧气。小组成员查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)Na2O2与水反应生成H2O2的反应是否属于氧化还原反应 (填是、否)。
(2)完成并配平该反应的离子方程式: 。
_______+_______H2O2+________H+=_______+_______O2↑+_______
II.某研究小组乙模拟侯德榜制碱法制取碱,流程如图:
已知:几种盐的溶解度
物质 NaCl NH4HCO3 NaHCO3 NH4Cl
溶解度 36.0 21.7 9.6 37.2
(3)“侯氏制碱法”誉满全球,其中的“碱”为 (填化学式)根据图示装置I中反应的化学方程式为 ;装置II中反应的化学方程式为 。
(4)该流程中可循环利用的物质是 (填化学式)
(5)下列选项中哪种物质可以鉴别浓度相同的Na2CO3溶液和NaHCO3溶液___________。
A.澄清石灰水 B.氢氧化钠溶液 C.稀盐酸 D.BaCl2溶液
(6)请写出(5)中能鉴别Na2CO3和NaHCO3两种物质并且能产生悬浊液的离子方程式: 。
17.在三支试管中分别加入2~3m、溶液、溶液,然后各滴入几滴溶液,观察现象;再分别滴入少量,观察现象。回答下列问题:
(1)在水中电离的电离方程式为 。
(2)①中分散质粒子直径 (填“<1nm”或“>100nm”)。
(3)常温下,饱和②溶液 (填“能”或“不能”)发生丁达尔效应。
(4)从物质的组成来看,④属于 (填“酸”、“碱”、“盐”或“氧化物”);上述标有序号的物质中,能导电的是 (填序号)。
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应,的摩尔质量为 ,该反应中,每生成0.8g,转移的电子数为 。
18.Ⅰ.利用物质的溶解度对物质进行分离、提纯。图甲、图乙所示为一些物质的溶解度随温度变化的曲线。
(1)固体中含少量NaCl,提纯固体的操作方法是加水溶解、 、 、过滤、洗涤、干燥。
(2)图乙所示为的溶解度随温度的变化曲线.常温下由稀溶液获取固体的方法是 。
Ⅱ.硫酸钠-过氧化氢加合物()的组成可通过下列实验测定:
①准确称取17.700 g样品,配制成100.00 mL溶液A
②将A两等份,取一份,加入盐酸酸化的BaCl 溶液至沉淀完全、过滤、洗涤、干燥至恒重,得到白色固体11.65 g。
③另一份加适量稀硫酸酸化后,与50 mL 0.2 mol/L 溶液恰好完全反应。
(3)已知与反应的化学方程式如下:,通过计算确定样品的组成 (写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】固体X经H2还原后得到的混合气体能使白色CuSO4变为蓝色,则说明产物中有水蒸气,即化合物X中含有O元素;最终所得固体单质呈紫红色,则该单质为Cu,说明化合物X含有Cu元素,且m(Cu)=1.28g,则2.38g X中含有Cu 1.28g÷64g/mol=0.02mol;最终所得碱性溶液的焰色反应为黄色,则说明化合物X中含有Na,该碱性溶液为NaOH,且n(NaOH)=n(HCl)=0.02mol;经H2还原后,所得固体混合物Y的成分是Cu和NaOH;综上所述,2.38g化合物X含1.28g Cu、0.02mol Na和O元素,则m(O)=2.38g-1.28g-0.02mol×23g/mol=0.64g,则n(O)=0.64g÷16g/mol=0.04mol,即2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2。
【详解】A.现象1为混合气体能使白色CuSO4变为蓝色,说明经H2还原的产物中有水蒸气,从而得出化合物X含有O元素,A正确;
B.经分析,2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2,B错误;
C.固体Y加水得紫红色的该单质为Cu,碱性溶液为NaOH溶液,故固体混合物Y的成分是Cu和NaOH,C正确;
D.化合物X中钠铜元素的化合价分别为+1、+3,D正确;
故选B。
2.C
【详解】A.黄色光会掩盖紫色光,用铂丝蘸取某溶液做焰色反应,火焰呈黄色说明溶液中一定含有钠离子,不能确定是否含有钾离子,故A错误;
B.过氧化钠与水反应生成氢氧化钠和氧气,则将过量过氧化钠加入无色酚酞溶液中,溶液会先变红后褪色,故B错误;
C.向溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀产生说明溶液中一定含有氯离子,故C正确;
D.臭氧和二氧化氮也能与碘化钾溶液反应生成使淀粉溶液变蓝色的单质碘,则某气体通入淀粉—碘化钾溶液中,溶液变蓝色不能说明该气体一定是氯气,故D错误;
故选C。
3.B
【详解】A.漂白粉其有效成分为,具有氧化性,可用作游泳池等场所的消毒剂,A正确;
B.有氧化性,可在呼吸面具或潜艇中作为氧气的来源,但不满足该性质,B错误;
C.的溶液显碱性,医疗上可用作中和胃酸,C正确;
D.有氧化性,可作为自来水的新型消毒剂,D正确。
故选B。
4.B
【详解】A.由于金属钠能与水剧烈反应生成具有可燃性的H2,故金属钠着火时,不可以用水灭火,而应该用干燥的沙土盖灭,A错误;
B.氧化钠由Na+和O2-构成,过氧化钠由Na+和构成,等物质的量的氧化钠和过氧化钠所含阳离子、阴离子个数相等,离子总数也相等,B正确;
C.Cl2能与氢氧化钠反应,碱石灰中含有氢氧化钠,不能用碱石灰干燥氯气,C错误;
D.氯气与氢气的混合气体关照时发生爆炸,应让氢气在氯气中燃烧制备HCl,D错误;
故选B。
5.C
【分析】某100mL溶液中加入BaCl2,产物的白色沉淀不溶于盐酸的是BaSO4,质量为2.33g,物质的量为0.01mol;溶于盐酸的沉淀为BaCO3,质量为1.97g,物质的量为0.01mol;加入NaOH溶液,产生的气体为NH3,物质的量为0.05mol。则原溶液中,n()=0.01mol,n()=0.01mol,n()=0.05mol,依据离子共存,溶液中不含有Ca2+,依据电荷守恒,溶液中一定含有Cl-,其物质的量≥0.01mol,可能含有Na+。
【详解】A.由分析可知,原溶液可能存在Na ,也可能不存在Na+,A不正确;
B.原溶液中存在、,则一定不存在Ca2+,B不正确;
C.原溶液中若含有Na+,c(Cl-)>0.1mol/L,若不含有Na+,c(Cl-)=0.1mol/L,C正确;
D.原溶液中n(Cl-)≥0.01mol,n()=0.01mol,则Cl 和的物质的量之比≥1:1,D不正确;
故选C。
6.C
【详解】A.溶液中的物质的量浓度为3mol/L;
B.溶液中的物质的量浓度为3mol/L
C.溶液中的物质的量浓度为4mol/L
D.溶液中的物质的量浓度为2mol/L;
的物质的量浓度最大的是溶液,选C。
7.C
【详解】A.脱脂棉燃烧说明已经具备以下条件:达到着火点和有助燃物质,达到着火点说明反应放热,助燃则说明产生氧气,A正确;
B.氢气在氯气中燃烧时瓶口上方出现白雾,是生成的氯化氢气体与空气中的水蒸气结合而呈现雾状,B正确;
C.向某溶液中先加入盐酸酸化,再加入硝酸银溶液,生成白色沉淀,白色沉淀可能是氯化银,但是加入的盐酸本身含氯离子,不能证明待测液中一定有氯离子,C错误;
向饱和Na2CO3溶液中通人足量的CO2气体,产生白色沉淀,说明溶解度大于,D正确;
故选C。
8.D
【详解】A.氯气与铁反应得到,不可以通过单质间的化合反应直接制取 ,A错误;
B.工业上将通入石灰乳制取漂白粉,B错误;
C.中氯元素为0价,处于中间价态,在化学反应中既能作氧化剂,又能作还原剂,C错误;
D.氯水中含次氯酸,次氯酸具有漂白性,能使鲜花褪色,D正确;
故选D。
9.B
【详解】A.由于Na2O2能与H2O和CO2反应产生O2来帮助人呼吸,因此可以用Na2O2作呼吸面具中的制氧剂,故A正确;
B.Na2CO3俗称纯碱,NaHCO3俗称小苏打,该物质不稳定,受热分解产生CO2气体,可以使面团松软,因此可用小苏打作发泡剂烘焙面包,故B错误;
C.含氯消毒剂具有强氧化性,所以用、漂白粉进行环境消毒,故C正确;
D.金属钠具有良好的导热性,可用作传热介质,故D正确;
故选B。
10.A
【详解】Na2O2与水反应生成氢氧化钠,溶液呈碱性,与OH-反应生成,则离子浓度减小,离子浓度增大;Na2O2具有强氧化性,将氧化为,则离子浓度减小,浓度增大;浓度基本不变。故选:A。
11.B
【详解】A.四个实验中氯元素的化合价均由0价变成-1价,被还原,体现出氧化性,A项正确;
B.氯气是黄绿色,有刺激性气味的气体,B项错误;
C.氯气具有强氧化性,会将变价金属氧化成高价态,C项正确;
D.氢气在氯气中燃烧,火焰呈苍白色,D项正确;
故选B。
12.D
【详解】A.Na与水反应若是放热反应,大试管内气体温度升高压强增大,右侧导管中红墨水左低右高,可观察红墨水的高低变化验证钠与水反应是否放热,A正确;
B.二氧化碳能与浓NaOH溶液反应而被大量吸收,烧瓶中压强突然减小,形成喷泉,B正确;
C.铁没有焰色反应,可用光洁的铁丝蘸取纯碱溶液灼烧观察纯碱的焰色反应,C正确;
D.比较碳酸钠和碳酸氢钠的稳定性,外试管中放碳酸钠,内试管中放碳酸氢钠,D错误;
故答案选D。
13.A
【详解】A.焰色试验是物理变化,A错误;
B.铁与硫酸铜反应是置换反应,铁置换铜,B正确;
C.司南即磁铁,成分是Fe3O4,C正确;
D.中药铜绿制法:“水洗净,细研水飞,去石澄清,慢火熬干”,涉及到的操作有洗涤、溶解、过滤、蒸发,D正确;
答案选A。
14.A
【详解】A.加热固体,为防止生成的水倒流,试管口应向下倾斜,A错误;
B.过氧化钠与水反应生成氧气,棉花着火,说明温度升高达到了棉花的着火点,所以证明放出大量的热,B正确;
C.钠与滴有酚酞的水反应,观察到溶液变红,说明钠与水反应生成了碱性物质,C正确;
D.钠与氯气加热生成氯化钠,碱液可吸收过量的氯气,图中装置可验证钠与氯气的反应,D正确;
故选A。
15.(1)恒压分液(滴液)漏斗
(2)
(3)在A、B装置间加饱和食盐水洗气瓶洗气
(4)使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率
(5)
(6)ac
(7)冰(冷)水洗涤
【分析】A装置用于制取氯气,生成的氯气进入B中与NaOH溶液反应生成次氯酸钠,NaClO溶液中滴加氰尿酸(C3H3N3O3)溶液,反应生成DCCNa,过量的氯气进入C中用NaOH等溶液吸收,防止污染环境,据此分析解答。
【详解】(1)由仪器构造可知a为恒压分液(滴液)漏斗;
(2)装置A中发生的离子反应方程式为:
(3)装置A中制备的氯气会混有氯化氢气体,与氢氧化钠发生反应从而造成NaOH溶液的利用率较低,所以改进方法是在A、B装置间加饱和食盐水洗气瓶洗气,以除去氯化氢气体;
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,可使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率;
(5)副反应为C3H3N3O3与氯气发生反应生成NCl3和CO2该副反应的化学方程式:;
(6)装置C的目的吸收氯气,防止污染环境,则ac均能与氯气反应吸收氯气,故选ac;
(7)装置B中的浊液经过滤、冰(冷)水洗涤、干燥得DCCNa粗产品。
16.(1)否
(2)2+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3) Na2CO3 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+H2O+CO2↑
(4)NaCl和CO2
(5)CD
(6)Ba2++=BaCO3↓
【详解】(1)过氧化钠与水反应生成过氧化氢和氢氧化钠,方程式为:,不属于氧化还原反应。
(2)反应中锰元素化合价降低5价,过氧化氢中的氧元素化合价升高1价,配平后的离子方程式为:。
(3)侯氏制碱法是向饱和氯化钠溶液中先通入氨气,再通入二氧化碳生成碳酸氢钠沉淀,过滤得到碳酸氢钠热分解生成碳酸钠和二氧化碳;在母液中含有大量的铵根和氯离子,氯化铵存在溶解平衡,增大氯离子和铵根离子浓度有利于氯化铵沉淀。侯氏制碱法的“碱”指Na2CO3,装置I中反应的化学方程式为:。装置II中碳酸氢钠加热分解,化学方程式为:。
(4)装置II中分解产生的CO2可循环利用加入装置I中,母液沉淀出氯化铵后溶液中的NaCl可循环进入装置I。
(5)A. 澄清石灰水与二者均反应产生白色沉淀,A不能鉴别;
B. 氢氧化钠溶液与碳酸氢钠反应生成碳酸钠,但无明显实验现象,B不能鉴别;
C. 稀盐酸滴入碳酸钠溶液中开始没有气泡,一段时间后产生气泡,滴入碳酸氢钠溶液中立即产生气泡,C可鉴别;
D. 氯化钡溶液与碳酸钠反应产生白色沉淀,与碳酸氢钠不反应,D可以鉴别;
答案选CD。
(6)氯化钡溶液与碳酸钠反应生成氯化钠和碳酸钡,离子方程式为:。
17.(1)
(2)<1nm
(3)不能
(4) 盐 ①⑤
(5) 80 0.08
【详解】(1)是强电解质,在水中完全电离,电离方程式:;
(2)稀盐酸属于溶液,分散质粒子直径大小小于1nm;
(3)饱和氯化钠溶液不是胶体,不能发生丁达尔效应;
(4)从物质组成来看,硝酸银属于盐;题干中,能导电的物质:稀盐酸和稀硝酸;
(5)的摩尔质量数值大小等于其相对分子质量:;该反应中,每生成0.8g,对应物质的量:0.01mol,则转移的电子数:0.08mol,即0.08。
18.(1) 蒸发浓缩 冷却结晶
(2)加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
(3)
【详解】(1)由图甲可知,KNO3的溶解度受温度影响较大,而NaCl的溶解度受温度的影响较小,则提纯含少量NaCl的KNO3固体的操作方法是:将固体加水溶解,所得溶液蒸发浓缩至出现晶膜,停止加热,形成KNO3的饱和溶液,冷却结晶后有KNO3固体析出,而NaCl不析出,经过滤、洗涤、干燥可得较纯净的KNO3固体,故答案为:蒸发浓缩;冷却结晶。
(2)由图乙可知,温度高于34℃时,Na2SO3的溶解度较小,有利于析出Na2SO3,因此常温下由Na2SO3稀溶液获取Na2SO3固体的方法是:加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,故答案为:加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。
(3)n(Na2SO4)=n(BaSO4)==0.05mol,根据H2O2与KMnO4反应的化学方程式可知,n(H2O2)=×0.2mol/L×0.05L=0.025mol,于是有m(Na2SO4)=0.05mol×142g/mol=7.1g,m(H2O2)=0.025mol×34g/mol=0.85g, 则n(H2O)==0.05mol,所以x:y:z=n(Na2SO4):n(H2O2):n(H2O)=0.05mol:0.025mol:0.05mol=2:1:2,硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O,故答案为:2Na2SO4·H2O2·2H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.固体化合物X由3种元素组成。某学习小组进行了如下实验:
下列推既不正确的是
A.由现象1得出化合物X含有O元素
B.X的化学式Na2CuO2
C.固体混合物Y的成分是Cu和NaOH
D.化合物X中两金属元素的化合价不同
2.下列实验操作、现象及实验结论相对应且正确的是
实验操作 现象 实验结论
A 用铂丝蘸取某溶液做焰色反应 火焰呈黄色 溶液中一定不含K+
B 将过量加入无色酚酞溶液中 酚酞变红后不褪色 生成了碱性物质
C 向某溶液中加入酸化的溶液 有白色沉淀产生 溶液中含有
D 某气体通入淀粉-溶液中 溶液变蓝 该气体一定为
A.A B.B C.C D.D
3.下列物质性质与用途对应关系错误的是
A.漂白粉其有效成分为,具有氧化性,可用作游泳池等场所的消毒剂
B.和均有氧化性,可在呼吸面具或潜艇中作为氧气的来源
C.的溶液显碱性,医疗上可用作中和胃酸
D.有氧化性,可作为自来水的新型消毒剂
4.下列说法正确的是
A.金属钠着火时用水扑灭
B.等物质的量的Na2O和Na2O2所含离子总数相等
C.可利用碱石灰干燥Cl2
D.将氯气与氢气混合后光照制备HCl
5.某100mL溶液可能含有 l 中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法正确的是
已知:
A.原溶液一定存在Na
B.原溶液中可能存在Ca2+
C.原溶液中c(Cl-)≥0.1mol/L
D.原溶液中 Cl 和的物质的量之比一定为1:1
6.下列溶液中,的物质的量浓度最大的是
A.溶液 B.溶液
C.溶液 D.溶液
7.通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列实验操作和现象或结论不正确的是
选项 实验操作和现象 结论
A 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,脱脂棉燃烧 过氧化钠与水反应放热
B 氢气在氯气中燃烧时瓶口上方出现白雾 氯化氢与空气中的水蒸气结合而呈现雾状
C 向某溶液中先加入盐酸酸化,再加入硝酸银溶液,生成白色沉淀 该溶液中一定含Cl-
D 向饱和Na2CO3溶液中通入足量的CO2气体,产生白色沉淀 NaHCO3溶解度大于Na2CO3
A.A B.B C.C D.D
8.下列说法正确的是
A.可以通过单质间的化合反应直接制取
B.工业上将通入澄清石灰水制取漂白粉
C.有很强的氧化性,在化学反应中只能作氧化剂
D.氯水能使鲜花褪色是因为有次氯酸生成
9.下列事实与所述的化学知识无关的是
选项 事实 化学知识
A 用作航天员的供氧剂 能与、反应产生
B 用小苏打作膨松剂烘焙面包 能与酸反应产生气体
C 用、漂白粉对环境消毒 含氯消毒剂具有强氧化性
D 金属钠用作传热介质 金属钠导热性好
A.A B.B C.C D.D
10.某溶液含有①②③④⑤等五种阴离子,向其中加入少量的固体后,溶液中离子浓度基本保持不变的是(设溶液体积无变化)
A.① B.①②④ C.①③⑤ D.①③④⑤
11.为了探究氯气的性质,进行了以下四个实验。下列说法错误的是
A.四个实验中氯气均表现氧化性
B.氯气是无色,有刺激性气味的气体
C.金属铁和铜在实验中均燃烧得到高价态的金属氯化物
D.氢气在氯气中燃烧,火焰呈苍白色
12.下列实验装置不能达到实验目的是
A.验证Na和水反应是否为放热反应 B.用做喷泉实验 C. 观察纯碱的焰色反应 D.比较、的稳定性
A.A B.B C.C D.D
13.中华传统文化中蕴含大量化学知识,下列说法不正确的是
选项 传统文化 化学知识
A 诗句“玉梅雪柳千家闹,火树银花十里开” 焰色试验,化学变化
B 诗句“熬胆矾铁釜,久之亦化为铜” 置换反应
C 诗句“司南之杓(勺)投之于地,其柢(勺柄)指南” “杓”的材质为
D 中药铜绿制法:“水洗净,细研水飞,去石澄清,慢火熬干” 实验操作:洗涤、溶解、过滤、蒸发
A.A B.B C.C D.D
14.用如图所示实验装置进行对应的相关实验探究,其中装置或结论不正确的是
A.甲:样品分别为碳酸钠和碳酸氢钠时,只有碳酸氢钠加热时澄清石灰水变浑浊,证明碳酸氢钠热稳定性弱于碳酸钠
B.乙:观察到脱脂棉燃烧,证明Na2O2与水反应放热
C.丙:观察到溶液变红,说明钠与水反应生成了碱性物质
D.丁:探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气
二、非选择题
15.DCCNa()是一种高效、安全的消毒杀菌剂。它常温下为白色固体,难溶于冷水,受热易分解。实验室利用NaClO溶液和氰尿酸()溶液反应制备DCCNa,实验装置如图所示:
已知:
回答下列问题:
(1)仪器a的名称为 。
(2)装置A中发生的离子反应方程式为 。
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是 。
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,其原因是 。
(5)实验过程中B的温度必须保持为7~12℃,pH控制在6.5~8.5的范围。若温度过高,pH过低,在溶液中会与发生副反应生成和等,写出该副反应的化学方程式: 。
(6)装置C的试剂可选用 (填标号)。
a. b.NaCl c. d。
(7)反应结束后,装置B中的浊液经过滤、 、干燥得DCCNa粗产品。
16.化学是一门以实验为基础的学科,研究小组需要经常做实验。
I.某研究小组甲在探究Na2O2的性质实验时,发现Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液M。溶液M可使酸性KMnO4溶液褪色,同时放出氧气。小组成员查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)Na2O2与水反应生成H2O2的反应是否属于氧化还原反应 (填是、否)。
(2)完成并配平该反应的离子方程式: 。
_______+_______H2O2+________H+=_______+_______O2↑+_______
II.某研究小组乙模拟侯德榜制碱法制取碱,流程如图:
已知:几种盐的溶解度
物质 NaCl NH4HCO3 NaHCO3 NH4Cl
溶解度 36.0 21.7 9.6 37.2
(3)“侯氏制碱法”誉满全球,其中的“碱”为 (填化学式)根据图示装置I中反应的化学方程式为 ;装置II中反应的化学方程式为 。
(4)该流程中可循环利用的物质是 (填化学式)
(5)下列选项中哪种物质可以鉴别浓度相同的Na2CO3溶液和NaHCO3溶液___________。
A.澄清石灰水 B.氢氧化钠溶液 C.稀盐酸 D.BaCl2溶液
(6)请写出(5)中能鉴别Na2CO3和NaHCO3两种物质并且能产生悬浊液的离子方程式: 。
17.在三支试管中分别加入2~3m、溶液、溶液,然后各滴入几滴溶液,观察现象;再分别滴入少量,观察现象。回答下列问题:
(1)在水中电离的电离方程式为 。
(2)①中分散质粒子直径 (填“<1nm”或“>100nm”)。
(3)常温下,饱和②溶液 (填“能”或“不能”)发生丁达尔效应。
(4)从物质的组成来看,④属于 (填“酸”、“碱”、“盐”或“氧化物”);上述标有序号的物质中,能导电的是 (填序号)。
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应,的摩尔质量为 ,该反应中,每生成0.8g,转移的电子数为 。
18.Ⅰ.利用物质的溶解度对物质进行分离、提纯。图甲、图乙所示为一些物质的溶解度随温度变化的曲线。
(1)固体中含少量NaCl,提纯固体的操作方法是加水溶解、 、 、过滤、洗涤、干燥。
(2)图乙所示为的溶解度随温度的变化曲线.常温下由稀溶液获取固体的方法是 。
Ⅱ.硫酸钠-过氧化氢加合物()的组成可通过下列实验测定:
①准确称取17.700 g样品,配制成100.00 mL溶液A
②将A两等份,取一份,加入盐酸酸化的BaCl 溶液至沉淀完全、过滤、洗涤、干燥至恒重,得到白色固体11.65 g。
③另一份加适量稀硫酸酸化后,与50 mL 0.2 mol/L 溶液恰好完全反应。
(3)已知与反应的化学方程式如下:,通过计算确定样品的组成 (写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】固体X经H2还原后得到的混合气体能使白色CuSO4变为蓝色,则说明产物中有水蒸气,即化合物X中含有O元素;最终所得固体单质呈紫红色,则该单质为Cu,说明化合物X含有Cu元素,且m(Cu)=1.28g,则2.38g X中含有Cu 1.28g÷64g/mol=0.02mol;最终所得碱性溶液的焰色反应为黄色,则说明化合物X中含有Na,该碱性溶液为NaOH,且n(NaOH)=n(HCl)=0.02mol;经H2还原后,所得固体混合物Y的成分是Cu和NaOH;综上所述,2.38g化合物X含1.28g Cu、0.02mol Na和O元素,则m(O)=2.38g-1.28g-0.02mol×23g/mol=0.64g,则n(O)=0.64g÷16g/mol=0.04mol,即2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2。
【详解】A.现象1为混合气体能使白色CuSO4变为蓝色,说明经H2还原的产物中有水蒸气,从而得出化合物X含有O元素,A正确;
B.经分析,2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2,B错误;
C.固体Y加水得紫红色的该单质为Cu,碱性溶液为NaOH溶液,故固体混合物Y的成分是Cu和NaOH,C正确;
D.化合物X中钠铜元素的化合价分别为+1、+3,D正确;
故选B。
2.C
【详解】A.黄色光会掩盖紫色光,用铂丝蘸取某溶液做焰色反应,火焰呈黄色说明溶液中一定含有钠离子,不能确定是否含有钾离子,故A错误;
B.过氧化钠与水反应生成氢氧化钠和氧气,则将过量过氧化钠加入无色酚酞溶液中,溶液会先变红后褪色,故B错误;
C.向溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀产生说明溶液中一定含有氯离子,故C正确;
D.臭氧和二氧化氮也能与碘化钾溶液反应生成使淀粉溶液变蓝色的单质碘,则某气体通入淀粉—碘化钾溶液中,溶液变蓝色不能说明该气体一定是氯气,故D错误;
故选C。
3.B
【详解】A.漂白粉其有效成分为,具有氧化性,可用作游泳池等场所的消毒剂,A正确;
B.有氧化性,可在呼吸面具或潜艇中作为氧气的来源,但不满足该性质,B错误;
C.的溶液显碱性,医疗上可用作中和胃酸,C正确;
D.有氧化性,可作为自来水的新型消毒剂,D正确。
故选B。
4.B
【详解】A.由于金属钠能与水剧烈反应生成具有可燃性的H2,故金属钠着火时,不可以用水灭火,而应该用干燥的沙土盖灭,A错误;
B.氧化钠由Na+和O2-构成,过氧化钠由Na+和构成,等物质的量的氧化钠和过氧化钠所含阳离子、阴离子个数相等,离子总数也相等,B正确;
C.Cl2能与氢氧化钠反应,碱石灰中含有氢氧化钠,不能用碱石灰干燥氯气,C错误;
D.氯气与氢气的混合气体关照时发生爆炸,应让氢气在氯气中燃烧制备HCl,D错误;
故选B。
5.C
【分析】某100mL溶液中加入BaCl2,产物的白色沉淀不溶于盐酸的是BaSO4,质量为2.33g,物质的量为0.01mol;溶于盐酸的沉淀为BaCO3,质量为1.97g,物质的量为0.01mol;加入NaOH溶液,产生的气体为NH3,物质的量为0.05mol。则原溶液中,n()=0.01mol,n()=0.01mol,n()=0.05mol,依据离子共存,溶液中不含有Ca2+,依据电荷守恒,溶液中一定含有Cl-,其物质的量≥0.01mol,可能含有Na+。
【详解】A.由分析可知,原溶液可能存在Na ,也可能不存在Na+,A不正确;
B.原溶液中存在、,则一定不存在Ca2+,B不正确;
C.原溶液中若含有Na+,c(Cl-)>0.1mol/L,若不含有Na+,c(Cl-)=0.1mol/L,C正确;
D.原溶液中n(Cl-)≥0.01mol,n()=0.01mol,则Cl 和的物质的量之比≥1:1,D不正确;
故选C。
6.C
【详解】A.溶液中的物质的量浓度为3mol/L;
B.溶液中的物质的量浓度为3mol/L
C.溶液中的物质的量浓度为4mol/L
D.溶液中的物质的量浓度为2mol/L;
的物质的量浓度最大的是溶液,选C。
7.C
【详解】A.脱脂棉燃烧说明已经具备以下条件:达到着火点和有助燃物质,达到着火点说明反应放热,助燃则说明产生氧气,A正确;
B.氢气在氯气中燃烧时瓶口上方出现白雾,是生成的氯化氢气体与空气中的水蒸气结合而呈现雾状,B正确;
C.向某溶液中先加入盐酸酸化,再加入硝酸银溶液,生成白色沉淀,白色沉淀可能是氯化银,但是加入的盐酸本身含氯离子,不能证明待测液中一定有氯离子,C错误;
向饱和Na2CO3溶液中通人足量的CO2气体,产生白色沉淀,说明溶解度大于,D正确;
故选C。
8.D
【详解】A.氯气与铁反应得到,不可以通过单质间的化合反应直接制取 ,A错误;
B.工业上将通入石灰乳制取漂白粉,B错误;
C.中氯元素为0价,处于中间价态,在化学反应中既能作氧化剂,又能作还原剂,C错误;
D.氯水中含次氯酸,次氯酸具有漂白性,能使鲜花褪色,D正确;
故选D。
9.B
【详解】A.由于Na2O2能与H2O和CO2反应产生O2来帮助人呼吸,因此可以用Na2O2作呼吸面具中的制氧剂,故A正确;
B.Na2CO3俗称纯碱,NaHCO3俗称小苏打,该物质不稳定,受热分解产生CO2气体,可以使面团松软,因此可用小苏打作发泡剂烘焙面包,故B错误;
C.含氯消毒剂具有强氧化性,所以用、漂白粉进行环境消毒,故C正确;
D.金属钠具有良好的导热性,可用作传热介质,故D正确;
故选B。
10.A
【详解】Na2O2与水反应生成氢氧化钠,溶液呈碱性,与OH-反应生成,则离子浓度减小,离子浓度增大;Na2O2具有强氧化性,将氧化为,则离子浓度减小,浓度增大;浓度基本不变。故选:A。
11.B
【详解】A.四个实验中氯元素的化合价均由0价变成-1价,被还原,体现出氧化性,A项正确;
B.氯气是黄绿色,有刺激性气味的气体,B项错误;
C.氯气具有强氧化性,会将变价金属氧化成高价态,C项正确;
D.氢气在氯气中燃烧,火焰呈苍白色,D项正确;
故选B。
12.D
【详解】A.Na与水反应若是放热反应,大试管内气体温度升高压强增大,右侧导管中红墨水左低右高,可观察红墨水的高低变化验证钠与水反应是否放热,A正确;
B.二氧化碳能与浓NaOH溶液反应而被大量吸收,烧瓶中压强突然减小,形成喷泉,B正确;
C.铁没有焰色反应,可用光洁的铁丝蘸取纯碱溶液灼烧观察纯碱的焰色反应,C正确;
D.比较碳酸钠和碳酸氢钠的稳定性,外试管中放碳酸钠,内试管中放碳酸氢钠,D错误;
故答案选D。
13.A
【详解】A.焰色试验是物理变化,A错误;
B.铁与硫酸铜反应是置换反应,铁置换铜,B正确;
C.司南即磁铁,成分是Fe3O4,C正确;
D.中药铜绿制法:“水洗净,细研水飞,去石澄清,慢火熬干”,涉及到的操作有洗涤、溶解、过滤、蒸发,D正确;
答案选A。
14.A
【详解】A.加热固体,为防止生成的水倒流,试管口应向下倾斜,A错误;
B.过氧化钠与水反应生成氧气,棉花着火,说明温度升高达到了棉花的着火点,所以证明放出大量的热,B正确;
C.钠与滴有酚酞的水反应,观察到溶液变红,说明钠与水反应生成了碱性物质,C正确;
D.钠与氯气加热生成氯化钠,碱液可吸收过量的氯气,图中装置可验证钠与氯气的反应,D正确;
故选A。
15.(1)恒压分液(滴液)漏斗
(2)
(3)在A、B装置间加饱和食盐水洗气瓶洗气
(4)使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率
(5)
(6)ac
(7)冰(冷)水洗涤
【分析】A装置用于制取氯气,生成的氯气进入B中与NaOH溶液反应生成次氯酸钠,NaClO溶液中滴加氰尿酸(C3H3N3O3)溶液,反应生成DCCNa,过量的氯气进入C中用NaOH等溶液吸收,防止污染环境,据此分析解答。
【详解】(1)由仪器构造可知a为恒压分液(滴液)漏斗;
(2)装置A中发生的离子反应方程式为:
(3)装置A中制备的氯气会混有氯化氢气体,与氢氧化钠发生反应从而造成NaOH溶液的利用率较低,所以改进方法是在A、B装置间加饱和食盐水洗气瓶洗气,以除去氯化氢气体;
(4)当装置B的三颈烧瓶内液面上方有黄绿色气体时,再加入氰尿酸溶液。并在整个过程中不断通入一定量的氯气,可使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率;
(5)副反应为C3H3N3O3与氯气发生反应生成NCl3和CO2该副反应的化学方程式:;
(6)装置C的目的吸收氯气,防止污染环境,则ac均能与氯气反应吸收氯气,故选ac;
(7)装置B中的浊液经过滤、冰(冷)水洗涤、干燥得DCCNa粗产品。
16.(1)否
(2)2+5H2O2+6H+=2Mn2++5O2↑+8H2O
(3) Na2CO3 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+H2O+CO2↑
(4)NaCl和CO2
(5)CD
(6)Ba2++=BaCO3↓
【详解】(1)过氧化钠与水反应生成过氧化氢和氢氧化钠,方程式为:,不属于氧化还原反应。
(2)反应中锰元素化合价降低5价,过氧化氢中的氧元素化合价升高1价,配平后的离子方程式为:。
(3)侯氏制碱法是向饱和氯化钠溶液中先通入氨气,再通入二氧化碳生成碳酸氢钠沉淀,过滤得到碳酸氢钠热分解生成碳酸钠和二氧化碳;在母液中含有大量的铵根和氯离子,氯化铵存在溶解平衡,增大氯离子和铵根离子浓度有利于氯化铵沉淀。侯氏制碱法的“碱”指Na2CO3,装置I中反应的化学方程式为:。装置II中碳酸氢钠加热分解,化学方程式为:。
(4)装置II中分解产生的CO2可循环利用加入装置I中,母液沉淀出氯化铵后溶液中的NaCl可循环进入装置I。
(5)A. 澄清石灰水与二者均反应产生白色沉淀,A不能鉴别;
B. 氢氧化钠溶液与碳酸氢钠反应生成碳酸钠,但无明显实验现象,B不能鉴别;
C. 稀盐酸滴入碳酸钠溶液中开始没有气泡,一段时间后产生气泡,滴入碳酸氢钠溶液中立即产生气泡,C可鉴别;
D. 氯化钡溶液与碳酸钠反应产生白色沉淀,与碳酸氢钠不反应,D可以鉴别;
答案选CD。
(6)氯化钡溶液与碳酸钠反应生成氯化钠和碳酸钡,离子方程式为:。
17.(1)
(2)<1nm
(3)不能
(4) 盐 ①⑤
(5) 80 0.08
【详解】(1)是强电解质,在水中完全电离,电离方程式:;
(2)稀盐酸属于溶液,分散质粒子直径大小小于1nm;
(3)饱和氯化钠溶液不是胶体,不能发生丁达尔效应;
(4)从物质组成来看,硝酸银属于盐;题干中,能导电的物质:稀盐酸和稀硝酸;
(5)的摩尔质量数值大小等于其相对分子质量:;该反应中,每生成0.8g,对应物质的量:0.01mol,则转移的电子数:0.08mol,即0.08。
18.(1) 蒸发浓缩 冷却结晶
(2)加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤
(3)
【详解】(1)由图甲可知,KNO3的溶解度受温度影响较大,而NaCl的溶解度受温度的影响较小,则提纯含少量NaCl的KNO3固体的操作方法是:将固体加水溶解,所得溶液蒸发浓缩至出现晶膜,停止加热,形成KNO3的饱和溶液,冷却结晶后有KNO3固体析出,而NaCl不析出,经过滤、洗涤、干燥可得较纯净的KNO3固体,故答案为:蒸发浓缩;冷却结晶。
(2)由图乙可知,温度高于34℃时,Na2SO3的溶解度较小,有利于析出Na2SO3,因此常温下由Na2SO3稀溶液获取Na2SO3固体的方法是:加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,故答案为:加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。
(3)n(Na2SO4)=n(BaSO4)==0.05mol,根据H2O2与KMnO4反应的化学方程式可知,n(H2O2)=×0.2mol/L×0.05L=0.025mol,于是有m(Na2SO4)=0.05mol×142g/mol=7.1g,m(H2O2)=0.025mol×34g/mol=0.85g, 则n(H2O)==0.05mol,所以x:y:z=n(Na2SO4):n(H2O2):n(H2O)=0.05mol:0.025mol:0.05mol=2:1:2,硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O,故答案为:2Na2SO4·H2O2·2H2O。
答案第1页,共2页
答案第1页,共2页
