初中化学人教版九年级上册第二单元 我们周围的空气课题1 空气 课件(共15张PPT)
文档属性
| 名称 | 初中化学人教版九年级上册第二单元 我们周围的空气课题1 空气 课件(共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 10:53:10 | ||
图片预览





文档简介
(共15张PPT)
第二单元 我们周围的空气
课题1空气(第1课时)
教学目标
1.了解空气的主要成分,认识空气对人类生活的重要作用。(重点)
2.掌握测定空气中氧气含量的方法及原理。(重难点)
3.初步认识纯净物和混合物的概念,学会区分纯净物与混合物。(重难点)
趣味实验 “瓶吞鸡蛋”
一.导入新课
【问题1】同学们能用化学知识解释出现这些现象的原因吗?
17世纪波义耳提出空气有一些活性物质。给人们启发,空气中含有两种截然不同的物质
1674年梅奥利用如图的装置证明空气的组成,是复杂的,空气至少包括两种成分的结论。
1703年,英国人史塔尔提出了“燃素说”他认为,
一切燃烧现象都是物体吸收和逸出燃素的过程,
煅烧金属燃素被释放出来,金属就变成了灰渣。
舍勒在1773年用多种方法制作比较纯净的氧气,但是他把这种气体叫做火气,并通过白磷燃烧测出火气占空气体积的1/5。
空气成分发现史
1771年,普里斯特林发现植物把二氧化碳转化为氧气,但是他不知道这是一种新元素的气体,把氧气称为脱燃素气。
1772年卢瑟福发现了氮气
1772年,法国化学家拉瓦锡推翻燃素说
1777年正式把这种气体命名为氧气。
1868年法国天文学家严森发现了氦
1892年英国物理学家雷利和英国化学家拉姆塞发现了氩。
1898年拉姆塞发现了氖.氪和氙
1990年德国物理学教授道恩发现了氡
空气成分发现史
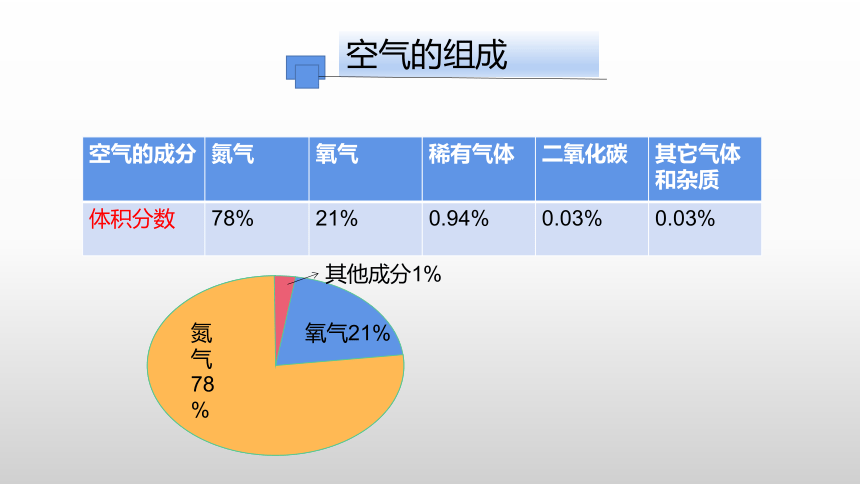
空气的组成
空气的成分 氮气 氧气 稀有气体 二氧化碳 其它气体和杂质
体积分数 78% 21% 0.94% 0.03% 0.03%
氮气
78%
氧气21%
其他成分1%
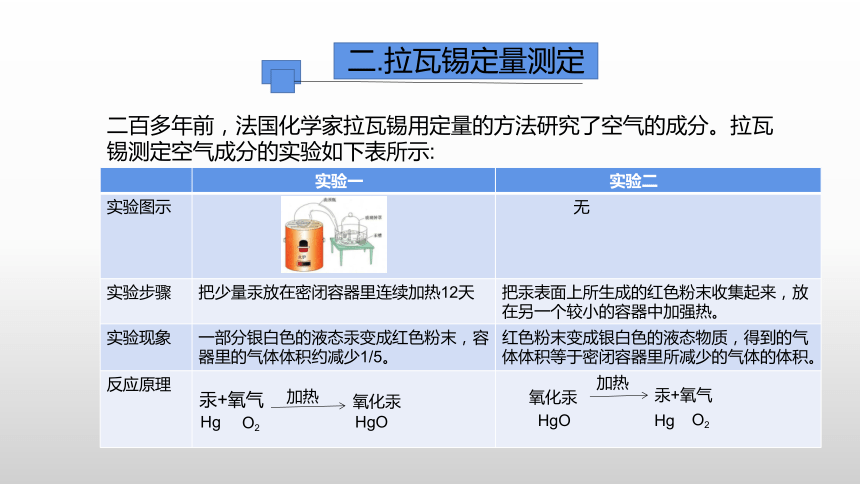
二.拉瓦锡定量测定
二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。拉瓦锡测定空气成分的实验如下表所示:
实验一 实验二
实验图示 无
实验步骤 把少量汞放在密闭容器里连续加热12天 把汞表面上所生成的红色粉末收集起来,放在另一个较小的容器中加强热。
实验现象 一部分银白色的液态汞变成红色粉末,容器里的气体体积约减少1/5。 红色粉末变成银白色的液态物质,得到的气体体积等于密闭容器里所减少的气体的体积。
反应原理
汞+氧气
加热
氧化汞
Hg
O2
HgO
加热
氧化汞
汞+氧气
HgO
O2
Hg
拉瓦锡定量测定
二.拉瓦锡定量测定
实 验 一 实 验 二
实验结论 剩余的4/5体积的气体既不能供给呼吸,也不能支持燃烧。他认为这些气体都是氮气。 氧化汞加热分解生成的氧气的体积恰好等于密闭容器里所减少的气体的体积。
总的结论 空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。 【问题2】拉瓦锡得到什么结论呢?
【问题3】拉瓦锡选择汞做实验的优缺点?
汞+氧气
加热
氧化汞
Hg
O2
HgO
优:在空气中能反应且只与空气中的氧气反应;汞反应后的生成物为固体,所占的空间体积可忽略不计
缺:汞有毒,容易污染空气
三.空气中氧气含量的测定
(2)实验装置如图
(3)实验步骤:
①连接装置并检查装置的气密性;
②先在集气瓶内加少量水,并做上记号,将水面上方的空间分成5份;
③关闭弹簧夹,点燃红磷,迅速伸入集气瓶,立即塞紧橡塞;
④燃烧结束后,冷却到室温,打开弹簧夹。
红磷在集气瓶内燃烧,放出热量,产生大量白烟;冷却至室温后打开弹簧夹,水沿导管进入集气瓶,进入集气瓶内的水的体积约占集气瓶内原有空气总体积的1/5
空气中氧气的体积约占空气总体积的1/5。
(1)实验原理
(4)实验现象:
(5)实验结论:
:红磷+氧气
点燃
五氧化二磷
4P+
5O2
2P2O5
点燃
【问题4】红磷在瓶中燃烧,消耗了什么气体
【问题5】为什么要求红磷过量,剩余的红磷未
全部燃烧说明了什么
【问题6】剩余气体是什么气体
【问题7】插人一根燃着的木条有何现象?
【问题8】瓶中剩余气体是氧气吗
[问题9]为什么瓶中只能进入约为容积五分之一
的水?说明了什么
【问题10】氮气有何性质
【问题11】某学生实验,发现集气瓶中的水不足五分
之一,原因可能是什么?
三.空气中氧气含量的测定
红磷的量不足(或装置气密性不好,或
未等装置冷却到室温就打开弹簧夹)
不溶于水物理性质和不能燃烧,也不支持燃烧的化学性质
【问题12】为什么使用红磷?
【问题13】能否改用木炭,硫,铁,镁带?
【问题14】如果只用木炭,该如何改进?
三.空气中氧气含量的测定
氢氧化钠溶液
二氧化碳+氢氧化钠
碳酸钠+水
木炭
四.知识拓展
【问题15】你还能设计什么物质燃烧实验,测定空气中氧气的体积分数呢
【问题16】我们还有什么设计实验装置图呢?
【问题17】设计实验装置图有什么优点?
【问题18】空气的成分及其含量是什么?
【问题19】空气属于混合物还是纯净物?
请同学们阅读27页课本内容回答问题
五.学习混合物和纯净物
从组成上比较下列物质并分类
空气 氧气 食盐水 蒸馏水(纯水)
由两种或两种以上物质混合而成的
混合物
只由一种物质组成的
纯净物
六.课堂总结
一.趣味实验 “瓶吞鸡蛋”
二.拉瓦锡定量测定
三.空气中氧气含量的测定
四.知识拓展
五.学习混合物和纯净物
谢 谢 观 看
第二单元 我们周围的空气
课题1空气(第1课时)
教学目标
1.了解空气的主要成分,认识空气对人类生活的重要作用。(重点)
2.掌握测定空气中氧气含量的方法及原理。(重难点)
3.初步认识纯净物和混合物的概念,学会区分纯净物与混合物。(重难点)
趣味实验 “瓶吞鸡蛋”
一.导入新课
【问题1】同学们能用化学知识解释出现这些现象的原因吗?
17世纪波义耳提出空气有一些活性物质。给人们启发,空气中含有两种截然不同的物质
1674年梅奥利用如图的装置证明空气的组成,是复杂的,空气至少包括两种成分的结论。
1703年,英国人史塔尔提出了“燃素说”他认为,
一切燃烧现象都是物体吸收和逸出燃素的过程,
煅烧金属燃素被释放出来,金属就变成了灰渣。
舍勒在1773年用多种方法制作比较纯净的氧气,但是他把这种气体叫做火气,并通过白磷燃烧测出火气占空气体积的1/5。
空气成分发现史
1771年,普里斯特林发现植物把二氧化碳转化为氧气,但是他不知道这是一种新元素的气体,把氧气称为脱燃素气。
1772年卢瑟福发现了氮气
1772年,法国化学家拉瓦锡推翻燃素说
1777年正式把这种气体命名为氧气。
1868年法国天文学家严森发现了氦
1892年英国物理学家雷利和英国化学家拉姆塞发现了氩。
1898年拉姆塞发现了氖.氪和氙
1990年德国物理学教授道恩发现了氡
空气成分发现史
空气的组成
空气的成分 氮气 氧气 稀有气体 二氧化碳 其它气体和杂质
体积分数 78% 21% 0.94% 0.03% 0.03%
氮气
78%
氧气21%
其他成分1%
二.拉瓦锡定量测定
二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。拉瓦锡测定空气成分的实验如下表所示:
实验一 实验二
实验图示 无
实验步骤 把少量汞放在密闭容器里连续加热12天 把汞表面上所生成的红色粉末收集起来,放在另一个较小的容器中加强热。
实验现象 一部分银白色的液态汞变成红色粉末,容器里的气体体积约减少1/5。 红色粉末变成银白色的液态物质,得到的气体体积等于密闭容器里所减少的气体的体积。
反应原理
汞+氧气
加热
氧化汞
Hg
O2
HgO
加热
氧化汞
汞+氧气
HgO
O2
Hg
拉瓦锡定量测定
二.拉瓦锡定量测定
实 验 一 实 验 二
实验结论 剩余的4/5体积的气体既不能供给呼吸,也不能支持燃烧。他认为这些气体都是氮气。 氧化汞加热分解生成的氧气的体积恰好等于密闭容器里所减少的气体的体积。
总的结论 空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。 【问题2】拉瓦锡得到什么结论呢?
【问题3】拉瓦锡选择汞做实验的优缺点?
汞+氧气
加热
氧化汞
Hg
O2
HgO
优:在空气中能反应且只与空气中的氧气反应;汞反应后的生成物为固体,所占的空间体积可忽略不计
缺:汞有毒,容易污染空气
三.空气中氧气含量的测定
(2)实验装置如图
(3)实验步骤:
①连接装置并检查装置的气密性;
②先在集气瓶内加少量水,并做上记号,将水面上方的空间分成5份;
③关闭弹簧夹,点燃红磷,迅速伸入集气瓶,立即塞紧橡塞;
④燃烧结束后,冷却到室温,打开弹簧夹。
红磷在集气瓶内燃烧,放出热量,产生大量白烟;冷却至室温后打开弹簧夹,水沿导管进入集气瓶,进入集气瓶内的水的体积约占集气瓶内原有空气总体积的1/5
空气中氧气的体积约占空气总体积的1/5。
(1)实验原理
(4)实验现象:
(5)实验结论:
:红磷+氧气
点燃
五氧化二磷
4P+
5O2
2P2O5
点燃
【问题4】红磷在瓶中燃烧,消耗了什么气体
【问题5】为什么要求红磷过量,剩余的红磷未
全部燃烧说明了什么
【问题6】剩余气体是什么气体
【问题7】插人一根燃着的木条有何现象?
【问题8】瓶中剩余气体是氧气吗
[问题9]为什么瓶中只能进入约为容积五分之一
的水?说明了什么
【问题10】氮气有何性质
【问题11】某学生实验,发现集气瓶中的水不足五分
之一,原因可能是什么?
三.空气中氧气含量的测定
红磷的量不足(或装置气密性不好,或
未等装置冷却到室温就打开弹簧夹)
不溶于水物理性质和不能燃烧,也不支持燃烧的化学性质
【问题12】为什么使用红磷?
【问题13】能否改用木炭,硫,铁,镁带?
【问题14】如果只用木炭,该如何改进?
三.空气中氧气含量的测定
氢氧化钠溶液
二氧化碳+氢氧化钠
碳酸钠+水
木炭
四.知识拓展
【问题15】你还能设计什么物质燃烧实验,测定空气中氧气的体积分数呢
【问题16】我们还有什么设计实验装置图呢?
【问题17】设计实验装置图有什么优点?
【问题18】空气的成分及其含量是什么?
【问题19】空气属于混合物还是纯净物?
请同学们阅读27页课本内容回答问题
五.学习混合物和纯净物
从组成上比较下列物质并分类
空气 氧气 食盐水 蒸馏水(纯水)
由两种或两种以上物质混合而成的
混合物
只由一种物质组成的
纯净物
六.课堂总结
一.趣味实验 “瓶吞鸡蛋”
二.拉瓦锡定量测定
三.空气中氧气含量的测定
四.知识拓展
五.学习混合物和纯净物
谢 谢 观 看
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
