化学人教版(2019)选择性必修1 3.1.2弱电解质的电离平衡常数(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1.2弱电解质的电离平衡常数(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-27 21:30:31 | ||
图片预览





文档简介
(共20张PPT)
组织建设
第一节 弱电解质的电离
(第2课时 弱电解质的电离平衡和平衡常数)
第三章 水溶液中的离子平衡
一、电离常数(K)
看课本自学相关内容并思考:
(1)什么叫电离常数?
(2)怎样用电离常数比较弱电解质的相对强弱?
(3)影响电离平衡常数的因素是什么?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
定量描述——
电离平衡常数K
2.表示方法
注:c指平衡时各组分的浓度;K不写单位。
1. 概念:在一定温度下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度幂之积跟溶液中未电离的分子浓度幂的比是一个常数,这个常数叫电离平衡常数。
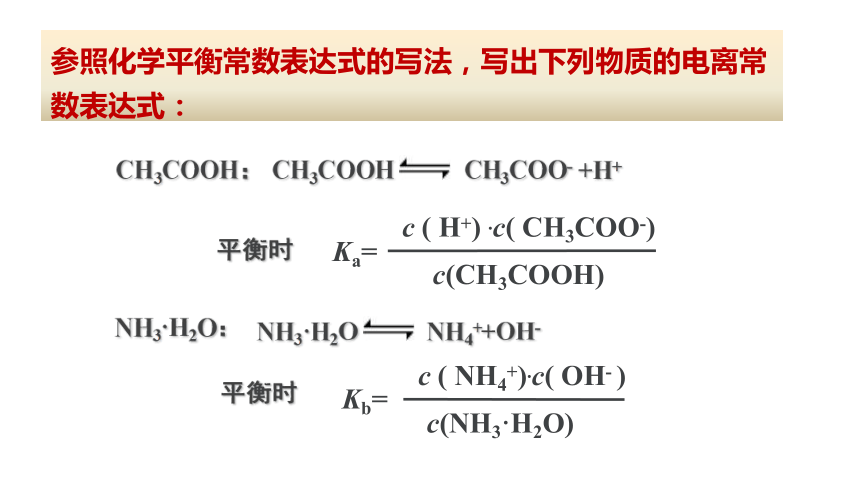
练习8:写出HAc (醋酸简写)、NH3·H2O的电离平衡常数的表达式。
c ( H+) .c( CH3COO-)
c(CH3COOH)
CH3COOH:
c ( NH4+).c( OH- )
c(NH3·H2O)
平衡时
CH3COOH CH3COO- +H+
NH3·H2O:
NH3·H2O NH4++OH-
平衡时
参照化学平衡常数表达式的写法,写出下列物质的电离常数表达式:
Ka=
Kb=
1)多元弱酸的电离是分步进行的,每一步各有电离常数。
通常用K1 、K2 、K3等来分别表示
H2CO3 H+ +
H+ + CO32-
H2CO3
Ka1=
Ka2=
Cu(OH)2 Cu2+ + 2OH-
K=
2)多元碱
4.3×10-7
5.6×10-11
(表达式中浓度指该粒子的总浓度)
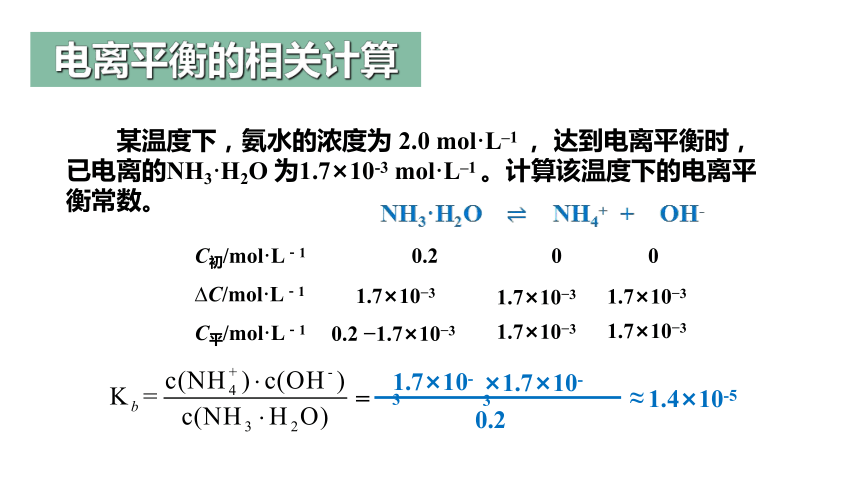
C初/mol·L-1 0.2 0 0
C/mol·L-1
C平/mol·L-1
某温度下,氨水的浓度为 2.0 mol·L–1 , 达到电离平衡时,已电离的NH3·H2O 为1.7×10-3 mol·L–1 。计算该温度下的电离平衡常数。
NH3·H2O NH4+ + OH-
=
0.2
1.7×10-3
≈
×1.7×10-3
1.4×10-5
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
电离平衡的相关计算
3.影响电离平衡常数的因素:
T ,K 。
①弱电解质本身性质(内因)
②温度(电离为吸热过程):
4.计算K的意义是什么?
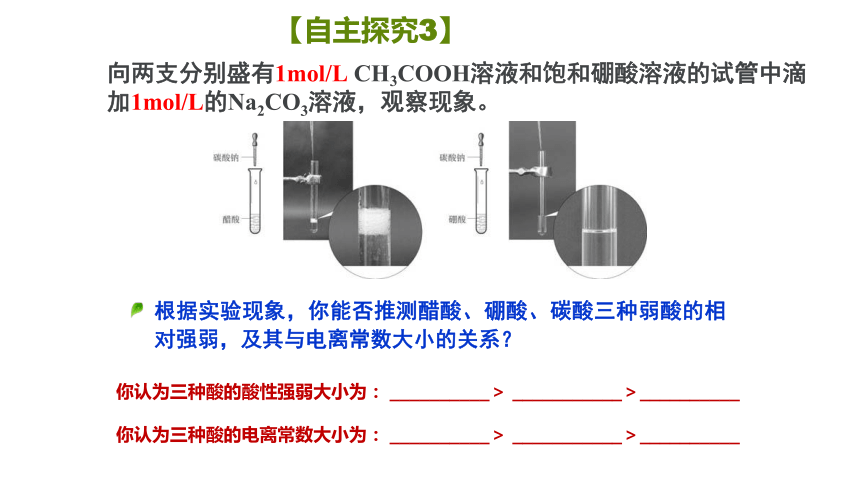
根据实验现象,你能否推测醋酸、硼酸、碳酸三种弱酸的相对强弱,及其与电离常数大小的关系?
【自主探究3】
向两支分别盛有1mol/L CH3COOH溶液和饱和硼酸溶液的试管中滴加1mol/L的Na2CO3溶液,观察现象。
你认为三种酸的酸性强弱大小为: __________> ___________>__________
你认为三种酸的电离常数大小为: __________> ___________>__________
【自主探究3】
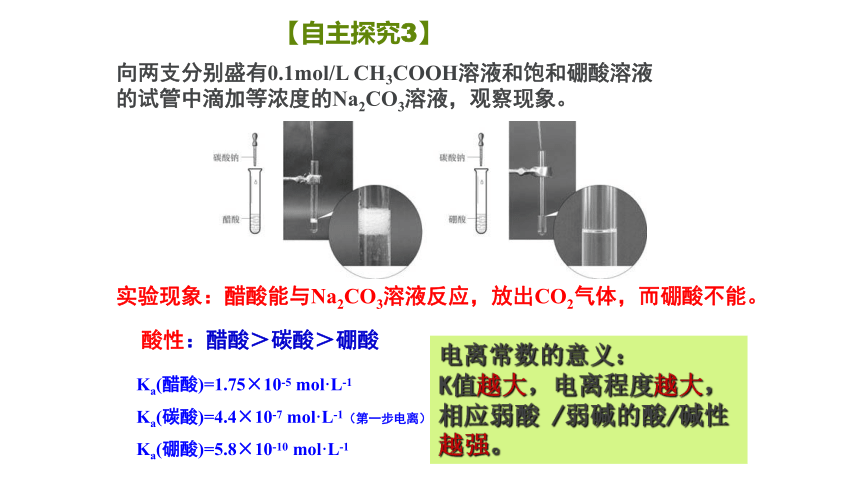
Ka(醋酸)=1.75×10-5 mol·L-1
Ka(碳酸)=4.4×10-7 mol·L-1(第一步电离)
Ka(硼酸)=5.8×10-10 mol·L-1
向两支分别盛有0.1mol/L CH3COOH溶液和饱和硼酸溶液的试管中滴加等浓度的Na2CO3溶液,观察现象。
实验现象:醋酸能与Na2CO3溶液反应,放出CO2气体,而硼酸不能。
酸性:醋酸>碳酸>硼酸
电离常数的意义:
K值越大,电离程度越大,
相应弱酸 /弱碱的酸/碱性越强。
4.K的意义:
K ,电离程度 ,对应的弱酸的酸性(或弱碱的碱性)就越强;
以下表中是某些弱电解质的电离常数(25 ℃),比较它们的酸性强弱。
弱电解质
电离常数
HClO
HF
HNO2
4.0×10 8
6.3×10 4
5.6×10 4
酸性:
HF > HNO2 > HClO
电离平衡常数 K的意义
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S
【课堂练习】
比较它们的酸性强弱。
H3PO4在水溶液中的电离方程式。
H3PO4
H+ + H2PO4-
H2PO4-
H+ + HPO42-
HPO42-
H+ + PO43-
请你推测每一步的电离程度如何变化,为什么?
多元弱酸是分步电离的,K1>>K2 >> K3
多元弱酸的酸性由第一步电离决定。
K1=7.1 ×10-3
K2=6.3 ×10-8
K3=4.2 ×10-13
试根据课本p42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
酸性:草酸>磷酸>柠檬酸>碳酸
【学以致用】
练习1:已知25℃时,
KHF=7.2×10-4 KHCN=4.9×10-10
KHNO2=4.6×10-4 KCH3COOH=1.8×10-5
同浓度的上述溶液中溶质分子浓度最大的是( ),酸性最强的是( ),溶液pH最大的是( )
A.HF B.HCN C.HNO2 D.CH3COOH
B
A
B
练习2:根据提供的电离常数,回答下列问题:
已知常温下几种常见弱酸的电离常数 化学式 HA HB HC
K 1.8 ×10-4 4.6×10-4 1.8×10-5
(1)酸性由弱到强排列___________________
(2)相同浓度以上溶液中氢离子浓度由小到大排列____________
(3)同浓度A - 、B - 、C -结合H+能力由强到弱_______________
HCHCC - > A - > B -
结论1: 酸性大小和氢离子浓度有关,同浓度的酸,其酸根结合氢离子的能力越强,电离出来的氢离子就越少,浓度就越低,酸性越弱。
练习3: 有0.1 mol/L的盐酸、硫酸、醋酸各50mL,试比较:
(A)三种酸里氢离子浓度由大到小的顺序是 。
(B)三种酸跟足量的锌反应,开始时产生H2的速率是:
。
(C)三种酸跟足量的锌反应产生H2的体积是 。
(D)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗 NaOH溶液的体积由大到小的顺序是 。
硫酸>盐酸>醋酸
硫酸>盐酸>醋酸
硫酸>盐酸= 醋酸
硫酸>盐酸= 醋酸
结论2:相同浓度的同元强酸和弱酸,强酸中氢离子浓度大;
结论3:若酸完全反应,产生氢气的量或消耗碱的量只取决于酸中所含氢离子的量。
思考一:氢离子浓度相同的HCl和CH3COOH,哪种酸的浓度更大?
结论4:氢离子浓度相同的同元强酸和弱酸,C(弱酸)》C(强酸)
结论5:氢离子浓度相同的HCl和CH3COOH,稀释相同倍数
后,_____酸中的氢离子浓度大,减小的程度小。
弱
练习11:25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如下图所示。
(1)“O”点导电能力为“0”的原因?
(3)a、b、c三点c(H+)最大的是?
(4)a、b、c三点醋酸电离程度最大的是?
(2)ab段溶液导电能力变化的主要原因?bc段溶液导电能力变化的主要原因?
电离平衡
常数
电离平衡常数
电离平衡常数的影响因素
电离程度、电离平衡常数的计算
电离平衡常数的计算
内因——电解质本身
外因——只受温度影响
表达式
意义 和 应用
课堂小结
组织建设
第一节 弱电解质的电离
(第2课时 弱电解质的电离平衡和平衡常数)
第三章 水溶液中的离子平衡
一、电离常数(K)
看课本自学相关内容并思考:
(1)什么叫电离常数?
(2)怎样用电离常数比较弱电解质的相对强弱?
(3)影响电离平衡常数的因素是什么?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
定量描述——
电离平衡常数K
2.表示方法
注:c指平衡时各组分的浓度;K不写单位。
1. 概念:在一定温度下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度幂之积跟溶液中未电离的分子浓度幂的比是一个常数,这个常数叫电离平衡常数。
练习8:写出HAc (醋酸简写)、NH3·H2O的电离平衡常数的表达式。
c ( H+) .c( CH3COO-)
c(CH3COOH)
CH3COOH:
c ( NH4+).c( OH- )
c(NH3·H2O)
平衡时
CH3COOH CH3COO- +H+
NH3·H2O:
NH3·H2O NH4++OH-
平衡时
参照化学平衡常数表达式的写法,写出下列物质的电离常数表达式:
Ka=
Kb=
1)多元弱酸的电离是分步进行的,每一步各有电离常数。
通常用K1 、K2 、K3等来分别表示
H2CO3 H+ +
H+ + CO32-
H2CO3
Ka1=
Ka2=
Cu(OH)2 Cu2+ + 2OH-
K=
2)多元碱
4.3×10-7
5.6×10-11
(表达式中浓度指该粒子的总浓度)
C初/mol·L-1 0.2 0 0
C/mol·L-1
C平/mol·L-1
某温度下,氨水的浓度为 2.0 mol·L–1 , 达到电离平衡时,已电离的NH3·H2O 为1.7×10-3 mol·L–1 。计算该温度下的电离平衡常数。
NH3·H2O NH4+ + OH-
=
0.2
1.7×10-3
≈
×1.7×10-3
1.4×10-5
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
电离平衡的相关计算
3.影响电离平衡常数的因素:
T ,K 。
①弱电解质本身性质(内因)
②温度(电离为吸热过程):
4.计算K的意义是什么?
根据实验现象,你能否推测醋酸、硼酸、碳酸三种弱酸的相对强弱,及其与电离常数大小的关系?
【自主探究3】
向两支分别盛有1mol/L CH3COOH溶液和饱和硼酸溶液的试管中滴加1mol/L的Na2CO3溶液,观察现象。
你认为三种酸的酸性强弱大小为: __________> ___________>__________
你认为三种酸的电离常数大小为: __________> ___________>__________
【自主探究3】
Ka(醋酸)=1.75×10-5 mol·L-1
Ka(碳酸)=4.4×10-7 mol·L-1(第一步电离)
Ka(硼酸)=5.8×10-10 mol·L-1
向两支分别盛有0.1mol/L CH3COOH溶液和饱和硼酸溶液的试管中滴加等浓度的Na2CO3溶液,观察现象。
实验现象:醋酸能与Na2CO3溶液反应,放出CO2气体,而硼酸不能。
酸性:醋酸>碳酸>硼酸
电离常数的意义:
K值越大,电离程度越大,
相应弱酸 /弱碱的酸/碱性越强。
4.K的意义:
K ,电离程度 ,对应的弱酸的酸性(或弱碱的碱性)就越强;
以下表中是某些弱电解质的电离常数(25 ℃),比较它们的酸性强弱。
弱电解质
电离常数
HClO
HF
HNO2
4.0×10 8
6.3×10 4
5.6×10 4
酸性:
HF > HNO2 > HClO
电离平衡常数 K的意义
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S
【课堂练习】
比较它们的酸性强弱。
H3PO4在水溶液中的电离方程式。
H3PO4
H+ + H2PO4-
H2PO4-
H+ + HPO42-
HPO42-
H+ + PO43-
请你推测每一步的电离程度如何变化,为什么?
多元弱酸是分步电离的,K1>>K2 >> K3
多元弱酸的酸性由第一步电离决定。
K1=7.1 ×10-3
K2=6.3 ×10-8
K3=4.2 ×10-13
试根据课本p42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
酸性:草酸>磷酸>柠檬酸>碳酸
【学以致用】
练习1:已知25℃时,
KHF=7.2×10-4 KHCN=4.9×10-10
KHNO2=4.6×10-4 KCH3COOH=1.8×10-5
同浓度的上述溶液中溶质分子浓度最大的是( ),酸性最强的是( ),溶液pH最大的是( )
A.HF B.HCN C.HNO2 D.CH3COOH
B
A
B
练习2:根据提供的电离常数,回答下列问题:
已知常温下几种常见弱酸的电离常数 化学式 HA HB HC
K 1.8 ×10-4 4.6×10-4 1.8×10-5
(1)酸性由弱到强排列___________________
(2)相同浓度以上溶液中氢离子浓度由小到大排列____________
(3)同浓度A - 、B - 、C -结合H+能力由强到弱_______________
HC
结论1: 酸性大小和氢离子浓度有关,同浓度的酸,其酸根结合氢离子的能力越强,电离出来的氢离子就越少,浓度就越低,酸性越弱。
练习3: 有0.1 mol/L的盐酸、硫酸、醋酸各50mL,试比较:
(A)三种酸里氢离子浓度由大到小的顺序是 。
(B)三种酸跟足量的锌反应,开始时产生H2的速率是:
。
(C)三种酸跟足量的锌反应产生H2的体积是 。
(D)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗 NaOH溶液的体积由大到小的顺序是 。
硫酸>盐酸>醋酸
硫酸>盐酸>醋酸
硫酸>盐酸= 醋酸
硫酸>盐酸= 醋酸
结论2:相同浓度的同元强酸和弱酸,强酸中氢离子浓度大;
结论3:若酸完全反应,产生氢气的量或消耗碱的量只取决于酸中所含氢离子的量。
思考一:氢离子浓度相同的HCl和CH3COOH,哪种酸的浓度更大?
结论4:氢离子浓度相同的同元强酸和弱酸,C(弱酸)》C(强酸)
结论5:氢离子浓度相同的HCl和CH3COOH,稀释相同倍数
后,_____酸中的氢离子浓度大,减小的程度小。
弱
练习11:25 ℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如下图所示。
(1)“O”点导电能力为“0”的原因?
(3)a、b、c三点c(H+)最大的是?
(4)a、b、c三点醋酸电离程度最大的是?
(2)ab段溶液导电能力变化的主要原因?bc段溶液导电能力变化的主要原因?
电离平衡
常数
电离平衡常数
电离平衡常数的影响因素
电离程度、电离平衡常数的计算
电离平衡常数的计算
内因——电解质本身
外因——只受温度影响
表达式
意义 和 应用
课堂小结
