4.3化学键课件(共28页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3化学键课件(共28页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 10:53:50 | ||
图片预览




文档简介
(共28张PPT)
高中化学人教版必修第一册
第四章 第三节《化学键》
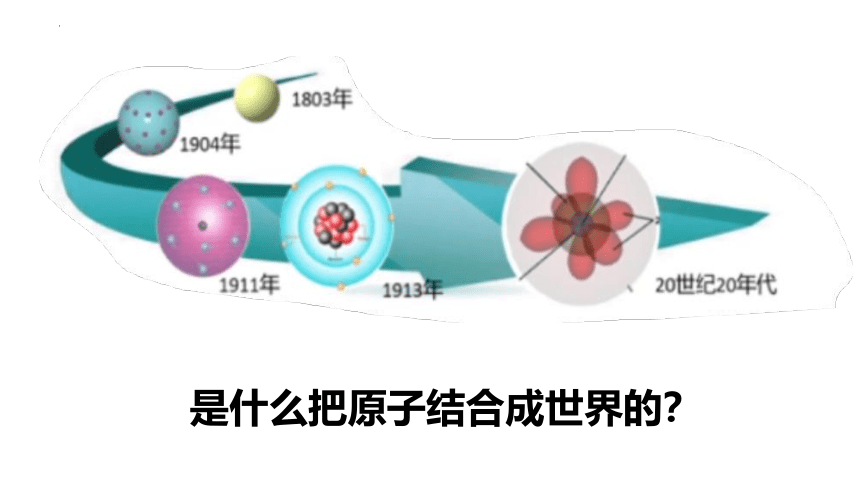
是什么把原子结合成世界的?
是什么把原子结合成世界的?
科学家的思考角度
什么力量
让原子在一起?
从原子结构寻找内因
电化二元论
甲烷分子
八电子稳定结构
以什么角度
让原子在一起?
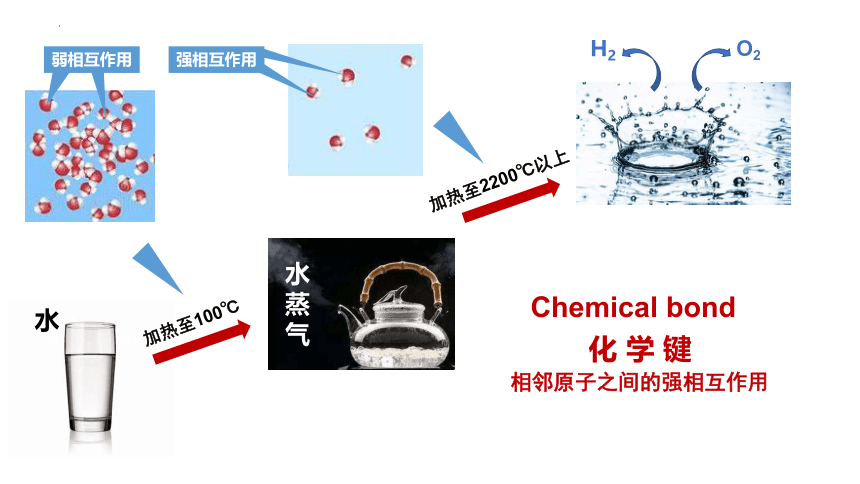
水
水蒸气
H2
O2
加热至100℃
加热至2200℃以上
弱相互作用
强相互作用
Chemical bond
化 学 键
相邻原子之间的强相互作用
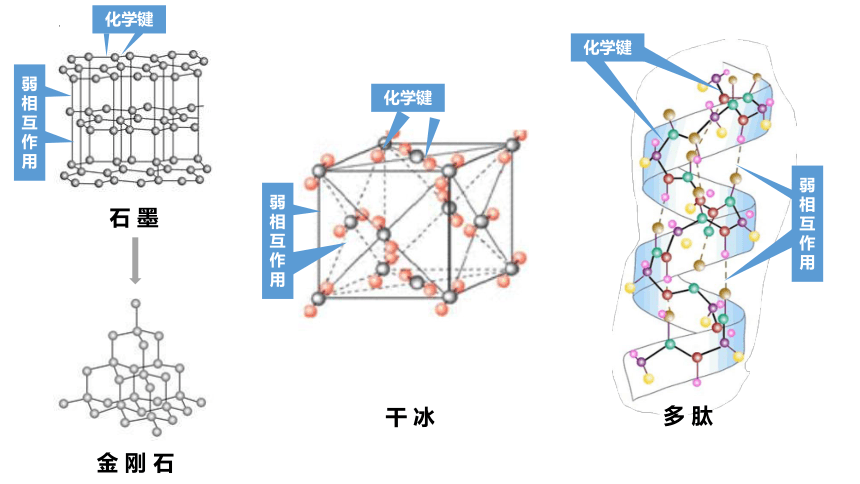
多 肽
化学键
弱
相
互
作
用
石 墨
金 刚 石
化学键
弱
相
互
作
用
干 冰
弱
相
互
作
用
化学键
化学键
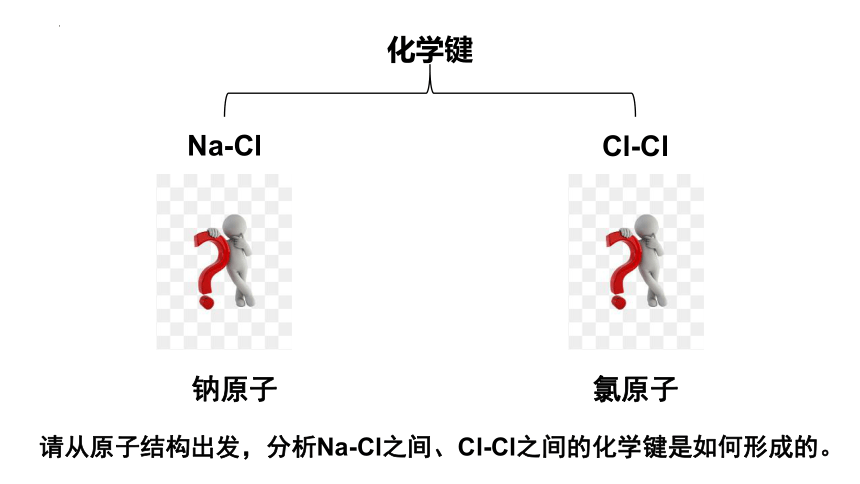
Na-Cl
Cl-Cl
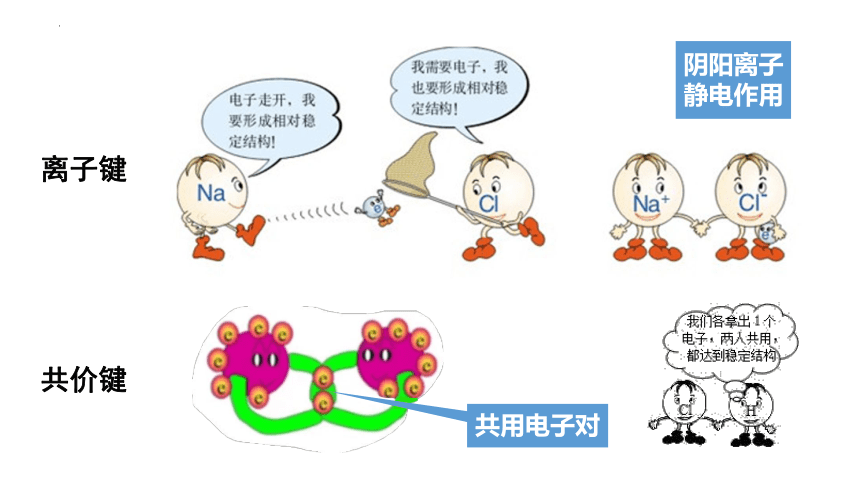
请从原子结构出发,分析Na-Cl之间、Cl-Cl之间的化学键是如何形成的。
氯原子
钠原子
离子键
共价键
阴阳离子
静电作用
共用电子对
【新概念】
带相反电荷离子之间的相互作用叫做离子键
(3)成键条件如:
(1)成键粒子:
①活泼金属(IA、IIA)和活泼非金属 (VIA、VIIA)间
阴、阳离子
(2)离子键的实质:
静电作用
静电引力:阴离子、阳离子之间
静电斥力:原子核与原子核、电子与电子
②金属阳离子或NH4+ 和某些带电原子团之间(即阴离子(团))
离子键
离子键
③活泼金属(IA、IIA)和氢负离子(H-)之间
原子间通过共用电子对所形成的相互作用称为共价键
【新概念】共价键
成键粒子:
成键本质:
成键元素:
原子
共用电子对形成的相互作用
非金属元素间(一般)
或某些不活泼金属和非金属间
共价键
哪些物质中存在共价键,请举例说明。
H2、O2、Cl2、CO2、H2O、HCl、OH-、SO 、NH4+等等。
非金属单质、非金属氧化物、非金属氢化物、带电原子团等
2Al2O3(熔融)=== 4Al+3O2 ↑
电解
冰晶石
熔融的AlCI3不导电,而熔融的Al2O3导电,且其储量丰富易得
短时间存在的氢化铵(化学式为NH4H或NH5),是由NH4+和H-通过离子键结合而成(或可能于某些极端条件下存在,如高压······)
【实例一】
所以选用刚玉(Al2O3)作为制铝的原材料
【实例二】
所以从根本上说,形成离子键还是共价键,
取决于吸引能力的差距,是否会形成阴阳离子
离子键与共价键
Cs-F Na-Cl Mg-Cl Al-Cl Si-Cl P-Cl S-Cl Cl-Cl
你能预测下面这些“拔河比赛”中卤素原子“获胜”的几率有多大吗? 按“获胜”概率由大到小排序。说说你的理由。
离子键与共价键
化学键 Cs-F Na-Cl Mg-Cl Al-Cl Si-Cl P-Cl S-Cl Cl-Cl
电负性差 3.2 2.1 1.8 1.5 1.2 0.9 0.5 0
离子性 92% 63% 55% 43% 30% 18% 6.5% 0%
离子键
共价键
极性共价键
非极性
共价键
吸引能力的
一种量化表达
物质 Cl2 HCl
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
键的类型
Cl-Cl
相同
不偏移
不显电性
非极性键
共价键的类型
H-Cl
Cl强于H
偏向Cl,偏离H
Cl显负电,H显正电
极性键
非极性键(同种原子组成,共用电子对不发生偏移)
极性键(不同种原子组成,共用电子对发生偏移)
用电子式表示化学键的形成
离子键的形成过程
共价键的形成过程
1.电子式中的“·”代表什么?
2.如何确定原子周围“·”的数量?
3.用电子式表示离子键与共价键的形成过程时,
有哪些不同之处?这些不同的含义是什么?
①Na2O
②Na2O2
③NaOH
Na O H
[ ]
+
—
×
×
Na O O Na
[ ]
2-
+
+
×
×
Na O Na
[ ]
2-
+
+
×
×
④HClO
⑤H2O2
H O O H
×
×
H O Cl
×
×
×
×
×
×
×
×
②NH3
①CO2
→
→
· O ·
··
··
+
· O ·
··
+
C
··
×
×
×
×
3H
+
:
· N
·
·
×
·
N
H
:
H
H
·
·
×
×
×
2. 用电子式表示下列分子的形成过程。
··
··
O
··
C
O
··
×
×
×
×
·
·
·
·
1. 写出下列物质的电子式。
⑥CaCl2
Cl Ca Cl
[ ]
-
2+
×
×
[ ]
-
分子 电子式 结构式 球棍模型 空间结构 比例模型
H2
HCl
CO2
H2O
CH4
H–H
H–Cl
O=C=O
H–O–H
【共价键形成的分子及其结构模型】
直线型
V型
正四面体
直线型
直线型
H–C–H
–
–
H
H
尝试写出乙烯(C2H4)、乙炔(C2H2)、
乙酸(CH3COOH)、碳酸(H2CO3)的结构式
物质类别 化学键 常见代表物 性质特点
含有离子键
只含有共价键
NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO
强碱、大多数盐及金属氧化物
CO2、H2O、HCl、CH4、H2SO4
非金属氧化物、非金属氢化物、酸等
熔融态能导电
熔沸点高、硬度大、难挥发
液态不能导电
熔沸点低、易挥发
【整理归纳】离子化合物和共价化合物
共价化合物
离子化合物
只含有共价键的化合物才属于共价化合物
(即若存在离子键,一定为离子化合物)
化学键 成键粒子 特点 成键元素 存在
离子键
共价键 非极性键
极性键
化学键——相邻的原子之间强烈的相互作用。
化学键的形成与原子结构有关,主要通过原子的价电子间的转移或共用来实现。
相同非金属元素
原 子
阴、阳离子
电子得失
形成共用电子对
活泼金属与活泼非金属元素
【整理归纳】
不同非金属元素
阴、阳离子相互作用
离子化合物
共用电子对不发生偏移
非金属单质、某些共价化合物和离子化合物
共用电子对偏向一方原子
共价化合物和某些离子化合物
科学家的思考角度
解释世界
如果让原子按照预设的路径形成世界……
化学键,它把原子结合成世界
——周公度
改造世界
2018年,中国科学院量子中心科研团队以普通氮气为原材料成功合成了超高含能材料金属氮,相关结果发表在国际期刊《自然通讯》上。
N
1s22s22p3
通常情况下,氮气以无色无味的双原子气体分子的形式存在,然而在极端高温高压条件下,氮气分子会发生一系列复杂的结构和性质变化,比如分子发生解离进而形成金属氮,这种原子形态的氮单质转变成氮气时会释放出巨大能量,是目前常用炸药TNT能量密度的十倍以上,具有含能密度高、绿色无污染和可循环利用等种种优点,如果能作为燃料应用于载人火箭一、二级推进器,有望将目前火箭起飞重量提升数倍以上。
结合化学用语及微观图示,完整说明氮原子是如何形成氮气的,并解释为什么科学家会猜测这个过程会释放出巨大的能量?
1. 关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
2. 下列各项中,能证明HCl是共价化合物的是( )
A. HCl极易溶于水 B. 液态HCl不能导电
C. HCl在水溶液中完全电离 D. HCl是无色有刺激性气味的气体
3. 用序号按要求回答问题:
下列各种物质:①H2O ②NH3 ③KOH ④Na2O2 ⑤MgCl2 ⑥Ne,不存在化学键的是______;只存在离子键的是______;属于共价化合物的是_______;含非极性键的离子化合物是______。
⑥
⑤
①②
④
资料:NaCl在常温下是固体(熔点:804℃)
Cl2常温下是气体(熔点:-107℃)
NaCl
Cl2
氯化钠、氯气中存在的离子键、共价键都属于化学键,即属于相邻原子间的强相互作用,其作用强度的数量级应该大体相当。但为什么熔化氯化钠需要的能量远远大于氯气的呢?请分析二者中的微粒间作用力有什么不同,又为什么不同。
请阅读书本P116资料卡片
(1)单质分子中一定含有共价键( )
(2)CO2的电子式为 ( )
(3)NaOH中含有离子键和极性键( )
(4)化学键既可存在于分子内的原子间,又可存在于分子之间( )
(5)氢键是化学键的一种( )
(6)水分子稳定,是因为水分子间存在氢键( )
×
√
×
×
×
×
判断正误
高中化学人教版必修第一册
第四章 第三节《化学键》
是什么把原子结合成世界的?
是什么把原子结合成世界的?
科学家的思考角度
什么力量
让原子在一起?
从原子结构寻找内因
电化二元论
甲烷分子
八电子稳定结构
以什么角度
让原子在一起?
水
水蒸气
H2
O2
加热至100℃
加热至2200℃以上
弱相互作用
强相互作用
Chemical bond
化 学 键
相邻原子之间的强相互作用
多 肽
化学键
弱
相
互
作
用
石 墨
金 刚 石
化学键
弱
相
互
作
用
干 冰
弱
相
互
作
用
化学键
化学键
Na-Cl
Cl-Cl
请从原子结构出发,分析Na-Cl之间、Cl-Cl之间的化学键是如何形成的。
氯原子
钠原子
离子键
共价键
阴阳离子
静电作用
共用电子对
【新概念】
带相反电荷离子之间的相互作用叫做离子键
(3)成键条件如:
(1)成键粒子:
①活泼金属(IA、IIA)和活泼非金属 (VIA、VIIA)间
阴、阳离子
(2)离子键的实质:
静电作用
静电引力:阴离子、阳离子之间
静电斥力:原子核与原子核、电子与电子
②金属阳离子或NH4+ 和某些带电原子团之间(即阴离子(团))
离子键
离子键
③活泼金属(IA、IIA)和氢负离子(H-)之间
原子间通过共用电子对所形成的相互作用称为共价键
【新概念】共价键
成键粒子:
成键本质:
成键元素:
原子
共用电子对形成的相互作用
非金属元素间(一般)
或某些不活泼金属和非金属间
共价键
哪些物质中存在共价键,请举例说明。
H2、O2、Cl2、CO2、H2O、HCl、OH-、SO 、NH4+等等。
非金属单质、非金属氧化物、非金属氢化物、带电原子团等
2Al2O3(熔融)=== 4Al+3O2 ↑
电解
冰晶石
熔融的AlCI3不导电,而熔融的Al2O3导电,且其储量丰富易得
短时间存在的氢化铵(化学式为NH4H或NH5),是由NH4+和H-通过离子键结合而成(或可能于某些极端条件下存在,如高压······)
【实例一】
所以选用刚玉(Al2O3)作为制铝的原材料
【实例二】
所以从根本上说,形成离子键还是共价键,
取决于吸引能力的差距,是否会形成阴阳离子
离子键与共价键
Cs-F Na-Cl Mg-Cl Al-Cl Si-Cl P-Cl S-Cl Cl-Cl
你能预测下面这些“拔河比赛”中卤素原子“获胜”的几率有多大吗? 按“获胜”概率由大到小排序。说说你的理由。
离子键与共价键
化学键 Cs-F Na-Cl Mg-Cl Al-Cl Si-Cl P-Cl S-Cl Cl-Cl
电负性差 3.2 2.1 1.8 1.5 1.2 0.9 0.5 0
离子性 92% 63% 55% 43% 30% 18% 6.5% 0%
离子键
共价键
极性共价键
非极性
共价键
吸引能力的
一种量化表达
物质 Cl2 HCl
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
键的类型
Cl-Cl
相同
不偏移
不显电性
非极性键
共价键的类型
H-Cl
Cl强于H
偏向Cl,偏离H
Cl显负电,H显正电
极性键
非极性键(同种原子组成,共用电子对不发生偏移)
极性键(不同种原子组成,共用电子对发生偏移)
用电子式表示化学键的形成
离子键的形成过程
共价键的形成过程
1.电子式中的“·”代表什么?
2.如何确定原子周围“·”的数量?
3.用电子式表示离子键与共价键的形成过程时,
有哪些不同之处?这些不同的含义是什么?
①Na2O
②Na2O2
③NaOH
Na O H
[ ]
+
—
×
×
Na O O Na
[ ]
2-
+
+
×
×
Na O Na
[ ]
2-
+
+
×
×
④HClO
⑤H2O2
H O O H
×
×
H O Cl
×
×
×
×
×
×
×
×
②NH3
①CO2
→
→
· O ·
··
··
+
· O ·
··
+
C
··
×
×
×
×
3H
+
:
· N
·
·
×
·
N
H
:
H
H
·
·
×
×
×
2. 用电子式表示下列分子的形成过程。
··
··
O
··
C
O
··
×
×
×
×
·
·
·
·
1. 写出下列物质的电子式。
⑥CaCl2
Cl Ca Cl
[ ]
-
2+
×
×
[ ]
-
分子 电子式 结构式 球棍模型 空间结构 比例模型
H2
HCl
CO2
H2O
CH4
H–H
H–Cl
O=C=O
H–O–H
【共价键形成的分子及其结构模型】
直线型
V型
正四面体
直线型
直线型
H–C–H
–
–
H
H
尝试写出乙烯(C2H4)、乙炔(C2H2)、
乙酸(CH3COOH)、碳酸(H2CO3)的结构式
物质类别 化学键 常见代表物 性质特点
含有离子键
只含有共价键
NaOH、NaCl、MgCl2、KCl、Na2SO4、NH4Cl、Na2O、MgO
强碱、大多数盐及金属氧化物
CO2、H2O、HCl、CH4、H2SO4
非金属氧化物、非金属氢化物、酸等
熔融态能导电
熔沸点高、硬度大、难挥发
液态不能导电
熔沸点低、易挥发
【整理归纳】离子化合物和共价化合物
共价化合物
离子化合物
只含有共价键的化合物才属于共价化合物
(即若存在离子键,一定为离子化合物)
化学键 成键粒子 特点 成键元素 存在
离子键
共价键 非极性键
极性键
化学键——相邻的原子之间强烈的相互作用。
化学键的形成与原子结构有关,主要通过原子的价电子间的转移或共用来实现。
相同非金属元素
原 子
阴、阳离子
电子得失
形成共用电子对
活泼金属与活泼非金属元素
【整理归纳】
不同非金属元素
阴、阳离子相互作用
离子化合物
共用电子对不发生偏移
非金属单质、某些共价化合物和离子化合物
共用电子对偏向一方原子
共价化合物和某些离子化合物
科学家的思考角度
解释世界
如果让原子按照预设的路径形成世界……
化学键,它把原子结合成世界
——周公度
改造世界
2018年,中国科学院量子中心科研团队以普通氮气为原材料成功合成了超高含能材料金属氮,相关结果发表在国际期刊《自然通讯》上。
N
1s22s22p3
通常情况下,氮气以无色无味的双原子气体分子的形式存在,然而在极端高温高压条件下,氮气分子会发生一系列复杂的结构和性质变化,比如分子发生解离进而形成金属氮,这种原子形态的氮单质转变成氮气时会释放出巨大能量,是目前常用炸药TNT能量密度的十倍以上,具有含能密度高、绿色无污染和可循环利用等种种优点,如果能作为燃料应用于载人火箭一、二级推进器,有望将目前火箭起飞重量提升数倍以上。
结合化学用语及微观图示,完整说明氮原子是如何形成氮气的,并解释为什么科学家会猜测这个过程会释放出巨大的能量?
1. 关于共价键的说法正确的是 ( )
A.金属原子在化学反应中只能失去电子,因而不能形成共价键
B.由共价键形成的分子可以是单质分子,也可以是化合物分子
C.共价键只能在不同原子之间形成
D.稀有气体分子中只存在共价键
2. 下列各项中,能证明HCl是共价化合物的是( )
A. HCl极易溶于水 B. 液态HCl不能导电
C. HCl在水溶液中完全电离 D. HCl是无色有刺激性气味的气体
3. 用序号按要求回答问题:
下列各种物质:①H2O ②NH3 ③KOH ④Na2O2 ⑤MgCl2 ⑥Ne,不存在化学键的是______;只存在离子键的是______;属于共价化合物的是_______;含非极性键的离子化合物是______。
⑥
⑤
①②
④
资料:NaCl在常温下是固体(熔点:804℃)
Cl2常温下是气体(熔点:-107℃)
NaCl
Cl2
氯化钠、氯气中存在的离子键、共价键都属于化学键,即属于相邻原子间的强相互作用,其作用强度的数量级应该大体相当。但为什么熔化氯化钠需要的能量远远大于氯气的呢?请分析二者中的微粒间作用力有什么不同,又为什么不同。
请阅读书本P116资料卡片
(1)单质分子中一定含有共价键( )
(2)CO2的电子式为 ( )
(3)NaOH中含有离子键和极性键( )
(4)化学键既可存在于分子内的原子间,又可存在于分子之间( )
(5)氢键是化学键的一种( )
(6)水分子稳定,是因为水分子间存在氢键( )
×
√
×
×
×
×
判断正误
