1.1.1物质的分类及转化课件(共32张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.1物质的分类及转化课件(共32张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 14:19:02 | ||
图片预览







文档简介
(共32张PPT)
第一章 物质及其变化
第一课时 物质的分类及转化
第一节 物质的分类及转化
图书馆
智能机器人正在对快递物品进行分拣
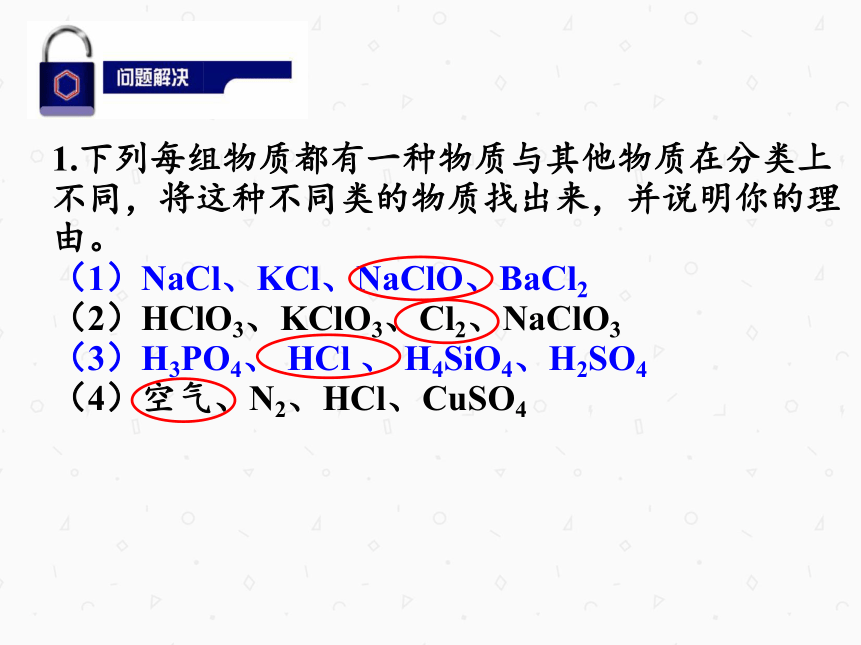
1.下列每组物质都有一种物质与其他物质在分类上不同,将这种不同类的物质找出来,并说明你的理由。
(1)NaCl、KCl、NaClO、BaCl2
(2)HClO3、KClO3、Cl2、NaClO3
(3)H3PO4、 HCl 、 H4SiO4、H2SO4
(4)空气、N2、HCl、CuSO4
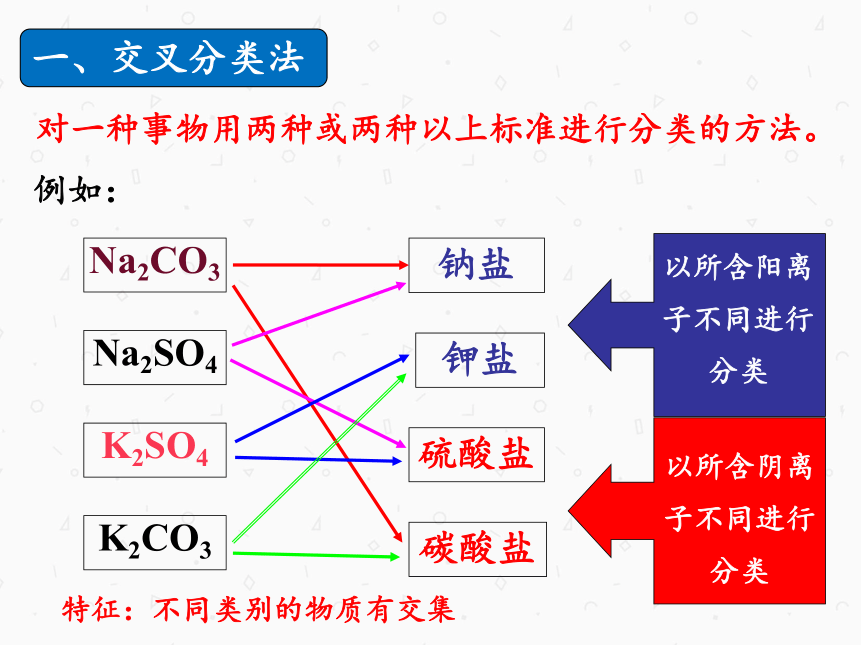
例如:
Na2CO3
K2SO4
钾盐
硫酸盐
钠盐
碳酸盐
Na2SO4
以所含阴离
子不同进行
分类
K2CO3
以所含阳离
子不同进行
分类
一、交叉分类法
对一种事物用两种或两种以上标准进行分类的方法。
特征:不同类别的物质有交集。
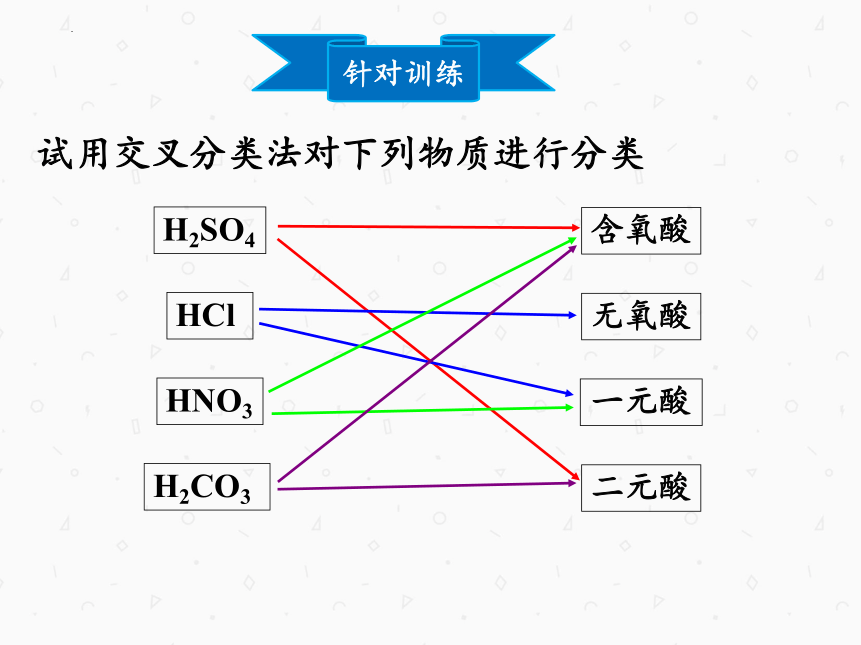
试用交叉分类法对下列物质进行分类
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
针对训练
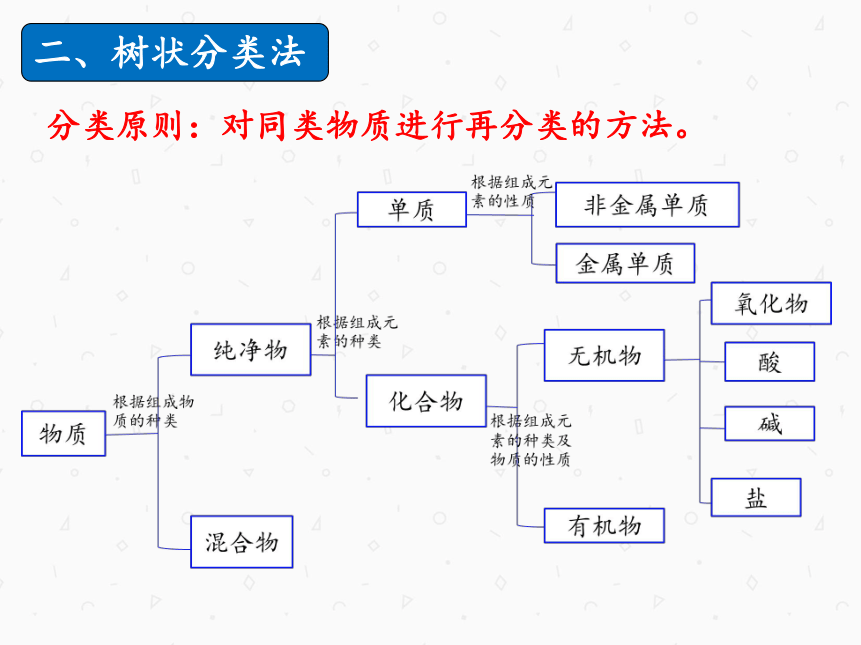
二、树状分类法
分类原则:对同类物质进行再分类的方法。
单质的分类
金属
非金属
单
质
由分子构成:
由原子直接构成:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
金刚石、石墨
H2、Cl2、P4、O3
稀有气体:
He Ne
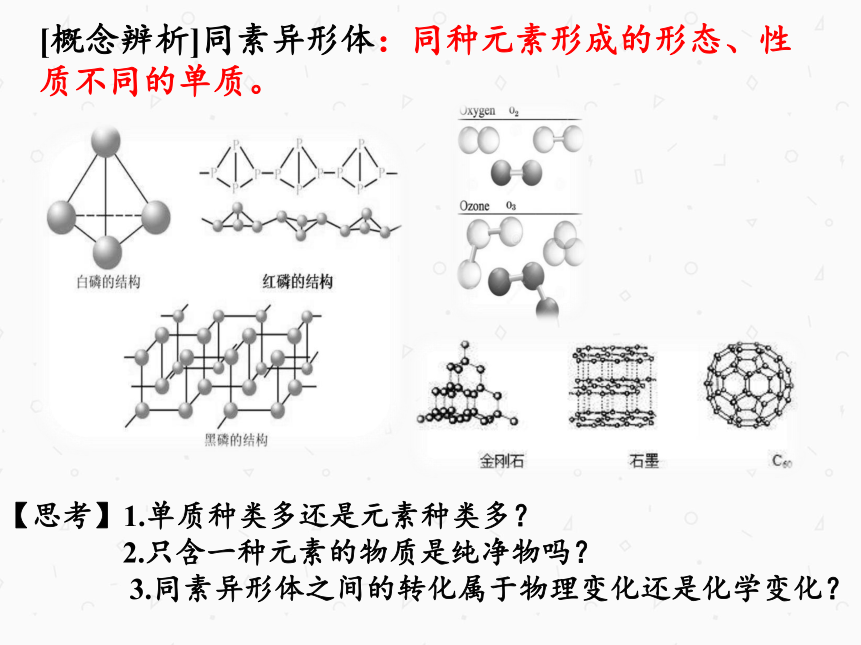
[概念辨析]同素异形体:同种元素形成的形态、性质不同的单质。
【思考】1.单质种类多还是元素种类多?
2.只含一种元素的物质是纯净物吗?
3.同素异形体之间的转化属于物理变化还是化学变化?
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3、Mn2O7、CrO3
CaO、CuO、Na2O
CO、NO
氧
化
物
从组成元素
非金属氧化物
金属氧化物
Al2O3
不成盐氧化物
酸性氧化物
(又称酸酐)
碱性氧化物
两性氧化物
从性质
氧化物 = X + O(负价)
酸性氧化物不一定是非金属氧化物,非金属氧化物不一定是酸性氧化物。碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
特殊氧化物:过氧化物
【思考】
(1)金属氧化物一定是碱性氧化物?
(2)非金属氧化物一定是酸性氧化物
(3)酸性氧化物都能溶于水生成相应的酸?
×
×
×
Mn2O7是酸性氧化物
NO、CO
如SiO2是酸性氧化物,但不溶于水
如何判断酸性氧化物和碱性氧化物?
(1)能与水反应:H2O+CO2
H2CO3
(2)能与碱性氧化物反应:CaO+CO2=CaCO3
(3)能与碱反应:CO2+Ca(OH)2=CaCO3↓+H2O
(4)能与某些盐反应:CO2+CaCO3+H2O=Ca(HCO3)2
酸性氧化物的通性
碱性氧化物的通性:
(1)能与水反应:H2O+CaO=Ca(OH)2
(2)能与酸性氧化物反应:Na2O+CO2=Na2CO3
(3)能与酸反应:MgO+2HCl=MgCl2+H2O
(4)能与某些盐反应:
H2O+CaO+Na2CO3=CaCO3↓+2NaOH
酸
H2SO4、HNO3、H3PO4、H2CO3、
CH3COOH
HCl、H2S
H2SO4、HNO3、HCl
H3PO4
H2CO3 、 CH3COOH
从是否含氧
从酸性强弱分
从电离产生的H+数目
HNO3、HCl、 CH3COOH、H3PO2
H2SO4、H2CO3、H2S、H3PO3
H3PO4
从性质分
HCl、HNO3
H2SO4、 H3PO4
酸 = H+ + 酸根离子
易分解的酸(不稳定酸):HClO、H2CO3、H2SO3、HNO3。
强氧化性酸:浓H2SO4、HNO3、HMnO4、HClO。(指成酸元素氧化性)
弱氧化性酸:稀HCl、稀H2SO4。
还原性酸:H2S、浓HCl、HBr、HI、H2SO3 。
酸的通性
1. 与碱反应生成相应的盐和水 HCl+NaOH
2. 与碱性氧化物反应生成盐和水 HCl+Na2O
3. 与盐反应生成新盐和新酸 HCl+AgNO3
4. 与活泼金属反应生成盐和氢气 HCl+Zn
5. 遇酸碱指示剂变色(紫色石蕊试液—变红,酚酞—不变色)
碱
NaOH KOH Ba(OH)2
Cu(OH)2 Fe(OH)3 NH3·H2O
从碱性强弱
从电离产生的OH-数目
NaOH KOH NH3·H2O
Ba(OH)2 Fe(OH) 2
Al(OH)3
从溶解性
NaOH KOH Ba(OH)2 NH3·H2O
Cu(OH)2 Fe(OH)3
碱 = 金属离子(铵根离子) + OH-
碱的通性
1. 与酸反应生成相应的盐和水
2. 与酸性氧化物反应生成相应的盐和水
3. 与盐反应生成新盐和新碱
4.遇酸碱指示剂变色(紫色石蕊变蓝,酚酞变红)
NaOH+HNO3
NaOH+CO2
Ca(OH)2+Na2CO3
盐
按溶解性
按酸根是否含氧
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
NaCl、CaCl2
……
酸式盐
碱式盐
正盐
KHSO4、 Ca(H2PO4)2
Cu2(OH)2CO3
NaCl、 BaSO4
按组成
盐 = 金属离子 (或铵根离子) + 酸根离子
无氧酸盐
含氧酸盐
KNO3、KMnO4、FeSO4
盐的通性
1. 与酸反应生成新盐和新酸 Na2CO3+HCl
2. 与碱反应生成新盐和新碱 MgCl2+NaOH
3. 与盐反应生成两种新盐 AgNO3+BaCl2
4. 与金属反应生成新盐和新金属 Fe+CuSO4
所有的盐之间都能发生反应吗?
金属的化学性质:
(1)与非金属反应:2Mg+O2
3Fe+2O2
2Cu+O2
2CuO
2MgO
Fe3O4
(2)与酸反应:Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(3)与盐反应:Fe+CuSO4=FeSO4+Cu
2Al+3CuSO4=Al2(SO4)3+3Cu
物质的转化关系
金属
+O2
金属氧化物
+H2O
碱
盐
非金属
+O2
非金属氧化物
+H2O
酸
盐
盐+水
新碱+新盐
新酸+新盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
四种基本
反应类型
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应:(A+BC=AC+B)
一种单质与化合物反应生成另外一种单质和化合物的化学反应
复分解反应(AB+CD=AD+BC)
由两种化合物互相交换成分,生成另外两种化合物的反应,沉淀、气体、弱电解质
反应类型分类
二、四大基本反应的条件或规律
1.置换反应:
金属+酸→盐+H2↑
(1)金属的活动性比氢强
(2)酸除浓硫酸、硝酸
(3)铁与酸反应生成亚铁盐(+2价)
金属+盐→新金属+新盐
(1)参于反应的盐应可溶
(2)金属的活动性“强”置换“弱”
(3)除K、Ca、Na外
(4)铁与盐反应生成亚铁盐(+2价)
2.复分解反应:生成难电离的物质如:水、气体、沉淀等
酸+盐→新盐+新酸(碳酸盐+酸→新盐+H2O+CO2↑)
弱酸不能与强酸盐反应;低沸点酸不能和高沸点酸盐反应
碱+盐→新碱+新盐
(1)反应物皆可溶
(2)生成物有沉淀
盐+盐→新盐+新盐
(1)反应物皆可溶
(2)生成物有沉淀
1、常见的转化方式 ——单质转化为盐
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
三、物质的转化
2、物质转化的应用——制取物质
(1)制取碱:
方法一:碱性氧化物+水→碱
方法二:盐+碱→碱
(2)工业制取物质:除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求
例:工业制取NaOH,采用电解饱和食盐水的方法,过去也曾用盐
(Na2CO3)和碱(Ca(OH)2)反应制取
同类物质常常具有许多共性。因此可以通过物质所属类别,推测其具有的性质。
例如:SO2和CO2同为酸性氧化物,试根据酸性氧化物具有的通性(或CO2的性质),推测二氧化硫具有的性质,用化学方程式表示:
①SO2+H2O=== ;
②SO2+CaO=== ;
③SO2+Ca(OH)2=== 。
H2SO3
CaSO3
CaSO3↓+H2O
知识拓展
1、下表中物质的分类组合完全正确的是( )
A B C D
氧化物 H2O H2O2 CuO KO2
酸 H2CO3 CH3COOH NaHCO3 HCl
碱 Mg(OH)Cl Na2CO3 Fe(OH)3 NaOH
盐 BaSO4 CuSO4·5H2O NaH2PO4 Na2S
D
针对训练
2、现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH和⑩NaHCO3。
其中属于混合物的是_____(填序号,下同);属于酸的是________;属于盐的是________;属于氧化物的是______;
②⑧ ⑤ ⑦⑩ ①④
1.分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是( )
A.H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物
B.HCl、H2SO4、HNO3都是含氧酸
C.非金属氧化物一定是酸性氧化物
D.Na2CO3、BaSO4、NH4Cl都属于盐
D
针对训练
2.下列叙述正确的是( )
A.非金属氧化物都是酸性氧化物
B.碱性氧化物都是金属氧化物
C.酸性氧化物都能与水反应生成酸
D.酸性氧化物都不能跟酸反应
B
① , ;
② , ;
③ , ;
④ , ;
⑤ , ;
⑥ , 。
3.以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型
2Ca+O2 == 2CaO
化合反应
CaO+H2O == Ca(OH)2
化合反应
CaO+CO2 == CaCO3
化合反应
Ca(OH)2+Na2CO3 == CaCO3↓+2NaOH
复分解反应
Ca(OH)2+2HCl == CaCl2+2H2O
复分解反应
CaCO3+2HCl == CaCl2+CO2↑+H2O
复分解反应
4、下列变化不能通过一步化学反应实现的是( )
A. BaCl2→BaSO4 B. CuO→Cu(OH)2
C. NaOH→Na2SO3 D. MgSO4→Mg(OH)2
E. Fe→FeCl2 F. Na2O→Na2CO3
B
D
第一章 物质及其变化
第一课时 物质的分类及转化
第一节 物质的分类及转化
图书馆
智能机器人正在对快递物品进行分拣
1.下列每组物质都有一种物质与其他物质在分类上不同,将这种不同类的物质找出来,并说明你的理由。
(1)NaCl、KCl、NaClO、BaCl2
(2)HClO3、KClO3、Cl2、NaClO3
(3)H3PO4、 HCl 、 H4SiO4、H2SO4
(4)空气、N2、HCl、CuSO4
例如:
Na2CO3
K2SO4
钾盐
硫酸盐
钠盐
碳酸盐
Na2SO4
以所含阴离
子不同进行
分类
K2CO3
以所含阳离
子不同进行
分类
一、交叉分类法
对一种事物用两种或两种以上标准进行分类的方法。
特征:不同类别的物质有交集。
试用交叉分类法对下列物质进行分类
H2SO4
HCl
HNO3
H2CO3
含氧酸
无氧酸
一元酸
二元酸
针对训练
二、树状分类法
分类原则:对同类物质进行再分类的方法。
单质的分类
金属
非金属
单
质
由分子构成:
由原子直接构成:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
金刚石、石墨
H2、Cl2、P4、O3
稀有气体:
He Ne
[概念辨析]同素异形体:同种元素形成的形态、性质不同的单质。
【思考】1.单质种类多还是元素种类多?
2.只含一种元素的物质是纯净物吗?
3.同素异形体之间的转化属于物理变化还是化学变化?
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3、Mn2O7、CrO3
CaO、CuO、Na2O
CO、NO
氧
化
物
从组成元素
非金属氧化物
金属氧化物
Al2O3
不成盐氧化物
酸性氧化物
(又称酸酐)
碱性氧化物
两性氧化物
从性质
氧化物 = X + O(负价)
酸性氧化物不一定是非金属氧化物,非金属氧化物不一定是酸性氧化物。碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
特殊氧化物:过氧化物
【思考】
(1)金属氧化物一定是碱性氧化物?
(2)非金属氧化物一定是酸性氧化物
(3)酸性氧化物都能溶于水生成相应的酸?
×
×
×
Mn2O7是酸性氧化物
NO、CO
如SiO2是酸性氧化物,但不溶于水
如何判断酸性氧化物和碱性氧化物?
(1)能与水反应:H2O+CO2
H2CO3
(2)能与碱性氧化物反应:CaO+CO2=CaCO3
(3)能与碱反应:CO2+Ca(OH)2=CaCO3↓+H2O
(4)能与某些盐反应:CO2+CaCO3+H2O=Ca(HCO3)2
酸性氧化物的通性
碱性氧化物的通性:
(1)能与水反应:H2O+CaO=Ca(OH)2
(2)能与酸性氧化物反应:Na2O+CO2=Na2CO3
(3)能与酸反应:MgO+2HCl=MgCl2+H2O
(4)能与某些盐反应:
H2O+CaO+Na2CO3=CaCO3↓+2NaOH
酸
H2SO4、HNO3、H3PO4、H2CO3、
CH3COOH
HCl、H2S
H2SO4、HNO3、HCl
H3PO4
H2CO3 、 CH3COOH
从是否含氧
从酸性强弱分
从电离产生的H+数目
HNO3、HCl、 CH3COOH、H3PO2
H2SO4、H2CO3、H2S、H3PO3
H3PO4
从性质分
HCl、HNO3
H2SO4、 H3PO4
酸 = H+ + 酸根离子
易分解的酸(不稳定酸):HClO、H2CO3、H2SO3、HNO3。
强氧化性酸:浓H2SO4、HNO3、HMnO4、HClO。(指成酸元素氧化性)
弱氧化性酸:稀HCl、稀H2SO4。
还原性酸:H2S、浓HCl、HBr、HI、H2SO3 。
酸的通性
1. 与碱反应生成相应的盐和水 HCl+NaOH
2. 与碱性氧化物反应生成盐和水 HCl+Na2O
3. 与盐反应生成新盐和新酸 HCl+AgNO3
4. 与活泼金属反应生成盐和氢气 HCl+Zn
5. 遇酸碱指示剂变色(紫色石蕊试液—变红,酚酞—不变色)
碱
NaOH KOH Ba(OH)2
Cu(OH)2 Fe(OH)3 NH3·H2O
从碱性强弱
从电离产生的OH-数目
NaOH KOH NH3·H2O
Ba(OH)2 Fe(OH) 2
Al(OH)3
从溶解性
NaOH KOH Ba(OH)2 NH3·H2O
Cu(OH)2 Fe(OH)3
碱 = 金属离子(铵根离子) + OH-
碱的通性
1. 与酸反应生成相应的盐和水
2. 与酸性氧化物反应生成相应的盐和水
3. 与盐反应生成新盐和新碱
4.遇酸碱指示剂变色(紫色石蕊变蓝,酚酞变红)
NaOH+HNO3
NaOH+CO2
Ca(OH)2+Na2CO3
盐
按溶解性
按酸根是否含氧
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
NaCl、CaCl2
……
酸式盐
碱式盐
正盐
KHSO4、 Ca(H2PO4)2
Cu2(OH)2CO3
NaCl、 BaSO4
按组成
盐 = 金属离子 (或铵根离子) + 酸根离子
无氧酸盐
含氧酸盐
KNO3、KMnO4、FeSO4
盐的通性
1. 与酸反应生成新盐和新酸 Na2CO3+HCl
2. 与碱反应生成新盐和新碱 MgCl2+NaOH
3. 与盐反应生成两种新盐 AgNO3+BaCl2
4. 与金属反应生成新盐和新金属 Fe+CuSO4
所有的盐之间都能发生反应吗?
金属的化学性质:
(1)与非金属反应:2Mg+O2
3Fe+2O2
2Cu+O2
2CuO
2MgO
Fe3O4
(2)与酸反应:Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(3)与盐反应:Fe+CuSO4=FeSO4+Cu
2Al+3CuSO4=Al2(SO4)3+3Cu
物质的转化关系
金属
+O2
金属氧化物
+H2O
碱
盐
非金属
+O2
非金属氧化物
+H2O
酸
盐
盐+水
新碱+新盐
新酸+新盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
四种基本
反应类型
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应:(A+BC=AC+B)
一种单质与化合物反应生成另外一种单质和化合物的化学反应
复分解反应(AB+CD=AD+BC)
由两种化合物互相交换成分,生成另外两种化合物的反应,沉淀、气体、弱电解质
反应类型分类
二、四大基本反应的条件或规律
1.置换反应:
金属+酸→盐+H2↑
(1)金属的活动性比氢强
(2)酸除浓硫酸、硝酸
(3)铁与酸反应生成亚铁盐(+2价)
金属+盐→新金属+新盐
(1)参于反应的盐应可溶
(2)金属的活动性“强”置换“弱”
(3)除K、Ca、Na外
(4)铁与盐反应生成亚铁盐(+2价)
2.复分解反应:生成难电离的物质如:水、气体、沉淀等
酸+盐→新盐+新酸(碳酸盐+酸→新盐+H2O+CO2↑)
弱酸不能与强酸盐反应;低沸点酸不能和高沸点酸盐反应
碱+盐→新碱+新盐
(1)反应物皆可溶
(2)生成物有沉淀
盐+盐→新盐+新盐
(1)反应物皆可溶
(2)生成物有沉淀
1、常见的转化方式 ——单质转化为盐
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
三、物质的转化
2、物质转化的应用——制取物质
(1)制取碱:
方法一:碱性氧化物+水→碱
方法二:盐+碱→碱
(2)工业制取物质:除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求
例:工业制取NaOH,采用电解饱和食盐水的方法,过去也曾用盐
(Na2CO3)和碱(Ca(OH)2)反应制取
同类物质常常具有许多共性。因此可以通过物质所属类别,推测其具有的性质。
例如:SO2和CO2同为酸性氧化物,试根据酸性氧化物具有的通性(或CO2的性质),推测二氧化硫具有的性质,用化学方程式表示:
①SO2+H2O=== ;
②SO2+CaO=== ;
③SO2+Ca(OH)2=== 。
H2SO3
CaSO3
CaSO3↓+H2O
知识拓展
1、下表中物质的分类组合完全正确的是( )
A B C D
氧化物 H2O H2O2 CuO KO2
酸 H2CO3 CH3COOH NaHCO3 HCl
碱 Mg(OH)Cl Na2CO3 Fe(OH)3 NaOH
盐 BaSO4 CuSO4·5H2O NaH2PO4 Na2S
D
针对训练
2、现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH和⑩NaHCO3。
其中属于混合物的是_____(填序号,下同);属于酸的是________;属于盐的是________;属于氧化物的是______;
②⑧ ⑤ ⑦⑩ ①④
1.分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是( )
A.H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物
B.HCl、H2SO4、HNO3都是含氧酸
C.非金属氧化物一定是酸性氧化物
D.Na2CO3、BaSO4、NH4Cl都属于盐
D
针对训练
2.下列叙述正确的是( )
A.非金属氧化物都是酸性氧化物
B.碱性氧化物都是金属氧化物
C.酸性氧化物都能与水反应生成酸
D.酸性氧化物都不能跟酸反应
B
① , ;
② , ;
③ , ;
④ , ;
⑤ , ;
⑥ , 。
3.以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型
2Ca+O2 == 2CaO
化合反应
CaO+H2O == Ca(OH)2
化合反应
CaO+CO2 == CaCO3
化合反应
Ca(OH)2+Na2CO3 == CaCO3↓+2NaOH
复分解反应
Ca(OH)2+2HCl == CaCl2+2H2O
复分解反应
CaCO3+2HCl == CaCl2+CO2↑+H2O
复分解反应
4、下列变化不能通过一步化学反应实现的是( )
A. BaCl2→BaSO4 B. CuO→Cu(OH)2
C. NaOH→Na2SO3 D. MgSO4→Mg(OH)2
E. Fe→FeCl2 F. Na2O→Na2CO3
B
D
