8.3 金属资源的利用和保护 课件(共46张PPT)人教版 九年级下册
文档属性
| 名称 | 8.3 金属资源的利用和保护 课件(共46张PPT)人教版 九年级下册 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 20:04:35 | ||
图片预览










文档简介
(共46张PPT)
第八单元 金属和金属材料
8.3 金属资源的利用和保护
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
常见的金属资源
铁的冶炼
含杂质物质的化学方程式的计算
铁生锈的条件及防护
金属资源的保护
感悟新知
知识点
1
1. 地球上的金属资源广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余的都以化合物的形式存在。
金属资源的概况
知1-讲
感悟新知
2. 工业上从含有金属元素并有开采价值的矿石中提炼金属。常见的金属矿石有:
知1-讲
呈黑色,具有磁性
呈红棕色
矿石 赤铁矿 磁铁矿 菱铁矿 黄铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 Fe2O3 Fe3O4 FeCO3 FeS2 Al2O3 CuFeS2 Cu2S
感悟新知
提示:矿石均为混合物,赤铁矿、磁铁矿、菱铁矿、黄铁矿是常见的铁矿石,工业上常用赤铁矿和磁铁矿来炼铁,因为它们的铁元素含量较高,且不会造成环境污染。
知1-讲
感悟新知
特别提醒:
化学性质比较活泼的金属在自然界以化合物形式存在,如铁、铝等,化学性质稳定的以单质形式存在,如金、银。
知1-讲
知1-练
感悟新知
[改编·晋中] 大自然向人类提供了丰富的金属矿物资源,以下四种矿石中,最适宜炼铁的是( )
A. 赤铁矿(主要成分是Fe2O3)
B. 炉甘石(主要成分是ZnCO3)
C. 铝土矿(主要成分是Al2O3)
D. 黄铁矿(主要成分是FeS2)
例1
A
考向 金属矿石的选择
感悟新知
解题秘方:从经济效益角度分析,要考虑铁矿石所含铁元素的质量分数;从环境保护角度分析,要考虑在炼铁生产中是否会产生污染环境的物质。
解:可用于炼铁的矿石中必须含有铁元素。赤铁矿和黄铁矿中含有铁元素,但黄铁矿中含硫元素,冶炼时会生成污染空气的SO2,故最适宜炼铁的是赤铁矿。
知1-练
感悟新知
知识点
2
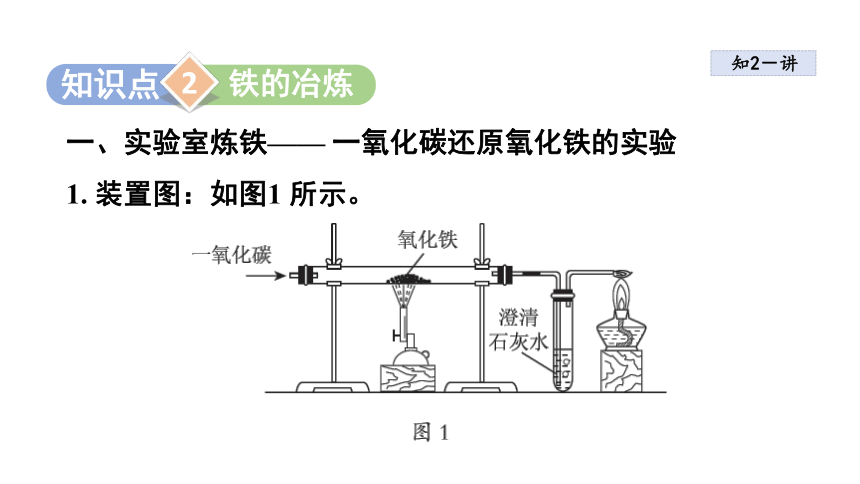
一、实验室炼铁—— 一氧化碳还原氧化铁的实验
1. 装置图:如图1 所示。
铁的冶炼
知2-讲
感悟新知
2. 实验步骤
检查装置的气密性→装入药品并固定装置→点燃酒精灯→向玻璃管内通入CO 气体→点燃酒精喷灯,加热氧化铁→熄灭酒精喷灯,停止加热→继续通入CO 气体至冷却至室温→熄灭酒精灯。
3. 实验现象
红色粉末逐渐变为黑色,澄清的石灰水变浑浊,尾气燃烧产生蓝色火焰。
知2-讲
感悟新知
4. 实验注意事项
(1) 先通入一氧化碳气体,排尽装置内的空气,然后再点燃酒精喷灯,防止一氧化碳与空气混合加热时发生爆炸。
(2) 实验完毕后要先撤酒精喷灯,继续通入一氧化碳气体,直到玻璃管冷却,防止高温的铁与空气接触,被再次氧化;同时可防止液体倒吸,炸裂玻璃管。
(3) 尾气中含有一氧化碳,一氧化碳有毒,可以用收集或点燃的方法处理,以防污染大气。
知2-讲
CO“早出晚归”,
酒精喷灯“迟到早退”
感悟新知
特别提醒:
1. 石灰石的主要作用:将矿石中的二氧化硅转化为炉渣而除去。
2. 工业炼铁炼出的不是纯铁,而是主铁;实验室炼出的为纯铁。
3. 工业炼铁的还原剂是CO,而不是焦炭。
知2-讲
感悟新知
二、工业炼铁
知2-讲
炼铁原理 在高温条件下, 利用高炉内反应生成的一氧化碳把铁从铁矿石中还原出来
原料及作用 铁矿石( 提供铁元素)
空气( 提供氧气)
焦炭: 提供反应所需热量,提供还原剂CO
石灰石: 使铁矿石中的脉石转变成炉渣而除去
感悟新知
知2-讲
主要设备 高炉
发生的有关化学反应 (2)C+O2===CO2
(3)C + CO2===2CO
(1) 3CO+ Fe2O3
=== 2Fe+3CO2
产品 生铁( 含碳量为2% ~4. 3% 并含少量磷和硫的铁合金, 不是纯铁)
高温
点燃
高温
感悟新知
拓展视野:
冶炼金属的常用方法:
1. 电解法:适用于排在金属活动性顺序中铝及其前面的较活泼金属的冶炼。
2. 热还原法:适用于位于金属活动性顺序中从Zn 至Cu 的冶炼,如:2CuO+C===2Cu+CO2↑,CuO+H2===Cu+H2O。
3. 热分解法: 适用于Ag、Hg 等金属的冶炼, 如:2HgO ====2Hg+O2 ↑。
△
△
△
知2-讲
知2-练
感悟新知
[中考·丹东] 在实验室里
可以利用如图2 所示的装置
进行还原氧化铁的实验。
(1)在点燃酒精喷灯前先通入一段时间一氧化碳的目的是 _______________________________________。
例2
排尽装置中的空气,防止加热时发生爆炸
考向 铁的冶炼
题型1 一氧化碳还原氧化铁实验
知2-练
感悟新知
(2)玻璃管中反应的化学方程式为 __________________________。
(3)装置B 的作用是_________________________ 。
(4)实验中还需补充的一个装置C 是 ____________________
____________________
___________________。
检验有无二氧化碳生成
在右端导管用酒精灯点燃尾气或用气球收集尾气
Fe2O3+3CO ====2Fe+3CO2
高温
感悟新知
解题秘方:了解实验原理、实验步骤、实验现象及尾气处理的目的是解题关键。
解:(2)一氧化碳具有还原性,高温下能与氧化铁反应生成铁和二氧化碳。(3)二氧化碳能使澄清的石灰水变浑浊,装置B 的作用是检验有无二氧化碳生成。(4)一氧化碳有毒,直接排放到空气中会污染环境,在右端导管用酒精灯点燃尾气或用气球收集尾气。
知2-练
知2-练
感悟新知
[中考·成都] 我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”,其生产过程可用下图表示。
资料:①潮泥灰主要成分是石灰石。②铁的熔点是 1 535 ℃。根据图文回答下列问题。
例3
题型2 钢铁冶炼工艺
知2-练
感悟新知
(1)常见的铁矿石有赤铁矿和 ____________(合理即可) 。
(2)不断鼓入空气的目的是 ______________。
(3)炼铁炉中生成铁的化学方程式为
_________________________________________________。
磁铁矿
提高炉温
Fe2O3+3CO===2Fe+3CO2( 或Fe3O4+4CO===3Fe+4CO2)
高温
高温
知2-练
感悟新知
(4)撒入潮泥灰的主要作用是 _______________________________________。不断翻炒液态生铁,是为了降低 ___________元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁_____ ,易于加工。
将铁矿石中的二氧化硅转化为炉渣而除去
碳( 或C)
低
感悟新知
知2-练
解题秘方:结合工艺流程,全面了解钢铁冶炼
的原理及各原料的作用是解题的关键。
解:(1)常见的铁矿石有赤铁矿和磁铁矿。 (2)不断鼓入空气的目的是使碳与氧气反应,提高炉温。 (3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式为Fe2O3+3CO ====2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式为Fe3O4+4CO ====3Fe+4CO2;
高温
高温
感悟新知
(4)撒入潮泥灰的主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的主要区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量。 (5)合金的熔点一般低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
知2-练
感悟新知
知识点
3
1. 化学方程式表示的各物质的质量关系是纯净物间的质量关系。实际生产中,原料和产物常为混合物,当已知量中含有杂质时,必须先将它们换算成纯净物的质量,再代入化学方程式进行计算。
含杂质物质的化学方程式的计算
知3-讲
感悟新知
2. 含杂质物质的有关化学方程式的计算步骤
(1)将含杂质物质质量换算成纯净物的质量;
(2)将纯净物质量代入化学方程式进行计算;
(3) 将计算得到的纯净物质量换算成含杂质物质的质量。
知3-讲
感悟新知
知3-讲
知识链接:
计算时涉及的公式有:
含杂质物质质量
× 纯净物质量分数
÷ 纯净物质量分数
纯净物质量;
物质的纯度= ×100%=1- 杂质的质量分数。
知3-练
感悟新知
[中考·青海] 根据Fe3O4+4CO ====3Fe+4CO2 的反应原理,工业上可用来冶炼铁。现用100 t 含四氧化三铁为46.4% 的某铁矿石冶炼金属铁。请完成下列问题,写出必要的计算过程。
(1)100 t 该铁矿石中含四氧化三铁的质量是多少?
(2)理论上可炼出含铁96% 的生铁的质量是多少?
例4
考向 含杂质物质的相关化学方程式的计算
高温
知3-练
感悟新知
解:(1)铁矿石中含四氧化三铁的质量是100 t×46.4%=46.4 t。
(2)方法一:设理论上可炼出含铁96% 的生铁的质量是x。
Fe3O4+4CO ====3Fe+4CO2
232 168
46.4 t 96%·x
x=35 t
高温
知3-练
感悟新知
方法二:本题还可利用“守恒法”即化学反应前后元素的质量不变,根据化学式进行计算。即四氧化三铁中所含铁元素的质量等于炼制的生铁中铁元素的质量,则有:
46.4 t× ×100%÷96%=35 t。
答:(1)100 t 该铁矿石中含四氧化三铁的质量是46.4 t;
(2)理论上可炼出含铁96% 的生铁的质量是35 t。
感悟新知
解题秘方: (1)根据混合物中某物质的质量=混合物的质量× 该物质的质量分数分析解答。(2)由四氧化三铁的质量、生铁中铁的质量分数,根据化学方程式可以列式计算出炼出生铁的质量。
知3-练
感悟新知
知识点
4
1. 探究铁制品锈蚀的条件
金属的锈蚀与防护
知4-讲
试管1 试管2 试管3
实验装置
感悟新知
金属的锈蚀与防护
知4-讲
试管1 试管2 试管3
反应条件 与O2、水接触 只与水接触 只与O2 接触
实验现象 铁钉生锈 铁钉不生锈 铁钉不生锈
实验结论 铁生锈的条件是铁和氧气、水同时接触
感悟新知
2. 铁锈的主要成分是Fe2O3·xH2O,结构疏松,呈红棕色。铁制品生锈后,应及时清除铁锈。
3. 防止铁生锈的措施
(1) 根据钢铁生锈的条件,防止钢铁生锈的基本思路是破坏其锈蚀的条件,使铁制品隔绝氧气和水。
(2)在生产生活中防止钢铁生锈的方法主要包括:
知4-讲
感悟新知
知4-讲
干 保持钢铁制品表面洁净和干燥
膜 在钢铁表面覆盖保护层,如在车、船的表面喷涂油漆,在机械表面涂油,在铁制品表面烧制搪瓷等
镀 在钢铁表面镀一层耐腐蚀的金属,如在钢铁表面镀锌、镀铬等
烤 用化学方法使钢铁表面形成致密的氧化膜,如锯条上的烤蓝等
改 加入其他金属,改变金属组成,如在钢铁中加入镍制成不锈钢,可以增强其耐腐蚀能力
感悟新知
知识拓展:
1. 铁在与氧气和水同时接触时才能生锈,因此在设计实验探究铁生锈的条件时,可采用控制变量法,使铁钉只与氧气、只与水、与氧气和水同时接触,比较现象得出结论。
知4-讲
感悟新知
2. 铁制品表面的铁锈应及时清除,而铝“生锈”时表面形成的致密的氧化膜可以隔绝空气,可防止金属腐蚀,不能除去。
3. 铁在食盐水中生锈的速率会加快。
4. 破坏铁生锈的任一条件即可防锈,如隔绝水或隔绝氧气。
知4-讲
知4-练
感悟新知
[中考·日照] 如图4 是探究铁钉锈蚀条件的4 个实验,
一段时间后观察现象。
例5
考向 铁生锈的条件及防锈措施
题型1 探究铁生锈的条件
知4-练
感悟新知
下列说法不正确的是( )
A. ①中甲、乙、丙三处比较,生锈最明显的地方是甲
B. ①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C. ③中附着在棉花上的氯
化钙的作用是作干燥剂
D. 四个实验中,生锈最快
的是④中的铁钉
A
感悟新知
解题秘方:根据铁生锈的条件(与O2、H2O 同时
接触),运用控制变量法对照实验条件分析得出结论。
解:①中的铁钉与氧气和水同时接触,特别是乙处,所以①中铁钉生锈,乙处生锈最明显,A 错误;②中铁钉只与水接触,不易生锈,③中氯化钙吸收空气中的水分,铁钉只与氧气接触,未生锈,C 正确;①②对比说明铁生锈需要氧气,①③对比说明铁生锈需要水,B 正确;④是往水中通入氧气,使铁钉与氧气和水充分接触,所以生锈最快,D 正确。
知4-练
知4-练
感悟新知
[中考·柳州] 柳州市被称为“桥梁博物馆”,刚建成的凤凰岭大桥成了“桥梁博物馆”的新成员,大桥的桥体使用了大量的金属材料。下列对桥梁中使用的金属材料保护措施不正确的是( )
A. 经常用浓盐酸清洗金属材料 B. 在金属材料表面刷油漆
C. 在金属材料表面镀保护层
D. 改变金属内部结构制成防腐合金
例6
A
题型2 防止铁生锈的方法
感悟新知
解题秘方:破坏铁生锈的条件(使铁与O2 或H2O 隔绝)即可防止铁生锈。
解:大桥的桥体使用的金属(主要是铁)能与浓盐酸反应,经常用浓盐酸清洗金属材料,金属材料易锈蚀,A 不正确;在金属材料表面刷油漆、镀保护层,能隔绝氧气和水,能防止金属材料生锈,B、C 正确;改变金属内部结构制成防腐合金,能防止金属材料生锈,D 正确。
知4-练
感悟新知
知识点
5
金属资源是不可再生的,且储量有限。金属资源的保护措施:
(1)防止金属锈蚀。(2)回收利用废旧金属。
(3)有计划合理地开采矿物。(4)寻找金属替代品。
金属资源的保护
知5-讲
节约资源及冶炼成本,减少污染
感悟新知
特别提醒:
废旧金属的随意丢弃、乱开采矿物资源不仅会造成资源浪费,还会造成环境污染。
知5-讲
知5-练
感悟新知
[中考·长沙] 我国的矿物种类比较齐全,储量很丰富,但是矿物不能再生。下列能保护金属资源的是( )
A. 废旧金属不需要回收利用
B. 矿物资源无限,可以任意开采
C. 寻找金属代用品
D. 将铁钉放置于潮湿的空气中
例7
C
考向 保护金属资源的措施
感悟新知
解题秘方:从防止金属腐蚀,合理开发矿物,回收利用废旧金属,寻找金属代用品等方面来分析判断。
解:回收利用废旧金属能保护金属资源,减少环境污染,A 错误;矿物资源是有限的,要合理开采,B 错误;寻找金属代用品,可以节约金属资源,保护金属资源,C 正确;将铁钉放置于潮湿的空气中,铁钉易生锈,不能保护金属资源,D 错误。
知5-练
课堂小结
金属资源
存在与分布
利用(铁的冶炼)
腐蚀(铁生锈)
保护
第八单元 金属和金属材料
8.3 金属资源的利用和保护
逐点
导讲练
课堂小结
作业提升
学习目标
课时讲解
1
课时流程
2
常见的金属资源
铁的冶炼
含杂质物质的化学方程式的计算
铁生锈的条件及防护
金属资源的保护
感悟新知
知识点
1
1. 地球上的金属资源广泛地存在于地壳和海洋中,除少数很不活泼的金属如金、银等有单质形式存在外,其余的都以化合物的形式存在。
金属资源的概况
知1-讲
感悟新知
2. 工业上从含有金属元素并有开采价值的矿石中提炼金属。常见的金属矿石有:
知1-讲
呈黑色,具有磁性
呈红棕色
矿石 赤铁矿 磁铁矿 菱铁矿 黄铁矿 铝土矿 黄铜矿 辉铜矿
主要成分 Fe2O3 Fe3O4 FeCO3 FeS2 Al2O3 CuFeS2 Cu2S
感悟新知
提示:矿石均为混合物,赤铁矿、磁铁矿、菱铁矿、黄铁矿是常见的铁矿石,工业上常用赤铁矿和磁铁矿来炼铁,因为它们的铁元素含量较高,且不会造成环境污染。
知1-讲
感悟新知
特别提醒:
化学性质比较活泼的金属在自然界以化合物形式存在,如铁、铝等,化学性质稳定的以单质形式存在,如金、银。
知1-讲
知1-练
感悟新知
[改编·晋中] 大自然向人类提供了丰富的金属矿物资源,以下四种矿石中,最适宜炼铁的是( )
A. 赤铁矿(主要成分是Fe2O3)
B. 炉甘石(主要成分是ZnCO3)
C. 铝土矿(主要成分是Al2O3)
D. 黄铁矿(主要成分是FeS2)
例1
A
考向 金属矿石的选择
感悟新知
解题秘方:从经济效益角度分析,要考虑铁矿石所含铁元素的质量分数;从环境保护角度分析,要考虑在炼铁生产中是否会产生污染环境的物质。
解:可用于炼铁的矿石中必须含有铁元素。赤铁矿和黄铁矿中含有铁元素,但黄铁矿中含硫元素,冶炼时会生成污染空气的SO2,故最适宜炼铁的是赤铁矿。
知1-练
感悟新知
知识点
2
一、实验室炼铁—— 一氧化碳还原氧化铁的实验
1. 装置图:如图1 所示。
铁的冶炼
知2-讲
感悟新知
2. 实验步骤
检查装置的气密性→装入药品并固定装置→点燃酒精灯→向玻璃管内通入CO 气体→点燃酒精喷灯,加热氧化铁→熄灭酒精喷灯,停止加热→继续通入CO 气体至冷却至室温→熄灭酒精灯。
3. 实验现象
红色粉末逐渐变为黑色,澄清的石灰水变浑浊,尾气燃烧产生蓝色火焰。
知2-讲
感悟新知
4. 实验注意事项
(1) 先通入一氧化碳气体,排尽装置内的空气,然后再点燃酒精喷灯,防止一氧化碳与空气混合加热时发生爆炸。
(2) 实验完毕后要先撤酒精喷灯,继续通入一氧化碳气体,直到玻璃管冷却,防止高温的铁与空气接触,被再次氧化;同时可防止液体倒吸,炸裂玻璃管。
(3) 尾气中含有一氧化碳,一氧化碳有毒,可以用收集或点燃的方法处理,以防污染大气。
知2-讲
CO“早出晚归”,
酒精喷灯“迟到早退”
感悟新知
特别提醒:
1. 石灰石的主要作用:将矿石中的二氧化硅转化为炉渣而除去。
2. 工业炼铁炼出的不是纯铁,而是主铁;实验室炼出的为纯铁。
3. 工业炼铁的还原剂是CO,而不是焦炭。
知2-讲
感悟新知
二、工业炼铁
知2-讲
炼铁原理 在高温条件下, 利用高炉内反应生成的一氧化碳把铁从铁矿石中还原出来
原料及作用 铁矿石( 提供铁元素)
空气( 提供氧气)
焦炭: 提供反应所需热量,提供还原剂CO
石灰石: 使铁矿石中的脉石转变成炉渣而除去
感悟新知
知2-讲
主要设备 高炉
发生的有关化学反应 (2)C+O2===CO2
(3)C + CO2===2CO
(1) 3CO+ Fe2O3
=== 2Fe+3CO2
产品 生铁( 含碳量为2% ~4. 3% 并含少量磷和硫的铁合金, 不是纯铁)
高温
点燃
高温
感悟新知
拓展视野:
冶炼金属的常用方法:
1. 电解法:适用于排在金属活动性顺序中铝及其前面的较活泼金属的冶炼。
2. 热还原法:适用于位于金属活动性顺序中从Zn 至Cu 的冶炼,如:2CuO+C===2Cu+CO2↑,CuO+H2===Cu+H2O。
3. 热分解法: 适用于Ag、Hg 等金属的冶炼, 如:2HgO ====2Hg+O2 ↑。
△
△
△
知2-讲
知2-练
感悟新知
[中考·丹东] 在实验室里
可以利用如图2 所示的装置
进行还原氧化铁的实验。
(1)在点燃酒精喷灯前先通入一段时间一氧化碳的目的是 _______________________________________。
例2
排尽装置中的空气,防止加热时发生爆炸
考向 铁的冶炼
题型1 一氧化碳还原氧化铁实验
知2-练
感悟新知
(2)玻璃管中反应的化学方程式为 __________________________。
(3)装置B 的作用是_________________________ 。
(4)实验中还需补充的一个装置C 是 ____________________
____________________
___________________。
检验有无二氧化碳生成
在右端导管用酒精灯点燃尾气或用气球收集尾气
Fe2O3+3CO ====2Fe+3CO2
高温
感悟新知
解题秘方:了解实验原理、实验步骤、实验现象及尾气处理的目的是解题关键。
解:(2)一氧化碳具有还原性,高温下能与氧化铁反应生成铁和二氧化碳。(3)二氧化碳能使澄清的石灰水变浑浊,装置B 的作用是检验有无二氧化碳生成。(4)一氧化碳有毒,直接排放到空气中会污染环境,在右端导管用酒精灯点燃尾气或用气球收集尾气。
知2-练
知2-练
感悟新知
[中考·成都] 我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”,其生产过程可用下图表示。
资料:①潮泥灰主要成分是石灰石。②铁的熔点是 1 535 ℃。根据图文回答下列问题。
例3
题型2 钢铁冶炼工艺
知2-练
感悟新知
(1)常见的铁矿石有赤铁矿和 ____________(合理即可) 。
(2)不断鼓入空气的目的是 ______________。
(3)炼铁炉中生成铁的化学方程式为
_________________________________________________。
磁铁矿
提高炉温
Fe2O3+3CO===2Fe+3CO2( 或Fe3O4+4CO===3Fe+4CO2)
高温
高温
知2-练
感悟新知
(4)撒入潮泥灰的主要作用是 _______________________________________。不断翻炒液态生铁,是为了降低 ___________元素的含量。
(5)钢的性能优良,如钢的熔点比纯铁_____ ,易于加工。
将铁矿石中的二氧化硅转化为炉渣而除去
碳( 或C)
低
感悟新知
知2-练
解题秘方:结合工艺流程,全面了解钢铁冶炼
的原理及各原料的作用是解题的关键。
解:(1)常见的铁矿石有赤铁矿和磁铁矿。 (2)不断鼓入空气的目的是使碳与氧气反应,提高炉温。 (3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式为Fe2O3+3CO ====2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式为Fe3O4+4CO ====3Fe+4CO2;
高温
高温
感悟新知
(4)撒入潮泥灰的主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的主要区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量。 (5)合金的熔点一般低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
知2-练
感悟新知
知识点
3
1. 化学方程式表示的各物质的质量关系是纯净物间的质量关系。实际生产中,原料和产物常为混合物,当已知量中含有杂质时,必须先将它们换算成纯净物的质量,再代入化学方程式进行计算。
含杂质物质的化学方程式的计算
知3-讲
感悟新知
2. 含杂质物质的有关化学方程式的计算步骤
(1)将含杂质物质质量换算成纯净物的质量;
(2)将纯净物质量代入化学方程式进行计算;
(3) 将计算得到的纯净物质量换算成含杂质物质的质量。
知3-讲
感悟新知
知3-讲
知识链接:
计算时涉及的公式有:
含杂质物质质量
× 纯净物质量分数
÷ 纯净物质量分数
纯净物质量;
物质的纯度= ×100%=1- 杂质的质量分数。
知3-练
感悟新知
[中考·青海] 根据Fe3O4+4CO ====3Fe+4CO2 的反应原理,工业上可用来冶炼铁。现用100 t 含四氧化三铁为46.4% 的某铁矿石冶炼金属铁。请完成下列问题,写出必要的计算过程。
(1)100 t 该铁矿石中含四氧化三铁的质量是多少?
(2)理论上可炼出含铁96% 的生铁的质量是多少?
例4
考向 含杂质物质的相关化学方程式的计算
高温
知3-练
感悟新知
解:(1)铁矿石中含四氧化三铁的质量是100 t×46.4%=46.4 t。
(2)方法一:设理论上可炼出含铁96% 的生铁的质量是x。
Fe3O4+4CO ====3Fe+4CO2
232 168
46.4 t 96%·x
x=35 t
高温
知3-练
感悟新知
方法二:本题还可利用“守恒法”即化学反应前后元素的质量不变,根据化学式进行计算。即四氧化三铁中所含铁元素的质量等于炼制的生铁中铁元素的质量,则有:
46.4 t× ×100%÷96%=35 t。
答:(1)100 t 该铁矿石中含四氧化三铁的质量是46.4 t;
(2)理论上可炼出含铁96% 的生铁的质量是35 t。
感悟新知
解题秘方: (1)根据混合物中某物质的质量=混合物的质量× 该物质的质量分数分析解答。(2)由四氧化三铁的质量、生铁中铁的质量分数,根据化学方程式可以列式计算出炼出生铁的质量。
知3-练
感悟新知
知识点
4
1. 探究铁制品锈蚀的条件
金属的锈蚀与防护
知4-讲
试管1 试管2 试管3
实验装置
感悟新知
金属的锈蚀与防护
知4-讲
试管1 试管2 试管3
反应条件 与O2、水接触 只与水接触 只与O2 接触
实验现象 铁钉生锈 铁钉不生锈 铁钉不生锈
实验结论 铁生锈的条件是铁和氧气、水同时接触
感悟新知
2. 铁锈的主要成分是Fe2O3·xH2O,结构疏松,呈红棕色。铁制品生锈后,应及时清除铁锈。
3. 防止铁生锈的措施
(1) 根据钢铁生锈的条件,防止钢铁生锈的基本思路是破坏其锈蚀的条件,使铁制品隔绝氧气和水。
(2)在生产生活中防止钢铁生锈的方法主要包括:
知4-讲
感悟新知
知4-讲
干 保持钢铁制品表面洁净和干燥
膜 在钢铁表面覆盖保护层,如在车、船的表面喷涂油漆,在机械表面涂油,在铁制品表面烧制搪瓷等
镀 在钢铁表面镀一层耐腐蚀的金属,如在钢铁表面镀锌、镀铬等
烤 用化学方法使钢铁表面形成致密的氧化膜,如锯条上的烤蓝等
改 加入其他金属,改变金属组成,如在钢铁中加入镍制成不锈钢,可以增强其耐腐蚀能力
感悟新知
知识拓展:
1. 铁在与氧气和水同时接触时才能生锈,因此在设计实验探究铁生锈的条件时,可采用控制变量法,使铁钉只与氧气、只与水、与氧气和水同时接触,比较现象得出结论。
知4-讲
感悟新知
2. 铁制品表面的铁锈应及时清除,而铝“生锈”时表面形成的致密的氧化膜可以隔绝空气,可防止金属腐蚀,不能除去。
3. 铁在食盐水中生锈的速率会加快。
4. 破坏铁生锈的任一条件即可防锈,如隔绝水或隔绝氧气。
知4-讲
知4-练
感悟新知
[中考·日照] 如图4 是探究铁钉锈蚀条件的4 个实验,
一段时间后观察现象。
例5
考向 铁生锈的条件及防锈措施
题型1 探究铁生锈的条件
知4-练
感悟新知
下列说法不正确的是( )
A. ①中甲、乙、丙三处比较,生锈最明显的地方是甲
B. ①②对比说明铁生锈需要空气,①③对比说明铁生锈需要水
C. ③中附着在棉花上的氯
化钙的作用是作干燥剂
D. 四个实验中,生锈最快
的是④中的铁钉
A
感悟新知
解题秘方:根据铁生锈的条件(与O2、H2O 同时
接触),运用控制变量法对照实验条件分析得出结论。
解:①中的铁钉与氧气和水同时接触,特别是乙处,所以①中铁钉生锈,乙处生锈最明显,A 错误;②中铁钉只与水接触,不易生锈,③中氯化钙吸收空气中的水分,铁钉只与氧气接触,未生锈,C 正确;①②对比说明铁生锈需要氧气,①③对比说明铁生锈需要水,B 正确;④是往水中通入氧气,使铁钉与氧气和水充分接触,所以生锈最快,D 正确。
知4-练
知4-练
感悟新知
[中考·柳州] 柳州市被称为“桥梁博物馆”,刚建成的凤凰岭大桥成了“桥梁博物馆”的新成员,大桥的桥体使用了大量的金属材料。下列对桥梁中使用的金属材料保护措施不正确的是( )
A. 经常用浓盐酸清洗金属材料 B. 在金属材料表面刷油漆
C. 在金属材料表面镀保护层
D. 改变金属内部结构制成防腐合金
例6
A
题型2 防止铁生锈的方法
感悟新知
解题秘方:破坏铁生锈的条件(使铁与O2 或H2O 隔绝)即可防止铁生锈。
解:大桥的桥体使用的金属(主要是铁)能与浓盐酸反应,经常用浓盐酸清洗金属材料,金属材料易锈蚀,A 不正确;在金属材料表面刷油漆、镀保护层,能隔绝氧气和水,能防止金属材料生锈,B、C 正确;改变金属内部结构制成防腐合金,能防止金属材料生锈,D 正确。
知4-练
感悟新知
知识点
5
金属资源是不可再生的,且储量有限。金属资源的保护措施:
(1)防止金属锈蚀。(2)回收利用废旧金属。
(3)有计划合理地开采矿物。(4)寻找金属替代品。
金属资源的保护
知5-讲
节约资源及冶炼成本,减少污染
感悟新知
特别提醒:
废旧金属的随意丢弃、乱开采矿物资源不仅会造成资源浪费,还会造成环境污染。
知5-讲
知5-练
感悟新知
[中考·长沙] 我国的矿物种类比较齐全,储量很丰富,但是矿物不能再生。下列能保护金属资源的是( )
A. 废旧金属不需要回收利用
B. 矿物资源无限,可以任意开采
C. 寻找金属代用品
D. 将铁钉放置于潮湿的空气中
例7
C
考向 保护金属资源的措施
感悟新知
解题秘方:从防止金属腐蚀,合理开发矿物,回收利用废旧金属,寻找金属代用品等方面来分析判断。
解:回收利用废旧金属能保护金属资源,减少环境污染,A 错误;矿物资源是有限的,要合理开采,B 错误;寻找金属代用品,可以节约金属资源,保护金属资源,C 正确;将铁钉放置于潮湿的空气中,铁钉易生锈,不能保护金属资源,D 错误。
知5-练
课堂小结
金属资源
存在与分布
利用(铁的冶炼)
腐蚀(铁生锈)
保护
同课章节目录
