3.2.1 水的电离课件(共26张ppt)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.1 水的电离课件(共26张ppt)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 00:00:00 | ||
图片预览




文档简介
课时1
水的电离
第二节 水的电离和溶液的PH
学习目标
1、了解水的电离平衡及其影响因素
2、掌握水的离子积——Kw
3、会计算酸碱溶液中水电离出的H+浓度或OH-的浓度,能分析应用水的电离平衡曲线
在用电安全教育中,强调不能用湿手触摸带电的电器,否则会有触电的危险。
问题:1.为什么湿手触摸带电的电器会触电,水能导电吗?
2.请设计实验验证。
新课导入
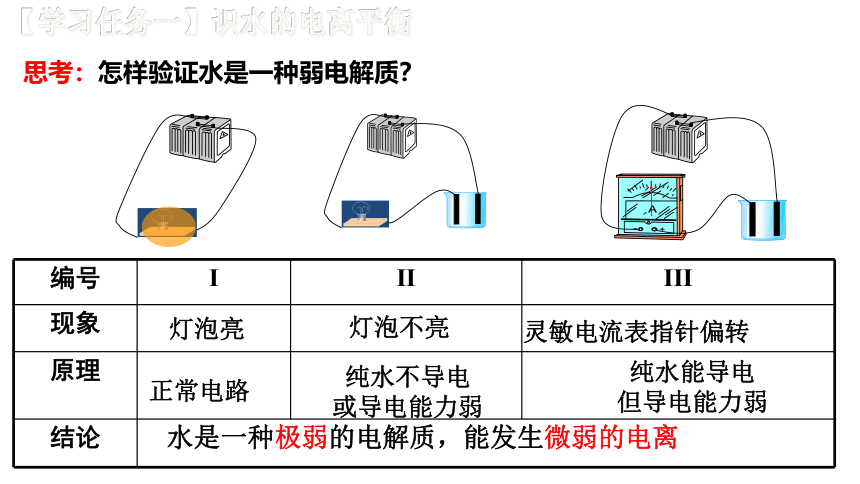
编号
I
II
III
现象
原理
结论
灯泡亮
灯泡不亮
灵敏电流表指针偏转
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
纯水能导电
但导电能力弱
【学习任务一】识水的电离平衡
思考:怎样验证水是一种弱电解质?
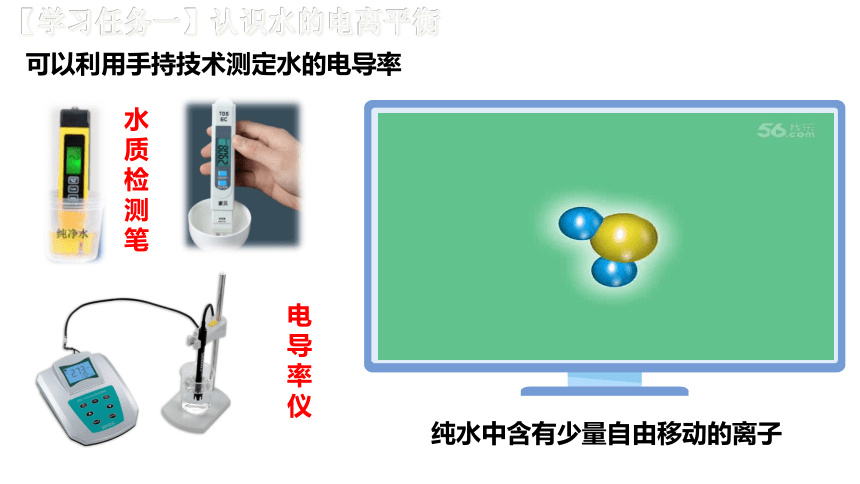
水质检测笔
电导率仪
纯水中含有少量自由移动的离子
可以利用手持技术测定水的电导率
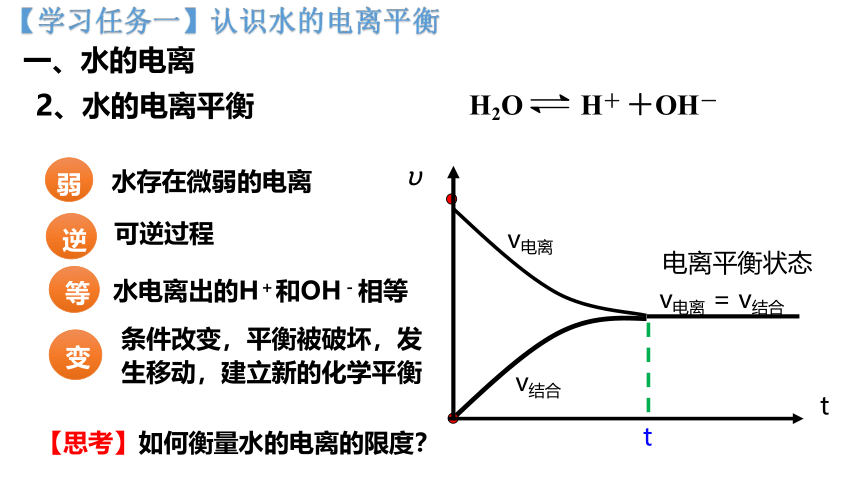
【学习任务一】认识水的电离平衡
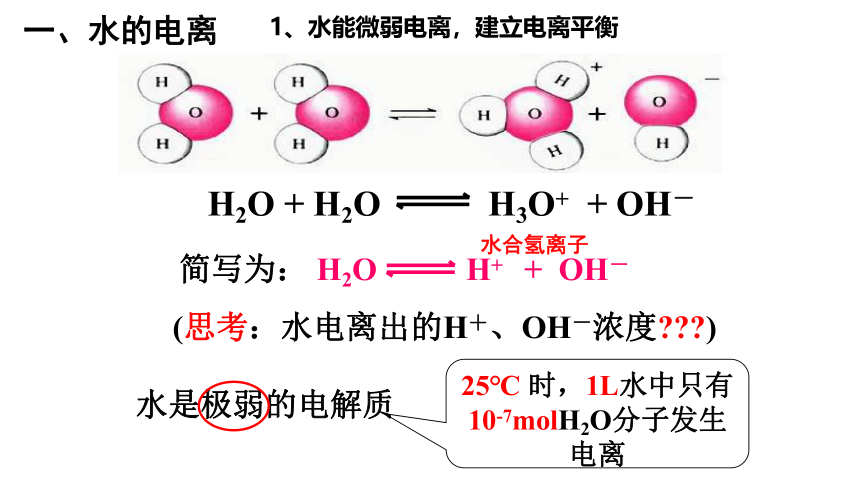
H2O + H2O H3O+ + OH-
一、水的电离
水是极弱的电解质
25℃ 时,1L水中只有10-7molH2O分子发生电离
水合氢离子
简写为: H2O H+ + OH-
(思考:水电离出的H+、OH-浓度???)
1、水能微弱电离,建立电离平衡
【学习任务一】认识水的电离平衡
一、水的电离
2、水的电离平衡
弱
等
逆
变
水存在微弱的电离
水电离出的H+和OH-相等
条件改变,平衡被破坏,发生移动,建立新的化学平衡
可逆过程
v电离
v结合
v电离 = v结合
t
t
υ
电离平衡状态
H2O H+ +OH-
【思考】如何衡量水的电离的限度?
K电离=
c(H+)×c(OH-)
c(H2O)
K电离·c(H2O) = c ( H+)·c( OH-)
H2O H+ + OH-
室温下1L(55.6mol)H2O中,只有1×10-7 molH2O电离,电离的水可以忽略不计,因此C(H2O)可视为常数
KW
(2)表达式:KW=c(H+)·c(OH-)
(1)定义:一定温度时,水(稀溶液)中c(H+)与c(OH-)的乘积是一个常数Kw,即水的离子积常数,简称水的离子积。
常温时,c(H+)=c(OH-)=1×10-7 mol/L
常温时,KW=c(H+)·c(OH-)=1×10-14
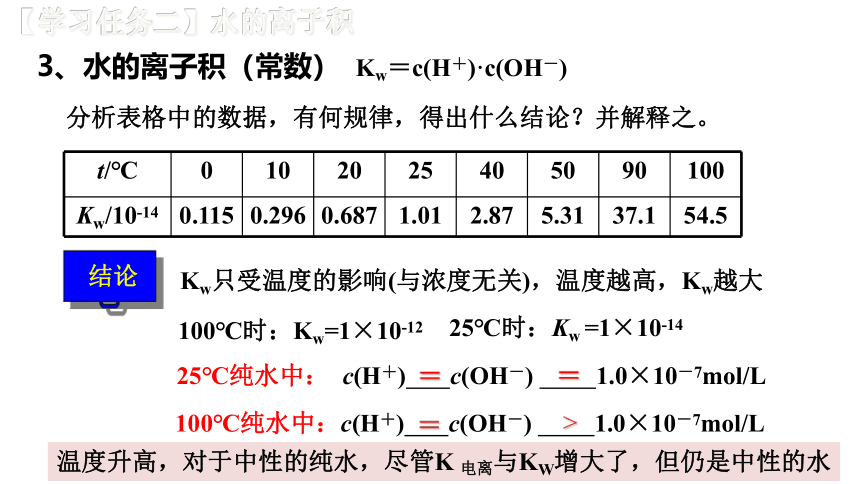
3、水的离子积(常数)
3、水的离子积(常数)
【学习任务二】水的离子积
Kw=c(H+)·c(OH-)
分析表格中的数据,有何规律,得出什么结论?并解释之。
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
Kw只受温度的影响(与浓度无关),温度越高,Kw越大
结论
100℃时:Kw=1×10-12
100℃纯水中:c(H+) c(OH-) 1.0×10-7mol/L
25℃纯水中: c(H+) c(OH-) 1.0×10-7mol/L
>
=
=
=
温度升高,对于中性的纯水,尽管K 电离与KW增大了,但仍是中性的水
25℃时:Kw =1×10-14
注意:
(1)KW只与温度有关(与浓度无关),温度↑, KW值↑。
(2)在纯水或稀溶液中,其中水电离出的H+、OH-永远相等,即c(H+)H2O = c(OH-)H2O 。
(3)KW不仅适应于纯水,也适应于电解质的稀溶液,都有
Kw =C(H+)aq·C(OH-)aq
在常温(25℃)时,c(H+) = c(OH-) = 10-7 mol/L
Kw = c(H+)·c(OH-) = 1×10-14
课堂练习1:下列说法正确的是( )
A.任何水溶液中都存在水的电离平衡。
B.任何水溶液中(不论酸、碱或中性)都存在Kw =10-14。
C.某温度下,某液体c(H+)= 10-7mol/L,则该溶液一定是纯水。
D.25 ℃时,若溶液中c(H+)=1.0×10-6 mol·L-1,则溶液中c(OH-)=1.0×10-8mol·L-1
AD
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
3. 0.1mol/L的NaOH溶液中,
c(OH-)= , c(H+)= 。
由水电离出的c(OH-)水= , c(H+)水= 。
2. 0.1mol/L的盐酸溶液中,
c(H+)= , c(OH-)= 。
由水电离出的c(OH-)水= , c(H+)水= 。
1. 0.1mol/L的NaCl溶液中,
c(OH-)= ,c(H+)= 。
0.1mol/L
10-13mol/L
10-13mol/L
10-13mol/L
0.1mol/L
10-13mol/L
10-13mol/L
10-13mol/L
10-7mol/L
10-7mol/L
即时检测
水的电离方程式为:H2O ? H+ + OH-,?H >0其平衡移动的分析,符合勒夏特列原理。
?
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
通入HCl(g)
通入氨气
加 Na2O
加FeCl3(s)
加入NaHSO4(s)
右移
增大
增大
增大
增大
左移
增大
减小
减小
不变
左移
减小
增大
减小
不变
左移
减小
增大
减小
不变
右移
增大
减小
增大
不变
左移
增大
减小
减小
不变
4.水的电离平衡的影响因素
水的电离为H2O ? H++OH-,在25 ℃时,水的离子积Kw=1.0×10-14;在35 ℃时,水的离子积Kw=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时,c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是吸热过程
D
【课堂练习】
1、酸性溶液中是否存在OH-?碱性溶液中是否存在H+?试解释原因。
酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗?
不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
思考与讨论
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
c(H+)来源于酸电离和水电离,且c(H+)酸?c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考与讨论
4.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
5.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
思考与讨论
常温下, 0. 1 mol·L-1的盐酸溶液中c(H+)、c(OH-)的来源?具体数值?由水电离产生的c(H+)与c(OH-)是多少?
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(H+)水=_______________,
c(OH-)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
【课堂练习】
常温下,浓度为0.01 mol·L-1的NaOH溶液中,c(H+)、c(OH-)的来源?具体数值?由水电离产生的c(H+)与c(OH-)是多少?
0.01 mol·L-1NaOH溶液中c碱(OH-)=0.01 mol·L-1 (NaOH电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,
可得c碱(OH-)·c水(H+)=1.0×10-14,
解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
【课堂练习】
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
课堂小结
1、在25℃, 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
(2)室温下, 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L=10-2
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
【课堂练习】
2、常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1
B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1
D.1.0×10-6 mol·L-1
B
【课堂练习】
3、(2021·全国高三专题练习)下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25”“<”或“=”)1×10-14,做出此判断的理由是_____。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为_____。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_____mol·L-1。
温度/℃
25
t1
t2
水的离子积常数
1×10-14
Kw
1×10-12
(1) > 水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大 (2) 2.4×10-7mol·L-1 5.76×10-9
【课堂练习】
4、某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为_______________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为___________________,此时温度___________(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
【课堂练习】
水的电离
水的离子积:
影响因素
KW = c(OH -)· c(H+)
( 25℃时,KW = 1.0 ×10 -14 )
温度:
酸:
碱:
T ↑, KW ↑
抑制水的电离, KW不变
抑制水的电离, KW 不变
3、无论是酸溶液还是碱溶液中都同时存在H+和OH-!
注意:
1、在任何水溶液中,均存在水的电离平衡,
Kw=c(H+)·c(OH-)均成立。(25℃时Kw =10-14 )
2、水电离出的H+、OH-永远相等
H2O H+ + OH-
阶段小结
水的电离
第二节 水的电离和溶液的PH
学习目标
1、了解水的电离平衡及其影响因素
2、掌握水的离子积——Kw
3、会计算酸碱溶液中水电离出的H+浓度或OH-的浓度,能分析应用水的电离平衡曲线
在用电安全教育中,强调不能用湿手触摸带电的电器,否则会有触电的危险。
问题:1.为什么湿手触摸带电的电器会触电,水能导电吗?
2.请设计实验验证。
新课导入
编号
I
II
III
现象
原理
结论
灯泡亮
灯泡不亮
灵敏电流表指针偏转
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
纯水能导电
但导电能力弱
【学习任务一】识水的电离平衡
思考:怎样验证水是一种弱电解质?
水质检测笔
电导率仪
纯水中含有少量自由移动的离子
可以利用手持技术测定水的电导率
【学习任务一】认识水的电离平衡
H2O + H2O H3O+ + OH-
一、水的电离
水是极弱的电解质
25℃ 时,1L水中只有10-7molH2O分子发生电离
水合氢离子
简写为: H2O H+ + OH-
(思考:水电离出的H+、OH-浓度???)
1、水能微弱电离,建立电离平衡
【学习任务一】认识水的电离平衡
一、水的电离
2、水的电离平衡
弱
等
逆
变
水存在微弱的电离
水电离出的H+和OH-相等
条件改变,平衡被破坏,发生移动,建立新的化学平衡
可逆过程
v电离
v结合
v电离 = v结合
t
t
υ
电离平衡状态
H2O H+ +OH-
【思考】如何衡量水的电离的限度?
K电离=
c(H+)×c(OH-)
c(H2O)
K电离·c(H2O) = c ( H+)·c( OH-)
H2O H+ + OH-
室温下1L(55.6mol)H2O中,只有1×10-7 molH2O电离,电离的水可以忽略不计,因此C(H2O)可视为常数
KW
(2)表达式:KW=c(H+)·c(OH-)
(1)定义:一定温度时,水(稀溶液)中c(H+)与c(OH-)的乘积是一个常数Kw,即水的离子积常数,简称水的离子积。
常温时,c(H+)=c(OH-)=1×10-7 mol/L
常温时,KW=c(H+)·c(OH-)=1×10-14
3、水的离子积(常数)
3、水的离子积(常数)
【学习任务二】水的离子积
Kw=c(H+)·c(OH-)
分析表格中的数据,有何规律,得出什么结论?并解释之。
t/℃
0
10
20
25
40
50
90
100
Kw/10-14
0.115
0.296
0.687
1.01
2.87
5.31
37.1
54.5
Kw只受温度的影响(与浓度无关),温度越高,Kw越大
结论
100℃时:Kw=1×10-12
100℃纯水中:c(H+) c(OH-) 1.0×10-7mol/L
25℃纯水中: c(H+) c(OH-) 1.0×10-7mol/L
>
=
=
=
温度升高,对于中性的纯水,尽管K 电离与KW增大了,但仍是中性的水
25℃时:Kw =1×10-14
注意:
(1)KW只与温度有关(与浓度无关),温度↑, KW值↑。
(2)在纯水或稀溶液中,其中水电离出的H+、OH-永远相等,即c(H+)H2O = c(OH-)H2O 。
(3)KW不仅适应于纯水,也适应于电解质的稀溶液,都有
Kw =C(H+)aq·C(OH-)aq
在常温(25℃)时,c(H+) = c(OH-) = 10-7 mol/L
Kw = c(H+)·c(OH-) = 1×10-14
课堂练习1:下列说法正确的是( )
A.任何水溶液中都存在水的电离平衡。
B.任何水溶液中(不论酸、碱或中性)都存在Kw =10-14。
C.某温度下,某液体c(H+)= 10-7mol/L,则该溶液一定是纯水。
D.25 ℃时,若溶液中c(H+)=1.0×10-6 mol·L-1,则溶液中c(OH-)=1.0×10-8mol·L-1
AD
课堂练习2:某温度下,纯水中的c(H+)=2.0×10-7mol/L, 则此时溶液的c(OH-)为__________mol/L;若温度不变, 滴入稀盐酸使c(H+)=5.0×10-6mol/L,则c(OH-)= __________mol/L。
2.0×10-7
8.0×10-9
Kw 不仅适用于纯水,也适用于稀的电解质水溶液。
3. 0.1mol/L的NaOH溶液中,
c(OH-)= , c(H+)= 。
由水电离出的c(OH-)水= , c(H+)水= 。
2. 0.1mol/L的盐酸溶液中,
c(H+)= , c(OH-)= 。
由水电离出的c(OH-)水= , c(H+)水= 。
1. 0.1mol/L的NaCl溶液中,
c(OH-)= ,c(H+)= 。
0.1mol/L
10-13mol/L
10-13mol/L
10-13mol/L
0.1mol/L
10-13mol/L
10-13mol/L
10-13mol/L
10-7mol/L
10-7mol/L
即时检测
水的电离方程式为:H2O ? H+ + OH-,?H >0其平衡移动的分析,符合勒夏特列原理。
?
条件
移动方向
c(H+)
c(OH-)
电离程度
Kw
升温
通入HCl(g)
通入氨气
加 Na2O
加FeCl3(s)
加入NaHSO4(s)
右移
增大
增大
增大
增大
左移
增大
减小
减小
不变
左移
减小
增大
减小
不变
左移
减小
增大
减小
不变
右移
增大
减小
增大
不变
左移
增大
减小
减小
不变
4.水的电离平衡的影响因素
水的电离为H2O ? H++OH-,在25 ℃时,水的离子积Kw=1.0×10-14;在35 ℃时,水的离子积Kw=2.1×10-14。则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时,c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是吸热过程
D
【课堂练习】
1、酸性溶液中是否存在OH-?碱性溶液中是否存在H+?试解释原因。
酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗?
不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
思考与讨论
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
c(H+)来源于酸电离和水电离,且c(H+)酸?c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考与讨论
4.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
5.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
思考与讨论
常温下, 0. 1 mol·L-1的盐酸溶液中c(H+)、c(OH-)的来源?具体数值?由水电离产生的c(H+)与c(OH-)是多少?
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(H+)水=_______________,
c(OH-)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
【课堂练习】
常温下,浓度为0.01 mol·L-1的NaOH溶液中,c(H+)、c(OH-)的来源?具体数值?由水电离产生的c(H+)与c(OH-)是多少?
0.01 mol·L-1NaOH溶液中c碱(OH-)=0.01 mol·L-1 (NaOH电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,
可得c碱(OH-)·c水(H+)=1.0×10-14,
解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
【课堂练习】
1. 温度升高,促进水的电离,Kw增大;
2. 酸、碱抑制水的电离,Kw不变;
3. 外加能与H+、OH- 反应的物质,会促进水的电离,能和水反应且产物为酸或者碱,会抑制水的电离,Kw不变。
课堂小结
1、在25℃, 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
(2)室温下, 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L=10-2
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
【课堂练习】
2、常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1
B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1
D.1.0×10-6 mol·L-1
B
【课堂练习】
3、(2021·全国高三专题练习)下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为_____。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_____mol·L-1。
温度/℃
25
t1
t2
水的离子积常数
1×10-14
Kw
1×10-12
(1) > 水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大 (2) 2.4×10-7mol·L-1 5.76×10-9
【课堂练习】
4、某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为_______________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·L-1,则溶液中c(OH-)为___________________,此时温度___________(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
【课堂练习】
水的电离
水的离子积:
影响因素
KW = c(OH -)· c(H+)
( 25℃时,KW = 1.0 ×10 -14 )
温度:
酸:
碱:
T ↑, KW ↑
抑制水的电离, KW不变
抑制水的电离, KW 不变
3、无论是酸溶液还是碱溶液中都同时存在H+和OH-!
注意:
1、在任何水溶液中,均存在水的电离平衡,
Kw=c(H+)·c(OH-)均成立。(25℃时Kw =10-14 )
2、水电离出的H+、OH-永远相等
H2O H+ + OH-
阶段小结
