专题3《微粒间作用力与物质性质》章末习题(含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3《微粒间作用力与物质性质》章末习题(含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 935.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 00:00:00 | ||
图片预览


文档简介
专题3《微粒间作用力与物质性质》章末习题
一、单选题
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.足量的Cu和100g98%的硫酸反应,被还原的硫酸为0.5NA
B.25°C时,pH=3的醋酸溶液1L,溶液中含H+的数目小于0.001NA
C.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA
D.60gSiO2和l2g金刚石中各含有4 NA个Si-O键和C-C键
2.下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.
C. D.金刚石>生铁>钠>纯铁
3.下列变化过程中,仅有共价键被破坏的是
A.干冰升华 B.HCl 溶于水
C.NaOH高温融化 D.NH4Cl固体受热分解
4.下列比较正确的是
A.熔、沸点:单晶硅>碳化硅>金刚石 B.熔、沸点:
C.熔、沸点: D.熔、沸点:
5.下列物质属于共价化合物的是
A.CaO B.CO2 C.C60 D.NaCl
6.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O=HClO+HCl
B.2Na2O2+2H2O=4NaOH+O2↑
C.NH4Cl+NaOHNaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl=2FeCl3+2H2O
7.下列有关说法中错误的是
A.碘晶体晶胞为面心立方,每个晶胞中含有4个碘分子 B.铜金合金的化学式为CuAu C.金刚石晶体中,每个碳采用sp3杂化轨道形成共价键 D.氯化钠晶体中,与Na+距离等同且最近的6个Cl-构成了正八面体
A.A B.B C.C D.D
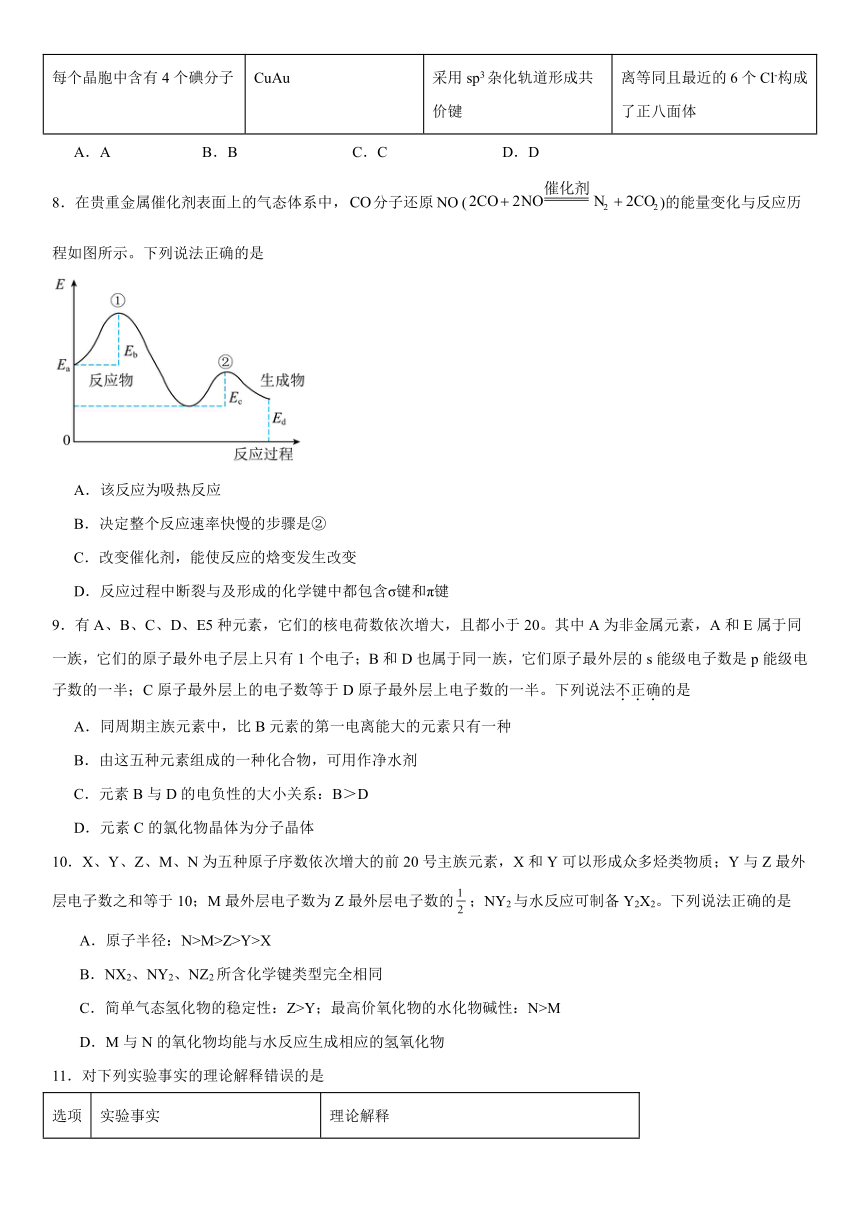
8.在贵重金属催化剂表面上的气态体系中,分子还原()的能量变化与反应历程如图所示。下列说法正确的是
A.该反应为吸热反应
B.决定整个反应速率快慢的步骤是②
C.改变催化剂,能使反应的焓变发生改变
D.反应过程中断裂与及形成的化学键中都包含σ键和π键
9.有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们的原子最外电子层上只有1个电子;B和D也属于同一族,它们原子最外层的s能级电子数是p能级电子数的一半;C原子最外层上的电子数等于D原子最外层上电子数的一半。下列说法不正确的是
A.同周期主族元素中,比B元素的第一电离能大的元素只有一种
B.由这五种元素组成的一种化合物,可用作净水剂
C.元素B与D的电负性的大小关系:B>D
D.元素C的氯化物晶体为分子晶体
10.X、Y、Z、M、N为五种原子序数依次增大的前20号主族元素,X和Y可以形成众多烃类物质;Y与Z最外层电子数之和等于10;M最外层电子数为Z最外层电子数的;NY2与水反应可制备Y2X2。下列说法正确的是
A.原子半径:N>M>Z>Y>X
B.NX2、NY2、NZ2所含化学键类型完全相同
C.简单气态氢化物的稳定性:Z>Y;最高价氧化物的水化物碱性:N>M
D.M与N的氧化物均能与水反应生成相应的氢氧化物
11.对下列实验事实的理论解释错误的是
选项 实验事实 理论解释
A 碘单质在苯中溶解度比在水中大 苯和都是非极性分子,而是极性分子
B Be单质能溶于KOH溶液 Be和Al在周期表中是对角线关系,性质相似
C 稳定性:HF>HI 非金属性:F>I
D 的分解温度高于 的式量比大
A.A B.B C.C D.D
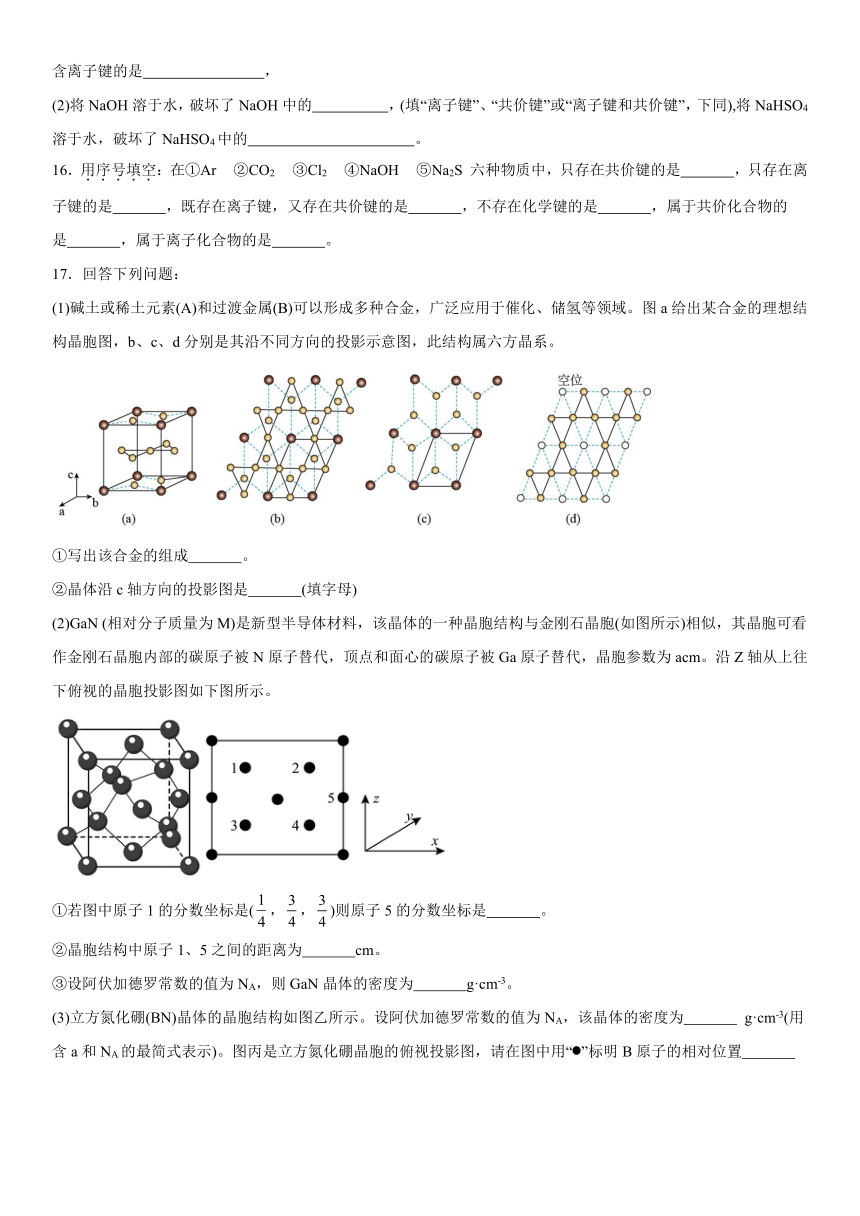
12.某种钻盐晶体的立方晶胞结构如图所示,已知晶胞参数为,A点的原子坐标参数为,C点的原子坐标参数为。下列说法错误的是
A.B点的原子坐标参数为
B.距离最近且等距离的的数目为8
C.该晶体的密度为
D.与之间的最短距离为
13.离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电作用,静电作用大则熔点高,静电作用小则熔点低。试根据学过的知识,判断、、、四种晶体熔点的高低顺序是
A. B.
C. D.
14.下列物质中,含有非极性共价键的离子化合物是
A.NaOH B. C. D.
二、填空题
15.为更好地体现结构决定性质的原理,请你对下面所熟悉的物质中含有的微粒间的相互作用进行分析:
①He ②CO2 ③H2SO4 ④NaOH ⑤CaCl2 ⑥NaHSO4
(1)这些物质中,不含化学键的是 ;只含共价键的是 ;只含离子键的是 ;既含共价键又含离子键的是 ,
(2)将NaOH溶于水,破坏了NaOH中的 ,(填“离子键”、“共价键”或“离子键和共价键”,下同),将NaHSO4溶于水,破坏了NaHSO4中的 。
16.用序号填空:在①Ar ②CO2 ③Cl2 ④NaOH ⑤Na2S 六种物质中,只存在共价键的是 ,只存在离子键的是 ,既存在离子键,又存在共价键的是 ,不存在化学键的是 ,属于共价化合物的是 ,属于离子化合物的是 。
17.回答下列问题:
(1)碱土或稀土元素(A)和过渡金属(B)可以形成多种合金,广泛应用于催化、储氢等领域。图a给出某合金的理想结构晶胞图,b、c、d分别是其沿不同方向的投影示意图,此结构属六方晶系。
①写出该合金的组成 。
②晶体沿c轴方向的投影图是 (填字母)
(2)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
①若图中原子1的分数坐标是(,,)则原子5的分数坐标是 。
②晶胞结构中原子1、5之间的距离为 cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为 g·cm-3。
(3)立方氮化硼(BN)晶体的晶胞结构如图乙所示。设阿伏加德罗常数的值为NA,该晶体的密度为 g·cm-3(用含a和NA的最简式表示)。图丙是立方氮化硼晶胞的俯视投影图,请在图中用“”标明B原子的相对位置
18.金属键
(1)概念:“电子气理论”把金属键描述为金属原子脱落下来的 形成遍布整块晶体的“ ”,被所有原子所共用,从而把所有的 维系在一起。
(2)成键粒子是 和 。
(3)金属键的强弱和对金属性质的影响
①金属键的强弱主要决定于金属元素的原子半径和价电子数。原子半径越 、价电子数越 ,金属键越 ;反之,金属键越 。
②金属键越强,金属的熔、沸点越 ,硬度越 。如:熔点最高的金属是 ,硬度最大的金属是 。
:金属键没有方向性和饱和性。
19.随着对晶体的不断探究,科学家们陆续发现了更多形状的晶体。各类不同的晶体由于其结构的不同,导致性质存在很大的区别,根据提示回答下列问题:
(1)如图所示的晶胞属于 。
A.面心立方 B.体心立方 C.简单立方
(2)一个氯离子周围与他最近且距离相等的氯离子有___________个。
A.3 B.4 C.6 D.8
(3)若此晶胞为紧密堆积,的摩尔质量为,密度为(,是阿伏加德罗常数,则的直径()最接近下列哪个数据___________。
A. B. C. D.
20.镁单质晶体中原子的堆积模型如图,它的堆积模型名称为 ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏加德罗常数为NA,则镁的摩尔质量计算式为 。
21.硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如表:
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 。
22.理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
图c为X的晶胞,设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
23.常见离子晶体
氯化钠型:每个晶胞中含 个Na+、 个Cl-;常见物质有 。
氯化铯型:每个晶胞中含 个Cs+、 个Cl-;常见物质有 。
硫化锌型:每个晶胞中有 个S2-、 个Zn2+;常见物质有 。
氟化钙型:每个晶胞中有 个Ca2+、 个F-;常见物质有 。
试卷第1页,共3页
参考答案:
1.C
【详解】A.随着反应的进行,硫酸浓度变小,反应就停止了,被还原的硫酸小于0.5NA,A错误;
B.25°C时,pH=3的醋酸溶液则其中氢离子浓度为0.001mol/L,1L溶液中含H+的数目等于0.001NA,B错误;
C.1分子乙烯、1分子乙醇均消耗3分子的氧气,则0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA,C正确;
D.60gSiO2和l2g C(金刚石)的物质的量均为1mol,SiO2中1个硅原子形成4个硅氧键,1mol SiO2中含有4 NA个Si-O键,C(金刚石)中平均1个碳原子形成2个碳碳键,1mol C(金刚石)中含有2 NA个C-C键,D错误;
故选C。
2.B
【详解】A.四种物质全部为共价晶体,由于键长,故键能,所以晶体硅的熔、沸点应比碳化硅的小,A错误;
B.四种物质为结构相似的分子晶体,相对分子质量越大,熔、沸点越高,B正确;
C.为离子晶体,固态、固态均为分子晶体,且常温常压下呈液态,呈气态,故熔、沸点:,C错误;
D.合金的熔、沸点比纯金属的低,熔、沸点高低顺序为金刚石>纯铁>生铁>钠,D错误。
故选:B。
3.B
【详解】A.干冰升华属于物理变化,化学键不变,A不符合;
B.HCl溶于水电离出氢离子和氯离子,共价键被破坏,B符合;
C.NaOH高温融化电离出钠离子和氢氧根离子,离子键被破坏,C不符合;
D.NH4Cl固体受热分解生成氨气和氯化氢,离子键和共价键均被破坏,D不符合;
答案选B。
4.D
【详解】A.单晶硅、碳化硅、金刚石都是共价晶体,熔沸点与共价键强度有关。原子半径Si>C,则键长Si-Si>Si-C>C-C,键能Si-SiB.MgO、NaCl、KCl同为离子晶体,熔沸点与晶格能(离子电荷数、离子半径)有关。镁离子、氧离子半径小且电荷数多,则晶格能最大;钾离子半径大且电荷少,晶格能最小,晶格能MgO>NaCl>KCl,故熔沸点:MgO>NaCl>KCl,B项错误;
C.Na、Mg、Al同为金属晶体,熔沸点与金属键强度(离子电荷数、离子半径)有关。金属键NaD.常温碘单质为固体、汞为液体、氧气为气体,从物质状态看,熔沸点:I2>Hg>O2,D项正确;
故选D。
5.B
【详解】A.氧化钙是由钙离子和阳离子以离子键结合形成的离子化合物,故A不选;
B.CO2中只含共价键,属于共价化合物,故B选;
C.C60中只含有共价键,是单质,故C不选;
D.NaCl中只存在离子键,属于离子化合物,故D不选;
故选B。
6.B
【详解】A.反应Cl2+H2O=HClO+HCl中,Cl和Cl之间的非极性键断裂,H和O之间的极性键断裂,H和O、O和Cl,H和Cl之间的极性键形成,A不满足题意;
B.反应2Na2O2+2H2O=4NaOH+O2↑中,钠离子和过氧离子之间的离子键断裂,过氧离子中两个O之间的非极性键断裂,H和O之间的极性键断裂,钠离子和氢氧根离子之间的离子键形成,H和O之间的极性键形成,O和O之间的非极性键形成,B满足题意;
C.反应NH4Cl+NaOHNaCl+NH3↑+H2O中,铵根离子和氯离子之间的离子键、钠离子和氢氧根离子之间的离子键断裂,铵根中N和H之间的极性键,氢氧根中H和O之间的极性键断裂,氯离子和钠离子之间的离子键、N和H之间的极性键、H和O之间的极性键形成,C不满足题意;
D.反应2FeCl2+H2O2+2HCl=2FeCl3+2H2O中,亚铁离子和氯离子之间的离子键、H和O之间的极性键、O和O之间的非极性键断裂,Fe和Cl之间的极性共价键(FeCl3是共价化合物)、H和O之间的极性共价键形成,D不满足题意;
答案选B。
7.B
【详解】A.碘分子占据晶胞的顶点和面心,为面心立方,每个晶胞中含有4个碘分子,A项正确;
B.Cu原子占据晶胞的顶点,Au原子占据晶胞的面心,则铜金合金的化学式为CuAu3,B项错误;
C.金刚石晶体中,每个C与周围4个C原子成键,采用sp3杂化轨道形成共价键,C项正确;
D.位于体心的Na+与周围六个位于面心的Cl-构成了正八面体,D项正确。
答案选B。
8.D
【详解】A.由图可知,反应物能量高于生成物,为放热反应,A错误;
B.活化能大的分反应为总反应的决速步骤,由图可知,反应①的活化能Eb高于反应②的Ec,①为决速步骤,B错误;
C.催化剂只能降低反应的活化能,不能改变反应的焓变,C错误;
D.反应物CO、NO、N2、CO2均含有σ键和π键,因此反应中σ键和π键既有断裂也有形成,D正确;
答案选D。
9.A
【分析】有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们的原子最外电子层上只有1个电子,则A为H元素、E为K元素;B和D也属于同一族,它们原子最外层的s能级电子数是p能级电子数的一半,则其价电子排布为ns2np4,B为O元素、D为S元素;C原子最外层上的电子数等于D原子最外层上电子数的一半,则C原子的最外层电子数为3,其价电子排布式为3s23p1,其为Al元素。从而得出A、B、C、D、E分别为H、O、Al、S、K。
【详解】A.B为O元素,同周期主族元素中,比O元素的第一电离能大的元素有N、F两种,A不正确;
B.由这五种元素组成的一种化合物为KAl(SO4)2 12H2O,是明矾的主要成分,可用作净水剂,B正确;
C.元素B与D分别为O和S,二者为同主族元素,非金属性O>S,则电负性的大小关系:O>S,C正确;
D.元素C为Al,其氯化物为氯化铝,由分子构成,晶体为分子晶体,D正确;
故选A。
10.C
【分析】X和Y可以形成众多烃类物质,且Y的原子序数大于X,则X为H元素,Y为C元素,Y与Z最外层电子数之和等于10,则Z为O元素;M最外层电子数为Z最外层电子数的,则M为Al元素;CaC2与水可制备C2H2,N为Ca元素。
【详解】A.电子层数越多原子半径越大,电子层数相同,核电荷数越小半径越大,所以原子半径:Ca>Al>C>O>H,A错误;
B.CaH2只含离子键,CaC2与CaO2既含离子键,又含共价键,B错误;
C.非金属性C>H,所以简单气态氢化物的稳定性:H2O>CH4;金属性Ca>Al,所以最高价氧化物的水化物碱性:Ca(OH)2>Al(OH)3,C正确;
D.CaO与水反应生成Ca(OH)2,但Al2O3不能与水反应生成Al(OH)3,D错误;
综上所述答案为C。
11.D
【详解】A.苯和I2都是非极性分子,而H2O是极性分子,根据相似相溶原理可知碘单质在苯中溶解度比在水中大,故A正确;
B.Be与Al元素周期表位于对角线位置,依据对角线规则,二者性质相似,依据铝能够与强碱反应可知Be能够与氢氧化钾溶液反应,故B正确;
C.简单氢化物越稳定,非金属性越强,稳定性HF>HI,故非金属性F>I,故C正确;
D.的分解温度高于说明MgO的晶格能大于CaO,与式量无关,故D错误;
故答案为D
12.C
【分析】根据题目所给已知条件,可知晶胞参数定为单位1,A点为原点建立坐标系;
【详解】A.B点原子在晶胞的正前面面心,原子位置的坐标关系x轴方向单位长度,y轴方向为0,z轴方向单位长度,所以原子坐标参数为,描述正确,不符题意;
B.在晶胞体心,距离最近且等距离的在晶胞8个顶点,描述正确,不符题意;
C.该晶体的化学式为,的摩尔质量为,,该晶体的密度为,描述错误,符合题意;
D.与之间的最短距离为立方晶胞中面对角线的一半,即,描述正确,不符题意;
综上,本题选C。
13.C
【详解】离子晶体中,离子键越强,熔、沸点越高,而离子所带电荷数越多,半径越小,离子键越强。、、都带2个电荷,、、都带1个电荷,,,故熔点,故选:C。
14.D
【详解】A.NaOH由Na+和OH-构成,在OH-中,O、H原子间形成极性共价键,A不符合题意;
B.由Mg2+和Cl-构成,不含有极性共价键,B不符合题意;
C.的结构式为H-O-O-H,只含有共价键,不含有离子键,C不符合题意;
D.由Na+和构成,在中存在非极性共价键,D符合题意;
故选D。
15.(1) ① ②③ ⑤ ④⑥
(2) 离子键 离子键和共价键
【分析】①He为单原子分子,不存在化学键;②CO2是共价化合物,只存在共价键;③H2SO4是共价化合物,只存在共价键;④NaOH是离子化合物,含有离子键,氢氧根离子中含有共价键;⑤CaCl2是离子化合物,只含有离子键;⑥NaHSO4是离子化合物,含有离子键,硫酸氢根离子中含有共价键。
【详解】(1)根据分析,不含化学键的是①;只含共价键的是②③;只含离子键的是⑤;既含共价键又含离子键的是④⑥,故答案为①;②③;⑤;④⑥;
(2)将NaOH溶于水,发生了电离生成钠离子和氢氧根离子,破坏了NaOH中的离子键,将NaHSO4溶于水,电离生成钠离子、氢离子和硫酸根离子,破坏了NaHSO4中的离子键和共价键,故答案为离子键;离子键和共价键。
16. ②③ ⑤ ④ ① ② ④⑤
【详解】①Ar 中不存在化学键;
②CO2 是共价化合物,碳原子和氧原子之间只存在共价键;
③Cl2 是双原子分子,只存在共价键;
④NaOH 中钠离子和氢氧根离子之间存在离子键,氢原子和氧原子之间存在共价键,为离子化合物;
⑤Na2S中钠离子和硫离子之间只存在离子键,是离子化合物;
故只存在共价键的是②③,只存在离子键的是⑤,既存在离子键,又存在共价键的是④,不存在化学键的是①,属于共价化合物的是②,属于离子化合物的是④⑤。
17.(1) AB5 b
(2) (1,,)
(3)
【详解】(1)①由晶胞结构可知A有8个位于顶点,个数为,B有8个位于面上,1个位于体心,个数为,则该合金的组成为AB5;
②晶体沿c轴方向的投影上下面的顶点重合为正方向四个顶点,四个面心的B球投影到正方形棱心上,体心B原子投影为面心,上下面上的四个B原子两两重合,均投影在对角线上,b图符合;
(2)①根据数学立体几何关系可知,若图中原子1的分数坐标是(,,)则原子5的分数坐标是(1,,);
②因为原子1的分数坐标是(,,),原子5的分数坐标是(1,,),所以两个原子之间的距离为;
③其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,所以晶胞中Ga的原子个数为,N原子个数也为4,设阿伏加德罗常数的值为NA,则GaN晶体的质量为g,故其密度为 g·cm-3;
(3)该晶胞中B原子个数=4,N原子个数=,晶胞体积=,则该晶体的密度为 g·cm-3= g·cm-3;4个B在底面上的投影分别位于面对角线处,其图像为。
18. 价电子 电子气 金属原子 金属阳离子 自由电子 大 少 弱 强 高 大 钨 铬 特征
【解析】略
19.(1)B
(2)C
(3)C
【详解】(1)氯化铯晶胞中,Cs+离子位于立方体的中心,Cl-离子位于立方体的顶角,属于体心立方晶胞;
(2)一个Cl-离子周围最近的氯离子位于该氯离子的上下左右前后六个方向,因此最近的氯离子是6个;
(3)此晶胞是紧密堆积,Cs+离子的直径最接近与晶胞的边长,边长为体积开三次方,体积等于晶胞的质量除以密度,该晶胞中有一个Cs+和一个Cl-离子,晶胞质量为g,体积为,边长为cm,Cs+离子的直径最接近cm。
20. 六方最密堆积 12NA·a·ρ
【详解】根据镁单质晶体中原子的堆积模型图,镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,它的堆积模型名称为六方最密堆积;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,晶胞是图中的b,紧邻的四个镁原子的中心连线构成的几何体为正四面体,该正四面体的高为晶胞的高的,可推知四面体的体积为整个晶胞的,而晶胞中含有的镁原子数为1+8×=2,====g cm-3,则有M=(12NA·a·ρ)g mol-1。
21. SiCl4 SiF4、SiCl4、SiBr4、SiI4都是分子晶体,相对分子质量依次增大,分子间作用力依次增大
【详解】0℃时,根据表格中各物质的沸点,SiF4为气态、SiCl4为液态、SiBr4为固态、SiI4为固态,故呈液态的是SiCl4;沸点依次升高的原因是:SiF4、SiCl4、SiBr4、SiI4都是分子晶体,相对分子质量依次增大,分子间作用力依次增大。
22.
【详解】根据均摊法可知,该晶胞的组成为Hg4Ge4Sb8,由于最简式的式量为Mr,1个晶胞的质量m=,1个晶胞的体积V=(x×10-7cm)2×(y×10-7cm)=x2y×10-21cm3,则X晶体的密度为== g/cm3,故答案为:。
23. 4 4 Li、Na、K和Rb的卤化物,AgF,MgO等 1 1 CsBr、Csl、NH4Cl等 4 4 BeO、BeS等 4 8 BaF2、PbF2、CeO2等
【解析】略
一、单选题
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.足量的Cu和100g98%的硫酸反应,被还原的硫酸为0.5NA
B.25°C时,pH=3的醋酸溶液1L,溶液中含H+的数目小于0.001NA
C.0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA
D.60gSiO2和l2g金刚石中各含有4 NA个Si-O键和C-C键
2.下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.
C. D.金刚石>生铁>钠>纯铁
3.下列变化过程中,仅有共价键被破坏的是
A.干冰升华 B.HCl 溶于水
C.NaOH高温融化 D.NH4Cl固体受热分解
4.下列比较正确的是
A.熔、沸点:单晶硅>碳化硅>金刚石 B.熔、沸点:
C.熔、沸点: D.熔、沸点:
5.下列物质属于共价化合物的是
A.CaO B.CO2 C.C60 D.NaCl
6.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A.Cl2+H2O=HClO+HCl
B.2Na2O2+2H2O=4NaOH+O2↑
C.NH4Cl+NaOHNaCl+NH3↑+H2O
D.2FeCl2+H2O2+2HCl=2FeCl3+2H2O
7.下列有关说法中错误的是
A.碘晶体晶胞为面心立方,每个晶胞中含有4个碘分子 B.铜金合金的化学式为CuAu C.金刚石晶体中,每个碳采用sp3杂化轨道形成共价键 D.氯化钠晶体中,与Na+距离等同且最近的6个Cl-构成了正八面体
A.A B.B C.C D.D
8.在贵重金属催化剂表面上的气态体系中,分子还原()的能量变化与反应历程如图所示。下列说法正确的是
A.该反应为吸热反应
B.决定整个反应速率快慢的步骤是②
C.改变催化剂,能使反应的焓变发生改变
D.反应过程中断裂与及形成的化学键中都包含σ键和π键
9.有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们的原子最外电子层上只有1个电子;B和D也属于同一族,它们原子最外层的s能级电子数是p能级电子数的一半;C原子最外层上的电子数等于D原子最外层上电子数的一半。下列说法不正确的是
A.同周期主族元素中,比B元素的第一电离能大的元素只有一种
B.由这五种元素组成的一种化合物,可用作净水剂
C.元素B与D的电负性的大小关系:B>D
D.元素C的氯化物晶体为分子晶体
10.X、Y、Z、M、N为五种原子序数依次增大的前20号主族元素,X和Y可以形成众多烃类物质;Y与Z最外层电子数之和等于10;M最外层电子数为Z最外层电子数的;NY2与水反应可制备Y2X2。下列说法正确的是
A.原子半径:N>M>Z>Y>X
B.NX2、NY2、NZ2所含化学键类型完全相同
C.简单气态氢化物的稳定性:Z>Y;最高价氧化物的水化物碱性:N>M
D.M与N的氧化物均能与水反应生成相应的氢氧化物
11.对下列实验事实的理论解释错误的是
选项 实验事实 理论解释
A 碘单质在苯中溶解度比在水中大 苯和都是非极性分子,而是极性分子
B Be单质能溶于KOH溶液 Be和Al在周期表中是对角线关系,性质相似
C 稳定性:HF>HI 非金属性:F>I
D 的分解温度高于 的式量比大
A.A B.B C.C D.D
12.某种钻盐晶体的立方晶胞结构如图所示,已知晶胞参数为,A点的原子坐标参数为,C点的原子坐标参数为。下列说法错误的是
A.B点的原子坐标参数为
B.距离最近且等距离的的数目为8
C.该晶体的密度为
D.与之间的最短距离为
13.离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电作用,静电作用大则熔点高,静电作用小则熔点低。试根据学过的知识,判断、、、四种晶体熔点的高低顺序是
A. B.
C. D.
14.下列物质中,含有非极性共价键的离子化合物是
A.NaOH B. C. D.
二、填空题
15.为更好地体现结构决定性质的原理,请你对下面所熟悉的物质中含有的微粒间的相互作用进行分析:
①He ②CO2 ③H2SO4 ④NaOH ⑤CaCl2 ⑥NaHSO4
(1)这些物质中,不含化学键的是 ;只含共价键的是 ;只含离子键的是 ;既含共价键又含离子键的是 ,
(2)将NaOH溶于水,破坏了NaOH中的 ,(填“离子键”、“共价键”或“离子键和共价键”,下同),将NaHSO4溶于水,破坏了NaHSO4中的 。
16.用序号填空:在①Ar ②CO2 ③Cl2 ④NaOH ⑤Na2S 六种物质中,只存在共价键的是 ,只存在离子键的是 ,既存在离子键,又存在共价键的是 ,不存在化学键的是 ,属于共价化合物的是 ,属于离子化合物的是 。
17.回答下列问题:
(1)碱土或稀土元素(A)和过渡金属(B)可以形成多种合金,广泛应用于催化、储氢等领域。图a给出某合金的理想结构晶胞图,b、c、d分别是其沿不同方向的投影示意图,此结构属六方晶系。
①写出该合金的组成 。
②晶体沿c轴方向的投影图是 (填字母)
(2)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
①若图中原子1的分数坐标是(,,)则原子5的分数坐标是 。
②晶胞结构中原子1、5之间的距离为 cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为 g·cm-3。
(3)立方氮化硼(BN)晶体的晶胞结构如图乙所示。设阿伏加德罗常数的值为NA,该晶体的密度为 g·cm-3(用含a和NA的最简式表示)。图丙是立方氮化硼晶胞的俯视投影图,请在图中用“”标明B原子的相对位置
18.金属键
(1)概念:“电子气理论”把金属键描述为金属原子脱落下来的 形成遍布整块晶体的“ ”,被所有原子所共用,从而把所有的 维系在一起。
(2)成键粒子是 和 。
(3)金属键的强弱和对金属性质的影响
①金属键的强弱主要决定于金属元素的原子半径和价电子数。原子半径越 、价电子数越 ,金属键越 ;反之,金属键越 。
②金属键越强,金属的熔、沸点越 ,硬度越 。如:熔点最高的金属是 ,硬度最大的金属是 。
:金属键没有方向性和饱和性。
19.随着对晶体的不断探究,科学家们陆续发现了更多形状的晶体。各类不同的晶体由于其结构的不同,导致性质存在很大的区别,根据提示回答下列问题:
(1)如图所示的晶胞属于 。
A.面心立方 B.体心立方 C.简单立方
(2)一个氯离子周围与他最近且距离相等的氯离子有___________个。
A.3 B.4 C.6 D.8
(3)若此晶胞为紧密堆积,的摩尔质量为,密度为(,是阿伏加德罗常数,则的直径()最接近下列哪个数据___________。
A. B. C. D.
20.镁单质晶体中原子的堆积模型如图,它的堆积模型名称为 ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏加德罗常数为NA,则镁的摩尔质量计算式为 。
21.硅和卤素单质反应可以得到SiX4。SiX4的熔、沸点如表:
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 。
22.理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
图c为X的晶胞,设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
23.常见离子晶体
氯化钠型:每个晶胞中含 个Na+、 个Cl-;常见物质有 。
氯化铯型:每个晶胞中含 个Cs+、 个Cl-;常见物质有 。
硫化锌型:每个晶胞中有 个S2-、 个Zn2+;常见物质有 。
氟化钙型:每个晶胞中有 个Ca2+、 个F-;常见物质有 。
试卷第1页,共3页
参考答案:
1.C
【详解】A.随着反应的进行,硫酸浓度变小,反应就停止了,被还原的硫酸小于0.5NA,A错误;
B.25°C时,pH=3的醋酸溶液则其中氢离子浓度为0.001mol/L,1L溶液中含H+的数目等于0.001NA,B错误;
C.1分子乙烯、1分子乙醇均消耗3分子的氧气,则0.1mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA,C正确;
D.60gSiO2和l2g C(金刚石)的物质的量均为1mol,SiO2中1个硅原子形成4个硅氧键,1mol SiO2中含有4 NA个Si-O键,C(金刚石)中平均1个碳原子形成2个碳碳键,1mol C(金刚石)中含有2 NA个C-C键,D错误;
故选C。
2.B
【详解】A.四种物质全部为共价晶体,由于键长,故键能,所以晶体硅的熔、沸点应比碳化硅的小,A错误;
B.四种物质为结构相似的分子晶体,相对分子质量越大,熔、沸点越高,B正确;
C.为离子晶体,固态、固态均为分子晶体,且常温常压下呈液态,呈气态,故熔、沸点:,C错误;
D.合金的熔、沸点比纯金属的低,熔、沸点高低顺序为金刚石>纯铁>生铁>钠,D错误。
故选:B。
3.B
【详解】A.干冰升华属于物理变化,化学键不变,A不符合;
B.HCl溶于水电离出氢离子和氯离子,共价键被破坏,B符合;
C.NaOH高温融化电离出钠离子和氢氧根离子,离子键被破坏,C不符合;
D.NH4Cl固体受热分解生成氨气和氯化氢,离子键和共价键均被破坏,D不符合;
答案选B。
4.D
【详解】A.单晶硅、碳化硅、金刚石都是共价晶体,熔沸点与共价键强度有关。原子半径Si>C,则键长Si-Si>Si-C>C-C,键能Si-Si
C.Na、Mg、Al同为金属晶体,熔沸点与金属键强度(离子电荷数、离子半径)有关。金属键Na
故选D。
5.B
【详解】A.氧化钙是由钙离子和阳离子以离子键结合形成的离子化合物,故A不选;
B.CO2中只含共价键,属于共价化合物,故B选;
C.C60中只含有共价键,是单质,故C不选;
D.NaCl中只存在离子键,属于离子化合物,故D不选;
故选B。
6.B
【详解】A.反应Cl2+H2O=HClO+HCl中,Cl和Cl之间的非极性键断裂,H和O之间的极性键断裂,H和O、O和Cl,H和Cl之间的极性键形成,A不满足题意;
B.反应2Na2O2+2H2O=4NaOH+O2↑中,钠离子和过氧离子之间的离子键断裂,过氧离子中两个O之间的非极性键断裂,H和O之间的极性键断裂,钠离子和氢氧根离子之间的离子键形成,H和O之间的极性键形成,O和O之间的非极性键形成,B满足题意;
C.反应NH4Cl+NaOHNaCl+NH3↑+H2O中,铵根离子和氯离子之间的离子键、钠离子和氢氧根离子之间的离子键断裂,铵根中N和H之间的极性键,氢氧根中H和O之间的极性键断裂,氯离子和钠离子之间的离子键、N和H之间的极性键、H和O之间的极性键形成,C不满足题意;
D.反应2FeCl2+H2O2+2HCl=2FeCl3+2H2O中,亚铁离子和氯离子之间的离子键、H和O之间的极性键、O和O之间的非极性键断裂,Fe和Cl之间的极性共价键(FeCl3是共价化合物)、H和O之间的极性共价键形成,D不满足题意;
答案选B。
7.B
【详解】A.碘分子占据晶胞的顶点和面心,为面心立方,每个晶胞中含有4个碘分子,A项正确;
B.Cu原子占据晶胞的顶点,Au原子占据晶胞的面心,则铜金合金的化学式为CuAu3,B项错误;
C.金刚石晶体中,每个C与周围4个C原子成键,采用sp3杂化轨道形成共价键,C项正确;
D.位于体心的Na+与周围六个位于面心的Cl-构成了正八面体,D项正确。
答案选B。
8.D
【详解】A.由图可知,反应物能量高于生成物,为放热反应,A错误;
B.活化能大的分反应为总反应的决速步骤,由图可知,反应①的活化能Eb高于反应②的Ec,①为决速步骤,B错误;
C.催化剂只能降低反应的活化能,不能改变反应的焓变,C错误;
D.反应物CO、NO、N2、CO2均含有σ键和π键,因此反应中σ键和π键既有断裂也有形成,D正确;
答案选D。
9.A
【分析】有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,A和E属于同一族,它们的原子最外电子层上只有1个电子,则A为H元素、E为K元素;B和D也属于同一族,它们原子最外层的s能级电子数是p能级电子数的一半,则其价电子排布为ns2np4,B为O元素、D为S元素;C原子最外层上的电子数等于D原子最外层上电子数的一半,则C原子的最外层电子数为3,其价电子排布式为3s23p1,其为Al元素。从而得出A、B、C、D、E分别为H、O、Al、S、K。
【详解】A.B为O元素,同周期主族元素中,比O元素的第一电离能大的元素有N、F两种,A不正确;
B.由这五种元素组成的一种化合物为KAl(SO4)2 12H2O,是明矾的主要成分,可用作净水剂,B正确;
C.元素B与D分别为O和S,二者为同主族元素,非金属性O>S,则电负性的大小关系:O>S,C正确;
D.元素C为Al,其氯化物为氯化铝,由分子构成,晶体为分子晶体,D正确;
故选A。
10.C
【分析】X和Y可以形成众多烃类物质,且Y的原子序数大于X,则X为H元素,Y为C元素,Y与Z最外层电子数之和等于10,则Z为O元素;M最外层电子数为Z最外层电子数的,则M为Al元素;CaC2与水可制备C2H2,N为Ca元素。
【详解】A.电子层数越多原子半径越大,电子层数相同,核电荷数越小半径越大,所以原子半径:Ca>Al>C>O>H,A错误;
B.CaH2只含离子键,CaC2与CaO2既含离子键,又含共价键,B错误;
C.非金属性C>H,所以简单气态氢化物的稳定性:H2O>CH4;金属性Ca>Al,所以最高价氧化物的水化物碱性:Ca(OH)2>Al(OH)3,C正确;
D.CaO与水反应生成Ca(OH)2,但Al2O3不能与水反应生成Al(OH)3,D错误;
综上所述答案为C。
11.D
【详解】A.苯和I2都是非极性分子,而H2O是极性分子,根据相似相溶原理可知碘单质在苯中溶解度比在水中大,故A正确;
B.Be与Al元素周期表位于对角线位置,依据对角线规则,二者性质相似,依据铝能够与强碱反应可知Be能够与氢氧化钾溶液反应,故B正确;
C.简单氢化物越稳定,非金属性越强,稳定性HF>HI,故非金属性F>I,故C正确;
D.的分解温度高于说明MgO的晶格能大于CaO,与式量无关,故D错误;
故答案为D
12.C
【分析】根据题目所给已知条件,可知晶胞参数定为单位1,A点为原点建立坐标系;
【详解】A.B点原子在晶胞的正前面面心,原子位置的坐标关系x轴方向单位长度,y轴方向为0,z轴方向单位长度,所以原子坐标参数为,描述正确,不符题意;
B.在晶胞体心,距离最近且等距离的在晶胞8个顶点,描述正确,不符题意;
C.该晶体的化学式为,的摩尔质量为,,该晶体的密度为,描述错误,符合题意;
D.与之间的最短距离为立方晶胞中面对角线的一半,即,描述正确,不符题意;
综上,本题选C。
13.C
【详解】离子晶体中,离子键越强,熔、沸点越高,而离子所带电荷数越多,半径越小,离子键越强。、、都带2个电荷,、、都带1个电荷,,,故熔点,故选:C。
14.D
【详解】A.NaOH由Na+和OH-构成,在OH-中,O、H原子间形成极性共价键,A不符合题意;
B.由Mg2+和Cl-构成,不含有极性共价键,B不符合题意;
C.的结构式为H-O-O-H,只含有共价键,不含有离子键,C不符合题意;
D.由Na+和构成,在中存在非极性共价键,D符合题意;
故选D。
15.(1) ① ②③ ⑤ ④⑥
(2) 离子键 离子键和共价键
【分析】①He为单原子分子,不存在化学键;②CO2是共价化合物,只存在共价键;③H2SO4是共价化合物,只存在共价键;④NaOH是离子化合物,含有离子键,氢氧根离子中含有共价键;⑤CaCl2是离子化合物,只含有离子键;⑥NaHSO4是离子化合物,含有离子键,硫酸氢根离子中含有共价键。
【详解】(1)根据分析,不含化学键的是①;只含共价键的是②③;只含离子键的是⑤;既含共价键又含离子键的是④⑥,故答案为①;②③;⑤;④⑥;
(2)将NaOH溶于水,发生了电离生成钠离子和氢氧根离子,破坏了NaOH中的离子键,将NaHSO4溶于水,电离生成钠离子、氢离子和硫酸根离子,破坏了NaHSO4中的离子键和共价键,故答案为离子键;离子键和共价键。
16. ②③ ⑤ ④ ① ② ④⑤
【详解】①Ar 中不存在化学键;
②CO2 是共价化合物,碳原子和氧原子之间只存在共价键;
③Cl2 是双原子分子,只存在共价键;
④NaOH 中钠离子和氢氧根离子之间存在离子键,氢原子和氧原子之间存在共价键,为离子化合物;
⑤Na2S中钠离子和硫离子之间只存在离子键,是离子化合物;
故只存在共价键的是②③,只存在离子键的是⑤,既存在离子键,又存在共价键的是④,不存在化学键的是①,属于共价化合物的是②,属于离子化合物的是④⑤。
17.(1) AB5 b
(2) (1,,)
(3)
【详解】(1)①由晶胞结构可知A有8个位于顶点,个数为,B有8个位于面上,1个位于体心,个数为,则该合金的组成为AB5;
②晶体沿c轴方向的投影上下面的顶点重合为正方向四个顶点,四个面心的B球投影到正方形棱心上,体心B原子投影为面心,上下面上的四个B原子两两重合,均投影在对角线上,b图符合;
(2)①根据数学立体几何关系可知,若图中原子1的分数坐标是(,,)则原子5的分数坐标是(1,,);
②因为原子1的分数坐标是(,,),原子5的分数坐标是(1,,),所以两个原子之间的距离为;
③其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,所以晶胞中Ga的原子个数为,N原子个数也为4,设阿伏加德罗常数的值为NA,则GaN晶体的质量为g,故其密度为 g·cm-3;
(3)该晶胞中B原子个数=4,N原子个数=,晶胞体积=,则该晶体的密度为 g·cm-3= g·cm-3;4个B在底面上的投影分别位于面对角线处,其图像为。
18. 价电子 电子气 金属原子 金属阳离子 自由电子 大 少 弱 强 高 大 钨 铬 特征
【解析】略
19.(1)B
(2)C
(3)C
【详解】(1)氯化铯晶胞中,Cs+离子位于立方体的中心,Cl-离子位于立方体的顶角,属于体心立方晶胞;
(2)一个Cl-离子周围最近的氯离子位于该氯离子的上下左右前后六个方向,因此最近的氯离子是6个;
(3)此晶胞是紧密堆积,Cs+离子的直径最接近与晶胞的边长,边长为体积开三次方,体积等于晶胞的质量除以密度,该晶胞中有一个Cs+和一个Cl-离子,晶胞质量为g,体积为,边长为cm,Cs+离子的直径最接近cm。
20. 六方最密堆积 12NA·a·ρ
【详解】根据镁单质晶体中原子的堆积模型图,镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,它的堆积模型名称为六方最密堆积;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg·cm-3,晶胞是图中的b,紧邻的四个镁原子的中心连线构成的几何体为正四面体,该正四面体的高为晶胞的高的,可推知四面体的体积为整个晶胞的,而晶胞中含有的镁原子数为1+8×=2,====g cm-3,则有M=(12NA·a·ρ)g mol-1。
21. SiCl4 SiF4、SiCl4、SiBr4、SiI4都是分子晶体,相对分子质量依次增大,分子间作用力依次增大
【详解】0℃时,根据表格中各物质的沸点,SiF4为气态、SiCl4为液态、SiBr4为固态、SiI4为固态,故呈液态的是SiCl4;沸点依次升高的原因是:SiF4、SiCl4、SiBr4、SiI4都是分子晶体,相对分子质量依次增大,分子间作用力依次增大。
22.
【详解】根据均摊法可知,该晶胞的组成为Hg4Ge4Sb8,由于最简式的式量为Mr,1个晶胞的质量m=,1个晶胞的体积V=(x×10-7cm)2×(y×10-7cm)=x2y×10-21cm3,则X晶体的密度为== g/cm3,故答案为:。
23. 4 4 Li、Na、K和Rb的卤化物,AgF,MgO等 1 1 CsBr、Csl、NH4Cl等 4 4 BeO、BeS等 4 8 BaF2、PbF2、CeO2等
【解析】略
