第三章 晶体结构与性质 测试题(含解析)2023-2024学年高二下学期人教版(2019)化学选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质 测试题(含解析)2023-2024学年高二下学期人教版(2019)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 898.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 19:59:48 | ||
图片预览




文档简介
第三章 晶体结构与性质 测试题
一、选择题
1.下列关于晶体的说法正确的是
A.离子晶体中一定含金属阳离子
B.只要含有金属阳离子的晶体就一定是离子晶体
C.在共价化合物分子中,各原子都形成8电子结构
D.分子晶体的熔点不一定比金属晶体的熔点低
2.碱性溶液中,可与缩二脲形成下图所示的紫色配离子。有关说法正确的是
A.该离子中,只有C、N和O原子可以和水分子形成氢键
B.基态Cu原子的价电子排布式是,该配离子中的配位数为4
C.该离子涉及的元素的电负性顺序为CuD.已知铜氨配离子为平面正方形结构,则图中离子也是平面型结构(均不考虑H原子)
3.某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,且Z只有三个能级,下列说法错误的是
A.原子半径:W>X>Y>Z>M
B.该物质中阴阳离子中均存在配位键
C.W的最高价含氧酸为弱酸
D.M与X形成化合物的沸点一定低于M与Z所形成的化合物
4.地壳表面分布很多阳离子,下列关于指定阳离子的检验方法正确的是
A.:向样品溶液中逐滴滴加氨水,先产生蓝色沉淀,然后沉淀消失,则有
B.:向样品溶液中滴加氯水,再加入溶液,溶液血红色,则有
C.:向样品溶液中滴加溶液,产生白色沉淀,再滴加稀盐酸,产生使澄清石灰水变浑浊的气体,则有
D.:向样品溶液中滴加溶液,产生使湿润的红色石蕊试纸变蓝的气体,则有
5.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
A.该晶体类型是原子晶体
B.晶体的空间最小环共有6个原子构成
C.晶体中碳原子数与C—O化学键数之比为1∶4
D.该晶体中碳原子和氧原子的个数比为1∶2
6.《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为:。下列说法正确的是
A.电负性: B.分子中C原子为杂化
C.单质硫属于共价晶体 D.中化学键只有键
7.有四组物质,每一组物质分别由同 一主族的元素组成,在101.3kPa时测定它们的沸点 (°C)如下表所示:
第一组 (a) -268. 8 Ne -249.5 Ar -185.8 Kr -151.7
第二组 F2 -187.0 Cl2 -33.6 (b) 58.7 I2 184.0
第三组 HF 19.4 (c) -84.0 HBr - 67.0 HI -35.3
第四组 H2O 100.0 H2S -60.2 (d) -42.0 H2Te -1.8
下列各项中正确的是
A.a、b、c的化学式分别为He2 、Br2、HCl
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中HF的沸点最高,是因为分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O> H2S > H2Se > H2Te
8.风暴瓶(如图)又称“天气瓶”。瓶中装有由樟脑()、硝酸钾、氯化铵、蒸馏水和乙醇组成的溶液。当外界温度降低时,樟脑结晶析出,其晶体形态会随条件的变化而发生改变。下列说法不正确的是
A.樟脑是有机化合物 B.樟脑的晶体属于离子晶体
C.樟脑在体系中的溶解度随温度升高而增大 D.“天气瓶”不能准确预示天气变化
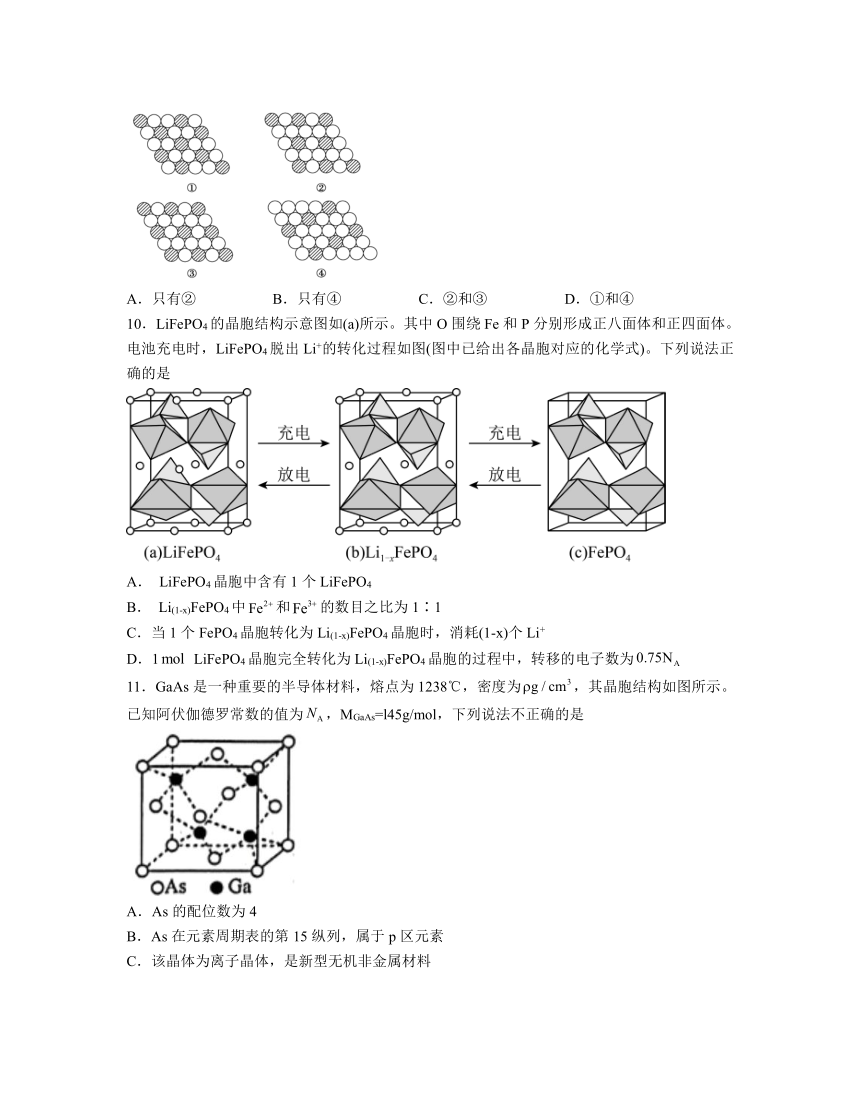
9.下面二维平面晶体所表示的化学式为AX3是
A.只有② B.只有④ C.②和③ D.①和④
10.LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体。电池充电时,LiFePO4脱出Li+的转化过程如图(图中已给出各晶胞对应的化学式)。下列说法正确的是
A. LiFePO4晶胞中含有1个LiFePO4
B. Li(1-x)FePO4中和的数目之比为1∶1
C.当1个FePO4晶胞转化为Li(1-x)FePO4晶胞时,消耗(1-x)个Li+
D.1 LiFePO4晶胞完全转化为Li(1-x)FePO4晶胞的过程中,转移的电子数为
11.GaAs是一种重要的半导体材料,熔点为1238℃,密度为,其晶胞结构如图所示。已知阿伏伽德罗常数的值为,MGaAs=l45g/mol,下列说法不正确的是
A.As的配位数为4
B.As在元素周期表的第15纵列,属于p区元素
C.该晶体为离子晶体,是新型无机非金属材料
D.GaAs的晶胞边长为
12.下列有关化学用语表示正确的是
A.Ne和Na+的结构示意图均为 B.质量数为37的氯原子
C.二氧化碳分子的结构式:C-O-C D.NH4Br的电子式:
13.下列对物质性质变化规律的叙述正确的是
A.NF3、NH3、H2O的键角依次减小 B.H2O、H2S、H2Se的键能依次增大
C.AlCl3、MgCl2、MgO的熔点依次增高 D.乙烷、乙烯、乙炔的碳碳键长依次增大
14.下列物质,按其晶体熔点由高到低排列正确的是
A.、Si、CsCl、NaCl、、、
B.Si、、CsCl、NaCl、、、
C.、Si、NaCl、CsCl、、、
D.Si、、CsCl、NaCl、、、
15.下列叙述中,正确的是
A.石英玻璃和水晶都是晶体
B.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
C.具有各向异性的固体可能是晶体
D.圆形容器中结出的冰是圆形的,体现了晶体的自范性
二、填空题
16.回答下列问题:
(1)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为_______。
②与CO互为等电子体的阴离子的电子式为_______,Ni能与CO形成正四面体形的配合物Ni(CO)4,该配合物中配位体分子式是_______,1mol Ni(CO)4的含有σ键的数目为_______NA。
(2)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。CH3COOH中C原子轨道杂化类型为_______,是否为手性分子_______(填是或否)。
17.碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___________结合在一起。四卤化硅(SiX4)的沸点按F、Cl、Br、I依次升高的原因是___________。
18.CaF2主要用于冶金、化工和建材三大行业。其晶胞结构如下图所示,若晶体密度为cg/cm3,则Ca2+间最近的距离为___________nm。
19.有下列七种晶体:
A 水晶 B 冰醋酸 C 白磷 D 晶体氩 E 氯化铵 F 铝 G 金刚石
用序号回答下列问题:
(1)属于原子晶体的化合物是___________,直接由原子构成的晶体是____________。
(2)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是__________,需克服共价键的是_____________。
20.氧族元素的单质及其化合物是一类重要物质,请回答下列问题。
⑴基态硒(Se)原子的价层电子排布式为____________。
⑵OCN-中所含三种元素的电负性从大到小的顺序为________(用元素符号表示,下同);第一电离能从大到小的顺序为________。已知等电子体具有相同的空间构型,则OCN-的空间构型为_______。
⑶H2O2分子中氧原子的轨道杂化类型是__________;H2O的沸点明显高于H2Se的沸点(42℃),其主要原因是_______________。
⑷硒化锌的晶胞结构如图所示,则硒化锌的化学式为_________,其中Zn(黑球)的配位数为______。
21.Ⅰ.已知元素M是组成物质 NH4Al(SO4)2的其中一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
I1 I2 I3 I4
电离能(kJ·mol-1) 578 1817 2745 11578
(1)元素M是_______ (填元素符号)。
(2)NH4Al(SO4)2中,电负性最大的元素是_______(填元素符号),S的_______杂化轨道与O的2p轨道形成_______键。
Ⅱ.如图所示为高温超导领域里的一种化合物-钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(3)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有_______个、_______个。
(4)该晶体结构中,氧、钛、钙的离子个数比是_______
(5)若钙、钛、氧三种元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛离子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为_______g/cm3。
22.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
23.铬是人体必需的微量元素,其在肌体的糖代谢和脂代谢中发挥着特殊作用,铬缺乏会造成葡萄糖耐量受损,可能伴随高血糖、尿糖等。而在工业中铬及其化合物在无机合成和有机合成中均有着重要作用。
Ⅰ.工业上以铬铁矿为原料生产铬酸钠,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到。
Ⅱ.市售的为深绿色晶体,实验室中可用甲醇在酸性条件下还原制备(装置如图A所示):
①将一定量铬酸钠、甲醇与水的混合物加入三颈烧瓶中;②升温至120℃时,缓慢滴加足量浓盐酸,保持100℃反应3h;③冷却,用NaOH溶液调节pH为6.5~7.5,得到沉淀;④洗净沉淀后,加入过量盐酸溶解,通过结晶法得到晶体。
已知:易溶于水、乙醇,易水解。
Ⅲ.重铬酸钾俗称红矾,是一种重要的化工产品,可向溶液中加酸,使转化为,再向溶液中加入KCl,升高温度,经过一系列操作后可获得晶体。已知的溶解度随温度变化的曲线如图B所示。
回答下列问题:
(1)是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为,该配合物的配体为___________、___________(填化学式)。
(2)在Ⅱ中制备晶体时,步骤④中“加入过量盐酸”的目的是___________。
(3)装置图A中,仪器c的名称为___________,仪器b的作用是___________。
(4)已知步骤Ⅱ中有产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为___________。
(5)往溶液中加入KCl,升高温度能获得。获得晶体的一系列操作包括:趁热过滤、___________、过滤、洗涤、干燥。其中“洗涤”步骤选用的洗涤剂为丙酮,其原因是___________。
【参考答案】
一、选择题
1.D
解析:A.离子晶体中不一定含金属阳离子,如NH4Cl中阳离子为铵根离子,属于非金属元素组成的原子团离子,故A错误;
B.只含有金属阳离子的晶体不一定是离子晶体,如金属晶体中存在金属阳离子和电子,故B错误;
C.在共价化合物分子中,各原子不一都形成8电子结构,如H2O中H原子只形成2电子稳定结构,故C错误;
D.分子晶体的熔点不一定比金属晶体的熔点低,如白磷与铯或汞,故D正确;
答案为D。
2.B
解析:A.该配离子中的N原子和O原子电负性较大、半径较小、含孤电子对,可与水分子中的H形成氢键,C不形成H键,选项A错误;
B.Cu为29号元素,基态Cu原子的价电子排布式是,根据配离子的结构可知,铜离子为受体,N和O为配体,铜离子的配位数为4,选项B正确;
C.同周期元素从左到右元素的电负性逐渐增大,非金属性越强电负性越大,电负性顺序为Cu < HD.氨气分子为三角锥形,结构中存在亚氨基,故图中离子不可能为平面结构,选项D错误;
答案选B。
3.D
【分析】M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,Z能形成2个共价键,则Z为O元素;M形成1个共价键,其原子序数最小,则M为H元素;X形成4个共价键,则X为C元素;Y、W能分别形成4个共价键,且分别形成阳离子、阴离子,则Y为N元素、W为B元素。
解析:A.由分析可知,M、W、X、Y、Z分别为H、B、C、N、O元素,除H外都属于第二周期元素,则原子半径:B>C>N>O>H,A正确;
B.该物质中,氮与氢、氧和硼之间存在配位键,B正确;
C.W的最高价含氧酸为H3BO3,属于弱酸,C正确;
D.M与X形成烃类物质,M与Z形成H2O、H2O2等,烃类物质沸点不一定低于H2O、H2O2的沸点,D错误;
故选D。
4.A
解析:A.向样品溶液中逐滴滴加氨水,先产生蓝色氢氧化铜沉淀,然后氢氧化铜沉淀和氨水反应生成络合离子而消失,则有,A正确;
B.若开始就存在铁离子,也会出现同样的现象,B错误;
C.溶液中若含有钡离子,也会出现同样的现象,C错误;
D.向样品溶液中滴加浓溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则有,实验中不加热氨气可能不会逸出,D错误;
故选A。
5.B
解析:A.根据题干,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,不存在分子,属于原子晶体,故A正确;
B. 该晶体的空间最小环由6个碳原子和6个氧原子构成,因此晶体的空间最小环共有12个原子构成,故B错误;
C.该晶体中,每个碳原子形成4个C-O共价键,所以C原子与C-O化学键数目之比为1:4,故C正确;
D.晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳氧原子个数比为1:2,故D正确。
故选B。
【点睛】每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,所以为原子晶体,和二氧化硅相似。最小环上的原子数、碳原子和C—O化学键数之比以及碳原子和氧原子的个数比都和二氧化硅相同。
6.B
解析:A.O的非金属性大于N,所以电负性N<O,故A错误;
B.CO2分子为直线型对称结构,C原子为sp杂化,故B正确;
C.单质硫是由分子通过分子间作用力结合而成,属于分子晶体,故C错误;
D.KNO3中既含离子键又含共价键,故D错误;
故选B。
7.D
解析:A.稀有气体均为单原子分子,a、b、c的化学式分别为He、Br2、HCl,A错误;
B.第二组物质中F2只表现氧化性,其余物质均既表现还原性又能表现出氧化性,B错误;
C.第三组物质中HF的沸点最高,是因为分子间存在氢键,C错误;
D.同一主族从上往下元素的非金属性依次减弱,气态氢化物的稳定性依次减弱,故第四组中各化合物的稳定性顺序为:H2O> H2S > H2Se > H2Te,D正确;
故答案为:D。
8.B
解析:A.樟脑含有碳、氢、氧三种元素,是有机化合物,故A正确;
B.构成樟脑晶体的微粒是分子,微粒间作用力为分子间作用力,属于分子晶体,故B错误;
C.当外界温度降低时,樟脑结晶析出,所以樟脑在体系中的溶解度随温度升高而增大,故C正确;
D.当外界温度降低时,樟脑结晶析出,其晶体形态会随条件的变化而发生改变,只能够预测温度的变化,其他天气问题无法预测,故D正确;
故选:B。
9.C
解析:①.图中每个黑球周围有6个白色球,而每个白色球为3个黑球共有,故黑球与白色球数目之比=1:6×=1:2,化学式为AX2;
②.图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×=1:3,化学式为AX3;
③.图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×=1:3,化学式为AX3;
④.图中每个黑球周围有6个白色球,但每个白色球并不是为2个黑球共有,其化学式不是AX3;
故选C。
10.D
解析:A.均摊法可知,晶胞中Li+数目为8×+4×+4×=4,故每个晶胞中含有LiFePO4的单元数有4个,A错误;
B.由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,Li(1-x)FePO4晶胞中Li+数目为8×+3×+3×=,Fe原子数目不变,有4个,故(1-x):1=:4,解得x=,则Fe的平均化合价为,假设含a个Fe2+,则Fe3+为b个,则有:=,解得:a:b=13:3,B错误;
C.由A项分析可知,每个LiFePO4晶胞中含有LiFePO4的单元数有4个,根据Fe原子不变可知,当1个LiFePO4晶胞转化为Li(1-x)FePO4晶胞时,消耗4(1-x)个Li+,C错误;
D.由B项分析可知,Li(1-x)FePO4晶胞中Fe的化合价为,1mol LiFePO4晶胞完全转化为Li(1-x)FePO4晶胞的过程中,转移的电子数为4×(-2)×NAmol-1=0.75NA,D正确;
故答案为:D。
11.C
解析:A.以面心的As分析,As的配位数为4,故A正确;
B.周期表中13到18纵列是p区元素,As在元素周期表的第15纵列,属于p区元素,故B正确;
C.GaAs是一种重要的半导体材料,熔点为1238℃,熔点较高,该晶体为共价晶体,故C错误;
D.根据GaAs晶胞分析晶胞中含有4个Ga,个As,则GaAs的晶胞密度为,边长为,故D正确。
综上所述,答案为C。
12.D
解析:A. Ne原子的质子数和电子数均为10,Ne的结构示意图均为,钠离子的质子数和电子数分别为11、10,钠离子的结构示意图均为 ,A错误;
B. 核素符号的左下角为质子数、左上角为质量数,质量数为37的氯原子,B错误;
C. 二氧化碳分子内存在碳氧双键,结构式:C=O=C,C错误;
D. NH4Br由铵离子和溴离子构成,电子式:,D正确;
答案选D。
13.C
解析:A.NF3、NH3都为三角锥形结构,H2O为“V”形结构,由于电负性F>N>H,因此NH3中共用电子对偏向氮,成对电子之间排斥力使得键角增大,氮原子有一个孤电子对,而氧原子有两个孤电子对,孤电子对之间的扩力大于成键电子对之间的,则三者键角大小顺序为NH3、NF3、H2O,故A错误;
B.原子半径O>S>Se,半径越小,键长越短,键能越大,因此H2O、H2S、H2Se的键能依次减小,故B错误;
C.AlCl3是分子晶体,MgCl2、MgO是离子晶体,一般离子晶体熔点大于分子晶体熔点,氧离子带电荷数比氯离子带电荷数多,氧化镁晶格能大于氯化镁晶格能,因此三者的熔点依次增高,故C正确;
D.乙烷分子中的碳碳键是碳碳单键,乙烯分子中的碳碳键是碳碳双键,乙炔分子中的碳碳键是碳碳三键,因此乙烷、乙烯、乙炔的碳碳键长依次减小,故D错误。
综上所述,答案为C。
14.C
解析:、Si为共价晶体,Si-Si的键长比Si-O长,则Si-Si的键能比Si-O小,所以熔点>Si;
CsCl和NaCl 为离子晶体,半径Cs+>Na+,所以CsCl的晶格能小,熔点CsCl、、都为分子晶体,分子间含有氢键熔点高,分子间不含有氢键,分子的相对分子质量越大,分子间作用力越强,熔点越高,则、、熔点:>>;
不同晶体的熔点:一般为共价晶体>离子晶体>分子晶体,所以按其晶体熔点由高到低排列顺序为:、Si、NaCl、CsCl、、、;
故选C。
15.C
解析:A.石英玻璃主要成分是二氧化硅,水晶融化冷却形成的石英玻璃都是非晶体,故A错误;
B.晶体与非晶体的根本区别在于晶体有自范性,故B错误;
C.晶体有自范性,所以具有各向异性的固体可能是晶体,故C正确;
D.晶体的自范性不受容器的影响,圆形容器中结出的冰是圆形,不是自发形成的,而是受容器限制形成的,故D错误;
故选:C。
二、填空题
16.(1) 1s22s22p63s23p63d84s2或[Ar]3d84s2 、 CO 8
(2) sp3、sp2 否
解析:(1)①Ni为28号元素,原子核外有28个电子,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
②CO含2个原子、10个价电子,其等电子体的阴离子为CN-和C,电子式分别为其电子式为 、;CO分子中C原子含有孤电子对,可以提供电子,作配体;CO分子与Ni之间的配位键为σ键,CO分子中有一个σ键,所以1mol Ni(CO)4的含有σ键的数目为8NA;
(2)CH3COOH分子甲基上的碳原子形成4σ键,为sp3杂化,羧基中C原子形成双键,为sp2杂化;甲基上的碳原子连接了3个H原子,不是手性碳,所以该分子不是手性分子。
17. 范德华力 四卤化硅SiX4均为分子晶体,范德华力随相对分子质量的增大而增大
解析:碳纳米管结构类似于石墨晶体,则推知多层碳纳米管的层与层之间靠范德华力结合在一起;四卤化硅SiX4均为分子晶体,范德华力随相对分子质量的增大而增大,所以四卤化硅(SiX4)的沸点按F、Cl、Br、I依次升高。
18.
解析:该晶胞中氟离子个数为8、钙离子个数为,晶胞体积为cm3,晶胞棱长为cm,晶胞中间最近的距离为晶胞面对角线的,所以Ca2+间最近的距离为nm。
19. A ADG F BCD AG
【分析】A水晶是由Si和O两种原子构成的原子晶体;B冰醋酸是由醋酸分子构成的分子晶体;C白磷是由P4构成的分子晶体;D晶体氩是由Ar原子构成的但原子和原子之间以分子间作用力的形式结合,属于分子晶体;E氯化铵是由铵根离子和氯离子构成的离子晶体;F铝是金属晶体;G金刚石是由C原子构成的原子晶体,据此答题。
解析:(1)根据分析,属于原子晶体的化合物是A;直接由原子构成的晶体是ADG;
(2)物质导电是由于离子或电子发生了定向移动,上述7个物质能导电而不发生化学变化的是F金属晶体;受热熔化后化学键不发生变化的是分子晶体,故选择BCD;熔化时需要克服共价键的是原子晶体,故选择AG。
20. 4s24p6 O > N > C N> O > C 直线形 sp3 H2O分子间存在氢键,H2Se分子间无氢键 ZnSe 4
【分析】⑴基态硒(Se)原子的电子排布式为[Ar]3d104s24p6。
⑵同周期从左到右电负性逐渐逐渐增大,同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
⑶分析H2O2分子中氧原子价层电子对数得到杂化类型。
⑷根据晶胞结构计算锌离子、硒离子个数得到化学式。
解析:⑴基态硒(Se)原子的电子排布式为[Ar]3d104s24p6,价层电子排布式为4s24p6;故答案为:4s24p6。
⑵同周期从左到右电负性逐渐逐渐增大,OCN-中所含三种元素的电负性从大到小的顺序为O > N > C;同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此第一电离能从大到小的顺序为N> O > C。已知等电子体具有相同的空间构型,则OCN-的价层电子对数为,其空间构型为直线形;故答案为:O > N > C;N> O > C;直线形。
⑶H2O2分子中氧原子σ键为2,孤对电子为2对,因此氧原子的轨道杂化类型是sp3;H2O的沸点明显高于H2Se的沸点(42℃),其主要原因是H2O分子间存在氢键,H2Se分子间无氢键;故答案为:sp3;H2O分子间存在氢键,H2Se分子间无氢键。
⑷硒化锌的晶胞结构如图所示,锌离子个数为4,硒离子个数为,则硒化锌的化学式为ZnS,其中Zn(黑球)与周围有四个硒离子,因此Zn(黑球)的配位数为4;故答案为:ZnS;4。
21.(1)Al
(2) O sp3 σ
(3) 6 8
(4)3:1:1
(5)
解析:(1)从元素M的电离能变化可知,当原子失去第四个电子时,其电离能急剧增加,说明该元素失去三个电子后达到稳定结构,则该元素最外层有3个电子,而元素M是组成物质NH4Al(SO4)2的其中一种元素,则M为Al;
(2)同一周期主族元素从左向右元素电负性逐渐增大,同一主族元素从上向下元素电负性逐渐减小,则NH4Al(SO4)2中,电负性最大的元素是O;其中S的杂化类型是sp3杂化,则S的sp3杂化轨道与O的2p轨道形成σ键;
(3)以钛离子为顶点,应有8个立方晶胞紧靠在一起,这样钛离子成为空间直角坐标系的中心原点,它的三维方向上前后左右上下最近且距离相等的氧离子有6个、钙离子有8个;
(4)依据均摊法,氧离子数为:12=3,钛离子数为:8=1,钙离子数为:1,则该晶体结构中,氧、钛、钙的离子个数比是:3:1:1;
(5)晶体质量m=g,体积V=d310-21cm3,则密度ρ====。
22. 1s22s22p63s23p63d10 sp3杂化 v形 SiO2 SiO2为原子晶体 CO2为分子晶体 2Cu + 8NH3 + O2 + 2H2O 2[Cu(NH3)4]2+ + 4OH- 8
【分析】由题意,X是所有元素中原子半径最小的,则X为H元素,Y有三个能级上且电子数相等, Y为C元素;R与Y同主族,R为Si,Z原子单电子数在同周期元素中最多,则外围电子排布为应符合ns2np3,结合题意可知Z为N元素;W与Z同周期,第一电离能比N的低,原子序数比N大,则W为O元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,其核外电子排布应为1s22s22p63s23p63d104s1,则Q为Cu,据此分析。
解析:详解:根据以上分析可知X、Y、Z、W、R、Q分别是H、C、N、O、Si、Cu。则
(1)Q为Cu,Cu+的核外电子排布式为1s22s22p63s23p63d10;
(2)X为H,Z为N,W为O,X2W2为H2O2,中心O原子价层电子对数为2+(6 2)/2=4,故O原子采取sp3杂化;ZW2-为NO2-,离子中N原子孤电子对数为(5+1 2×2)/2=1、价层电子对数为2+1=3,其立体构型是V形,故答案为:sp3,V形;
(3)Y为C,R为Si,最高价氧化物分别为CO2、SiO2,CO2为分子晶体,SiO2为原子晶体,沸点较高的是SiO2,故答案为:SiO2、CO2为分子晶体,SiO2为原子晶体;
(4)Q为Cu,ZX3为NH3,W2为O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,则该反应的离子方程式为2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-;
(5)由晶胞示意图可知,该晶体一个晶胞的中Y原子数为:4+8×1/8+6×1/2=8;每个Y与周围的4个Y原子相邻,故Y原子的配位数为4;若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则晶胞质量为(a×10-10)3cm3×ρ g/cm3 = a3×10-30ρ g,则8×12/NA g=a3×10-30ρ g,故NA=。
23.(1) (两空答案不分先后)
(2)抑制(或)水解
(3) (球形)干燥管 导气、冷凝回流
(4)
(5) 降温结晶 减少的溶解,并便于干燥
【分析】铬酸钠、甲醇与足量浓盐酸在加热条件下发生反应,调节pH得到Cr(OH)3沉淀,往Cr(OH)3沉淀中加入过量盐酸溶解,通过结晶法得到CrCl36H2O晶体。
解析:(1)配合物中,配体为和。
(2)易水解,步骤④中“加入过量盐酸”的目的是抑制(或)水解。
(3)装置图A中,仪器c的名称为球形干燥管;仪器b为(球形)干燥管,其作用是导气和冷凝回流。
(4)步骤Ⅱ中有产生,则三颈烧瓶中甲醇将铬酸根离子还原为+3价铬离子,反应的离子方程式为。
(5)由于的溶解度受温度影响比较大,可通过降温结晶的方法析出晶体,因此获得晶体的一系列操作包括:趁热过滤、降温结晶、过滤、洗涤、干燥;其中“洗涤”步骤中选用丙酮作为洗涤剂,目的是减少的溶解,并便于干燥
一、选择题
1.下列关于晶体的说法正确的是
A.离子晶体中一定含金属阳离子
B.只要含有金属阳离子的晶体就一定是离子晶体
C.在共价化合物分子中,各原子都形成8电子结构
D.分子晶体的熔点不一定比金属晶体的熔点低
2.碱性溶液中,可与缩二脲形成下图所示的紫色配离子。有关说法正确的是
A.该离子中,只有C、N和O原子可以和水分子形成氢键
B.基态Cu原子的价电子排布式是,该配离子中的配位数为4
C.该离子涉及的元素的电负性顺序为Cu
3.某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,且Z只有三个能级,下列说法错误的是
A.原子半径:W>X>Y>Z>M
B.该物质中阴阳离子中均存在配位键
C.W的最高价含氧酸为弱酸
D.M与X形成化合物的沸点一定低于M与Z所形成的化合物
4.地壳表面分布很多阳离子,下列关于指定阳离子的检验方法正确的是
A.:向样品溶液中逐滴滴加氨水,先产生蓝色沉淀,然后沉淀消失,则有
B.:向样品溶液中滴加氯水,再加入溶液,溶液血红色,则有
C.:向样品溶液中滴加溶液,产生白色沉淀,再滴加稀盐酸,产生使澄清石灰水变浑浊的气体,则有
D.:向样品溶液中滴加溶液,产生使湿润的红色石蕊试纸变蓝的气体,则有
5.最近科学家成功制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,下列对该晶体叙述错误的是( )
A.该晶体类型是原子晶体
B.晶体的空间最小环共有6个原子构成
C.晶体中碳原子数与C—O化学键数之比为1∶4
D.该晶体中碳原子和氧原子的个数比为1∶2
6.《天工开物》记载:“凡火药以硝石、硫黄为主,草木灰为辅……而后火药成声”。其中涉及的主要反应为:。下列说法正确的是
A.电负性: B.分子中C原子为杂化
C.单质硫属于共价晶体 D.中化学键只有键
7.有四组物质,每一组物质分别由同 一主族的元素组成,在101.3kPa时测定它们的沸点 (°C)如下表所示:
第一组 (a) -268. 8 Ne -249.5 Ar -185.8 Kr -151.7
第二组 F2 -187.0 Cl2 -33.6 (b) 58.7 I2 184.0
第三组 HF 19.4 (c) -84.0 HBr - 67.0 HI -35.3
第四组 H2O 100.0 H2S -60.2 (d) -42.0 H2Te -1.8
下列各项中正确的是
A.a、b、c的化学式分别为He2 、Br2、HCl
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中HF的沸点最高,是因为分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O> H2S > H2Se > H2Te
8.风暴瓶(如图)又称“天气瓶”。瓶中装有由樟脑()、硝酸钾、氯化铵、蒸馏水和乙醇组成的溶液。当外界温度降低时,樟脑结晶析出,其晶体形态会随条件的变化而发生改变。下列说法不正确的是
A.樟脑是有机化合物 B.樟脑的晶体属于离子晶体
C.樟脑在体系中的溶解度随温度升高而增大 D.“天气瓶”不能准确预示天气变化
9.下面二维平面晶体所表示的化学式为AX3是
A.只有② B.只有④ C.②和③ D.①和④
10.LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体。电池充电时,LiFePO4脱出Li+的转化过程如图(图中已给出各晶胞对应的化学式)。下列说法正确的是
A. LiFePO4晶胞中含有1个LiFePO4
B. Li(1-x)FePO4中和的数目之比为1∶1
C.当1个FePO4晶胞转化为Li(1-x)FePO4晶胞时,消耗(1-x)个Li+
D.1 LiFePO4晶胞完全转化为Li(1-x)FePO4晶胞的过程中,转移的电子数为
11.GaAs是一种重要的半导体材料,熔点为1238℃,密度为,其晶胞结构如图所示。已知阿伏伽德罗常数的值为,MGaAs=l45g/mol,下列说法不正确的是
A.As的配位数为4
B.As在元素周期表的第15纵列,属于p区元素
C.该晶体为离子晶体,是新型无机非金属材料
D.GaAs的晶胞边长为
12.下列有关化学用语表示正确的是
A.Ne和Na+的结构示意图均为 B.质量数为37的氯原子
C.二氧化碳分子的结构式:C-O-C D.NH4Br的电子式:
13.下列对物质性质变化规律的叙述正确的是
A.NF3、NH3、H2O的键角依次减小 B.H2O、H2S、H2Se的键能依次增大
C.AlCl3、MgCl2、MgO的熔点依次增高 D.乙烷、乙烯、乙炔的碳碳键长依次增大
14.下列物质,按其晶体熔点由高到低排列正确的是
A.、Si、CsCl、NaCl、、、
B.Si、、CsCl、NaCl、、、
C.、Si、NaCl、CsCl、、、
D.Si、、CsCl、NaCl、、、
15.下列叙述中,正确的是
A.石英玻璃和水晶都是晶体
B.晶体与非晶体的根本区别在于固体是否具有规则的几何外形
C.具有各向异性的固体可能是晶体
D.圆形容器中结出的冰是圆形的,体现了晶体的自范性
二、填空题
16.回答下列问题:
(1)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为_______。
②与CO互为等电子体的阴离子的电子式为_______,Ni能与CO形成正四面体形的配合物Ni(CO)4,该配合物中配位体分子式是_______,1mol Ni(CO)4的含有σ键的数目为_______NA。
(2)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。CH3COOH中C原子轨道杂化类型为_______,是否为手性分子_______(填是或否)。
17.碳、硅与铅同主族。碳纳米管可以制成透明导电的薄膜,其结构类似于石墨晶体,则多层碳纳米管的层与层之间靠___________结合在一起。四卤化硅(SiX4)的沸点按F、Cl、Br、I依次升高的原因是___________。
18.CaF2主要用于冶金、化工和建材三大行业。其晶胞结构如下图所示,若晶体密度为cg/cm3,则Ca2+间最近的距离为___________nm。
19.有下列七种晶体:
A 水晶 B 冰醋酸 C 白磷 D 晶体氩 E 氯化铵 F 铝 G 金刚石
用序号回答下列问题:
(1)属于原子晶体的化合物是___________,直接由原子构成的晶体是____________。
(2)在一定条件下能导电而不发生化学变化的是___________,受热熔化后化学键不发生变化的是__________,需克服共价键的是_____________。
20.氧族元素的单质及其化合物是一类重要物质,请回答下列问题。
⑴基态硒(Se)原子的价层电子排布式为____________。
⑵OCN-中所含三种元素的电负性从大到小的顺序为________(用元素符号表示,下同);第一电离能从大到小的顺序为________。已知等电子体具有相同的空间构型,则OCN-的空间构型为_______。
⑶H2O2分子中氧原子的轨道杂化类型是__________;H2O的沸点明显高于H2Se的沸点(42℃),其主要原因是_______________。
⑷硒化锌的晶胞结构如图所示,则硒化锌的化学式为_________,其中Zn(黑球)的配位数为______。
21.Ⅰ.已知元素M是组成物质 NH4Al(SO4)2的其中一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
I1 I2 I3 I4
电离能(kJ·mol-1) 578 1817 2745 11578
(1)元素M是_______ (填元素符号)。
(2)NH4Al(SO4)2中,电负性最大的元素是_______(填元素符号),S的_______杂化轨道与O的2p轨道形成_______键。
Ⅱ.如图所示为高温超导领域里的一种化合物-钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
(3)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有_______个、_______个。
(4)该晶体结构中,氧、钛、钙的离子个数比是_______
(5)若钙、钛、氧三种元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛离子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为_______g/cm3。
22.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
23.铬是人体必需的微量元素,其在肌体的糖代谢和脂代谢中发挥着特殊作用,铬缺乏会造成葡萄糖耐量受损,可能伴随高血糖、尿糖等。而在工业中铬及其化合物在无机合成和有机合成中均有着重要作用。
Ⅰ.工业上以铬铁矿为原料生产铬酸钠,实际操作是将铬铁矿和纯碱置于坩埚中,在空气中加热,得到。
Ⅱ.市售的为深绿色晶体,实验室中可用甲醇在酸性条件下还原制备(装置如图A所示):
①将一定量铬酸钠、甲醇与水的混合物加入三颈烧瓶中;②升温至120℃时,缓慢滴加足量浓盐酸,保持100℃反应3h;③冷却,用NaOH溶液调节pH为6.5~7.5,得到沉淀;④洗净沉淀后,加入过量盐酸溶解,通过结晶法得到晶体。
已知:易溶于水、乙醇,易水解。
Ⅲ.重铬酸钾俗称红矾,是一种重要的化工产品,可向溶液中加酸,使转化为,再向溶液中加入KCl,升高温度,经过一系列操作后可获得晶体。已知的溶解度随温度变化的曲线如图B所示。
回答下列问题:
(1)是配位化合物,由于内界配体不同而有不同的颜色,呈深绿色的晶体为,该配合物的配体为___________、___________(填化学式)。
(2)在Ⅱ中制备晶体时,步骤④中“加入过量盐酸”的目的是___________。
(3)装置图A中,仪器c的名称为___________,仪器b的作用是___________。
(4)已知步骤Ⅱ中有产生,则三颈烧瓶中甲醇还原铬酸钠的离子方程式为___________。
(5)往溶液中加入KCl,升高温度能获得。获得晶体的一系列操作包括:趁热过滤、___________、过滤、洗涤、干燥。其中“洗涤”步骤选用的洗涤剂为丙酮,其原因是___________。
【参考答案】
一、选择题
1.D
解析:A.离子晶体中不一定含金属阳离子,如NH4Cl中阳离子为铵根离子,属于非金属元素组成的原子团离子,故A错误;
B.只含有金属阳离子的晶体不一定是离子晶体,如金属晶体中存在金属阳离子和电子,故B错误;
C.在共价化合物分子中,各原子不一都形成8电子结构,如H2O中H原子只形成2电子稳定结构,故C错误;
D.分子晶体的熔点不一定比金属晶体的熔点低,如白磷与铯或汞,故D正确;
答案为D。
2.B
解析:A.该配离子中的N原子和O原子电负性较大、半径较小、含孤电子对,可与水分子中的H形成氢键,C不形成H键,选项A错误;
B.Cu为29号元素,基态Cu原子的价电子排布式是,根据配离子的结构可知,铜离子为受体,N和O为配体,铜离子的配位数为4,选项B正确;
C.同周期元素从左到右元素的电负性逐渐增大,非金属性越强电负性越大,电负性顺序为Cu < H
答案选B。
3.D
【分析】M、W、X、Y、Z五种短周期元素原子序数依次增大,电负性Z大于Y,Z能形成2个共价键,则Z为O元素;M形成1个共价键,其原子序数最小,则M为H元素;X形成4个共价键,则X为C元素;Y、W能分别形成4个共价键,且分别形成阳离子、阴离子,则Y为N元素、W为B元素。
解析:A.由分析可知,M、W、X、Y、Z分别为H、B、C、N、O元素,除H外都属于第二周期元素,则原子半径:B>C>N>O>H,A正确;
B.该物质中,氮与氢、氧和硼之间存在配位键,B正确;
C.W的最高价含氧酸为H3BO3,属于弱酸,C正确;
D.M与X形成烃类物质,M与Z形成H2O、H2O2等,烃类物质沸点不一定低于H2O、H2O2的沸点,D错误;
故选D。
4.A
解析:A.向样品溶液中逐滴滴加氨水,先产生蓝色氢氧化铜沉淀,然后氢氧化铜沉淀和氨水反应生成络合离子而消失,则有,A正确;
B.若开始就存在铁离子,也会出现同样的现象,B错误;
C.溶液中若含有钡离子,也会出现同样的现象,C错误;
D.向样品溶液中滴加浓溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则有,实验中不加热氨气可能不会逸出,D错误;
故选A。
5.B
解析:A.根据题干,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,不存在分子,属于原子晶体,故A正确;
B. 该晶体的空间最小环由6个碳原子和6个氧原子构成,因此晶体的空间最小环共有12个原子构成,故B错误;
C.该晶体中,每个碳原子形成4个C-O共价键,所以C原子与C-O化学键数目之比为1:4,故C正确;
D.晶体中每个碳原子均以四个共价单键与氧原子结合,每个氧原子和2个碳原子以共价单键相结合,所以碳氧原子个数比为1:2,故D正确。
故选B。
【点睛】每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构,所以为原子晶体,和二氧化硅相似。最小环上的原子数、碳原子和C—O化学键数之比以及碳原子和氧原子的个数比都和二氧化硅相同。
6.B
解析:A.O的非金属性大于N,所以电负性N<O,故A错误;
B.CO2分子为直线型对称结构,C原子为sp杂化,故B正确;
C.单质硫是由分子通过分子间作用力结合而成,属于分子晶体,故C错误;
D.KNO3中既含离子键又含共价键,故D错误;
故选B。
7.D
解析:A.稀有气体均为单原子分子,a、b、c的化学式分别为He、Br2、HCl,A错误;
B.第二组物质中F2只表现氧化性,其余物质均既表现还原性又能表现出氧化性,B错误;
C.第三组物质中HF的沸点最高,是因为分子间存在氢键,C错误;
D.同一主族从上往下元素的非金属性依次减弱,气态氢化物的稳定性依次减弱,故第四组中各化合物的稳定性顺序为:H2O> H2S > H2Se > H2Te,D正确;
故答案为:D。
8.B
解析:A.樟脑含有碳、氢、氧三种元素,是有机化合物,故A正确;
B.构成樟脑晶体的微粒是分子,微粒间作用力为分子间作用力,属于分子晶体,故B错误;
C.当外界温度降低时,樟脑结晶析出,所以樟脑在体系中的溶解度随温度升高而增大,故C正确;
D.当外界温度降低时,樟脑结晶析出,其晶体形态会随条件的变化而发生改变,只能够预测温度的变化,其他天气问题无法预测,故D正确;
故选:B。
9.C
解析:①.图中每个黑球周围有6个白色球,而每个白色球为3个黑球共有,故黑球与白色球数目之比=1:6×=1:2,化学式为AX2;
②.图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×=1:3,化学式为AX3;
③.图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×=1:3,化学式为AX3;
④.图中每个黑球周围有6个白色球,但每个白色球并不是为2个黑球共有,其化学式不是AX3;
故选C。
10.D
解析:A.均摊法可知,晶胞中Li+数目为8×+4×+4×=4,故每个晶胞中含有LiFePO4的单元数有4个,A错误;
B.由图可知,(a)→(b)充电过程中,晶胞失去1个棱心、1个面心位置的Li+,Li(1-x)FePO4晶胞中Li+数目为8×+3×+3×=,Fe原子数目不变,有4个,故(1-x):1=:4,解得x=,则Fe的平均化合价为,假设含a个Fe2+,则Fe3+为b个,则有:=,解得:a:b=13:3,B错误;
C.由A项分析可知,每个LiFePO4晶胞中含有LiFePO4的单元数有4个,根据Fe原子不变可知,当1个LiFePO4晶胞转化为Li(1-x)FePO4晶胞时,消耗4(1-x)个Li+,C错误;
D.由B项分析可知,Li(1-x)FePO4晶胞中Fe的化合价为,1mol LiFePO4晶胞完全转化为Li(1-x)FePO4晶胞的过程中,转移的电子数为4×(-2)×NAmol-1=0.75NA,D正确;
故答案为:D。
11.C
解析:A.以面心的As分析,As的配位数为4,故A正确;
B.周期表中13到18纵列是p区元素,As在元素周期表的第15纵列,属于p区元素,故B正确;
C.GaAs是一种重要的半导体材料,熔点为1238℃,熔点较高,该晶体为共价晶体,故C错误;
D.根据GaAs晶胞分析晶胞中含有4个Ga,个As,则GaAs的晶胞密度为,边长为,故D正确。
综上所述,答案为C。
12.D
解析:A. Ne原子的质子数和电子数均为10,Ne的结构示意图均为,钠离子的质子数和电子数分别为11、10,钠离子的结构示意图均为 ,A错误;
B. 核素符号的左下角为质子数、左上角为质量数,质量数为37的氯原子,B错误;
C. 二氧化碳分子内存在碳氧双键,结构式:C=O=C,C错误;
D. NH4Br由铵离子和溴离子构成,电子式:,D正确;
答案选D。
13.C
解析:A.NF3、NH3都为三角锥形结构,H2O为“V”形结构,由于电负性F>N>H,因此NH3中共用电子对偏向氮,成对电子之间排斥力使得键角增大,氮原子有一个孤电子对,而氧原子有两个孤电子对,孤电子对之间的扩力大于成键电子对之间的,则三者键角大小顺序为NH3、NF3、H2O,故A错误;
B.原子半径O>S>Se,半径越小,键长越短,键能越大,因此H2O、H2S、H2Se的键能依次减小,故B错误;
C.AlCl3是分子晶体,MgCl2、MgO是离子晶体,一般离子晶体熔点大于分子晶体熔点,氧离子带电荷数比氯离子带电荷数多,氧化镁晶格能大于氯化镁晶格能,因此三者的熔点依次增高,故C正确;
D.乙烷分子中的碳碳键是碳碳单键,乙烯分子中的碳碳键是碳碳双键,乙炔分子中的碳碳键是碳碳三键,因此乙烷、乙烯、乙炔的碳碳键长依次减小,故D错误。
综上所述,答案为C。
14.C
解析:、Si为共价晶体,Si-Si的键长比Si-O长,则Si-Si的键能比Si-O小,所以熔点>Si;
CsCl和NaCl 为离子晶体,半径Cs+>Na+,所以CsCl的晶格能小,熔点CsCl
不同晶体的熔点:一般为共价晶体>离子晶体>分子晶体,所以按其晶体熔点由高到低排列顺序为:、Si、NaCl、CsCl、、、;
故选C。
15.C
解析:A.石英玻璃主要成分是二氧化硅,水晶融化冷却形成的石英玻璃都是非晶体,故A错误;
B.晶体与非晶体的根本区别在于晶体有自范性,故B错误;
C.晶体有自范性,所以具有各向异性的固体可能是晶体,故C正确;
D.晶体的自范性不受容器的影响,圆形容器中结出的冰是圆形,不是自发形成的,而是受容器限制形成的,故D错误;
故选:C。
二、填空题
16.(1) 1s22s22p63s23p63d84s2或[Ar]3d84s2 、 CO 8
(2) sp3、sp2 否
解析:(1)①Ni为28号元素,原子核外有28个电子,核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
②CO含2个原子、10个价电子,其等电子体的阴离子为CN-和C,电子式分别为其电子式为 、;CO分子中C原子含有孤电子对,可以提供电子,作配体;CO分子与Ni之间的配位键为σ键,CO分子中有一个σ键,所以1mol Ni(CO)4的含有σ键的数目为8NA;
(2)CH3COOH分子甲基上的碳原子形成4σ键,为sp3杂化,羧基中C原子形成双键,为sp2杂化;甲基上的碳原子连接了3个H原子,不是手性碳,所以该分子不是手性分子。
17. 范德华力 四卤化硅SiX4均为分子晶体,范德华力随相对分子质量的增大而增大
解析:碳纳米管结构类似于石墨晶体,则推知多层碳纳米管的层与层之间靠范德华力结合在一起;四卤化硅SiX4均为分子晶体,范德华力随相对分子质量的增大而增大,所以四卤化硅(SiX4)的沸点按F、Cl、Br、I依次升高。
18.
解析:该晶胞中氟离子个数为8、钙离子个数为,晶胞体积为cm3,晶胞棱长为cm,晶胞中间最近的距离为晶胞面对角线的,所以Ca2+间最近的距离为nm。
19. A ADG F BCD AG
【分析】A水晶是由Si和O两种原子构成的原子晶体;B冰醋酸是由醋酸分子构成的分子晶体;C白磷是由P4构成的分子晶体;D晶体氩是由Ar原子构成的但原子和原子之间以分子间作用力的形式结合,属于分子晶体;E氯化铵是由铵根离子和氯离子构成的离子晶体;F铝是金属晶体;G金刚石是由C原子构成的原子晶体,据此答题。
解析:(1)根据分析,属于原子晶体的化合物是A;直接由原子构成的晶体是ADG;
(2)物质导电是由于离子或电子发生了定向移动,上述7个物质能导电而不发生化学变化的是F金属晶体;受热熔化后化学键不发生变化的是分子晶体,故选择BCD;熔化时需要克服共价键的是原子晶体,故选择AG。
20. 4s24p6 O > N > C N> O > C 直线形 sp3 H2O分子间存在氢键,H2Se分子间无氢键 ZnSe 4
【分析】⑴基态硒(Se)原子的电子排布式为[Ar]3d104s24p6。
⑵同周期从左到右电负性逐渐逐渐增大,同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族。
⑶分析H2O2分子中氧原子价层电子对数得到杂化类型。
⑷根据晶胞结构计算锌离子、硒离子个数得到化学式。
解析:⑴基态硒(Se)原子的电子排布式为[Ar]3d104s24p6,价层电子排布式为4s24p6;故答案为:4s24p6。
⑵同周期从左到右电负性逐渐逐渐增大,OCN-中所含三种元素的电负性从大到小的顺序为O > N > C;同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族大于第VIA族,因此第一电离能从大到小的顺序为N> O > C。已知等电子体具有相同的空间构型,则OCN-的价层电子对数为,其空间构型为直线形;故答案为:O > N > C;N> O > C;直线形。
⑶H2O2分子中氧原子σ键为2,孤对电子为2对,因此氧原子的轨道杂化类型是sp3;H2O的沸点明显高于H2Se的沸点(42℃),其主要原因是H2O分子间存在氢键,H2Se分子间无氢键;故答案为:sp3;H2O分子间存在氢键,H2Se分子间无氢键。
⑷硒化锌的晶胞结构如图所示,锌离子个数为4,硒离子个数为,则硒化锌的化学式为ZnS,其中Zn(黑球)与周围有四个硒离子,因此Zn(黑球)的配位数为4;故答案为:ZnS;4。
21.(1)Al
(2) O sp3 σ
(3) 6 8
(4)3:1:1
(5)
解析:(1)从元素M的电离能变化可知,当原子失去第四个电子时,其电离能急剧增加,说明该元素失去三个电子后达到稳定结构,则该元素最外层有3个电子,而元素M是组成物质NH4Al(SO4)2的其中一种元素,则M为Al;
(2)同一周期主族元素从左向右元素电负性逐渐增大,同一主族元素从上向下元素电负性逐渐减小,则NH4Al(SO4)2中,电负性最大的元素是O;其中S的杂化类型是sp3杂化,则S的sp3杂化轨道与O的2p轨道形成σ键;
(3)以钛离子为顶点,应有8个立方晶胞紧靠在一起,这样钛离子成为空间直角坐标系的中心原点,它的三维方向上前后左右上下最近且距离相等的氧离子有6个、钙离子有8个;
(4)依据均摊法,氧离子数为:12=3,钛离子数为:8=1,钙离子数为:1,则该晶体结构中,氧、钛、钙的离子个数比是:3:1:1;
(5)晶体质量m=g,体积V=d310-21cm3,则密度ρ====。
22. 1s22s22p63s23p63d10 sp3杂化 v形 SiO2 SiO2为原子晶体 CO2为分子晶体 2Cu + 8NH3 + O2 + 2H2O 2[Cu(NH3)4]2+ + 4OH- 8
【分析】由题意,X是所有元素中原子半径最小的,则X为H元素,Y有三个能级上且电子数相等, Y为C元素;R与Y同主族,R为Si,Z原子单电子数在同周期元素中最多,则外围电子排布为应符合ns2np3,结合题意可知Z为N元素;W与Z同周期,第一电离能比N的低,原子序数比N大,则W为O元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,其核外电子排布应为1s22s22p63s23p63d104s1,则Q为Cu,据此分析。
解析:详解:根据以上分析可知X、Y、Z、W、R、Q分别是H、C、N、O、Si、Cu。则
(1)Q为Cu,Cu+的核外电子排布式为1s22s22p63s23p63d10;
(2)X为H,Z为N,W为O,X2W2为H2O2,中心O原子价层电子对数为2+(6 2)/2=4,故O原子采取sp3杂化;ZW2-为NO2-,离子中N原子孤电子对数为(5+1 2×2)/2=1、价层电子对数为2+1=3,其立体构型是V形,故答案为:sp3,V形;
(3)Y为C,R为Si,最高价氧化物分别为CO2、SiO2,CO2为分子晶体,SiO2为原子晶体,沸点较高的是SiO2,故答案为:SiO2、CO2为分子晶体,SiO2为原子晶体;
(4)Q为Cu,ZX3为NH3,W2为O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,则该反应的离子方程式为2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-;
(5)由晶胞示意图可知,该晶体一个晶胞的中Y原子数为:4+8×1/8+6×1/2=8;每个Y与周围的4个Y原子相邻,故Y原子的配位数为4;若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则晶胞质量为(a×10-10)3cm3×ρ g/cm3 = a3×10-30ρ g,则8×12/NA g=a3×10-30ρ g,故NA=。
23.(1) (两空答案不分先后)
(2)抑制(或)水解
(3) (球形)干燥管 导气、冷凝回流
(4)
(5) 降温结晶 减少的溶解,并便于干燥
【分析】铬酸钠、甲醇与足量浓盐酸在加热条件下发生反应,调节pH得到Cr(OH)3沉淀,往Cr(OH)3沉淀中加入过量盐酸溶解,通过结晶法得到CrCl36H2O晶体。
解析:(1)配合物中,配体为和。
(2)易水解,步骤④中“加入过量盐酸”的目的是抑制(或)水解。
(3)装置图A中,仪器c的名称为球形干燥管;仪器b为(球形)干燥管,其作用是导气和冷凝回流。
(4)步骤Ⅱ中有产生,则三颈烧瓶中甲醇将铬酸根离子还原为+3价铬离子,反应的离子方程式为。
(5)由于的溶解度受温度影响比较大,可通过降温结晶的方法析出晶体,因此获得晶体的一系列操作包括:趁热过滤、降温结晶、过滤、洗涤、干燥;其中“洗涤”步骤中选用丙酮作为洗涤剂,目的是减少的溶解,并便于干燥
